Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.64 no.1 México ene./feb. 2007
Caso clínico
Leishmaniasis visceral tratada con anfotericina B
Visceral leishmaniasis treated with amphotericin B
José de Jesús Hernández–Flores1, José Juan Morales–Aguirre2, Antonio Zamora–Chávez3
1 Departamento de Hematología, Hospital Infantil de México Federico Gómez México, D.F., México.
2 Departamento Infectología, Hospital Infantil de México Federico Gómez México, D.F., México.
3 Coordinación de Hospitalización, Hospital Infantil de México Federico Gómez México, D.F., México.
Solicitud de sobretiros:
José Juan Morales Aguirre
Departamento de Infectología, Hospital Infantil de México Federico Gómez
Calle Dr. Márquez Núm. 162, Col. Doctores, Deleg. Cuauhtemoc, CP. 06720. México, D. F., México.
Fecha de recepción: 28–07–2006
Fecha de aprobación: 22–03–2007
Resumen
Introducción. La leishmaniasis es una enfermedad endémica en más de 82 países, con una población en riesgo de más de 350 millones de personas en el mundo. La Organización Mundial de la Salud estima que existen más de 12 millones de casos actualmente, con una incidencia anual de más de 600 000 casos por año y 750 000 muertes. No existen cifras confiables debido al gran número de casos no reportados, y por una gran proporción de casos asintomáticos o subclínicos.
Caso clínico. Se presenta el caso de un varón de 1 año 4 meses de edad proveniente del estado de Guerrero, el cual presentó cuadro clínico caracterizado por fiebre, esplenomegalia y pancitopenia. Se descartaron procesos infiltrativos y otra etiología infecciosa, se realizó inmunofluorescencia indirecta para Leishmania sp., obteniendo un resultado de 1:4 096, la cual apoyó el diagnóstico de leishmaniasis por la marcada seropositividad aun en la ausencia de amastigotes en el aspirado de médula ósea. Se dio tratamiento con anfotericina B desoxicolato a dosis de 1 mg/kg/día por 15 días, con buena evolución.
Conclusión. El tratamiento con anfotericina B es una alternativa al tratamiento habitual con antimoniales, especialmente por la alta resistencia que se reporta a estos últimos.
Palabras clave. Leishmaniasis; visceral; kala–azar; anfotericina B; Leishmania.
Abstract
Introduction. Leishmaniasis is an endemic disease in more than 82 countries with a risk population of more than 350 million people worldwide. The World Health Organization estimates more than 12 million cases annually, with an annual incidence of more than 600 000 cases per year and 750 000 deaths.
Case report. We present a case of visceral leishmaniasis treated with amphotericin B in the Hospital Infantil de Mexico Federico Gomez. The patient was a 16 month old male from the state of Guerrero, who was admitted to the hospital with history of fever, pancitopenia, and hepatosplenomegally. After ruling out neoplastic and other infectious and non infectious causes of organ infiltration, a positive Leishmania serology was reported. The bone marrow aspirate was examined but was reported negative for amastygotes. Based on the serology, a presumptive diagnosis of visceral leishmaniasis was made. Treatment with amphotericin B, 1 mg/kg/day for 15 days resulted in significant clinical improvement.
Conclusion. Treatment of visceral leishmaniasis with amphotericin B instead of antimony is a good alternative, principally due to the high resistance reported in the treatment with antimonials.
Key words. Leishmaniasis; visceral; kala–azar; amphotericin B; Leishmania.
Introducción
En 1903, Leishman y Donovan por separado describen al protozoario aislándolo del bazo, el cual actualmente es llamado Leishmania donovani.1 El término leishmaniasis se refiere colectivamente a una variedad de síndromes clínicos causado por el protozoario intracelular del género Leishmania. El primer estudio epidemiológico sobre leishmaniasis, en México, fue realizado en 1942 por Beltrán y Bustamante.2 La distribución geográfica en el país es amplia y afecta por lo menos a 17 estados: Coahuila, Nuevo León y Tamaulipas en el norte, algunos estados del Pacífico y el centro, y todos los estados del Sureste. Del año 1995 a 2000 se reportaron casos en 11 estados con presencia regular en ocho de ellos, al norte como Nayarit y Sinaloa, en el Océano Pacífico; en el Golfo de México se distribuyen desde Veracruz, Tabasco y Campeche, Oaxaca y Chiapas en el Pacífico Sur y en el Caribe mexicano, Quintana Roo. La incidencia y prevalencia global de casos de kala–azar por año son de 0.5 a 2.5 millones respectivamente.3 Más de 90% de los casos de leishmaniasis visceral en el mundo se presentan en la India, Bangladesh, Nepal, Sudan y Brasil.4,5 Cerca de la mitad de los casos de leishmaniasis visceral ocurren en la edad pediátrica. La leishmaniasis es una zoonosis, la cual requiere de un vector; los parásitos son transmitidos por la picadura del mosco hembra flebótomos (existen más de 30 especies6,7), dejando el promastigote en la piel y en la mucosa naso-oro–faríngea respectivamente. Estos promastigotes se unen a receptores macrofágicos, los cuales son fagocitados y transformados en amastigotes, liberados posteriormente.8
La leishmaniasis puede ser causada por 21 especies diferentes de Leishmania. Existen tres formas clínicas: cutánea, mucosa y visceral. La leishmaniasis visceral también conocida como kala–azar, es causada típicamente mas no exclusivamente por organismos del complejo Leishmania donovan (L. donovani, L. infantum, L. chagasi), otros son: L. trópica, L. major, L. aethiopica, y L. mexicana; las cuales se asocian con leishmaniasis cutánea (espundia).
La infección visceral puede permanecer subclínica o seguir un curso agudo, subagudo o crónico con presencia de fiebre, caquexia grave,9 hepatoesplenomegalia, característicamente predomina la esplenomegalia, es común la presencia de pancitopenia (anemia, trombocitopenia, leucopenia, y neutropenia), también es posible observar eosinofilia marcada, linfocitosis relativa y monocitosis. La hipergammaglobulinemia se debe a una activación policlonal de células B, observándose predominio de inmunoglobulina G (IgG), en estos pacientes también es común el hallazgo de hipoalbuminemia.9
Para el diagnóstico definitivo se requiere de la demostración del parásito o la observación del amastigote en tejidos bajo microscopia de luz. Otros métodos indirectos son los inmunológicos como la serología y pruebas de hipersensibilidad retardada, cultivo in vitro o inoculación en otros animales.9–13
Clásicamente el tratamiento es a base de complejos de amonio pentavalente, éstos han sido utilizados desde la década de 1940, como el estibogluconato de sodio (Pentostam, Glaxo Wellcom UK), y antimoniato de meglumine (Glucantime, Rhone–Poulence Rorer, France);9,14 la anfotericina B y la pentamidina, consideradas en alguna época como fármacos de segunda línea, están ahora resurgiendo como tratamientos de primera línea.9,15
Presentación del caso clínico
Paciente masculino de 16 meses de edad, originario de San Miguel Totolapan, quien es referido a nuestra institución por fiebre y hepatoesplenomegalia en estudio. Entre sus antecedentes de importancia: padre y madre de 24 y 22 años respectivamente, sanos, analfabetas, con dos hermanos de seis y tres años sanos, habitan casa tipo rural, sin servicios intradomiciliarios, agua obtenida de pozo, fecalismo a ras del suelo, conviven con un perro, hábitos higiénicos con baño cada tercer día, la alimentación es con base en frijoles, arroz, leche, tortillas. Previo a este evento el paciente era sano.
El paciente ingresó por cuadro caracterizado por fiebre de 15 días de evolución, cuantificada entre 38 a 39° C, corroborada a su ingreso y persistiendo ésta durante los siguientes 30 días después. Epistaxis de dos días de evolución la cual se presentó en sólo una ocasión y que se resolvió espontáneamente. Vómito de tres días de evolución de contenido gástrico, precedido de náusea y arqueo, el cual cedió con antieméticos no especificados. Edema de miembros inferiores de tres días de moderada intensidad y adinamia de 15 días de evolución.
La exploración física al ingreso con un peso de 9.7 kg (percentil 10), talla de 89 cm (percentil 90), perímetro cefálico de 48 cm (percentil 60), perímetro abdominal 47 cm. Frecuencia cardiaca de 130/min, frecuencia respiratoria de 40/min, tensión arterial 90/60 mm Hg, temperatura de 38° C. Se observó abdomen globoso, blando, depresible, palpándose hígado a 4–5–5 cm por debajo del borde costal sobre líneas convencionales, el bazo se palpaba a 12 cm del borde costal; hipoactivo neurológicamente, sin hallazgos anormales agregados, cardiopulmonar sin alteraciones, sin otras anormalidades que comentar.
Los estudios de laboratorio al ingreso mostraron pancitopenia con hemoglobina de 7.6 g/dL, hematócrito de 23.8%, leucocitos de 3 000/µL, segmentados 19%, bandas 8%, monocitos 4%, linfocitos 69%, plaquetas 30 000/µL. Nitrógeno ureico 9, ácido úrico 3.1 mg/dL, creatinina 0.3 mg/dL, glucosa 71 mg/dL, sodio 133 mEq/L, potasio 4.1 mEq/ L, cloro 100 mEq/L, calcio 7.4 mg/dL, fósforo 4.6 mg/dL, bilirrubinas totales de 0.64 mg/dL, indirecta 0.5 mg/dL, directa de 0.14 mg/dL, proteínas totales de 6.1 g/dL, albúmina 2.1 g/dL, globulina de 4.0 g/dL, transaminasas AST de 60 UI/L, ALT 29 UI/L, DHL 433 U/L, fosfatasa alcalina 115 U/L, tiempos de coagulación en límites normales.
Por los hallazgos de pancitopenia y esplenomegalia masiva, se abordó por los servicios de oncología, hematología e infectología para descartar causas neoplásicas, infiltrativas e infecciosas.
Se realizaron antigenemia para citomegalovirus, PCR para Epstein Barr serologías para Toxoplasma, hepatitis B, hepatitis C, sífilis, búsqueda en gota gruesa de Plasmodium, bacilo ácido alcohol resistente (BAAR) en jugo gástrico, reacciones febriles y mielocultivo, resultando todos estos negativos, la búsqueda de probables neoplasias y enfermedades de atesoramiento en médula ósea fueron negativas. El aspirado de médula ósea mostró hiperplasia de la serie mieloide con granulaciones tóxicas. No se observaron parásitos intracelulares en la biopsia de médula ósea ni en el aspirado. Los estudios de imagen mostraron en ultrasonido abdominal hepatomegalia moderada, esplenomegalia, así como hipertensión portal.
En la biopsia de hígado y bazo, se observó parénquima hepático con arquitectura conservada, espacios porta con infiltrado de células inflamatorias mononucleares. Había hemofagocitosis focal y en el lobulillo se observó esteatosis macrovesicular y dilatación sinusoidal. No se observaron microorganismos ni células neoplásicas, el bazo mostró congestión de pulpa roja. El tejido linfoide mostró disminución focal de la celularidad, con hemofagocitosis y no se observaron microorganismos ni células neoplásicas. Se recibió el resultado de la inmunofluorescencia indirecta para Leishmania sp. 1:4 096 con lo cual se apoyó el diagnóstico de leishmaniasis por la marcada seropositividad aún con la ausencia de amastigotes en el aspirado de médula ósea y se decidió dar tratamiento con anfotericina B convencional a dosis de 1 mg/kg/ día, dosis total administrada de 20 mg/kg.
Posterior al inicio del tratamiento con anfotericina B, desapareció la fiebre, mejoró el apetito, disminuyó de tamaño el bazo y el hígado (Figs 1, 2, 3, 4). Egresándose en buenas condiciones generales, habiendo sido evaluado seis meses después del egreso y mostrando buen estado de salud y con disminución del tamaño del bazo.



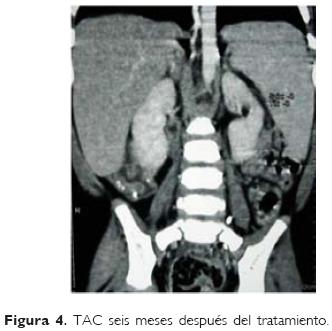
El diagnóstico de leishmaniasis demoró un mes desde el ingreso del paciente hasta que se recibió el resultado de la inmunofluorescencia indirecta.
Discusión
La leishmaniasis visceral continúa siendo una enfermedad fuertemente asociada a un alto nivel de pobreza, es de esperar que en estos países donde se necesitan más los avances en la prevención, control y tratamiento adecuado, es donde menos se pueden implementar las medidas pertinentes.16 En nuestro medio desconocemos la prevalencia real de esta entidad.
El diagnóstico oportuno y la rápida instauración del tratamiento contra leishmaniasis visceral es de vital importancia, ya que sin tratamiento la enfermedad es irremediablemente fatal.9,17 Es bien sabido la dificultad que se tiene en diagnosticar la leishmaniasis visceral, en muchas ocasiones no se cuenta con medios de cultivo, y aun realizando éstos, el microorganismo no crece con facilidad, además de la dificultad que ofrece su observación en muestras de tejidos, cuando el observador es poco experto.11–13,18,19 En este caso no se tuvo identificación del parásito por cultivo ni por observación directa en las muestras de tejido hepático y del bazo. El diagnóstico se puede basar en la detección de anticuerpos fluorescentes por hemaglutinación, siendo esta prueba bastante específica y con una alta sensibilidad;20,27 es éste el método diagnóstico mediante el cual se identificó este caso, además de la respuesta clínica al tratamiento.
Clásicamente los pacientes con leishmaniasis visceral o kala–azar presentan pancitopenia, así como hepatomegalia y esplenomegalia, siendo esta última la que más predomina, en algunos casos se observan datos de hemofagocitosis,28 como la reportada en este caso.
Con respecto al tratamiento, ya se había comentado que los compuestos pentavalentes de amonio han sido el estándar por más de 60 años;9,29 sin embargo, debido a la alta resistencia observada a estos fármacos, como en la India, con frecuencia de resistencia cercana a 100%,9 la desventaja de una administración prolongada (tratamientos de 28 días), efectos colaterales tóxicos, aunque reversibles, como son: fatiga, mialgias, anormalidades electrocardiográficas, elevación de aminotransferasas, pancreatitis química; por lo anterior ha resurgido el tratamiento con anfotericina B.30–33
El esquema de tratamiento con anfotericina B a dosis de 0.75–1.0 mg/kg por 15 días en días alternos, ha mostrado efectividad de cura por arriba de 97% de los pacientes,30–35 cabe aclarar que la mayoría de los autores recomiendan el uso de anfotericina liposomal, debido a que presenta menos efectos tóxicos que la anfotericina desoxicolato,32 sin embargo la experiencia con la anfotericina B convencional también ha mostrado buenos resultados. Por otro lado, la leishmaniasis ocurre generalmente en países pobres, en donde la posibilidad de contar con anfotericina liposomal es prácticamente nula, por tal razón se considera que el uso de la anfotericina B convencional es una alternativa eficaz para el tratamiento de leishmaniasis visceral.
Referencias
1. Herwaldt B. Leishmaniasis. Lancet. 1999; 354: I 191–9. [ Links ]
2. Cordova C, Albertos N, Andrade F, Canto S. Leishmaniasis: estudio preliminar en una localidad de la zona endémica del Estado de Tabasco. Salud Publica Mex. 1993; 35: 345–50. [ Links ]
3. Life in the twenty–first century: a vision for all. World Health Report 1998. Geneva: World Health Organization; 1998. p. 45. [ Links ]
4. Bora D. Epidemiology of visceral leishmaniasis in India. Nati Med J India. 1999; 12: 62–8. [ Links ]
5. Desjeux P. Human leishmaniasis: Epidemiology and public health aspects. World Health Statist Q. 1992; 45: 267–75. [ Links ]
6. Ashford RW. The leishmaniases as model zoonoses. Ann Trop Med Parasitol. 1997; 91: 693–701. [ Links ]
7. Killick–Kendrick R. Phlebotomine vectors ofthe leishmaniasis: a review. Med Vet Entomol. 1990; 4: 1–24. [ Links ]
8. Reed SG, Scott P. T–cell and cytokine responses in leishmaniasis. Curr Opin Immunol. 1993; 5: 524–31. [ Links ]
9. Berman JD. Human leishmaniasis: clinical, diagnostic and chemotherapeutic developments in the last 10 years. Clin Infect Dis. 1997; 24: 684–703. [ Links ]
10. Kalter DC. Laboratory test forthe diagnosis and evaluation of leishmaniasis. Dermatol Clin. 1994; 12:37–50. [ Links ]
11. Chulay JD, Bryceson AD. Quantitation of amastigotes of Leishmania donovani in smears of splenic aspirates from patients with visceral leishmaniasis. AmJ Trop Med Hyg. 1983; 32: 475–9. [ Links ]
12. Sundar S, Kumar K, Singh VP, Mahopatra TM. Diagnostic lag period in Kala–azan test for early diagnostics hended. J Assoc Physicians India. 1991; 39: 651. [ Links ]
13. Sundar S, Rai M. Laboratory diagnosis of visceral leishmaniasis. Clin Diagn Lab Immunol. 2002; 9: 95 I –8. [ Links ]
14. Herwaldt BL, Berman JD. Recommendations for treating leishmaniasis with sodium stibogluconate (Pentostam) and review of pertinent clinical studies. AmJ Trop Med Hyg. 1992; 46: 296–306. [ Links ]
15. Berman JD. Editorial response: U. S. Food and Drug Administration approval of AmBisome (liposomal amphotericin B) fortreatment of visceral leishmaniasis. Clin Infect Dis. 1999; 28: 49–51. [ Links ]
16. Seaman J, Mercer AJ, Sondorp HE, Herwaldt BL. Epidemic visceral leishmaniasis in southern Sudan: treatment of severely debilitates patients under wartime conditions and with limited resources. Ann Intern Med. 1996; 124:664–72. [ Links ]
17. Ramesh V, Mukherjee A. Post–kala–azar dermal leishmaniasis. IntJ Dermatol. 1995; 34: 85–91. [ Links ]
18. Kalter DC. Laboratory test forthe diagnosis and evaluation of leishmaniasis. Dermatol Clin. 1994; 12:37–50. [ Links ]
19. Lightner LK, Chulay JD, Bryceson AD. Comparison of microscopy and culture in the detection of Leishmania donovani from splenic aspiates. Am J Trop Med Hyg. 1983; 32: 296–9. [ Links ]
20. Aikat BK, Sehgal S, Mehajan RC, Pathania AG, Bhatta–charya PK, Sahaya S, et al. The role of counter immuno–electrophoresis as a diagnostic tool in kala–azar. Indian J Med Res. 1979; 70: 592–7. [ Links ]
21. Haldar JP, Saha KC, Ghose AC. Serological profiles in Indian post kala–azar termal leishmaniasis. Trans R Soc Trop Med Hyg. 1981; 75: 514–7. [ Links ]
22. Hockmeyer WT, Wellde BT, Sabwa CL, Smith DH, Rees PH, Kager PA. A complement fixation test for visceral leishmaniasis using homologous parasite antigen I. Ann Trop Med Parasitol. 1984; 78: 489–93. [ Links ]
23. Sinha R, Sehgal S. Comparative evaluation of serological tests in Indian kala–azar. J Trop Med Hyg. 1994; 97: 333–40. [ Links ]
24. Harith AE, Kolk AH, Kager PA, Leeuwenburg J, Faber FJ, Muigai R, et al. Evaluation of a newly developed direct agglutination test (DAT) forserodiagnosis and seroepidemiological studies of visceral leishmaniasis: comparison with IFAT and ELISA. Trans R Soc Trop Med Hyg. 1987; 81: 603–6. [ Links ]
25. Badaro R, Reed SG, Carvalho EM, Immunofluorescent antibody test in American visceral leishmaniasis: sensitivity and specificity of different morphological forms of two Leishmania species. AmJ Trop Med Hyg. 1983; 32: 480–4. [ Links ]
26. Boalaert M, Rijal S, Regmi S, Singh R, Karki B, Jacquet D, et al. A comparative study ofthe effectiveness of diagnostic test for visceral leishmaniasis. Am J Trop Med Hyg. 2004; 70: 72–7. [ Links ]
27. Singla N, Sinh GS, Saundar S, Vinayak VK. Evaluation of the direct agglutination test as an immunodiagnostic tool for kala–azar in India. Trans R Soc Trop Med Hyg. 1993; 87: 276–8. [ Links ]
28. Gagnaire MH, Galambrun C, Stéphan JL. Hemophagocytic syndrome: A misleading complication of visceral leishmaniasis in children. A series of I 2 cases. Pediatrics. 2000; 106: 101–6. [ Links ]
29. Herwaldt BL, Berman JD. Recommendations for treating leishmaniasis with sodium stibogluconato (Pentostam) and review of pertinent clinical studies. AmJ Trop Med Hyg. 1992; 46: 296–306. [ Links ]
30. Mishra M, Biswas UK, Jha DN, Khan AB. Amphotericin versus pentamidine in antimony–unresponsive kala–azar. Lancet. 1992; 340: 1256–7. [ Links ]
31. Thakur CP, Singh RK, Hassan SM, Kumar R, Narain S, Kumar A. Amphotericin B deoxycholate treatment of visceral leishmaniasis with newer modes of administration and precautions: a study of 938 cases. Trans R Soc Trop Med Hyg. 1999; 93: 319–23. [ Links ]
32. Heimenz J, Walsh TJ. Lipid formulations of amphotericin B: recent progress and future directions. Clin Infect Dis. 1996; 22: SI 33–44. [ Links ]
33. Sundar S, Jha TK, Thakur CP, Mishra M, Singh VR, Buffels R. Low–dose liposomal amphotericin B in refractory Indian visceral leishmaniasis: a multicenter study. Am J Trop Med Hyg. 2002; 66: 143–6. [ Links ]
34. Thakur CP. A single dose treatment of kala–azar with Ambisome (amphotericin B lipid complex): a pilot study. Int J Antimicrob Agents. 200 I; 17: 67–70. [ Links ]
35. Sundar S, Agrewal G, Rai M, Makharia MK, Murray HW. Treatment of Indian visceral leishmaniasis with single or daily infusions of low dose liposomal amphotericin B: randomized trial. BMJ. 200 I; 323: 4 19–22. [ Links ]














