Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.64 no.1 México ene./feb. 2007
Artículo original
Brote de bacteriemia nosocomial y colonización por Serratia marcescens en una Unidad de Cuidado Intensivo Neonatal
Nosocomial bacteremia and gastrointestinal tract colonization outbreak of Serratia marcescens in Neonatal Intensive Care Unit
Luis Romano–Mazzotti1, Teresa Murguía–Peniche2, Víctor M. Pérez–Robles3, José Ignacio Santos–Preciado4, Dolores Alcántar–Curiel5, Celia M. Alpuche–Aranda5,6
1 Departamento de Infectología
2 Departamento de Neonatología
3 Departamento de Epidemiología
4 Dirección General, Hospital Infantil de México Federico Gómez
5 Unidad de Medicina Experimental, Facultad de Medicina, Universidad Nacional Autónoma de México
6 Instituto de Diagnóstico y Referencia Epidemiológicos, México, D. F., México.
Solicitud de sobretiros:
Celia M. Alpuche Aranda, Directora General Adjunta del InDRE
Prolongación de Carpió No. 470, 3er piso, Col. Casco de Santo Tomás
Deleg. Miguel Hidalgo, C.P. I 1340, México, D. F., México.
Fecha de recepción: 11–01–2007
Fecha de aprobación: 22–03–2007
Resumen
Introducción. Se presenta la descripción de un brote de bacteriemia y colonización gastrointestinal nosocornial por Serratia marcescens en una Unidad de Cuidado Intensivo Neonatal (UCIN) de un hospital de tercer nivel.
Material y métodos. El período epidémico fue considerado del 17 de mayo al 17 de junio de 2006. Se definió como caso a cualquier paciente con cultivo positivo para S. marcescens durante el período epidémico, ya que no se había identificado ningún cultivo positivo para esta bacteria en 6 meses de período pre–epidémico. Para identificar factores de riesgo de desarrollo de infección/colonización por S. mareescens, se compararon los casos con pacientes controles, definidos como aquéllos expuestos durante el período del brote sin aislamiento de esta bacteria. Todos los aislamientos de microorganismos fueron genotipificados por restricción con endonucleasa y electroforesis en gel por campos pulsados (PFGE).
Resultados. Durante el período epidémico se identificaron 7 pacientes con cultivos positivos para S. marcescens y 12 controles. El paciente índice tuvo hemocultivo positivo y cuadro clínico de bacteriemia nosocomial, seguido por un caso de ventriculitis con cultivo positivo para S. marcescens en líquido cefalorraquídeo. Los otros 5 casos tuvieron aislamiento de S. marcescens en coprocultivos. Los cultivos de soluciones intravenosas y superficies inanimadas fueron negativos. El análisis univariado demostró que los pacientes con infección/colonización por S. marcescens tuvieron una estancia hospitalaria más prolongada (52 vs 27.9 días, P < 0.05), mayor frecuencia de alimentación enteral y presencia de sonda orogástrica al compararse con los controles. El patrón de PFGE fue idéntico en todos los aislamientos de S. mareescens. El reforzamiento de precauciones de contacto, incluyendo lavado de manos, además de cierre temporal de la UCIN, controló el problema de brote.
Conclusión. El análisis epidemiológico complementado con técnicas de epidemiología molecular en este estudio aporta evidencia de un brote de 2 casos de bacteriemia nosocomial por transmisión cruzada de S. marcescens a través de un reservorio gastrointestinal. Estos hallazgos confirman la importancia que tienen las medidas de precauciones de contacto como el lavado de manos en el manejo de pacientes de la UCIN para prevenir infecciones nosocomiales y control de brotes.
Palabras clave. Serrada marcescens; brote nosocomial; infección neonatal.
Abstract
Introduction. We investigated an outbreak of Serratia marcescens bloodstream infection (BSI)/colonization in patients from a Neonatal Intensive Care Unit (NICU) in a tertiary care pediatric Hospital.
Material and methods. May 17 through June 17, 2006 was considered as the study period. A case was defined as any patient with S. marcescens–positive culture in the NICU during the outbreak period because no S. marcescens was identified in this area within 6 month of pre–epidemic period. To identify risk factors we compared patients with S. marcescens positive–cultures with controls exposed to the cases during the outbreak period without positive cultures. Genotyping of all S. marcescens isolates were evaluated by restriction endonuclease and pulsed–field gel electrophoresis (PFGE).
Results. Seven S. marcescens positive cultures were identified; the index case had a positive blood culture with diagnosis of BSI, followed by a patient with CSF positive culture with diagnosis of ventriculitis and BSI. The remaining 5 cases had concurrent S. marcescens isolates from stool cultures (colonization). Environmental cultures (water, IV solutions and inanimate surfaces) were negative for these bacteria. According to univariate analysis, patients with S. marcescens stayed in the NICU longer than controls (52 vs 27.9 days, P < 0.05), they were more likely to have an orogastric tube in place and to receive enteral nutrition. All the S. marcescens had an identical pattern of PFGE analysis. Contact precaution, including hand washing, was reinforced in addition to temporary closing of the NICU in order to control the outbreak.
Conclusions. This outbreak of S. marcescens was studied using epidemiological analysis and molecular biology techniques, confirming cross–transmission between cases associated to a possible gastrointestinal reservoir. Our findings underscore the importance of hand hygiene and other contact precaution methods in hospital settings, such as NICU.
Key words. Serratia marcescens; nosocomial outbreak; neonatal infection.
Introducción
Serrada marcescens es un bacilo aerobio gramnegativo de la familia Enterobacteriaceae, que clásicamente había sido considerado una bacteria saprofita; sin embargo, en los últimos 60 años se ha convertido en un agente de gran relevancia clínica, responsable de brotes nosocomiales, provocando una gran diversidad de infecciones como: neumonía, infección de vías urinarias, infección de heridas quirúrgicas, meningitis, endocarditis y sepsis. En los últimos 10 años ha tomado mayor importancia por su participación en brotes en terapia intensiva neonatal, además de que cada vez es más frecuente el aislamiento de cepas multirresistentes1–10.
Los brotes nosocomiales en adultos se relacionan comúnmente a colonización de los tractos respiratorio y urinario, mientras que los brotes en Unidades de Cuidados Intensivos Neonatales (UCIN) se relacionan más al tracto gastrointestinal, lo cual facilita la contaminación cruzada.5,11,12
Debido a su capacidad de colonizar el tracto gastrointestinal, piel y objetos inanimados de las terapias, así como sobrevivir en sustancias desinfectantes, estos brotes suelen ser difíciles de controlar causando el cierre de unidades de terapia intensiva. En estudios previos se han identificado factores de riesgo como bajo peso al nacer, estancia hospitalaria prolongada y maniobras invasivas.1,2,8,13,14
A pesar de que se han identificado cepas de S. marcescens que persisten por varios meses en la terapia de cuidados intensivos, la mayoría de los brotes no son estudiados a fondo sin poderse establecer si se trata de una misma cepa o de aislamientos con origen endógeno.
Las técnicas de biología molecular permiten establecer la relación genética de las cepas aisladas, caracterizando de una forma más completa los brotes nosocomiales. A pesar que se han descrito varias técnicas como RFLP, RAPD y ribotipificación, se considera que la electroforesis en gel por campos pulsados es la técnica más discriminativa y reproducible para estudios de epidemiología molecular.10,12,15–19 Actualmente, con el desarrollo de técnicas cortas se pueden obtener resultados en 72 horas,11 lo cual permite implementar medidas para el manejo de los brotes nosocomiales.
Material y métodos
Estudio de brote. En la UCIN del Hospital Infantil de México Federico Gómez se identificó un caso de bacteriemia nosocomial por S. marcescens el 17 de mayo de 2006 en un paciente con diagnóstico de prematurez y cardiopatía, hospitalizado en el área de terapia intensiva, y un segundo caso en un paciente con diagnóstico de ventriculitis y bacteriemia nosocomial del que sólo se aisló S. marcescens en el líquido cefalorraquídeo (LCR). Al identificarse el segundo caso, se notificó al Departamento de Epidemiología iniciándose el estudio de brote y el cierre de la sala. El período de estudio fue del 17 de mayo al 17 de junio de 2006; se definió como caso a aquellos pacientes hospitalizados en la UCIN durante este período epidémico, con cultivos positivos para S. marcescens. Los casos se describen en dos categorías: pacientes asintomáticos con aislamiento de S. marcescens de sitios no estériles, y pacientes infectados con aislamiento de sitio estéril y con datos clínicos compatibles con bacteriemia. Se consideró como período pre–epidémico a los 12 meses previos al período epidémico. Para definir brote nosocomial se calcularon las tasas de infección por S. mareescens en el período pre–epidémico y epidémico, así como la tasa de letalidad y mortalidad.
Análisis de factores de riesgo. Se realizó el estudio epidemiológico de casos y controles para identificar factores de riesgo de desarrollo de infección/colonización por S. marcescens. Los controles se definieron como aquellos pacientes hospitalizados en UCIN durante el período epidémico, sin cultivos positivos para S. marcescens ni datos clínicos compatibles con bacteriemia y que contaran con un mínimo de 72 horas de exposición a los casos. Para el análisis de factores de riesgo se incluyeron las variables: sexo, peso al ingreso, prematurez, bajo peso para edad gestacional, uso de antibióticos previos, duración de estancia en UCIN hasta el final del período epidémico, uso de catéter venoso central, nutrición parenteral total (NPT), sonda orogástrica (SOG), alimentación y manifestaciones gastrointestinales (diarrea o vómito).
Microbiología. La identificación primaria y el patrón de susceptibilidad antimicrobiana de S. marcescens se realizó por el sistema automatizado Vitek (bioMerieux, Inc., Hazelwood, MO, USA) en el laboratorio de Microbiología Clínica del hospital.
Método de epidemiología molecular. Para establecer si se trataba de una misma cepa de S. mareescens, se realizó la genotipificación con base a la técnica descrita previamente por Miranda y col.,11 a través de digestión con enzima endonucleasa Spel (Roche, Mannheim, Alemania) y electroforesis en campos pulsados (CHEF–DR II, BioRad, Hercules, CA). La definición de cepa se realizó mediante los criterios de Tenover y col.20
Análisis estadístico. Se recolectaron los datos de los pacientes y se procesaron utilizando el paquete SPSS vi 1.0 (SPSS Inc., Chicago, IL).
Se realizó análisis univariado de las variables de riesgo utilizando la prueba exacta de Fisher para variables categóricas y t de Student para variables continuas. Se calcularon la razón de momios e intervalos de confianza al 95% para las variables que mostraron diferencias estadísticamente significativas (P < 0.05).
Resultados
Después del aislamiento de los dos casos iniciales de bacteriemia nosocomial, los demás pacientes de la terapia intensiva fueron colocados temporalmente en el área de cuidados intermedios mientras se realizaba un lavado del área, por lo que durante 24 horas todos los pacientes estuvieron en una misma área física bajo el manejo de un mismo grupo de personas. En las semanas siguientes, se mantuvo vigilancia del resto de los pacientes hospitalizados en la UCIN, identificándose cinco coprocultivos con desarrollo de S. marcescens en pacientes diferentes de los casos iniciales. Se cultivaron fórmulas de alimentación, soluciones, agua y lavabos sin lograrse ningún aislamiento microbiano. No se realizó estudio microbiológico a ningún médico ni enfermera del área. Al no documentarse más aislamientos en sitios estériles después de 10 días, se decidió abrir la sala nuevamente, aunque persistieron los aislamientos de S. marcescens en coprocultivos por lo que se insistió en reforzamiento de precauciones de contacto en el área, incluyendo lavado de manos. El 17 de junio de 2006 se registró el último aislamiento de S. marcescens en un coprocultivo, después de lo cual pasaron 30 días sin nuevos aislamientos.
De esta forma, se identificaron siete casos y 12 controles durante el período epidémico, dos de los casos fueron diagnosticados como septicemia, uno de éstos con infección de sistema nervioso central, y los otros cinco fueron pacientes colonizados a nivel gastrointestinal.
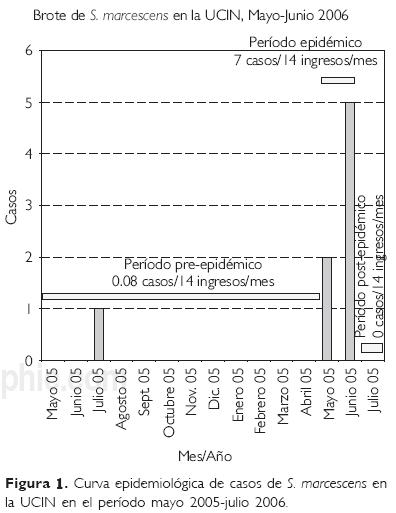
Las tasas de incidencia para aislamientos de S. marcescens en los períodos pre–epidémico, epidémico y post–epidémico demostraron claramente que se trató de un brote nosocomial, ya que sólo se identificó un caso de S. marcescens entre mayo de 2005 y mayo de 2006 (período pre–epidémico) equivalente a 0.08 casos/14 ingresos/mes, lo cual incrementó a siete casos/14 ingresos/mes (período epidémico). En el mes de seguimiento posterior al brote no se identificaron casos (Fig. 1). Uno de los casos falleció, por lo que se calculó una tasa de letalidad de 14.2% y una tasa de mortalidad de 5.2 por 100 expuestos.
El análisis estadístico mostró diferencias significativas en el uso de SOG (casos 7/7, controles 5/ 12, P < 0.05), alimentación enteral (casos 7/7, controles 6/12, P < 0.05), estancia hospitalaria (casos 52 días [34–85], controles 27.9 días [4–72], P < 0.05) y manifestaciones gastrointestinales (casos 5/7, controles 2/12, P < 0.05) (Cuadro 1).
La distribución de los datos no permitió establecer razones de momios.
Los resultados del PFGE mostraron que se trató de una misma cepa de S. marcescens tanto en los aislamientos de los pacientes con infección sistémica como en los colonizados (Fig. 2) (Cuadro 2).
Discusión
Las terapias intensivas neonatales son escenarios de brotes nosocomiales con consecuencias devastadoras dadas las condiciones de los pacientes.21
Los reportes de brotes por S. marcescens se han incrementado en los últimos años, ya que éstos presentan diseminación rápida y difícil control, además de que se asocian con alta morbilidad y mortalidad. En muchas ocasiones es necesario el cierre de estas unidades para poder controlar los brotes.3,4,6,8,13,22,24
Aun cuando este estudio sólo tuvo dos casos de infección demostrada por S. marcescens acompañada de cinco casos de colonización, se define como brote porque en todo el año previo en esta UCIN sólo se había identificado S. marcescens en secreción conjuntival de un paciente, ningún caso de infección sistémica o colonizante gastrointestinal en los cientos de cultivos tomados rutinariamente. Aunque en varios estudios de brote se ha podido rastrear un reservorio,25,26 la mayoría de las publicaciones no logra identificar una fuente común o de origen como inicio de los brotes. Este estudio tiene las limitantes de no haber realizado estudios de escrutinio microbiológico en el personal que labora en la UCIN, ni contar con estudios microbiológicos al inicio del brote. Dada la evidencia de que el brote presentó un mecanismo de transmisión horizontal, ya que se trata de la misma cepa de bacteria, hubiera sido interesante contar con resultados de coprocultivos del paciente índice, el cual cursó con septicemia pero muy probablemente la diseminación bacteriana se inició por vía gastrointestinal. Tampoco podemos definir si este paciente llegó colonizado por esta bacteria desde su ingreso.
Varios reportes de casos han logrado identificar a la prematurez, bajo peso para edad gestacional y dispositivos invasivos como factores de riesgo para desarrollo de infección por esta bacteria, aunque éstos también han sido reconocidos como factores de riesgo para complicaciones infecciosas en general.8,13,14,27–29 En este estudio sólo se identificaron como factores de riesgo la estancia hospitalaria prolongada, alimentación enteral y el uso de SOG, lo cual es compatible con un reservorio gastrointestinal con un mecanismo de transmisión horizontal.
En esta serie de casos se presentó una defunción, a pesar del patrón de susceptibilidad multisensible que presentaba la cepa aislada, a diferencia de otros reportes donde cada vez es más frecuente encontrar cepas multirresistentes.7,24 Llama la atención que los casos con aislamiento de S. marcescens en coprocultivo presentaron manifestaciones clínicas gastrointestinales al mismo tiempo que se tomó la muestra de heces. La gastroenteritis no está descrita como una presentación clínica de infección por S. marcescens, y estas manifestaciones pueden atribuirse a una gran variedad de factores infecciosos y no infecciosos que no se estudiaron. Sin embargo, la asociación entre aumento en la frecuencia de las evacuaciones y mayor manipulación por parte del personal pudo facilitar la propagación horizontal del brote.
Aunque se podría plantear la posibilidad de contaminación de las fórmulas de leche maternizada, este escenario es poco probable ya que se hubieran registrado más casos en la misma UCIN así como en otras áreas del hospital.
Los estudios de caracterización genética bacteriana como la genotipificación ayudan a definir el origen y la ruta de diseminación de una bacteria en un entorno epidemiológico, ya que la definición de cepa indica que se trata de la misma bacteria que se ha diseminado de un caso a otro, lo que se conoce como transmisión cruzada, a diferencia de infecciones endógenas donde por lo común se identifica variabilidad clonal.30 Por lo tanto, son una herramienta útil para definir conductas en el control de infecciones hospitalarias; en este caso se utilizó una técnica rápida de PFGE con la cual es posible tener información en 72 horas y plantear intervenciones oportunas para evitar transmisión cruzada.
Siguiendo las recomendaciones de los Departamentos de Epidemiología y de la UCIN, se lo gró reforzar las medidas higiénicas de la sala con énfasis en el lavado de manos y técnicas de curación de sondas, con lo cual se logró limitar el brote, lo que permitió la apertura temprana de la unidad.
Las medidas universales de seguridad biológica, especialmente el lavado de manos estricto es una conducta que no debe ser ignorada y el apego a estas prácticas llevará a un mejor control de infecciones nosocomiales.31–33
Referencias
1. David MD, WellerTM, Lambert P, Fraise AP. An outbreak of Serratia marcescens on the neonatal unit: átale of two clones. J Hosp Infect. 2006; 63: 27–33. [ Links ]
2. Dhiraputra C, Tribuddharat C, Pongpech P, Chokephaibulkit K, Danchaivijitr S. Endemic Serratia marcescens in a neonatal intensive care unit. J Med Assoc Thai. 2005; 88 Supl 10: SI0–3. [ Links ]
3. Sarvikivi E, Lyytikainen O, Salmenlinna S. Clustering of Serratia marcescens infections in a neonatal intensive care unit. Infect Control Hosp Epidemiol. 2004; 25: 723–9. [ Links ]
4. Milisavljevic V, Wu F, Larson E. Molecular epidemiology of Serratia marcescens outbreaks in two neonatal intensive care units. Infect Control Hosp Epidemiol. 2004; 25: 719–21. [ Links ]
5. Lai KK, Baker SP, Fontecchio SA. Rapid eradication of a cluster of Serratia marcescens in a neonatal intensive care unit: use of epidemiologic chromosome profiling by pulsed–field gel electrophoresis. Infect Control Hosp Epidemiol. 2004; 25: 730–4. [ Links ]
6. Fleisch F, Zimmermann–Baer U, Zbinden R. Three consecutive outbreaks of Serratia marcescens in a neonatal intensive care unit. Clin Infect Dis. 2002; 34: 767–73. [ Links ]
7. Villari P, Crispino M, Salvadori A, Scarcella A. Molecular epidemiology of an outbreak of Serratia marcescens in a neonatal intensive care unit. Infect Control Hosp Epidemiol. 2001; 22: 630–4. [ Links ]
8. Prasad GA, Jones PG, Michaels J, Garland JS, Shivpuri CR. Outbreak of Serratia marcescens infection in a neonatal intensive care unit. Infect Control Hosp Epidemiol. 2001; 22: 303–5. [ Links ]
9. Van Ogtrop ML, van Zoeren–Grobben D, Verbakel–Salomons EM, van Boven CP. Serratia marcescens infections in neonatal departments: description of an outbreak and review of the literature. J Hosp Infect. 1997; 36: 95–103. [ Links ]
10. Miranda G, Kelly C, Solórzano F, Léanos B, Coria R, Patterson JE. Use of pulsed–field gel electrophoresis typing to study an outbreak of infection due to Serratia marcescens in a neonatal intensive care unit. J Clin Microbiol. 1996; 34: 3138–41. [ Links ]
11. Miranda–Novales G, Léanos–Miranda B, Diaz–Ramos R. An outbreak due to Serratia marcescens in a neonatal intensive care unit typed by 2–day pulsed field gel electrophoresis protocol. Arch Med Res. 2003; 34: 237–41. [ Links ]
12. Steppberger K, Walter S, Claros MC. Nosocomial neonatal outbreak of Serratia marcescensâanalysis of pathogens by pulsed field gel electrophoresis and polymerase chain reaction. Infection. 2002; 30: 277–81. [ Links ]
13. Muñoz JM, Macias AE. Nosocomial outbreak of Serratia marcescens in a neonatal intensive care unit. Infect Control Hosp Epidemiol. 2003; 24: 3 I 2; author reply –3. [ Links ]
14. Jones BL, Gorman LJ, Simpson J. An outbreak of Serratia marcescens in two neonatal intensive care units. J Hosp Infect. 2000; 46: 314–9. [ Links ]
15. Alfizah H, Nordiah AJ, Rozaidi WS. Using pulsed–field gel electrophoresis in the molecular investigation of an outbreak of Serratia marcescens infection in an intensive care unit. Singapore Med J. 2004; 45: 214–8. [ Links ]
16. Krawczyk B, Naumiuk L, Lewandowski K. Evaluation and comparison of random amplification of polymorphic DNA, pulsed–field gel electrophoresis and ADSRRS–fin–gerprinting for typing Serratia marcescens outbreaks. FEMS Immunol Med Microbiol. 2003; 38: 241–8. [ Links ]
17. Jang TN, Fung CP, Yang TL, Shen SH, Huang CS, Lee SH. Use of pulsed–field gel electrophoresis to investigate an outbreak of Serratia marcescens infection in a neonatal intensive care unit. J Hosp Infect. 200 I; 48: I 3–9. [ Links ]
18. Irmscher HM, Fischer R, BeerW, Seltmann G. Characterization of nosocomial Serratia marcescens isolates: comparison of Fourier–transform infrared spectroscopy with pulsed–field gel electrophoresis ofgenomic DNA fragments and multilocus enzyme electrophoresis. Zentralbl Bakteriol. 1999; 289: 249–63. [ Links ]
19. Chetoui H, Delhalle E, Melin P, et al. Typing of nosocomial strains of Serratia marcescens: comparison of pulsed–field gel electrophoresis of macrorestriction fragments with biotyping, esterase typing and ribotyping. Res Microbiol. 1998; 149: 137–43. [ Links ]
20. Tenover FC, Arbeit RD, Goering RV. Interpreting chromosomal DNA restriction patterns produced by pulsed–field gel electrophoresis: criteria for bacterial strain typing. J Clin Microbiol. 1995; 33: 2233–9. [ Links ]
21. Makhoul IR, Sujov P, Smolkin T, Lusky A, Reichman B. Pathogen–specific early mortality in very low birth weight infants with late–onset sepsis: a national survey. Clin Infect Dis. 2005; 40: 218–24. [ Links ]
22. Cullen MM, Trail A, Robinson M, Keaney M, Chadwick PR. Serratia marcescens outbreak in a neonatal intensive care unit prompting review of decontamination of laryngoscopes. J Hosp Infect. 2005; 59: 68–70. [ Links ]
23. Casolari C, Pecorari M, Fabio G. A simultaneous outbreak of Serratia marcescens and Kiebsieiia pneumoniae in a neonatal intensive care unit. J Hosp Infect. 2005; 61: 312–20. [ Links ]
24. Assadian O, Berger A, Aspock C, Mustafa S, Kohlhauser C, Hirschl AM. Nosocomial outbreak of Serratia marcescens in a neonatal intensive care unit. Infect Control Hosp Epidemiol. 2002; 23: 457–61. [ Links ]
25. Ostrowsky BE, Whitener C, Bredenberg HK, et al. Serratia marcescens bacteremia traced to an infused narcotic. N Engl J Med. 2002; 346: 1529–37. [ Links ]
26. Neal TJ, Corkill JE, Bennett KJ, Yoxall CW. Serratia marcescens pseudobacteraemia in neonates associated with a contaminated blood glucose/lactate analyzer confirmed by moleculartyping. J Hosp Infect. 1999; 41: 219–22. [ Links ]
27. Larson EL, Cimiotti JP, Haas J. Gramnegative bacilli associated with catheter–associated and non–catheter–associated bloodstream infections and hand carriage by healthcare workers in neonatal intensive care units. Pediatr Crit Care Med. 2005; 6: 457–61. [ Links ]
28. Benjamin DK Jr, DeLong ER, Cotten CM, Garges HP, Clark RH. Postconception age and other risk factors associated with mortality following Gramnegative rod bacteremia. J Perinatol. 2004; 24: 169–74. [ Links ]
29. Aygun C, Yigit S, Gur D. Serratia marcescens: an emerging microorganism in the neonatal intensive care unit. Turki Pediatr. 2000; 42: 219–22. [ Links ]
30. Zaidi N, Konstantinou K, Zervos M. The role of molecular biology and nucleic acid technology in the study of human infection and epidemiology. Arch Pathol Lab Med. 2003; 127: 1098–105. [ Links ]
31. Hudome SM, Fisher MC. Nosocomial infections in the neonatal intensive care unit. Curr Opin Infect Dis. 200 I; 14: 303–7. [ Links ]
32. Lam BC, Lee J, Lau YL. Hand hygiene practices in a neonatal intensive care unit: a multimodal intervention and impact on nosocomial infection. Pediatrics. 2004; I 14: e565–7l. [ Links ]
33. Won SP, Chou HC, Hsieh WS. Handwashing program forthe prevention of nosocomial infections in a neonatal intensive care unit. Infect Control Hosp Epidemiol. 2004; 25: 742–6. [ Links ]














