Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.63 no.4 México jul./ago. 2006
Caso clínico
Aplasia adquirida de la serie roja por infección por parvovirus B19 en una adolescente con trasplante renal
Pure red cell aplasia caused by parvovirus B19 infection in a female adolescent after renal transplantation
Dra. Martha Portillo–Carrillo1, Dr. Luis Velásquez–Jones1, Dra. Rebeca Gómezchico–Velasco1,Dra. Mara Medeiros–Domingo1, Dr. Saúl Valverde–Rosas1, Dra. Verónica Reséndiz–Núñez1, Dra. Eunice Cuervo–Moreno1, Dr. Teodoro Muñiz–Ronquillo2, Dr. Gustavo Varela–Fascinetto3, Dr. Benjamín Romero–Navarro1
1 Departamento de Nefrología
2 Departamento de Hematología
3 Departamento de Cirugía de Trasplantes, Hospital Infantil de México Federico Gómez, México, D.F., México.
Solicitud de sobretiros.
Dr. Luis Velásquez Jones,
Departamento de Nefrología, Hospital Infantil de México Federico Gómez,
Dr. Márquez 162, Col. Doctores, Deleg. Cuauhtemoc,
C P. 06720, México, D. F.,
México.
Fecha de recepción: 22–05–2006.
Fecha de aprobación: 12–10–2006.
Resumen
Introducción. El parvovirus B19 ha sido identificado como el agente etiológico del eritema infeccioso o quinta enfermedad, de las crisis aplásicas transitorias en niños con enfermedades hemolíticas, y de la aplasia adquirida de la serie roja en pacientes inmunocomprometidos, incluyendo los pacientes que reciben un trasplante de un órgano sólido o de médula ósea.
Caso clínico. Adolescente femenina de 15 años de edad con insuficiencia renal crónica terminal de causa desconocida, quien recibió trasplante renal de donador cadavérico. Dos meses después del trasplante presentó anemia grave arregenerativa que requirió transfusiones de sangre, sin responder a la suspensión del tratamiento con mofetil micofenolato. Aunque la investigación de anticuerpos IgM e IgG contra el parvovirus B19 fue negativa, se encontró positividad en la investigación del DNA viral por medio de la prueba de reacción en cadena de la polimerasa. El estudio de la médula ósea mostró el patrón característico de pronormoblastos con cambios megaloblásticos y vacuolas en el citoplasma y detención en la maduración a nivel de los normoblastos. El tratamiento con inmunoglobulina intravenosa por 10 días se acompañó de respuesta reticulocitaria adecuada y corrección de la anemia.
Conclusiones. En los pacientes con trasplante renal y anemia grave arregenerativa debe investigarse la presencia de parvovirus B19, preferentemente a través de la prueba de reacción en cadena de la polimerasa. El tratamiento con inmunoglobulina intravenosa es el más adecuado para eliminar la infección y corregir el cuadro anémico.
Palabras clave. Trasplante renal; parvovirus B19; anemia; inmunoglobulina intravenosa; aplasia adquirida de serie roja.
Abstract
Introduction. Parvovirus B19 can present in children as erythema infectious rash, aplastic anemia in patients with hemolytic diseases and pure red cell aplasia in immunocompromised patients, such as in bone marrow and solid organ transplant recipients.
Case report. A 15–year–old female with end stage renal disease of unknown origin received a renal transplant from a cadaveric donor. Two months after the transplant, she presented severe arregenerative anemia despite mofetil micofenolate withdrawal and required blood transfusions. IgM and IgG titers for parvovirus B19 were negative, but DNA polymerase chain reaction was positive. Bone marrow showed the characteristic pattern of pronormoblasts with megaloblastic changes and cytoplasmic vaculations, with maturation arrest at normoblast level. The patient was treated with intravenous immunoglobulin for 10 days with adequate reticulocyte response and resolution of her anemia.
Conclusions. Parvovirus B19 should be investigated in renal transplant patients with severe arregenerative anemia; DNA polymerase reaction test is the diagnostic test of choice. Treatment with intravenous immunoglobulin is the recommended therapy for the control and elimination of the infection and anemia resolution.
Key words. Renal transplant; parvovirus B19; PCR diagnosis, intravenous immunoglobulin; acquired red cell aplasia.
Introducción
Actualmente el trasplante renal constituye el tratamiento de elección de los niños con insuficiencia renal crónica terminal.1 La morbilidad que presentan los niños con insuficiencia renal crónica y los aspectos diversos y complejos que rodean al trasplante renal pueden favorecer el desarrollo de diversas complicaciones. A este respecto, se ha observado que en forma global la frecuencia de complicaciones ha disminuido en las últimas tres décadas, debido a los progresos en las técnicas quirúrgicas, los mejores y más precisos métodos diagnósticos y a los avances en los esquemas de inmunosupresión utilizados. Sin embargo, las complicaciones infecciosas continúan siendo una causa importante de morbilidad y mortalidad en los pacientes trasplantados.2,3
A este respecto, el parvovirus B19 constituye una causa rara de aplasia adquirida de la serie roja en pacientes con trasplante renal. Aunque no se cuenta con estudios prospectivos de vigilancia, se ha estimado que la frecuencia de infecciones sintomáticas por parvovirus B19 en pacientes trasplantados varía entre 1 y 2%.4,5 La infección viral induce afección de las células progenituras eritroides, dando como resultado, en el estudio de la médula ósea, la presencia de pronormoblastos con cambios megaloblásticos y detención en la maduración de los normoblastos.6
Se presenta el estudio de una adolescente que recibió trasplante renal de donador cadavérico y quien posteriormente desarrolló anemia grave arregenerativa por infección por parvovirus B19, con respuesta favorable al tratamiento intensivo con inmunoglobulina intravenosa.
Presentación del caso clínico
Paciente femenina con diagnóstico de insuficiencia renal crónica terminal a la edad de 15 años.
No pudo determinarse la causa de la insuficiencia renal. Se mantuvo con tratamiento conservador, sin diálisis, y a los 17 años se le realizó trasplante renal de donador cadavérico. Después del trasplante el tratamiento inmunosupresor indicado fue basiliximab 20 mg el día cero y al cuarto día postrasplante, mofetil micofenolato 1 200 mg/m2sc/ día, tacrolimus 0.10 mg/kg/día, metilprednisolona 10 mg/kg/día por tres días y posteriormente prednisona 2 mg/kg/día en dosis de reducción. Al momento del alta, a las dos semanas postrasplante, presentó creatinina en suero de 1 mg/dL y hemoglobina en sangre de 10.8 g/dL.
Seis semanas después del trasplante presentó elevación de la creatinina en suero (2.2 mg/dL) y anemia grave con hemoglobina de 6.3 g/dL con descompensación hemodinámica. La investigación de infección por citomegalovirus y virus de Epstein–Barr fue negativa. El estudio de ultrasonido renal mostró discreta ectasia del sistema pielocaliceal. Con la sospecha de rechazo renal agudo se indicó tratamiento con metilprednisolona intravenosa (IV) a 10 mg/kg/día cada 24 horas por tres dosis. El estudio hematológico en este ingreso al hospital mostró que la anemia era de tipo normocítica, normocrómica, arregenerativa (sin elevación de reticulocitos en sangre); recibió una transfusión de concentrado eritrocitario desleucocitado. Por la sospecha de efecto tóxico de los inmunosupresores se suspendió el tratamiento con mofetil micofenolato y se egresó dos semanas después con nivel de creatinina en suero de 1.2 mg/dL y manejo inmunosupresor con tacrolimus a 0.22 mg/kg/día y prednisona 0.5 mg/kg/día. A su egreso el nivel de hemoglobina fue de 10.2 g/dL.
Diez días después reingresó al hospital por recurrencia de la anemia con hemoglobina de 6.9 g/dL, dolor en el sitio del injerto, hipertensión arterial (150/100 mm Hg) y elevación de la creatinina en suero a 1.9 g/dL. El estudio de ultrasonido renal mostró hidronefrosis de riñon trasplantado con dilatación ureteral por lo que se realizó laparotomía exploradora con liberación de fibrosis retroperitO' neal y bandas oclusivas del uréter del riñon trasplantado; además se colocó catéter doble "J".
Los estudios de laboratorio en este ingreso mostraron niveles séricos de hierro de 192 µg/dL (normal 50–170 µg/dL), vitamina B12 450.6 pg/mL (normal 150–900 pg/mL), ferritina 827.3 ng/mL (normal 104 ng/mL) y eritropoyetina 759 mU/mL (normal 9.0 a 28.0 mU/mL). Se realizó asimismo investigación de sangre oculta en heces y coproparasitoscópico en serie de tres con resultados negativos.
Se realizó nueva transfusión de concentrado eritrocitario desleucocitado en dosis de 10 mL/kg. La biometría hemática postransfusión mostró hemoglobina de 10.8 g/dL, hematócrito de 30.7%, leucocitos 12 700/mm3, segmentados 75%, linfocitos 14%, monocitos 9%, bandas 2%, eosinófilos 0% y plaquetas de 266 000/mm3. Se realizó determinación de anticuerpos antiparvovirus B19 observándose índice de 0.2 para IgG (negativo menor a 0.9) y de 0.3 para IgM (valor negativo menor de 0.9).
En este momento de la evolución se contaba con el resultado normal de la concentración en suero de vitamina B12 (además que la anemia no era de tipo megaloblástico), no se comprobó pérdidas ocultas de sangre en el tracto intestinal ni infestación por parásitos, los valores de hierro sérico eran normales y no se comprobó déficit en la producción de eritropoyetina por el riñon trasplantado. Además, los estudios para investigar infección por citomegalovirus y virus de Epstein–Barr así como el estudio serológico para infección por parvovirus B19 fueron negativos. Por lo anterior se consideró la anemia como consecuencia de la retención nitrogenada debido a la obstrucción ureteral, la cual fue corregida. Se concluyó por consiguiente que no existía efecto tóxico de los inmunosupresores por lo que se reinició tratamiento con mofetil micofenolato en dosis bajas (450 mg/m2sc/día) cada 12 horas. En este ingreso se realizó diagnóstico de diabetes mellitus secundaria al uso de tacrolimus, por lo cual se suspendió este medicamento y se inició tratamiento con ciclosporina 8 mg/kg/día, dividido cada 12 horas. Se egresó a los 14 días de su internamiento con hemoglobina de 8.2 g/dL y creatinina en suero de 1.6 g/dL.
Cuatro días después del egreso (tres meses después del trasplante renal) reingresa nuevamente al hospital con valores de hemoglobina de 6.9 g/dL y hematócrito de 19.7%, por lo que se transfundió concentrado eritrocitario a 10 mL/kg. Se solicitó estudio de reacción en cadena de la polimerasa para parvovirus B19, con resultado positivo. Simultáneamente, el estudio de aspirado de médula ósea mostró celularidad normal, megacariocitos normales en número y morfología, pronormoblastos con cambios megaloblásticos y vacuolas en el citoplasma y detención en la maduración a nivel de los normoblastos (Figs. 1 y 2).


Con el diagnóstico de aplasia adquirida de la serie roja por infección por parvovirus B19 se indicó tratamiento con inmunoglobulina humana en dosis de 0.4 g/kg/día IV por 10 días. A los ocho días de iniciado el tratamiento se observó hemoglobina de 10.5 g/dL y hematócrito de 30%, con respuesta reticulocitaria de 6%, leucocitos 7 000/ mm3, segmentados 54%, linfocitos 28%, monocitos 10%, bandas 8%, eosinófilos 0% y plaquetas 345 000/mm3.
En los cuatro meses siguientes de indicado el tratamiento con inmunoglobulina los niveles de hemoglobina en sangre han variado entre 8.9 y 10.4 g/dL y no se ha observado ningún episodio de anemia aguda que requiera nuevamente transfusión de concentrados eritrocitarios (Fig. 3).
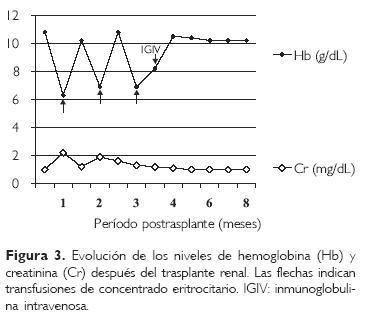
A las ocho semanas del tratamiento mencionado se realizó nuevo estudio de reacción en cadena de la polimerasa para parvovirus B19 con resultado negativo.
En su último control, a los ocho meses postrasplante, la biometría hemática mostró hemoglobina de 10.2 g/dL, hematócrito 30.4%, VCM 87.4 fL, HCM 29.4 pg, CHCM 33.6 g/dL, leucocitos 6 000/mm3, segmentados 56%, linfocitos 32%, monocitos 9%, eosinófilos 3%, bandas 0% y plaquetas 320 000/mm3; los niveles de creatinina en suero fueron de 1.3 g/dL, y el tratamiento indicado incluye mofetil micofenolato 769 mg/m2sc/día, ciclosporina 5.7 mg/kg/día y prednisona 0.12 mg/ kg/día.
Discusión
En las últimas dos décadas se ha observado un desarrollo considerable en el estudio, prevención y tratamiento de las complicaciones infecciosas en los receptores de trasplantes de órganos sólidos como el riñon. El espectro de las enfermedades infecciosas en este contexto se modifica continuamente y se ha tornado más complejo con la introducción de los tratamientos profilácticos y diagnóstico anticipado de algunas infecciones, los métodos de diagnóstico moleculares altamente sensibles, los nuevos agentes antimicrobianos y también la presencia actual de nuevos microorganismos emergentes.2
La familia Parvoviridae incluye diversos virus patogénicos en animales que han sido de interés de veterinarios y virólogos. Éstos incluyen el virus panleucopénico felino, parvo virus canino y parvovirus porcino. Los parvovirus dependen para replicarse de las células del huésped, particularmente de las células en proceso de división activa.7 Parvovirus B19 es el miembro más característico del género de los Eritrovirus, que incluye también un virus simiano similar,8 los cuales se propagan especialmente en las células eritroides progenituras.7
La infección por parvovirus B19 es frecuente en los niños; se ha observado que hacia la edad de 15 años hasta la mitad de los adolescentes ya presentan anticuerpos específicos antiparvovirus B19.9 Los adultos mayores generalmente ya son seropositivos para la infección. La paciente de este informe es posible que haya adquirido la infección en el período inmediato pre o postrasplante por exposición a las secreciones respiratorias de una persona infectada o, menos probablemente, al recibir un riñon de un donador infectado.10 Se ha descrito asimismo infección por parvovirus B19 a consecuencia de exposición nosocomial al virus.11
Las principales enfermedades causadas por el parvovirus B19 incluyen la quinta enfermedad o eritema infeccioso, artropatía, particularmente en mujeres adultas de mediana edad, crisis aplásicas transitorias en pacientes con eritropoyesis activa como en la esferocitosis hereditaria y enfermedad de células falciformes, hidrops fetalis y en pacientes con inmunodeficiencias primarias o secundarias como el síndrome de Nezelof, infectados por el virus de la inmunodeficiencia humana, que reciben quimioterapia citotóxica y receptores de trasplante de órganos.7
En la paciente motivo de este informe los estudios de laboratorio iniciales para determinar la causa de la anemia grave arregenerativa (sin respuesta reticulocitaria) fueron negativos. Así, no se encontraron infecciones bacterianas o por citomegalovirus y el virus de Epstein–Barr, por lo que se decidió suspender el tratamiento con el mofetil micofenolato, el cual se ha descrito puede producir leucopenia y sólo raramente pancitopenia.12
Sin embargo, en el siguiente ingreso al hospital se observó recurrencia de la anemia grave, demostrándose la presencia de hidronefrosis del riñon trasplantado y elevación de la creatinina en el suero. En este ingreso se realizó corrección de la obstrucción ureteral causante de la hidronefrosis. Los estudios de laboratorio realizados mostraron niveles normales de hierro sérico y vitamina B12 (además no se observó anemia megaloblástica característica de la deficiencia de vitamina B12), sin deficiencia en la producción de eritropoyetina. Asimismo, no se demostraron pérdidas ocultas de sangre en heces y la búsqueda de parásitos en el tracto digestivo fue negativa. Finalmente, no se encontraron niveles detectables de anticuerpos (IgG e IgM) contra parvovirus B19. Por esta razón, en este momento de la evolución de la paciente, se consideró que la anemia podría corresponder a la observada en los pacientes con retención nitrogenada.
Como ocurrió en el caso motivo de este estudio, se ha descrito que en los pacientes postras–plantados que reciben tratamiento inmunosupresor puede no observarse inicialmente elevación de los títulos de anticuerpos IgM (manifestación de infección reciente) o IgG (manifestación tardía de la infección).13,14 De esta manera, en ausencia de anticuerpos protectores la infección por parvovirus B19 persiste; a este respecto, se ha considerado que la aplasia de las células rojas, como la observada en esta paciente, es una manifestación de infección persistente por parvovirus B19. Por otro lado, al encontrar resultados negativos en este examen serológico en la paciente estudiada, se consideró en ese momento, erróneamente, que se descartaba la infección por parvovirus B19.
Sin embargo, debido a la persistencia de la anemia grave (con requerimientos transfusionales) se realizó el estudio del DNA viral por medio del ensayo de la reacción en cadena de la polimerasa (PCR), el cual dio resultados positivos. Simultáneamente, el estudio de la médula ósea mostró el patrón histológico característico de pronormoblastos gigantes con detención de la progresión de la serie a normoblastos, reticulocitos y finalmente eritrocitos.6
A pesar que el estudio del DNA viral por medio de PCR fue de tipo cualitativo, se considera que puede establecerse una relación de causa–efecto entre la infección viral y el desarrollo y persistencia de la anemia, en base a que se descartaron otras causas infecciosas de la anemia, ésta persistió a pesar de la suspensión del tratamiento con mofetil micofenolato y de la mejoría de la función renal, no se demostró deficiencia de hierro, de vitamina Bl2 y de la producción de eritropoyetina endógena y no hubo evidencia de anemia de tipo hemolítico ni por pérdidas intestinales u otros sangrados (en estos casos, además, la anemia es de tipo regenerativo, es decir con respuesta reticulocitaria); asimismo, el estudio de la médula ósea mostró un patrón celular completamente compatible con el diagnóstico de aplasia de la serie roja. Finalmente, se pudo demostrar una adecuada respuesta terapéutica a la administración de inmunoglobulina IV, lo cual apoya el diagnóstico planteado.
Otra de las complicaciones que presentó la paciente a consecuencia del tratamiento con tacrolimus fue la diabetes dependiente de insulina.15 El cambio de tacrolimus a ciclosporina permitió la reducción progresiva de la dosis de insulina y la remisión del cuadro de diabetes; esta complicación no tiene relación con la infección por parvovirus B19.16
La inmunoglobulina IV constituye una fuente adecuada de anticuerpos contra el parvovirus B19; la infección persistente responde habitualmente, como se observó en la paciente estudiada, a un curso de 5 a 10 días, en dosis de 0.4 g por kg de peso corporal por día,7 con declinación rápida del DNA viral en el suero, respuesta reticulocitaria e incremento de los niveles de hemoglobina en sangre.
El tratamiento con inmunoglobulina IV puede acompañarse de erupción cutánea semejante a la observada en el eritema infeccioso y manifestaciones articulares. En pacientes con trasplante renal se ha descrito como complicación la insuficiencia renal aguda; esta complicación se relaciona al parecer al alto contenido de sacarosa en la preparación IV, lo cual induce lesión renal osmótica con dilatación y vacuolización tubular.17
Sin embargo, se han propuesto métodos complementarios de tratamiento asociados al empleo de la gammaglobulina IV, o bien en algunos casos métodos alternativos. Así, en una revisión realizada por Geetha y col.18 en el año 2000, se informó que a esa fecha se habían publicado 26 casos de aplasia de la serie roja inducida por infección por parvovirus B19, en pacientes que recibieron un trasplante de órgano sólido, la mayoría (18 pacientes) de riñon; 12 de los pacientes se encontraban recibiendo tratamiento con base a ciclosporina y 14 a tacrolimus. Dieciséis de los pacientes recibieron tratamiento con inmunoglobulina IV, uno recibió inmunoglobulina IV y plasmaféresis, en cuatro se indicó inmunoglobulina IV y eritropoyetina, uno inmunoglobulina IV y conversión de tacrolimus a ciclosporina, uno presentó mejoría del hematócrito con tratamiento sólo con eritropoyetina y en tres pacientes la enfermedad se autolimitó. En el estudio mencionado, los autores informan el caso de un paciente adulto de 65 años de edad, quien recibió un trasplante renal de donador cadavérico; posteriormente el paciente presentó anemia grave que requirió transfusiones de sangre, demostrándose infección reciente por parvovirus B19 con estudio de la médula ósea compatible. Una semana después de descontinuar el tratamiento con mofetil micofenolato, se observó respuesta reticulocitaria y el paciente corrigió el cuadro anémico sin requerir tratamiento con inmunoglobulina IV. La suspensión del tratamiento con mofetil micofenolato en la paciente de este informe no condujo a corrección de la anemia, por lo cual al establecer el diagnóstico de infección por parvovirus B19 se indicó el manejo con inmunoglobulina IV.
En otro caso, informado por Rerolle y col.,19 se trató de un paciente adulto que recibió un trasplante renal y presentó anemia grave a consecuencia de infección por parvovirus B19. Debido a que el primer tratamiento con inmunoglobulina IV (1 g/kg/día por dos días) no indujo mejoría de la anemia, se decidió suspender la administración de azatioprina e indicar un nuevo tratamiento con inmunoglobulina IV, con lo cual se obtuvo respuesta adecuada y corrección de la anemia.
Se ha informado que el tratamiento concomitante con eritropoyetina recombinante e inmunoglobulina IV puede llevar al fracaso del tratamien' to instituido. A este respecto, se ha sugerido que el tratamiento con eritropoyetina facilita la infección viral al estimular la replicación de las células progenituras eritroides en la médula ósea, las cuales en este estado constituyen las únicas líneas celulares en las cuales ocurre reactivación y replicación viral.13
Se ha investigado la incidencia de la infección por parvovirus B19 en pacientes con trasplante renal y de otros órganos. Así, Gallinella y col.20 estudiaron la ocurrencia de la infección por parvovirus B19 en un total de 212 receptores de trasplante renal o de médula ósea y encontraron sólo un paciente que recibió trasplante de médula ósea con estudio de PCR positiva; ninguno de los 59 receptores de trasplante renal presentó la prueba positiva. Zolnourian y col.21 también observaron una baja frecuencia en pacientes con trasplante renal estudiados por medio de la PCR; entre 110 pacientes estudiados sólo dos presentaron la prueba positiva.
Por lo mencionado anteriormente, llamó la atención el estudio realizado recientemente por Ki y col.22 en pacientes adultos con trasplante renal, con el fin de conocer la incidencia y significado clínico de la infección por el parvovirus B19. De 167 pacientes estudiados, 52 (31.1%) fueron positivos al estudio del DNA viral por medio de la PCR; 20 de estos pacientes (12.0%) presentaron positividad de la prueba en más de dos estudios consecutivos en sangre y mostraron valores de hemoglobina en sangre significativamente menores (7.7 g/dL) que aquellos que no mostraron resultados positivos (11.1 g/dL) o tuvieron sólo un resultado positivo (11.8 g/dL). Finalmente, dos pacientes en este estudio desarrollaron aplasia de células rojas, confirmada por el estudio de la médula ósea; ambos pacientes recibieron tratamiento con inmunoglobulina IV por siete días con mejoría de la anemia. Los resultados presentados previamente muestran una incidencia muy alta de infección por parvovirus B19 en pacientes con trasplante renal; a este respecto, los autores señalaron que lo anterior probablemente se debió a que durante el período de estudio se observó un brote de infección por parvovirus B19 en la unidad de trasplante renal.22 En este estudio se hace evidente que el hallazgo de un examen positivo cualitativo del DNA viral, en caso de que no se realice una determinación cuantitativa de la carga viral,23 no necesariamente es indicativo de una infección activa ya que puede encontrarse en individuos no enfermos.24 En la paciente presentada se pudo plantear una probable relación causal debido a la prueba positiva y el desarrollo de anemia grave arregenerativa que no pudo ser explicada por otras causas. Asimismo, el hallazgo del estudio serológico de control negativo en esta paciente no indica necesariamente la eliminación completa del virus, sino que los niveles bajos de viremia probablemente persistentes se encuentran por debajo de la posibilidad de detección por medio de la prueba cualitativa empleada.
En la paciente estudiada no se observó alteración persistente de la función renal u otra manifestación de lesión glomerular (proteinuria o hematuria) durante el período que presentó anemia grave a consecuencia de la infección por parvovirus B19. Sin embargo, se ha descrito en algunos pacientes alteración de la función renal e incluso se ha relacionado la infección con el desarrollo de glomerulopatía colapsante.10,19,25,26 Sin embargo, en una de las series de pacientes con trasplante renal con la mayor frecuencia de infección por parvovirus B19 no se encontró manifestaciones de disfunción renal en ninguno de los 52 pacientes con prueba de PCR positiva para parvovirus B19.22
Otras complicaciones descritas en pacientes adultos y niños con trasplante renal e infección por parvovirus B19 han incluido manifestaciones del sistema nervioso central (déficit neurológicos focales, cefalea, crisis convulsivas focales, encefalopatía y hemiparesia) a consecuencia probablemente de vasculitis de causa viral25 y cuadro de hepatitis aguda con elevación de aminotransferasas.27,28
Referencias
1. Harmon WE. Pediatric renal transplantation. En: Avner ED, Harmon WE, Niaudet P, editores. Pediatric nephrology. Fifth ed. Philadelphia: Lippincott Williams & Wilkins; 2004. p. 1437–68. [ Links ]
2. Green M, Avery RK. Foreword. Am J Transplant. 2004; 4 Supl 10: 5. [ Links ]
3. Renoult E, Buteau C, Lamarre V, Turgeon N, Tapiero B. Infectious risk in pediatric organ transplant recipients. Is it increased with the new immunosuppressive agents? Pediatr Transplant. 2005; 9: 470–9. [ Links ]
4. Green M, Avery RK, Preiksaitis J. Guidelines for the prevention and management of infectious complications of solid organ transplantation. Am J Transplant. 2004; 4 Supl 10:92–4. [ Links ]
5. Broliden K. Parvovirus B19 infection in pediatric solid–organ and bone marrow transplantation. Pediatr Transplant. 2001; 5: 320–30. [ Links ]
6. Garewal G, Ahluwalia J, Varma N, Das R, Sakhuja VK, Vinay K. Parvovirus B19 infection–associated red–cell aplasia in renal transplant recipients: clues from the bone marrow. Transplantation. 2004; 77: 320–1. [ Links ]
7. Young SN, Brown KE. Parvovirus B19. N Engl J Med. 2004; 350: 586–97. [ Links ]
8. Brown KE, Young NS. The simian parvoviruses. Rev Med Virol. 1997; 7: 211–8. [ Links ]
9. Risk associated with human parvovirus B19 infection. MMWR Morb Mortal Wkly Rep. 1989; 38: 81–8, 93–7. [ Links ]
10. Yango A Jr, Morrisey P, Gohh R, Wahbeh A, Monaco A. Donor–transmitted parvovirus infection in a kidney transplant recipient presenting as pancytopenia and allograft dysfunction. Transplant Infect Dis. 2002; 4: 163–6. [ Links ]
11. Lui SL, Luk WK, Cheung CY, Chan TM, Lai KN, Peiris JSM. Nosocomial outbreak of parvovirus B19 infection in a renal transplant unit. Transplantation. 2001; 71: 59–64. [ Links ]
12. Al–Uzri A, Yorgin PD, Kling PJ. Anemia in children after transplantation: etiology and the effect of immunosuppressive therapy on erytropoiesis. Pediatr Transplant. 2003; 7: 253–64. [ Links ]
13. Kumar J, Shaver MJ, Abul–Ezz S. Long–term remission of recurrent parvovirus–B associated anemia in a renal transplant recipient induced by treatment with immunoglobulin and positive seroconversion. Transplant Infect Dis. 2005; 7: 30–3. [ Links ]
14. Arzouk N, Snanoudj R, Beauchamp–Nicoud A, Mourad G, Charpentier B, Tchernia G, et al. Parvovirus B19–induced anemia in renal transplantation: a role for rHuE–PO in resistance to classical treatment. Transplant Int. 2006; 19: 166–9 [ Links ]
15. Danovitch GM. Immunosuppressive medications and protocols for kidney transplantation. En: Danovitch GM, editor. Handbook of kidney transplantation. Fourth ed. Philadelphia: Lippincott Williams & Wilkins; 2005. p. 72–134. [ Links ]
16. Mathias RS. Chronic anemia as a complication of parvovirus B19 infection in a pediatric kidney transplant patient. Pediatr Nephrol. 1997; 11: 355–7. [ Links ]
17. Subtirelu MM, Flynn JT, Schechner RS, Pullman JM, Feuerstein D, del Rio M. Acute renal failure in a pediatric kidney allograft recipient treated with intravenous immunoglobulin for parvovirus BI9 induced pure red cell aplasia. Pediatr Transplant. 2005; 9: 801–4. [ Links ]
18. Geetha D, Zachary JB, Baldado HM, Kronz JD, Kraus ES. Pure red cell aplasia caused by parvovirus B19 infection in solid organ transplant recipients: a case report and review of literature. Clin Transplant. 2000; 14: 586–91. [ Links ]
19. Rerolle JP, Morelon M, Helal I, Peraldi MN, Mamzer–Brunnel MF, Kreis H. Parvovirus B19–related anaemia after renal transplantation. Scand J Infect Dis. 2004; 36: 513–6. [ Links ]
20. Gallinella G, Manaresi E, Venturoli S, Grazi GL, Musiani M, Zerbini M. Occurrence and clinical role of active parvovirus B19 infection in transplant recipients. Eur J Clin Microbiol Infect Dis. 1999; 18:811–3. [ Links ]
21. Zolnourian ZR, Curran MD, Rima BK, Coyle PV, O'Nell HJ, Middleton D. Parvovirus B19 in kidney transplant patients. Transplantation. 2000; 69: 2198–202. [ Links ]
22. Ki CS, Kim IS, Kim JW, Lee NY, Kim SH, Lee KW, et al. Incidence and clinical significance of human parvovirus B19 infection in kidney transplant recipients. Clin Transplant. 2005; 19: 751–5. [ Links ]
23. Daly P, Corcoran A, Mahon BP, Doyle S. High–sensitivity PCR detection of parvovirus B19 in plasma. J Clin Microbiol. 2002; 40: 1958–62. [ Links ]
24. Heegaard ED, Brown KE. Human parvovirus B19. Clin Microbiol Rev. 2002; 15: 485–505. [ Links ]
25. Moudgil A, Nast CC, Bagga A, Wei L, Nurmamet A, Cohen AH, et al. Association of parvovirus B19 infection with idiopathic collapsing glomerulopathy. Kidney Int. 2001; 59: 2126–33. [ Links ]
26. Moudgil A, Shidban H, Nast CC, Bagga A, Aswad S, Graham SL Parvovirus B19 infection related complications in renal transplant recipients: treatment with intravenous immunoglobulin. Transplantation. 1997; 64: 1847–50. [ Links ]
27. Bilge I, Sadikoglu B, Emre S, Sirin A, Aydin K, That B. Central nervous system vasculitis secondary to parvovirus B19 infection in a pediatric renal transplant patient. Pediatr Nephrol. 2005; 20: 529–33. [ Links ]
28. Lee PC, Hung CJ, Lei HY, Chang TT, Wang JR, Jan MS. Parvovirus B19–related acute hepatitis in an immunosuppressed kidney transplant. Nephrol Dial Transplant. 2000; 15: 1486– [ Links ]8.














