Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.63 no.1 México ene./feb. 2006
Artículo original
Procalcitonina semicuantitativa (PCT–Q) como prueba diagnóstica y marcador pronóstico en niños con sepsis bacteriana
Semiquantitative procalcitonin (PCT–Q) as a diagnostic tool and prognostic marker in children with bacterial sepsis
Dr. Norberto Gómez–Rivera1, Dr. Francisco Antonio Molina–Moreno5, Dra. María Guadalupe García–Zarate1, Dr. Jaime Castillo–Ramos2, Dr. Roberto Jesús García–Hernández3, Dra. Elba Vázquez–Pizaña6, Dr. Manuel Alberto Cano–Rangel4, M.C. Ignacio Fonseca–Chon7
1 Servicio de Urgencias
2 Servicio de Consulta Externa
3 Servicio de Consulta de Urgencias
4 Servicio de Infectología, Hospital Infantil del Estado de Sonora
5 Dirección del Hospital de Ginecología y Pediatría del IMSS en Hermosillo, Sonora
6 Medicina del Adolescente, Vicepresidenta Zona Norte de la Asociación Mexicana para la Salud de la Adolescencia A.C.
7 Universidad de Sonora, México.
Solicitud de sobretiros:
Dr. Norberto Gómez Rivera,
Servicio de Urgencias, Hospital Infantil del Estado de Sonora,
Reforma No. 355 Norte, Col. Ley 57,
C. P. 83100,
Hermosillo, Sonora, México.
Fecha de recepción: 02–08–2005.
Fecha de aprobación: 10–02–2006.
Resumen
Introducción. El presente trabajo evalúa la utilidad de la prueba para diagnóstico temprano de infección bacteriana, en pacientes con criterios de síndrome de respuesta inflamatoria sistémica (SRIS) por el método semicuantitativo (PCT–Q®), con otro grupo de pacientes que presenta SRIS sin infección bacteriana.
Objetivo: probar el poder diagnóstico de este nuevo marcador PCT–Q® en pacientes con infecciones bacterianas en una fase temprana, además como marcador pronóstico y mortalidad.
Material y métodos. Diseño: prueba diagnóstica. Se seleccionaron 2 grupos, uno con 22 pacientes con criterios de SRIS con infección bacteriana, demostrados con hemocultivos positivos (sepsis), y otro con 18 pacientes con criterios de SRIS sin infección bacteriana. Las variables estudiadas: PCT–Q® con punto de corte de > 10 ng/mL y mortalidad.
Resultados. Primer día en el grupo de estudio resultaron positivos 18 casos y 2 casos en el grupo de control, con un valor de P =0.00063, altamente significativo. En la mortalidad, al séptimo día, se presentaron 8 casos en el grupo de estudio y 1 caso en el grupo control, con un valor de P =0.04, significativo. En la distribución de sexos, en el grupo de estudio se presentaron 15 casos del sexo masculino, y 5 casos en el grupo control, en el sexo femenino 7 casos en el grupo de estudio y 13 casos en el grupo control, con un valor de P =0.01104 altamente significativo, con un riesgo relativo de 2.1428. La sensibilidad y especificidad en este estudio fue 82 y 89%; VPP de 90% y VPN de 80%. índice de mortalidad de 44.4%.
Conclusiones. La PCT–Q® es una herramienta útil en detectar pacientes con sepsis bacteriana en una fase temprana. Niveles persistentes > 10 ng/mL de PCT–Q® en pacientes con sepsis, ponen en correlación la gravedad de la enfermedad y muerte.
Palabras clave. PCT–Q® semicuantitativa; infección bacteriana; sepsis; síndrome de respuesta inflamatoria sistémica.
Abstract
Introduction. This study evaluates the utility of the semiquantitative determination of procalcitonin (PCT–Q®) in the early diagnosis of bacterial infection in patients with systemic inflammatory response syndrome (SIRS) and positive bacterial cultures with another group of patients that presented SIRS without positive bacterial cultures.
Objective: to evaluate PCT–Q® as a diagnostic tool of this new PCT–Q® marker in patients with bacterial infections in an early phase, besides and as prognostic marker in as prognosis and mortality Scoreboard.
Material and methods. Design: comparative and transversal cross sectional study. Two groups were selected. The study group: included 22 patients with SIRS and positive blood cultures, shown with positive blood cultives (sepsis). The control group: included 18 patients with SIRS criteria but negative bacterial cultures. The male to female distribution in both groups included 15/22 in the study group vs 5/18 in the controls; P =0.01104. The studied variables: PCT–Q® with a cut off > 10 ng/mL and mortality.
Results. On the first day, 18 cases in the study group and 2 cases in the control group, yielded a highly significant positive value; P =0.00063. By the 7th day, 8 deaths had occurred in the study group and only 1 in the control group; P =0.04. The mortality rate was of the 44.4% with a relative risk of 2.1428; the sensitivity and specificity in this study was 82 and 89% respectively.
Conclusions. The PCT–Q® is a useful tool for the early detection of patients with bacterial sepsis. Persistent levels > 10 ng/mL of PCT–Q in patients with sepsis, correlates the severity of the illness and death.
Keywords. Bacterial infections; septicemia; systemic inflammatory response syndrome; semiquantitative procalcitonin levels.
Introducción
En 1991, meses antes de la guerra del golfo, un grupo de médicos franceses, Bomande y col.,1 estudiando marcadores de daño pulmonar grave en pacientes quemados que inhalaban gases tóxicos, asoció la elevación de procalcitonina (PCT) a la situación de sepsis, o sea la presencia de síndrome de respuesta inflamatoria sistémica (SRIS) más un foco infeccioso bacteriano, observado en algunos de estos pacientes, y es a partir de aquí donde se inician los primeros estudios. Dos años después, Assicot y col.2 publicaron el primer estudio en 1993, y se comprobó la asociación entre infección bacteriana grave en niños y la elevación de la PCT.
La PCT es una proteína de 116 aminoácidos, con una secuencia idéntica a la prohormona de la calcitonina de 32 aminoácidos. En condiciones normales se produce en las células C de la glándula tiroides; en infecciones bacterianas graves o fúngicas presenta elevaciones importantes en sangre, hasta de 1 000 ng/mL; sin embargo, hay evidencias que en condiciones de infecciones bacterianas graves la PCT proviene de macrófagos y monocitos, especialmente de origen hepático, células neurocrinas del pulmón e intestino, y al parecer la producción de este biomarcador está inducida por el factor de necrosis tumoral alfa (TNF–α) y la interleucina 2 (IL–2).3–5
Desde la descripción inicial y novedosa de la PCT por Assicot y col.,2 en donde describen las elevaciones de esta prohormona en forma temprana en pacientes con sepsis bacteriana, numerosos estudios clínicos han informado a la PCT como un excelente biomarcador de infección bacteriana grave,6–8 incluso como marcador pronóstico en pacientes que presentan sepsis, o SRIS de etiología no infecciosa y que posteriormente, como complicación, evolucionan a ella.9,10
Desde el año 1996, la empresa alemana BRAHMS® comercializa un test inmunocromato–gráfico con determinación semicuantitativa de la PCT (PCT–Q®) y que se puede llevar a cabo en 30 min, a la cabecera del paciente, en un servicio de urgencias, la cual permite la identificación de la PCT en el suero o plasma, es de fácil realización y de bajo costo.
Una de sus principales características es poder diagnosticar en forma temprana un SRIS de origen infeccioso bacteriano y diferenciar otras etiologías que se acompañan con SRIS. Por lo mismo, actualmente se considera a la PCT un marcador de primer orden en el diagnóstico de enfermedad bacteriana invasiva grave.
Este trabajo tiene como objetivo comparar el poder diagnóstico de este biomarcador PCT–Q® semicuantitativo, en pacientes que cursan con SRIS con infección bacteriana agregada (sepsis), con otro grupo de pacientes que presentan SRIS sin infección bacteriana, y valorar este marcador como predictor de gravedad y muerte. El punto de corte de PCT–Q® en este análisis fue igual o mayor de 10 ng/mL.
Material y métodos
Mediante una encuesta transversal comparativa, se analizaron los registros clínicos de 102 pacientes de 1 mes a 18 años de edad, atendidos en el servicio de urgencias del Hospital Infantil del Estado de Sonora, por episodios de sepsis y SRIS, seleccionando 40 de ellos, que cumplieran con los criterios actuales, de las entidades mencionadas anteriormente. Tratados de enero de 2004 a marzo de 2005. Para el grupo de estudio se seleccionó una muestra conveniencia de 22 pacientes con SRIS e infección bacteriana, demostrados con hemocultivos positivos. Los criterios de SRIS, que se manifiesta por dos o más de las siguientes condiciones, fueron: temperatura más de 38° C o menos de 36° C, frecuencia cardiaca mayor de 90 latidos por minuto (L/m), frecuencia respiratoria mayor de 20 respiraciones por minuto (r/m) o glóbulos blancos mayor de 12 000 cel/mm3 o menor de 4 000 cel/mm3 o más de 10% de formas inmaduras. El grupo de control se constituyó por 18 pacientes con datos de SRIS según los criterios de Definitions Conference11 Con hemocultivos negativos, sin evidencia clínica de infección bacteriana, ingresados en la unidad del servicio de urgencias en el mismo período de tiempo.
Variables estudiadas
Independientes. SIRS con infección bacteriana (sepsis): se definió en el grupo de pacientes con criterios de sepsis con infección bacteriana a los pacientes que reunieran los criterios actuales para estas entidades (International Sepsis Definitions Conference. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis), con hemocultivos positivos. Los focos de infección más frecuentes fueron: abdomen (30%), sistema nervioso central (25%), pulmón (25%), y bacteriemia (20%).
SRIS sin infección bacteriana (sin sepsis): pacientes con criterios de SRIS sin infección bacteriana, pacientes que reunieron los criterios actuales para esta entidad ya definidos de SRIS (American College of Chest Physicians y la Society of Critical Care Medicine Intensive) ,11 con hemocultivos negativos, según los siguientes criterios: la presencia de dos o más de las siguientes manifestaciones clínicas, temperatura corporal mayor de 38° C o menor de 36° C, frecuencia cardiaca mayor de 90 l/m, taquipnea manifestada por frecuencia respiratoria mayor de 20 r/m, alteraciones en la cuenta leucocitaria mayor de 12 000 células/mm3 o menor de 4 000 células/mm3 o la presencia de más de 10% de neutrófilos inmaduros. Los pacientes incluidos fueron: politraumatizados (35%), asmáticos (30%), quemados (15%), cetoacidosis diabética (10%), cardiopatías congénitas descompensadas (5%), dermatosis atópica (3%), enfermedades autoinmunes sistémicas en actividad (2%).
Variables dependientes
PCT–Q igual o mayor de 10 ng/mL al primero, tercero, quinto y séptimo día del estudio y defunción relacionada a sepsis. La determinación de PCT sérica se realizó mediante técnica de PCT–Q® medida en nanogramos por mililitro (ng/mL), por la empresa Brahms Diagnostica, Berlín, Germany.
Para la ejecución de la prueba PCT–Q® se aplicaron seis gotas de suero en la cavidad redondeada del BRAHMS PCT–Q® mediante una pipeta adjunta, los restos de suero o plasma fueron desechados, después de 30 min (máximo 45). Una vez aplicada la prueba, se forma un complejo de anticuerpos de antígenos marcados, este complejo se mueve por el sistema del test, pasando por las bandas; según la intensidad del color rojo de las bandas va a ser directamente proporcional a la concentración de PCT. Asignando cuatro límites de concentraciones: < 0.5 ng/mL, > 0.5 ng/mL, > 2 ng/mL y > 10 ng/mL.
Tomando como punto de corte el valor de PCT–Q® sérica igual o mayor de 10 ng/mL, se consideraron como resultado positivo los valores que eran iguales o superiores a esta cifra, los días primero, tercero, quinto y séptimo del estudio. Para el valor predictivo de la gravedad de la enfermedad y muerte se procedió de igual modo, tomando como punto de corte los valores persistentes de PCT sérica mayor o igual a 10 ng/mL. De acuerdo con estos puntos de corte, se calculó el valor de P, la especificidad y sensibilidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN), índice de mortalidad y riesgo relativo.
Los hemocultivos fueron procesados en frascos de la marca Bactec, peds plus/f, colocándose posteriormente en incubadoras Bactecmodelo 9050 BD. Al presentar crecimiento en tres a cinco días, se identifican las colonias con resiembras en agar sangre, agar chocolate y MacConkey, se incuban a 35° C, y en el medio de Sabouraud a temperatura ambiente.
Criterios de inclusión: pacientes con datos de sepsis con hemocultivos positivos y pacientes con criterios de SRIS con hemocultivos negativos. Determinación de PCT–Q® en todos los casos. Sin tratamiento previo con antibióticos. Edad 1 mes a 18 años.
Criterios de exclusión: haber recibido antibióticos y hemoglobina igual o menor de 5 g/dL.
Criterios de eliminación: transferencia a otro centro hospitalario, expediente clínico incompleto.
La relación grupo de estudio–grupo control fue de 1:1.2.
Análisis estadístico
Se realizó usando el software estadístico JMP versión 5.12. Las herramientas estadísticas usadas fueron ji cuadrada, considerándose significativo un valor de P < 0.05. Análisis de sensibilidad y especificidad, VPP y VPN e índice de mortalidad.
Resultados
En el primer día de ingreso hospitalario en el grupo de estudio resultaron positivos 18 casos, y dos en el grupo control, con un valor de P =0.00063, altamente significativo. En la mortalidad se presentaron ocho casos en el grupo de estudio y un caso en el grupo de control, con un valor de P = 0.04, significativo (Cuadro 1).
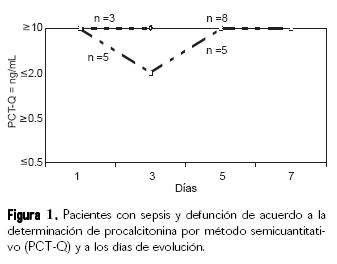
Los pacientes con sepsis y defunción, de acuerdo a la determinación de PCT por método semi–cuantitativo (PCT–Q®) y a los días de evolución, se presentaron en ocho casos, el día de ingreso 100% de estos casos con PCT–Q® igual o mayor de 10 ng/mL, tres pacientes fallecieron al tercer día con determinaciones de PCT–Q® igual o mayor de 10 ng/mL. Los restantes cinco pacientes disminuyeron las determinaciones al tercer día a igual o menor de 2 ng/mL, para posteriormente presentar incremento al quinto y séptimo día del fallecimiento (Fig. 1).
De los pacientes con sepsis sin defunción de acuerdo a la determinación de PCT por método semicuantitativo (PCT–Q®) y a los días de evolución, se presentaron en 10 casos, en el primer día de inicio del tratamiento, 100% el valor de PCT–Q® en igual o mayor de 10 ng/mL, en dos de ellos las determinaciones de PCT–Q® resultaron iguales o mayores de 10 ng/mL los días primero y tercero, para posteriormente presentar disminución progresiva al quinto junto con los ocho pacientes restantes (Fig. 2).

Tomando como punto de corte PCT–Q® mayor o igual a 10 ng/mL, se obtuvo una sensibilidad de 82% y una especificidad de 89%, con un VPP de 90% y un VPN de 80%. El índice de mortalidad de 44.4% (Cuadros 2 y 3).


En la distribución de sexos en ambos grupos se observaron 15 casos del sexo masculino en el grupo de estudio y cinco casos en el grupo de control; del sexo femenino fueron siete casos en el grupo de estudio y 13 en el grupo de control, con un valor de P =0.01104, altamente significativo, con un riesgo relativo de 2.142857 (Cuadro 4).
Discusión
Una característica de un buen marcador es el que puede diferenciar el SRIS secundario a infección bacteriana grave de otros SRIS de etiología viral o de otros tipos de condicionantes que pueden producir un SRIS.
Recientes publicaciones sugieren que este pudiera ser el marcador ideal de infección bacteriana.12,13 Como lo muestran nuestros resultados, los valores de PCT–Q® iguales o mayores de 10 ng/mL fueron muy evidentes en el grupo de pacientes con SRIS con infección bacteriana agregada (sepsis) (grupo de estudio), con relación al grupo de pacientes con SRIS sin infección bacteriana (grupo control), con un valor de P =0.00063, altamente significativo (Cuadro 1), lo que muestra la importancia de este biomarcador para poder diferenciar un SRIS secundario a infección bacteriana de los que no lo son, ya que los cambios en la temperatura del cuerpo, leucocitosis o leucopenia, taquicardia y taquipnea, también pueden presentarlo los pacientes con SRIS sin infección bacteriana, por lo tanto, el diagnóstico temprano que permite distinguir un SRIS con infección bacteriana agregada (sepsis), implica a este marcador como un gran avance en el campo clínico, principalmente en la toma de decisiones para el uso de antibióticos, y además, no sólo refleja la presencia de infección bacteriana, sino también su gravedad,14–16 como lo muestran los resultados de este estudio.
Un análisis reciente por Casado–Flores y col.17 mostró una casuística donde se incluye a 35 niños con sepsis y choque séptico por meningococcemia, reportando que los niveles más altos y persistentes de PCT estaban presentes en los pacientes que no sobrevivieron, resultados parecidos a este estudio, en donde se observó en tres de los ocho casos, la persistencia del valor de PCT–Q® en valores iguales o mayores de 10 ng/mL al tercer día del fallecimiento, en los cinco pacientes restantes el valor de la PCT–Q® disminuyó igual o menor de 2 ng/mL, para volver a incrementarse al quinto día en cifras iguales o mayores de 10 ng/mL hasta el fallecimiento al séptimo día, además presentaron disminución en los valores de PCT–Q® al tercer día del estudio, para posteriormente incrementarse al quinto y séptimo día del fallecimiento (Fig. 1).18
El índice de mortalidad en pacientes con sepsis, sepsis grave y choque séptico observado en este análisis fue de 0.444, no difiriendo de lo publicado.19,20
Los 10 pacientes con sepsis que sobrevivieron del grupo de estudio con PCT–Q® igual o menor de 10 ng/mL, en dos de ellos el valor de PCT–Q® se mantuvo en cifras iguales o mayores de 10 ng/ mL hasta el tercer día, para posteriormente presentar disminución junto con los ocho casos restantes a partir del quinto y séptimo día (Fig. 2). En este sentido, los resultados de este estudio concuerdan con lo publicado por otros autores en considerar a este marcador –PCT–Q®–, como predictor para monitorizar la respuesta de éxito o fracaso en la terapéutica del paciente en estado crítico con sepsis en cualquiera de sus modalidades clínicas.21–24
En cuanto a la sensibilidad y especificidad en este estudio, existen diferencias a lo reportado por otros autores; los resultados en este apartado no fueron tan altos a lo publicado por otros autores.21,25 Teniendo como estándar de oro los resultados de los hemocultivos y los criterios en las definiciones de SRIS y sepsis, la sensibilidad fue de 82% y especificidad de 89%, con un VPP de 90% y un VPN de 80%, las cuales se consideran aceptables.
El punto de corte y las variables independientes en este estudio, difieren de los encontrados en otros trabajos, dadas las distintas asignaciones en otros estudios, la técnica utilizada para la detección de PCT (cuantitativa–semicuantitativa), los diferentes grupos de estudio, y los puntos de corte de la PCT en cada estudio; sin embargo, entre los más representativos que se pueden comparar con éste, se encuentran los trabajos de Moulin y col.,26 donde se describe una sensibilidad de 86% y una especificidad de 87.5%, en pacientes que presentaban SRIS secundario a neumonía neumocócica, confirmada con hemocultivos, utilizando un punto de corte de 1 ng/mL en la forma cuantitativa (luminométrica).
En otros trabajos, utilizando el método cuantitativo (luminométrica) se confirma a la PCT con una sensibilidad de 93% y especificidad de 98% frente a la PCR (proteína C reactiva) cuantitativa en pacientes con infección bacteriana grave, con un punto de corte de 2 ng/mL,27,28 sin embargo, ha sido señalado por otros autores los puntos de corte igual o mayor de 2 ng/dL, con estos niveles es difícil de diferenciar entre SRIS de origen bacteriano de otro tipo de etiologías que también producen SRIS, considerándolo en algunas publicaciones como "zona gris".29–31 Por estas mismas razones, en este análisis se tomó el punto de corte más alto en las determinaciones de la PCT–Q®, para considerar como sepsis positiva una PCT–Q® igual o mayor de 10 ng/mL en el grupo de estudio (Cuadros 2 y 3).
Es interesante resaltar que en los dos casos reportados del grupo de control con PCT–Q® igual o mayor de 10 ng/mL, el SRIS fue secundario en el primer caso a quemadura grave con 40% de superficie corporal quemada, y el segundo caso, por traumatismo craneoencefálico grave; esto demuestra que los resultados máximos de PCT–Q®, en este grupo de pacientes, no difieren de los pacientes con sepsis grave o choque séptico,32–34 por lo tanto, el uso de PCT–Q® como marcador temprano de infección bacteriana en estos pacientes en estado crítico, debe tomarse con cautela.
Por otra parte, cuando se analizó la distribución del sexo en ambos grupos, pudo observarse la predominancia del sexo masculino con respecto al femenino, con una diferencia muy significativa (P =0.01104); resultados similares al de este estudio han sido reportados por diferentes autores,35–37 en relación a la predominancia del sexo masculino en eventos sépticos. Lo interesante de los resultados de este estudio es el riesgo relativo observado en ambos grupos, en donde el riesgo en los pacientes con sepsis y con marcador de PCT–Q® con cifras iguales o mayores de 10 ng/mL es 2.1 veces mayor en el hombre que en la mujer (Cuadro 4).
En resumen, se puede concluir que la PCT–Q® es un marcador útil y rápido, práctico en un servicio de urgencias, con una sensibilidad y especificidad aceptables; se confirma en este estudio a la PCT–Q® como una herramienta de apoyo ante sospechas de enfermedades bacterianas graves, principalmente en el primer día, punto importante dentro de la clínica en la toma de decisiones y en el uso de antibióticos.
Su capacidad como predictor pronóstico y de mortalidad ayuda a detectar a pacientes de alto riesgo para el manejo en una sala de cuidados intensivos.
Niveles persistentes iguales o mayores de 10 ng/ mL de PCT–Q® en pacientes con sepsis, ponen en correlación la gravedad de la enfermedad y muerte. La PCT–Q® resulta ser buen marcador de sepsis, de determinación rápida, al alcance de laboratorios, sin equipamiento sofisticado.
Así mismo, se puede mencionar que la PCT–Q®, por sí sola, no puede considerarse como estándar de oro y debe ser valorada en forma conjunta con la clínica, como una herramienta más de laboratorio, teniendo siempre presente el aspecto clínico de los pacientes.
Cabe aclarar que el tamaño de muestra no permite un análisis concluyente, por lo que se deberá ampliar y diseñar nuevamente para corroborar si el fenómeno se repite de nueva cuenta.
Referencias
1. Bomande–Rodríguez L, Camaño–Santos B, Alonso–Martín MR. La procalcitonina como marcador de infección. Una revisión desde atención primaria. Rev Pediatr Aten Prim. 2002; 16: 619–30. [ Links ]
2. Assicot M, Gendrel D, Carsin H, et al. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet. 1993; 341: 515–8. [ Links ]
3. Bohuon C. A brief history of pro–calcitonin. Intensive Care Med. 2000; 25: 146–7. [ Links ]
4. Korczowski B, Bijo A, Rybak A. Procalcitonin in diagnosis of purulent and aseptic meningitis in children. Polski Merkuriusz Lekarski. 2000; 9: 755–7. [ Links ]
5. Müller B, Becker KL. Procalcitonin: How a hormone became a marker and mediator of sepsis. Swiss Med Wkly. 2001; 131: 595–602. [ Links ]
6. Natanson C, Danner RL, Reilly JM, et al. Antibiotics versus cardiovascular support in a canine model of human septic shock. Am J Physiol. 1990; 259: H1440–7. [ Links ]
7. Bernardin G, Pradier C, Tiger F, et al. Blood pressure and arterial lactate level are early indicators of short term survival in human septic shock. Intensive Care Med. 1996; 22: 17–25. [ Links ]
8. Rivers E, Nguyen B, Havstad S, et al. Early goal–directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001; 345: 1368–77. [ Links ]
9. Heath CH, Grove DI, Look DF. Delay in appropriate therapy of Legionella pneumonia associated with increased mortality. Euro J Clin Microbiol Infect Dis. 1996; 15: 286–90. [ Links ]
10. Wheeler AP, Bernard GR. Treating patients with severe sepsis. N Engl J Med. 1999; 340: 207–14. [ Links ]
11. Society of Critical Care Medicine Consensus Conference Committee: American College of Chest Physicians/ Society of Critical Care Medicine Consensus Conference: Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med. 1992; 20: 864–74. [ Links ]
12. Dybdahl B, Wahba A, Lien E, Flo TH, Waage A, Qureshi N, et al. Inflammatory response after open heart surgery: release of heat–shock protein 70 and signaling through toll–like receptor–4. Circulation. 2002; 105: 685–90. [ Links ]
13. Reinhart K, Meisner M, Hartog C. Diagnosis of sepsis: Novel and conventional parameters. Adv Sepsis. 2001; 2: 46–8. [ Links ]
14. Pinkola K, Magy S. Procalcitonin rapid test in surgical patients treated in the intensive care unit. J Pediatr. 2001; 54: 368–70. [ Links ]
15. Fernández–López A. Procalcitonin in pediatric emergency departments for the early diagnosis of invasive bacterial infections in febrile infants: results of a multicenter study and utility of a rapid qualitative test for this marker. Pediatr Infect Dis J. 2003; 22: 895–903. [ Links ]
16. Prat C, Domínguez J, Rodrigo C, et al. Procalcitonin, C–reactive protein and leukocyte count in children with lower respiratory tract infection. Pediatr Infect Dis J. 2003; 22: 963–8. [ Links ]
17. Casado–Flores J, Blanco–Quiroz A, Asensio J, et al. Serum procalcitonin in children with suspected sepsis: A comparison with C–reactive protein and neutrophil count. Pediatr Crit Care Med. 2003; 4: 190–5. [ Links ]
18. Suprin E, Camus C, Gacouin A, et al. Procalcitonin: a valuable indicator of infection in a medical ICU? Intensive Care Med. 2000; 26: 1232–8. [ Links ]
19. Moulin F, Raymond J, Lorrot R, Marc E, Coste J, Iñiguez JL, et al. Procalcitonin in children admitted to hospital with community acquired pneumonia. Arch Dis Child. 2000; 84: 332–6. [ Links ]
20. Hatherill M, Tibby SM, Sykes K, et al. Diagnostic markers of infection: comparison of procalcitonin with C reactive protein and leukocyte count. Arch Dis Child. 1999; 81: 417–42. [ Links ]
21. Reny JL, Vuagnat A, Ract C, et al. Diagnosis and follow–up of infections in intensive care patients: Value of C–reactive protein compared with other clinical and biological variables. Crit Care Med. 2002; 30: 529–35. [ Links ]
22. Gramm HJ, Hannemann L. Activity markers for the inflammatory host response and early criteria of sepsis. Clin Intensive Care. 1996; 7. [ Links ]
23. Aouifi A, Piriou V, Bastien O, et al. Usefulness of procalcitonin for diagnosis of infection in cardiac surgical patients. Crit Care Med. 2000; 28: 3171–6. [ Links ]
24. Selberg O, Hector H, Martin M, et al. Discrimination of sepsis and systemic inflammatory response syndrome by determination of circulating plasma concentrations of procalcitonin, protein complement 3a, and interleukin–6. Crit Care Med. 2000; 28: 2793–8. [ Links ]
25. Wanner G, Keel M, Steckholzer U, et al. Relationship between procalcitonin plasma levels and severity of injury, sepsis, organ failure, and mortality in injured patients. Crit Care Med. 2000; 28: 950–7. [ Links ]
26. Moulin F, Raymond J, Lorrot M, et al. Procalcitonin in children admitted to hospital with community acquires pneumonia. Arch Dis Child. 2000; 84: 332–61. [ Links ]
27. Hatherill M, Tibby SM, Sykes K, et al. Diagnostic markers of infection: comparison of procalcitonin with C reactive protein and leukocyte count. Arch Dis Child. 1999; 81: 417–21. [ Links ]
28. Leclerc F, Cremer R, Noizet O. Procalcitonin as a diagnostic and prognostic biomarker of sepsis in critically ill children. Pediatr Crit Care Med. 2003; 4: 197–201. [ Links ]
29. Brunkhorst FM, Eberhard OK, Brunkhorst R. Discrimination of infectious and noninfectious causes of early acute respiratory distress syndrome by procalcitonin. Crit Care Med. 1999; 27: 2172–6. [ Links ]
30. Miller PR, Munn DD, Meredith JW, et al. Systemic inflammatory response syndrome in the trauma intensive care unit: Who is infected? J Trauma. 1999; 47: 1004–8. [ Links ]
31. Ugarte H, Silva E, Mercan D, et al. Procalcitonin used as a marker of infection in the intensive care unit. Crit Care Med. 1999; 27. [ Links ]
32. Enguix A, Rey C, Concha A, et al. Comparison of procalcitonin with C–reactive protein and serum amyloid for the early diagnosis of bacterial sepsis in critically ill neonates and children. Intensive Care Med. 2001; 27: 211–5. [ Links ]
33. Hatherill M, Tibby SM, Sykes K, et al. Diagnostic markers of infection: comparison of procalcitonin with C reactive protein and leukocyte count. Arch Dis Child. 1999; 81: 417–21. [ Links ]
34. Fernández–López A, Luaces–Cubells C, García–García JJ, Fernández–Pou J. Procalcitonin in pediatric emergency departments for the early diagnosis of invasive bacterial infections in febrile infants: results of a multicenter study and utility of a rapid qualitative test for this marker. Pediatr Infect Dis J. 2003; 22: 895–903. [ Links ]
35. Tschaikowsky K, Hedwig–Geissing M, Schiele A, et al. Coincidence of pro–and anti–inflammatory responses in the early phase of severe sepsis: Longitudinal study of mononuclear histocompatibility leukocyte antigen DR expression, procaicitonin, C–reactive protein, and changes in T–cell subsets in septic and postoperative patients. Crit Care Med. 2002; 30: 1015–23. [ Links ]
36. Han YY, Doughty LA, Kofos D, Sasser H, Carcillo JA. Procaicitonin is persistently increased among children with poor outcome from bacterial sepsis. Pediatr Crit Care Med. 2003; 4: 21–5. [ Links ]
37. Wanner GA, Keel M, Steckholzer U, Beier W, Stocker R, Ertel W. Relationship between procalcitonin plasma levels and severity of injury, sepsis, organ failure, and mortality in injured patients. Crit Care Med. 2000; 28: 950–7. [ Links ]














