Introducción
Las cardiopatías congénitas son las malformaciones congénitas con mayor morbilidad y mortalidad en la infancia1. La incidencia anual mundial de estos defectos es de 8 a 12 casos por cada 1000 recién nacidos vivos2. Aproximadamente, 2-3 de estos niños presentarán síntomas graves antes de alcanzar el año de vida, y aun cuando el 50% de ellos logrará ser diagnosticado luego del nacimiento, el porcentaje restante afrontará una realidad distinta en los países en vías de desarrollo, en los que la detección temprana es infrecuente3. Las malformaciones cardiovasculares se ubican entre las 10 primeras causas de mortalidad infantil en 22 de 28 países de América4. Tanto en Colombia en general como en Cartagena de Indias, estas anomalías ocupan el tercer puesto de todos los defectos congénitos, con una prevalencia estimada en 15.73 por cada 10,000 nacidos vivos, siendo la segunda causa de muerte en niños menores de 1 año4,5.
El tratamiento de las cardiopatías congénitas precisa calcular el riesgo quirúrgico, según la complejidad de cada intervención, mediante escalas que pueden excluir información relevante para el pronóstico perioperatorio6. Se ha descrito que las malformaciones cardíacas congénitas cursan con una respuesta inflamatoria que se exacerba al desarrollar insuficiencia cardíaca; la gravedad de dicha reacción antes y después de la cirugía se relaciona con las tasas de morbilidad y mortalidad de estos padecimientos7. Algunos marcadores inflamatorios se han utilizado en el pronóstico perioperatorio de estas lesiones, pero las conclusiones de los estudios son limitadas y no permiten llevarlos a la práctica8. El ancho de distribución eritrocitaria (ADE) se vislumbra como una herramienta pronóstica gracias al creciente número de publicaciones que mencionan su capacidad para predecir la mortalidad en diversas patologías9. El ADE, al ser una medida que cuantifica el tamaño de los eritrocitos circulantes, se expresa como un porcentaje que oscila entre el 12% y el 15% como límites de referencia10. Utilizado en el diagnóstico de las anemias, este índice ha demostrado tener utilidad en el pronóstico de mortalidad11. Tal hallazgo fue publicado por primera vez en el año 2007, cuando Felker et al.11 describieron para el ADE una faceta desconocida: su uso como predictor de morbilidad y mortalidad en pacientes con falla cardíaca crónica. A la fecha, no existen estudios similares que describan su empleo en población pediátrica de Suramérica12.
Desde finales del año 2014, el Hospital Infantil Napoleón Franco Pareja, de la ciudad de Cartagena de Indias, Colombia, cuenta con un servicio de cirugía cardiovascular que hasta el mes de enero de 2017 intervino cerca de 223 pacientes con cardiopatías. Su necesidad de establecer el riesgo perioperatorio generó la inquietud descrita como el objetivo principal del presente estudio: indagar sobre la capacidad del ADE como herramienta de pronóstico en pacientes pediátricos sometidos a corrección quirúrgica de cardiopatía congénita en esta ciudad del Caribe colombiano.
Método
El presente es un estudio observacional, analítico, de corte transversal, llevado a cabo en la Fundación Hospital Infantil Napoleón Franco Pareja, que incluyó pacientes entre 0 y 17 años del Programa de Cirugía Cardiovascular Pediátrica de la institución. Se obtuvieron 104 registros desde el año 2014 (cuando se inauguró dicho servicio) hasta el año 2017. De estos, se excluyeron 59 al constatar que no contaban con la valoración paraclínica completa para establecer el curso perioperatorio. Luego de refrendar la disponibilidad de datos en las historias clínicas, se seleccionaron finalmente 45 pacientes en los que fue posible extraer los valores del ADE antes de la cirugía, luego de 24 horas de la intervención quirúrgica y previo al egreso o deceso.
El riesgo prequirúrgico fue establecido según la escala RACHS-1 (Risk Adjustment in Congenital Heart Surgery), desarrollada por el Boston Children's Hospital13. Esta escala categoriza 207 procedimientos quirúrgicos en seis grupos con riesgo de mortalidad similar, ubicando en el primero aquellos procedimientos que suponen un riesgo quirúrgico menor, hasta alcanzar progresivamente el sexto grupo, que contiene los procedimientos con mayor complejidad quirúrgica y mayor riesgo de mortalidad perioperatoria13.
Análisis estadístico
Los datos fueron registrados en una base de datos construida en Excel y analizados por el programa estadístico Statistical Package for Social Sciences Version 20.0. para Windows (SPSS® Statistics para Windows - Multilenguaje Español - 2011. IBM SPSS Statistics, Armonk, NY: IBM Corp.). Las variables de estudio se analizaron para determinar patrones de distribución de datos estimando medidas de tendencia central (media y mediana) y medidas de dispersión (desviación estándar y rango intercuartílico). Para comparar variables según el primer y el último rangos intercuartílicos, se aplicó la prueba χ2 o el test exacto de Fisher para las variables categóricas, y la U de Mann-Whitney para las demás variables no paramétricas. Se consideraron estadísticamente significativos los valores de p < 0.05.
Para determinar el desempeño de la predicción del ADE y el puntaje RACHS-1 en cuanto a mortalidad, se empleó el análisis por curvas receptor operador (ROC), identificando el punto de corte con mayores sensibilidad, especificidad, valor predictivo negativo y valor predictivo positivo, y expresando la probabilidad del desenlace con la estimación del área bajo la curva. Para calcular la diferencia entre el área bajo la curva del ADE vs. RACHS-1 se utilizó la prueba de Hanley-McNeil mediante el programa MedCalc para Windows, versión 19.4 (MedCalc Software, Ostend, Belgium). La correlación de los valores del ADE prequirúrgico, posquirúrgico y posquirúrgico tardío con desenlaces secundarios se estableció mediante el coeficiente de correlación rho de Spearman.
Este estudio fue aprobado por el Departamento de Investigaciones de la Universidad de Cartagena bajo el registro No. 981, fechado el 13 de junio de 2018. Su ejecución cumple con las normas éticas dispuestas en la Resolución 008430 de 1993 del Ministerio de Salud de Colombia y detenta la categoría de investigación sin riesgo.
Resultados
Los datos demográficos y los antecedentes de la población se encuentran en la tabla 1. En el total de los 45 individuos incluidos, la mediana de edad fue de 6 meses. Hubo una proporción similar de hombres y mujeres (53.3% hombres). El 20% de los todos los niños tenían un síndrome genético asociado, siendo el síndrome de Down el más frecuente (11% de los 45 sujetos). El 44.4% estuvieron en la unidad de cuidados intensivos neonatal, y de estos, solo dos individuos ameritaron ventilación mecánica durante esa etapa. Adicionalmente, el 13.3% requirieron hospitalización en la unidad de cuidados intensivos pediátrica en algún momento previo a la corrección quirúrgica cardiovascular.
Tabla 1 Características demográficas y antecedentes de la población de estudio y su distribución de acuerdo con el primer y último cuartiles del ADE prequirúrgico
| Variables | Me (RIC) o n (%) (n = 45) | Primer cuartil ADE < 14.2% (n = 14) | Último cuartil ADE > 15.52% (n = 18) | p |
|---|---|---|---|---|
| Características demográficas | ||||
| Edad | 6 (2-21) | 6 (2.75-53.5) | 4.5 (1-11) | 0.11 |
| Sexo masculino | 24 (53.3%) | 8 (57.5%) | 11 (61.1%) | 0.8 |
| Departamento Bolívar | 31 (68.9%) | 9 (64.3%) | 12 (66.7%) | 0.8 |
| Régimen subsidiado | 43 (95.6%) | 13 (92.6%) | 18 (100%) | -* |
| Convivencia con la madre | 44 (97.8%) | 14 (100%) | 17 (94.4%) | - |
| Convivencia con el padre | 35 (77.8%) | - | ||
| Antecedentes | ||||
| Vía del parto | ||||
| Cesárea | 25 (55.6%) | |||
| No datos | 9 (20%) | |||
| Edad gestacional | ||||
| Término | 28 (62.2%) | |||
| Pretérmino | 7 (15.6%) | |||
| Postérmino | 3 (6.7%) | |||
| No datos | 7 (15.6%) | |||
| Lactancia | ||||
| Materna exclusiva | 5 (11.1%) | |||
| Fórmula | 2 (4.4%) | |||
| Mixta | 27 (60% | |||
| No datos | 11 (24.4%) | |||
| Defectos perinatales | ||||
| Sí | 16 (35.6%) | |||
| No datos | 9 (20%) | |||
| Síndrome genético | ||||
| Sí | 9 (20%) | |||
| No datos | 36 (80%) | |||
| Síndrome de Down | 5 (11%) | |||
| Diagnóstico de cardiopatía | ||||
| congénita | 10 (22.2%) | |||
| Sí | 32 (71.1%) | |||
| No datos | ||||
| Estancia en UCIN previa | 20 (44.4%) | |||
| Sí | 7 (15.6%) | |||
| No datos | ||||
| VM durante etapa neonatal | 2 (4.4%) | |||
| Sí | 11 (24.4%) | |||
| No datos | ||||
| Estancia en UCIP previamente | 6 (13.3%) | |||
| Sí | 6 (13.3%) | |||
| No datos | ||||
| Medicación previa | 26 (57.8%) | |||
| Cardiovascular | 15 (33.4%) | |||
| No cardiovascular | 11 (24.4%) | |||
| No aplica | ||||
| Adherencia | 1 (2.2%) | |||
| No | 23 (51.1%) | |||
| Sí | 3 (6.7%) | |||
| No datos | 18 (40%) | |||
| No aplica | 9 (20%) | |||
| Antibiótico previo |
*Variables no calculadas por datos no disponibles en registro de historias clínicas; Me (RIC): mediana (rango intercuartílico); UCIN: unidad de cuidados intensivos neonatal; UCIP: unidad de cuidados intensivos pediátrica; VM: ventilación mecánica.
La comorbilidad durante la hospitalización quirúrgica y la frecuencia de las patologías se presentan en la tabla 2. El 91.1% de los individuos requirieron ECMO (oxigenación por membrana extracorpórea) durante la cirugía y el 8.9% sufrieron una parada cardíaca durante la intervención. En cuanto a los desenlaces, el 95.6% de los pacientes requirió ventilación mecánica y vasoactivos posterior a la intervención quirúrgica. La mediana de estancia en la unidad de cuidados intensivos fue de 14 días. La mortalidad fue del 26.7% (Tabla 3).
Tabla 2 Comorbilidad y frecuencia de los diagnósticos
| Variables | Me (RIC) o n (%) (n = 45) | Primer cuartil ADE < 14.2% (n = 14) | Último cuartil ADE > 15.52% (n = 18) | p |
|---|---|---|---|---|
| Comorbilidad al ingreso | ||||
| Respiratoria | 23 (51.1%) | 5 (35.7%) | 12 (66.7%) | 0.08 |
| Renal | 0 | 4 (28.6%) | 1 (5.6%) | - |
| Neurológica | 7 (15.6%) | 7 (50%) | 9 (50%) | 0.14 |
| Gastrointestinal | 4 (8.9%) | 5 (45.5%) | 4 (22.2%) | - |
| Talla baja | 20 (44.4%) | 1 | ||
| Desnutrición aguda (P/T) | 15 (33.4%) | 0.19 | ||
| Delgadez (IMC/E) | 1 (2.2%) | - | ||
| Diagnóstico | ||||
| Prenatal | 4 (8.9%) | |||
| Ecocardiograma al ingreso | 36 (80%) | |||
| Cateterismo prequirúrgico | 18 (40%) | |||
| Defecto | ||||
| CIA ostium secundum | 9 (20%) | |||
| CIV septo membranoso | 12 (26.7%) | |||
| CIV muscular | 2 (4.4%) | |||
| CIV infundibular | 2 (4.4%) | |||
| DAP | 13 (28.9%) | |||
| Coartación aorta | 2 (4.4%) | |||
| Tronco arterial común | 2 (4.4%) | |||
| Tetralogía de Fallot | 10 (22.2%) | |||
| Canal AV común | 2 (4.4%) | |||
| Estenosis pulmonar | 6 (13.3%) | |||
| Transposición grandes vasos | 3 (6.7%) | |||
| Atresia tricuspídea | 3 (6.7%) | |||
| Drenaje venoso anómalo total | 3 (6.7%) | |||
| Ventrículo izquierdo hipoplásico | 1 (2.2%) | |||
| Ventrículo único | 3 (6.7%) |
AV: auriculoventricular; CIA: comunicación interauricular; CIV: comunicación interventricular; DAP: ductus arterioso persistente; IMC/E: índice de masa corporal para la edad; Me (RIC): mediana (Rango Intercuartílico); P/T: peso para la talla.
Tabla 3 Datos de morbilidad y desenlaces posquirúrgicos de acuerdo con la distribución del ADE
| Variables | Me (RIC) o n (%) (n = 45) | Primer cuartil ADE < 14.2% (n = 14) | Último cuartil ADE > 15.52% (n = 18) | p |
|---|---|---|---|---|
| Score RASCH -1 | 3 (2-4) | 3 (2-3.5) | 4 (3-4) | 0.04 |
| Morbilidad posquirúrgica | ||||
| Shock cardiogénico | 41 (91.1%) | 13 (92.9%) | 18 (100%) | - |
| Shock séptico | 15 (33.3%) | 5 (35.7%) | 7 (38.9%) | 0.85 |
| Shock hipovolémico | 40 (88.9%) | 10 (71.4%) | 18 (100%) | - |
| Shock mixto | 38 (84.4%) | 11 (78.6%) | 18 (100%) | - |
| Hemorragia | 10 (22.2%) | 3 (21.4%) | 5 (27.8%) | 1 |
| ISO | 2 (4.4%) | |||
| Sepsis | 16 (35.6%) | 5 (35.7%) | 9 (50%) | 0.41 |
| Neumonía | 4 (8.9%) | 1 (7.1%) | 1 (5.6%) | 1 |
| Otra infección | 7 (15.6%) | 3 (21.4%) | 3 (16.7%) | 1 |
| Reintervención | 11 (24.4%) | 3 (21.4%) | 5 (27.8%) | 1 |
| Paro en UCIP | 10 (22.2%) | 2 (14.3%) | 8 (44.4%) | 0.12 |
| Transfusión GRE | 31 (68.9%) | 7 (50%) | 15 (83.3%) | 0.062 |
| Desenlaces | ||||
| Uso de VM | 43 (95.6%) | - | ||
| Días de VM (n = 43) | 1 (1-12) | 1.5 (1-5.7) | 10.5 (1-18.7) | 0.08 |
| Uso de vasoactivos | 43 (95.6%) | 8.5 (4.7-18.5) | - | |
| Días de vasoactivos (n = 43) | 6 (3.5-15) | 5.5 (2.7-14.2) | 14 (77.8%) | 0.16 |
| Epinefrina | 26 (57.8%) | 7 (50%) | 7 (0.7-13.5) | 0.14 |
| Días de epinefrina (n = 26) | 3 (0-9.5) | 1 (0-9.2) | 0.018 | |
| Milrinona | 43 (95.6%) | 10 (55.6%) | - | |
| Uso de diálisis | 18 (40%) | 5 (35.7%) | 0.5 (0-5.5) | 0.3 |
| Días de diálisis (n = 18) | 0 (0-2.5) | 0 (0-1) | 8 (44.4%) | 0.23 |
| Mortalidad | 12 (26.7%) | 3 (21.4%) | 28.5 (11.7-63) | 0.26 |
| Días de estancia en UCIP | 14 (6-41.5) | 10.5 (5.7-34.2) | 36 (16.5-66.2) | 0.1 |
| Días de hospitalización total | 25 (15-57) | 23 (16.5-49.7) | 0.25 |
GRE: glóbulos rojos empacados; ISO: infección de sitio operatorio; Me (RIC): mediana (rango intercuartílico); UCIP: unidad de cuidados intensivos pediátrica; VM: ventilación mecánica.
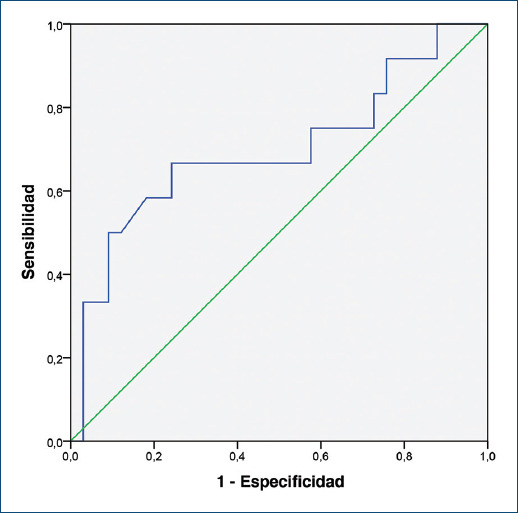
El comportamiento de las variables de interés de acuerdo con el primer y el último cuartiles del ADE prequirúrgico se encuentra en las tablas 1 a 3. No hubo diferencias significativas entre los individuos que pertenecieron al primer cuartil del ADE prequirúrgico y los sujetos del último cuartil. Se comparó la distribución de las variables solo con datos completos. La ventilación mecánica y el uso de vasoactivos previos a la cirugía fueron más frecuentes, en forma significativa, en el grupo que falleció posterior a la cirugía. El ADE prequirúrgico y el puntaje RACHS-1 también fueron significativamente mayores en el grupo de mortalidad. La variable fue categorizada de acuerdo con el cuarto percentil (ADE > 15.52%) de su distribución. Un ADE > 15.52% proporcionaba un riesgo de morir 1.6 veces mayor (intervalo de confianza del 95% [IC95%]: 1.01-2.6; p = 0.034) con respecto a quienes estaban por debajo de ese valor. En cuanto a la relación del ADE prequirúrgico con la escala de riesgo RACHS-1, se encontró una correlación débil, pero significativa (r2 = 0.3; p = 0.045). El área bajo la curva del ADE para discriminar la mortalidad fue de 0.697 (IC95%: 0.502-0.89; p = 0.045), lo que denota un poder moderado (Fig. 1).
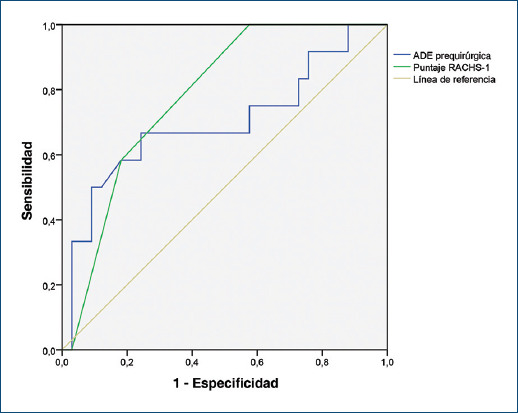
El área bajo la curva del RACHS-1 fue de 0.8 (IC95%: 0.64-0.91; p = 0.004). Al comparar el desempeño del ADE vs. RACHS-1 no hubo diferencia significativa entre estos dos predictores, con una diferencia entre las áreas bajo las curvas de 0.083 (IC95%: −0.12-0.29; p = 0.42) (Fig. 2).
Discusión
Al caracterizar el tamaño de los glóbulos rojos circulantes, el ADE refleja la biología eritrocitaria12. Sus límites oscilan entre valores fisiológicos (edad, envejecimiento, embarazo) y umbrales alterados en muchas enfermedades (cáncer, trauma, infecciones) o tratamientos (terapia transfusional)14,15. Se ha demostrado que el aumento del ADE es un indicador de mal pronóstico en diversas patologías12, entre las que se incluye la infección por SARS-CoV-216.
En nuestro estudio, los resultados revelan que el valor del ADE prequirúrgico presenta un poder moderado para discriminar mortalidad, y si bien esto no tuvo significancia estadística al relacionarse con la distribución de dicho índice, la proporción de pacientes fallecidos con altos valores (> 15.52%) resultó mayor que en aquellos con cifras menores (< 14.2%). Esta tendencia puede explicarse por el limitado tamaño de la muestra. Pese a su discreción, nuestro hallazgo se respalda en estudios similares. El primero fue llevado a cabo en 2012 por Massin12, quien estimó que en 688 niños sometidos a cirugía correctiva de cardiopatías congénitas el riesgo de muerte posquirúrgica fue cinco veces más alto para los pacientes con valores de ADE prequirúrgico ≥ 16%. Lo propio fue reiterado por Polat et al.17 en el año 2014, pues en 107 niños operados por estas malformaciones no solo describen que los valores prequirúrgicos del ADE fueron superiores, sino que también agregan que los valores previos al egreso fueron menores que los reseñados en el posquirúrgico. Ello contrasta con los resultados de nuestra investigación, que planteó una observación similar al discriminar las cifras del ADE durante los períodos prequirúrgico, posquirúrgico inmediato (primeras 24 horas) y posquirúrgico tardío. Contrario a lo expuesto por Polat et al.17, nuestro análisis no encontró correlación entre las cifras del ADE consignadas en dichos momentos y los desenlaces descritos en la tabla 4.
Tabla 4 Evaluación de la correlación entre el ADE y los desenlaces secundarios
| Variables | ADE prequirúrgico | ADE posquirúrgico | ADE posquirúrgico tardío |
|---|---|---|---|
| Días de UCI | |||
| Rho | 0.28 | −0.41 | 0.12 |
| p | 0.055 | 0.78 | 0.39 |
| Días de hospitalización | |||
| Rho | 0.17 | 0.008 | 0.14 |
| p | 0.24 | 0.95 | 0.35 |
| Días de uso de vasoactivos | |||
| Rho | 0.21 | −0.08 | 0.1 |
| p | 0.16 | 0.6 | 0.5 |
| Días de ventilación mecánica | |||
| Rho | 0.25 | 0.1 | 0.14 |
| p | 0.09 | 0.47 | 0.33 |
UCI: unidad de cuidados intensivos.
Otras publicaciones señalan la correlación entre el ADE y la evolución posquirúrgica de algunas cardiopatías congénitas específicas. Kumar et al.18 realizaron un análisis de los datos de 94 niños con reparación quirúrgica de tetralogía de Fallot, y encontraron que el ADE prequirúrgico fue mayor en la población de estudio al ser comparado con pacientes con comunicación interventricular (17.7 ± 3.7 vs. 16.2 ± 4.2; p < 0.001). De los 93 sobrevivientes, 29 pacientes con ADE mayor (> 17.8%) presentaron más complicaciones, con lo que concluyen que un ADE prequirúrgico elevado se asocia a una recuperación posquirúrgica prolongada. Kojima et al.19 demuestran también que el ADE es un buen indicador de los cambios hemodinámicos que ocurren a corto plazo luego de la corrección quirúrgica de la tetralogía de Fallot. Así mismo, este mismo grupo de autores20 informó también que el ADE fue un potente marcador para detectar insuficiencia cardíaca en pacientes con cirugía de Fontan, y que su desempeño fue superior al de otros marcadores que se emplean con más frecuencia en la valoración de la insuficiencia cardíaca pediátrica.
La anisocitosis está ligada a una amplia red de fenómenos que, al representar la circulación de eritrocitos inmaduros, se traduce como la respuesta medular a múltiples influencias21. Para explicar la anisocitosis en los niños con cardiopatías congénitas es necesario remitirse a factores como la anemia, vinculada a la insuficiencia cardíaca y denominador común en el que convergen el déficit nutricional, el estrés oxidativo, la producción inadecuada de eritropoyetina y el impacto de la comorbilidad, entre otros21. Otras hipótesis enlazan el ADE con la disminución en el volumen de los eritrocitos circulantes, puesto que, al envejecer, los glóbulos rojos reducen gradualmente su tamaño, permitiendo que formas inmaduras ingresen y se mantengan por más tiempo en la circulación. Acaso sean todos estos factores los que en conjunto se expresen como un incremento en la anisocitosis y, en consecuencia, se alteren los valores de referencia conocidos para el ADE22.
Evaluar el riesgo quirúrgico de los defectos cardíacos congénitos brinda una perspectiva tanto del rendimiento como de la calidad de un programa cardiovascular pediátrico. En el caso del presente estudio, se consignó el puntaje RACHS-1, según el protocolo institucional. Si bien la mortalidad posquirúrgica puede ser predicha por el RACHS-1, la inquietud generada en torno a la adición de un biomarcador se dirige a establecer si, al combinar ambos, la capacidad predictiva aumenta. Los resultados de esta investigación muestran que tanto el ADE prequirúrgico como el puntaje RACHS-1 fueron significativamente mayores en el grupo de mortalidad, pero al comparar el desempeño de ambos no encontramos diferencias significativas. El puntaje RACHS-1 se centra en la anatomía del defecto congénito y coloca en primer plano el riesgo que encara el equipo a cargo de la intervención quirúrgica, mientras que el ADE alude al estado clínico del paciente en su evolución perioperatoria. Es así como, al alertar sobre el pronóstico prequirúrgico, el ADE puede ayudar al facultativo vinculado al seguimiento de estos pacientes a disminuir sus tasas de morbilidad y mortalidad.
No obstante las ventajas descritas, surgen algunas inquietudes. La profusa evidencia que surge en torno al ADE confirma que no debe ser considerado como un espectador inocente22, al saber que la anisocitosis ostenta una presencia activa en la evolución de las cardiopatías congénitas.
Conclusiones
En nuestro estudio, solo el ADE prequirúrgico presentó un poder moderado para discriminar mortalidad perioperatoria en la corrección quirúrgica de cardiopatías congénitas.
No hubo diferencias estadísticamente significativas al comparar el desempeño del valor del ADE con el del puntaje RACHS-1.
Existe mucho por dilucidar sobre el empleo del ADE como biomarcador pronóstico en el perioperatorio de cardiopatías congénitas; a la luz de los resultados del presente estudio, se precisan más estudios con mayor tamaño de muestra para implementar adecuados análisis.











 nueva página del texto (beta)
nueva página del texto (beta)