Introducción
Los esfingolípidos (esfingomielina, glucolípidos, gangliósidos) son el segundo grupo más abundante de lípidos de membrana. Los esfingolípidos, junto con el colesterol, forman microdominios llamados balsas lipídicas o lipidrafts, que regulan la función de las proteínas de membrana (receptores, enzimas, transportadores y canales iónicos) y participan en la transducción de señales, así como en los procesos de comunicación celular. La esfingomielina y sus metabolitos (ceramida, esfingosina y esfingosina-1-fosfato) modulan procesos celulares como la diferenciación, la proliferación, el crecimiento, la senescencia y la apoptosis1,2.
Metabolismo de los esfingolípidos
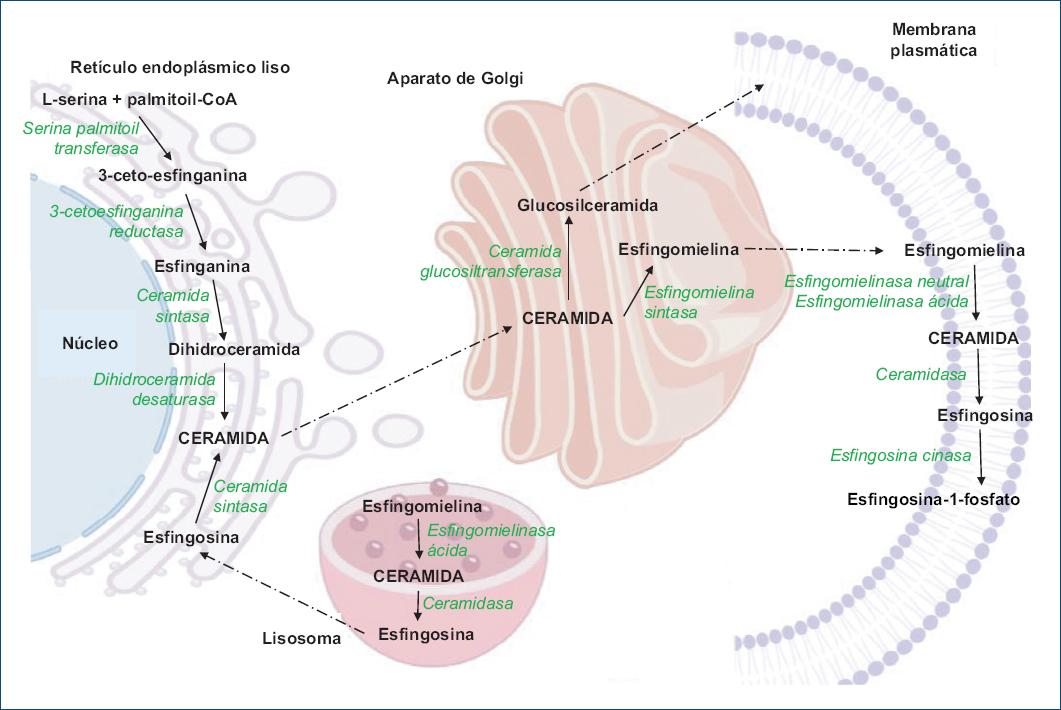
La síntesis de novo de los esfingolípidos se lleva a cabo en el retículo endoplásmico liso, iniciando con la condensación de la L-serina con palmitoil-CoA para formar 3-ceto-esfinganina, en una reacción catalizada por la serina palmitoil-transferasa. La 3-ceto-esfinganina es reducida a esfinganina, la cual es N-acilada por la ceramida sintasa para formar dihidroceramida, y posteriormente la dihidroceramida es oxidada por la dihidroceramida desaturasa para formar ceramida (Fig. 1)3-5.
La esfingosina que proviene de los lisosomas puede ser utilizada por la ceramida sintasa para formar ceramida. La ceramida que se forma a través de estas dos vías puede ser transportada del retículo endoplásmico liso al aparato de Golgi. En la cara citosólica del aparato de Golgi, la ceramida es glucosilada por la glucosilceramida sintasa para formar glucosilceramida, así como otros glucoesfingolípidos complejos, que posteriormente son transportados en vesículas para incorporarse a las membranas plasmáticas (Fig. 1)3-5.
Por otro lado, en el lumen de los primeros compartimentos del aparato de Golgi, la esfingomielina sintasa utiliza ceramida como substrato para la biosíntesis de esfingomielina. La esfingomielina también será transportada hacia la membrana plasmática. En las membranas plasmáticas, los glucoesfingolipidos y la esfingomielina aparecen organizados en microdominios llamados balsas lipídicas o lipidrafts (Fig. 1)3-5.
Es importante señalar que en las membranas plasmáticas también se localizan las enzimas que participan en el catabolismo de los esfingolípidos. Así, las esfingomielinasas hidrolizan a la esfingomielina y liberan ceramida, la cual es hidrolizada por la ceramidasas y se libera esfingosina, y esta a su vez es fosforilada por la esfingosina cinasa para formar esfingosina-1-fosfato (Fig. 1)3-5.
El catabolismo de los esfingolípidos también se lleva a cabo en los lisosomas. Los glucoesfingolípidos son hidrolizados por las glucosidasas, en tanto que la esfingomielina es hidrolizada por la esfingomielinasa ácida. Ambas reacciones liberan ceramida, la cual es hidrolizada por las ceramidasas para formar esfingosina. La esfingosina es transportada al retículo endoplásmico liso para formar ceramida, reacción que es catalizada por la ceramida sintasa (Fig. 1)3-5.
Como se mencionó anteriormente, en el aparato de Golgi la ceramida puede ser utilizada para la síntesis de glucoesfingolípidos o de esfingomielina; también, en la cara trans del aparato de Golgi, así como en la membrana plasmática, la ceramida puede ser fosforilada por la ceramida cinasa para formar ceramida-1-fosfato (Fig. 1)3-5.
Es importante señalar que la deficiencia de enzimas lisosomales que participan en el metabolismo de los esfingolípidos ocasiona su acumulación y entonces se manifiestan las enfermedades que se mencionan en la tabla 1. Los genes que codifican para estas enzimas siguen un patrón de herencia autosómico recesivo, con excepción de la enfermedad de Fabry, que sigue una herencia ligada al sexo (cromosoma X, locus Xq22)6,7.
Tabla 1 Enfermedades por deficiencia de enzimas lisosomales que participan en el metabolismo de los esfingolípidos
| Enfermedad | Enzima |
|---|---|
| Enfermedad de Gaucher | Glucocerebrosidasa o β-glucosidasa |
| Niemann-Pick tipos A y B | Esfingomielinasa ácida (aSMasa) |
| Enfermedad de Krabbe | Galactosil ceramidasa |
| Leucodistrofía metacromática | Arilsulfatasa A |
| Enfermedad de Fabry | α-Galactosidasa |
| Enfermedad de Tay-Sachs | Hexosaminidasa A |
| Enfermedad de Sandhoff | Hexosaminidasas A y B |
| Enfermedad de Farber | Ceramidasa ácida |
Los esfingolípidos y sus metabolitos en las enfermedades cardiovasculares, renales y metabólicas
En condiciones fisiológicas, la esfingomielina, así como sus metabolitos (ceramida, esfingosina y esfingosina-1-fosfato), se encuentran presentes en el plasma y en las lipoproteínas8. Sin embargo, se han reportado cambios en la concentración de esfingomielina y de sus metabolitos en el plasma de pacientes con enfermedades cardiovasculares, renales, y metabólicas (Tabla 2)9-27. También, la esfingomielina y sus metabolitos se han determinado en las arterias, el músculo esquelético y cardiaco, y el tejido adiposo de pacientes con obesidad o con enfermedad arterial coronaria (Tabla 3)28-33.
Tabla 2 Esfingolípidos o sus metabolitos en el plasma de pacientes con enfermedad metabólica, renal o cardiovascular
| Esfingolípido o metabolito | Enfermedad |
|---|---|
| Esfingomielina | Hipercolesterolemia familiar |
| Enfermedad arterial coronaria | |
| Fibrilación auricular | |
| Enfermedad renal y coronaria, | |
| diabetes tipo 1 | |
| Ceramida | Fibrilación auricular |
| Diabetes tipo 2 | |
| Diabetes tipo 1 | |
| Enfermedad renal crónica | |
| Síndrome metabólico | |
| Síndrome coronario agudo | |
| Hipertensión arterial | |
| Isquemia miocárdica | |
| Esfingosina | Diabetes tipo 2 |
| Esfingosina-1-fosfato | Hipertensión arterial |
| Enfermedad arterial coronaria Obesidad | |
| Isquemia-reperfusión (intervención | |
| coronaria percutánea) | |
| Infarto al miocardio |
Tabla 3 Esfingolípidos o sus metabolitos en los tejidos de pacientes con enfermedad cardiovascular o metabólica
| Esfingolípido o metabolito | Enfermedad |
|---|---|
| Esfingomielina en arterias | Enfermedad arterial coronaria |
| Ceramida en músculo esquelético Ceramida en corazón | Obesidad Enfermedad isquémica cardiaca |
| Ceramida, esfinganina, esfingosina y esfingosina-1-fosfato en tejido adiposo | Obesidad |
Los cambios en el contenido de esfingolípidos, así como de sus metabolitos, en el plasma y los tejidos se pueden deber a cambios en la expresión o la actividad de las enzimas que participan en su metabolismo. Con respecto a la expresión, se ha reportado que en el miocardio de pacientes con sobrepeso u obesidad moderada, con o sin antecedentes de diabetes tipo 2, aumenta la expresión a nivel de ARNm de las enzimas involucradas en la síntesis y la degradación de ceramida, incluidas la serina palmitoiltransferasa, la esfingomielinasa neutra, las ceramidasas y la esfingosina cinasa 1; sin embargo, no se han observado cambios en el contenido de ceramida34. En el tejido adiposo intraabdominal de pacientes con obesidad también se ha encontrado aumentada la expresión de las esfingomielinasas a nivel de ARNm35.
Con respecto a la actividad enzimática, se ha reportado que en el plasma de pacientes con diabetes tipo 2, insuficiencia cardiaca crónica o síndrome coronario agudo se observa un incremento la actividad de la esfingomielinasa ácida21,36,37.
Los esfingolípidos y sus metabolitos posiblemente se acumulan en los tejidos y de esta manera contribuyen en el desarrollo y el mantenimiento de las enfermedades cardiovasculares, renales y metabólicas.
Participación de los esfingolípidos en la apoptosis celular
La apoptosis es un proceso fisiológico que durante el período prenatal y tras el nacimiento contrarresta los efectos de la proliferación celular, lo cual contribuye en el mantenimiento de la masa celular, así como en la arquitectura de los órganos y los tejidos38-44. Los estudios experimentales y clínicos han demostrado que la desregulación de la apoptosis puede contribuir al desarrollo y al mantenimiento de diversas enfermedades cardiovasculares; por ejemplo, un aumento en la apoptosis conduce a atrofia y pérdida de la función de un órgano, mientras que una disminución de la apoptosis conduce a la remodelación del órgano45-56.
Por otro lado, también se ha reportado que la ceramida y la esfingosina regulan el ciclo celular, la diferenciación y la apoptosis, mientras que la esfingosina-1-fosfato promueve la proliferación y la supervivencia e inhibe la apoptosis57-60.
A continuación, se describen las principales vías de señalización celular a través de las cuales la ceramida, la esfingosina y la esfingosina-1-fosfato participan en la regulación de la apoptosis. Estas vías de señalización se han estudiado principalmente en cultivos de líneas celulares de cáncer, lo cual sugiere que algunas vías de señalización pueden estar involucradas en el desarrollo tanto del cáncer como de las enfermedades cardiovasculares.
La ceramida actúa directamente sobre diversas proteínas intracelulares, como la proteína fosfatasa activada por ceramida (CAPP), la proteína cinasa activada por ceramida (CAPK), la proteína cinasa C ς (PKC ς) y la catepsina D61-65. La CAPP cataliza la desfosforilación y con ello la inactivación de PKCα, Akt/PKB y del factor antiapoptótico Bcl-2. La ceramida inhibe Akt a través de PKC ς, y la catepsina D estimula la liberación del citocromo c y la activación de las caspasas 9 y 3 (Fig. 2)66-70.

Figura 2 Vías de señalización a través de las cuales la ceramida, la esfingosina y la esfingosina-1-fosfato regulan el proceso de apoptosis. Akt/PKB: proteína cinasa B; Bcl-2: protooncogén B-cell lymphoma 2; CAPK: proteína cinasa activada por ceramida; CAPP: fosfatasas activadas por ceramida; CREB: proteína de unión a elementos de respuesta cAMP; ERK: cinasa de señalización extracelular; ERK: cinasa reguladora de señales extracelulares; JNK: cinasas c-Jun N-terminal; p38MAPK: MAP cinasa p38; PI3K/Akt: fosfatidilinositol-3 cinasa; PKA: proteína cinasa A; PKC α: proteína cinasa C isoforma α; PKC ς: proteína cinasa C isoforma ς; PLA2: fosfolipasa A2; PP1: proteína fosfatasa 1; PP2A: proteína fosfatasa 2A; STAT3: transductor de señal y activador de la transcripción.
La ceramida también puede activar ERK y p38MAPK; puede o no activar JNK; disminuye la activación de P13k/Akt, CREB, STAT3, p21/p53, FAK y PKC; y aumenta la activación de PLA2, PKA y calpaína, lo cual puede conducir a la apoptosis. La comunicación cruzada entre MAPK, PKC y CREB también puede regular la apoptosis inducida por ceramida (Fig. 2)71-80.
Además, Bcl-2/Bcl-xL inhibe la actividad de la ceramida sintasa y de las esfingomielinasas, y también activa a la esfingosina cinasa, y por lo tanto aumenta la esfingosina-1-fosfato, la cual disminuye la expresión y la actividad de Bax/Bak, y así disminuye la apoptosis (Fig. 2)81-83.
La esfingosina es uno de los metabolitos menos estudiados, pero se sabe que inhibe a la proteína cinasa C (PKC) y también regula el Ca++ intracelular. Por otro lado, la ceramida-1-fosfato inhibe la apoptosis, al menos en parte, estimulando la vía PI3-K/PKB/NF-κB y manteniendo la producción del factor Bcl-xL antiapoptótico84.
Considerando lo antes descrito, es necesario realizar estudios enfocados en demostrar si la ceramida, la esfingosina y la esfingosina-1-fosfato participan en la regulación de las vías de señalización de la apoptosis en las enfermedades cardiovasculares, renales y metabólicas, lo cual en un futuro hará posible la intervención y, en algunos casos, la interrupción de la apoptosis.
La esfingomielina y sus metabolitos en la COVID-19
Los pacientes con riesgo cardiovascular, renal y metabólico son especialmente vulnerables para una mayor morbimortalidad cuando sufren la COVID-19 (acrónimo de Coronavirus Disease 2019) causada por el SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus 2)85. Se ha demostrado que, en el epitelio nasal humano, la esfingosina evita la interacción de la proteína spike del SARS-CoV-2 y la enzima convertidora de la angiotensina 2; evidencia que sugiere que la esfingosina podría ser una alternativa terapéutica para prevenir y tratar las infecciones por SARS-CoV-286. Además de la esfingosina, también se propone que los análogos de la esfingosina-1-fosfato, como el FTY720, tendrían un gran potencial en el tratamiento de la COVID-1987,88. En cultivo de células de epitelio nasal humano se ha demostrado que los antidepresivos, como la amitriptilina, inhiben la actividad de la esfingomielinasa ácida, lo cual disminuye la infección por SARS-CoV-289. No obstante, es necesario realizar estudios de preclínica y clínicos para evaluar los efectos terapéuticos y los riesgos de la respuesta a la esfingosina y la esfingosina-1-fosfato, así como la inhibición de la esfingomielinasa ácida en pacientes con enfermedades cardiovasculares, diabetes y obesidad, ya que estas constituyen la comorbilidad más prevalente en los pacientes con COVID-19.
Métodos para el estudio de los esfingolípidos y sus metabolitos
Para el estudio de los esfingolípidos y de sus metabolitos se requieren técnicas que permitan su aislamiento, análisis y cuantificación. Para la detección y la cuantificación de los esfingolípidos se han descrito métodos como los ensayos a través de la diacilglicerol cinasa o la cromatografía en capa fina, pero son técnicas poco utilizadas. Actualmente, técnicas como la cromatografía de gases o la cromatografía líquida de alta eficacia (HPLC, High Performance Liquid Chromatography) permiten una mejor separación e identificación de estas moléculas, a través de los tiempos de retención. Por otra parte, si el cromatógrafo de gases o líquidos está acoplado a un espectrómetro de masas (MS), este último permitirá la identificación y la cuantificación de los esfingolípidos y sus metabolitos, a través de su masa y carga (m/z). Estos resultados son corroborados a través de estándares que pueden ser analizados dentro de unas bases de datos. Finalmente, si el análisis se desea hacer con mayor profundidad puede desarrollarse un análisis de fragmentación de las moléculas analizadas dentro del espectrómetro de masas, o también llamado MS2, que en conjunto con las técnicas anteriores no solo proporciona los tiempos de retención, la masa y la carga, sino también su espectro de fragmentación90-95.
La microcopía de alta resolución (STED-Microscopy, Stimulated Emission Depletion-Microscopy) es otra de las técnicas que en los últimos años nos ha acercado a tener un dato visual del tipo y de la interacción de los lípidos de la membrana celular96-99.
Otras de las técnicas utilizadas para identificar cambios en los esfingolípidos y sus metabolitos en la membrana celular son la microscopía de fluorescencia y la citometría de flujo. Estas permiten identificar y cuantificar algunos lípidos mediante el uso de anticuerpos monoclonales o de colorantes fluorescentes100-102. Recientemente reportamos que con la técnica de ELISA (Enzyme-Linked-Immunosorbent Assay) es posible determinar la concentración de ceramida, esfingosina y esfingosina-1-fosfato en plasma y tejidos103, lo cual permitirá en un futuro aplicarlo en la clínica.
Conclusiones
Se ha sugerido que la esfingomielina, así como sus metabolitos, podrían ser biomarcadores potencialmente útiles en la clínica para el diagnóstico, el pronóstico y el tratamiento de las enfermedades cardiovasculares, renales y metabólicas, aunque aún existen limitaciones para su validez. Por esta razón, es importante realizar estudios preclínicos enfocados en comprender el metabolismo de los esfingolípidos, incluyendo a las enzimas que participan en este proceso, lo cual permitirá explicar los cambios en la concentración de esfingomielina y de sus metabolitos en el plasma, así como su contenido en algunos tejidos. Además, es necesario estudiar el o los mecanismos a través de los cuales los esfingolípidos y sus metabolitos contribuyen en la fisiopatología de las enfermedades cardiovasculares, lo cual nos permitirá proponer alternativas farmacológicas en el tratamiento de las enfermedades cardiovasculares, renales y metabólicas.











 nueva página del texto (beta)
nueva página del texto (beta)