Introducción
En la actualidad, se han identificado los beneficios en cuanto a costo-efectividad de los programas de rehabilitación cardiaca y prevención secundaria (PRCyPS), determinando una importante mejoría en la calidad de vida, reducción de la mortalidad y reincidencia de hospitalizaciones, esto secundario a las ganancias obtenidas en el consumo máximo de oxígeno, lo cual permite una mayor tolerancia al esfuerzo1-6.
El índice de eficiencia miocárdica (IEM) es un parámetro que relaciona el consumo miocárdico de oxígeno (MVO2) con la carga de trabajo máxima lograda, establecida por el consumo pico de oxígeno (VO2p), el cual proporciona información del estado hemodinámico que depende del equilibrio entre el aporte miocárdico de oxígeno y las variaciones mecánicas de este; cuanto mayor es la relación, menor es la eficiencia. En sujetos sanos entrenados, se considera normal cuando el resultado es menor a 10; pero cuando este es superior, indica un excesivo trabajo miocárdico en relación con el gasto energético, que se manifiesta comúnmente con elevación exagerada de la frecuencia cardiaca (FC) y presión arterial (PA) a una baja carga de trabajo7-11.
El MVO2 se define como la capacidad del corazón para absorber y utilizar oxígeno, el cual tiene determinantes mayores y menores, entre los que encontramos la FC, la contractilidad, la tensión o estrés parietal (definido por la ley de Laplace [T= (Pxr)/2 h]), el inotropismo y el volumen sistólico. Cualquiera de estas variables que se modifiquen durante el ejercicio conllevan un aumento del MVO2, el cual se expresa en mL de O2 kg/min12-14.
El VO2p se define como la mayor cantidad de oxígeno que una persona es capaz de absorber, transportar y consumir durante el esfuerzo máximo y este dependerá, de acuerdo con la teoría de los engranajes de Wasserman15, de un componente central constituido por el corazón, pulmones y capacidad de transporte por la hemoglobina y el componente periférico, constituido por la masa muscular, su densidad capilar y carga mitocondrial, es la variable que mejor se relaciona con el estado cardiovascular y con la capacidad física; se expresa también en ml de O2/kg/min). Por lo tanto, un incremento del VO2p es el método mas común para demostrar un efecto de adaptación cardiometabólica al entrenamiento16-20.
En la práctica deportiva el IEM se usa para evaluar la eficiencia cardiovascular. Suele mostrar mejorías notables posterior a un microciclo de entrenamiento, el cual se caracteriza por periodos de entrenamiento cortos habitualmente de entre cuatro a seis semanas orientados a un objetivo, que es incrementar el rendimiento previo a la competición. Desde esta vertiente, la fase II de los PRCyPS han demostrado ganancias sustanciales en el VO2p y equivalentes metabólicos (MET)-carga, por lo que su estructura se asemeja a la de un microciclo de entrenamiento21.
Dado que se ha demostrado que el IEM mejora en atletas posterior a un programa de entrenamiento, se espera entonces que los pacientes cardiópatas posterior a la fase II de un PRCyPS, al disminuir el MVO2 para una misma carga de trabajo y aumentar el VO2p por el mismo proceso adaptativo, mejoren el IEM.
En la actualidad no hay estudios en donde se determine cuál es el comportamiento del IEM en pacientes cardiópatas de alto riesgo cardiovascular posterior a un PRCyPS, por tal motivo, el objetivo principal de este estudio es cuantificar su porcentaje de mejoría al término de la fase II de un PRCyPS, y con ello establecer su utilidad dentro de la evaluación final como adaptación cardiovascular al entrenamiento.
Material y métodos
Población
Se realizó un estudio de cohorte ambilectivo, descriptivo, analítico y no aleatorizado en el Centro Médico Nacional 20 de noviembre, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, en la Ciudad de México, México, durante el periodo de marzo 2019 a enero 2021. Se incluyeron pacientes cardiópatas considerados de alto riesgo cardiovascular de acuerdo con el modelo de estratificación de riesgo para la presentación de arritmias o isquémica durante las sesiones de entrenamiento del Servicio de Rehabilitación Cardiaca del Instituto Nacional de Cardiología Ignacio Chávez22, diagnosticados con cardiopatía isquémica, insuficiencia cardiaca, cardiopatía valvular, hipertensión arterial pulmonar y cardiopatías congénitas, ingresados a un PRCyPS fase II. Los criterios de exclusión fueron pacientes portadores de marcapasos, fibrilación atrial, pacientes inestables o con alguna incapacidad física de realizar la prueba de ejercicio y como criterios de eliminación aquellos pacientes que no completaron la fase II o con asistencia menor al 80% de la programada. Todos los participantes firmaron el consentimiento informado sobre los riesgos y complicaciones de realizar la prueba, así como de su ingreso al PRCyPS. Se cumplió con los reglamentos de ética, investigación y bioseguridad.
Descripción de la intervención
Se realizó una prueba de esfuerzo convencional en banda sin fin, de acuerdo con el protocolo de Bruce modificado en rampa, la cual fue limitada por fatiga o por criterios de suspensión absoluta23-26. A todos los pacientes, a su ingreso y término del PRCyPS, se determinaron umbrales, VO2p, MET-carga al máximo esfuerzo, doble producto (DP) al máximo esfuerzo e IEM. Previa estratificación de riesgo y prescripción del entrenamiento se determinó la longitud del programa de acuerdo con la capacidad física medida por MET logrados.
El programa de entrenamiento consistió en ejercicio concurrente caracterizado por 3-5 días de ejercicio dinámico con duración de 30 minutos, alternando tapiz rodante con cicloergometría, distribuidos en 5 min de calentamiento, 20 minutos de ejercicio en zona de entrenamiento al 70% de la FC de reserva (FCR) calculada por la fórmula de Karvonen, o entre el 60-70% del VO2p y por percepción del esfuerzo definida por Borg entre 12-14, y 5 minutos de enfriamiento. El ejercicio de fuerza se realizó al menos dos días a la semana, con una duración mínima de 20 minutos, y comprendió ejercicios de calistenia, flexibilidad, equilibrio y fuerza del tren superior al 30-40% de la 1RM y del tren inferior al 40-50% de la 1RM27,28. Se proporcionó vigilancia y control de sus factores de riesgo cardiovascular, así como evaluación nutricional, atención psicoemocional y sesiones educativas sobre técnicas del ejercicio, terapia ocupacional, reincorporación laboral y técnicas antitabaco.
Variables cardiopulmonares
Las variables estimadas a partir de la prueba de ejercicio se calcularon de acuerdo con las siguientes fórmulas7:
IEM = (MVO2/VO2p) x 10
Donde MVO2 es el consumo miocárdico de oxígeno y VO2p es el consumo pico de O2.
Para obtener el valor real y preciso del MVO2 es necesario realizar un estudio invasivo de cateterización cardiaca, lo cual es poco factible en la práctica clínica; por lo tanto, en este estudio dicho parámetro se estimo por medio de sus determinantes como la frecuencia cardiaca y la tensión arterial sistólica (expresadas ambas en su variable subrogada, el DP). Esta correlación ha sido descrita y representada con modelos lineales de regresión mediante la siguiente ecuación7,8:
MVO2 = (DP máximo x 0.14 x 0.01) – (6.3)
El VO2p se calcula por medio de la ecuación de Fick VO2máx = GC (gasto cardiaco) x DAVO2 (diferencia arterio-venosa de oxígeno). Hill et al.29 propusieron que el gasto cardiaco máximo fue el principal factor que explicaba las diferencias individuales en el VO2 máx.
Para fines de este estudio, el VO2p se determinó durante la realización de esfuerzo dinámico en carga incremental en una prueba de ejercicio en banda sin fin al obtener los MET máximos conseguidos en la prueba de ejercicio multiplicado por 3.5 ml30.
VO2p = (número de MET X 3.5 ml de O2/kg/min)
Análisis estadístico
Los datos se analizaron con el paquete estadístico Social Package for Social Sciences (SPSS) versión 24. Para las variables cuantitativas se realizaron pruebas de normalidad mediante el estadístico Kolgomorov-Smirnov. Los datos con distribución normal se reportaron como medias ± desviación estándar, los datos con distribución no normal se reportaron como medianas y percentiles. Para el caso de las variables categóricas, los datos fueron presentados en frecuencias absolutas y relativas. Para la comparación de las variables cuantitativas con distribución normal preintervención y postintervención, se utilizó la prueba t de Student para muestras pareadas y para la comparación de las variables cuantitativas sin distribución normal preintervención y postintervención se utilizó la prueba de Wilcoxon. Por otro lado, se realizó el cálculo de un punto de corte para el IEM mediante una curva ROC, considerando la mejor sensibilidad y 1-especificidad. Posteriormente se realizó un análisis de variables dicotómicas preintervención y postintervención de acuerdo con el punto de corte calculado utilizando la prueba de McNemar. Se consideró significancia estadística valores con un p < 0.05.
Resultados
Se recolectaron un total de 212 pacientes de acuerdo con las características de los criterios de inclusión, de los cuales 12 pacientes fueron excluidos y 7 fueron eliminados al presentar uno o más factores de los criterios de exclusión y eliminación respectivamente, quedando una muestra final de 193 pacientes. La media de edad fue de 62.3 ± 10.5 años, la mayoría de la muestra fue representada por el sexo masculino (n = 129, 66.2%), así mismo la patología cardiovascular más representativa fue la cardiopatía isquémica con el 84.1% de la muestra. El resto de las características demográficas, etiología de la enfermedad, clínica y tratamiento farmacológico se presentan en la tabla 1.
Tabla 1 Características demográficas, etiología, comorbilidades y tratamiento farmacológico de la población de estudio*
| Características | n = 193 |
|---|---|
| Demográficas | |
| Edad (años) | 62.3 ± 10.5 |
| Sexo n (%) | |
| Masculino | 129 (66.2) |
| Femenino | 64 (32.8) |
| Tabaquismo | 112 (57.4) |
| Etiología n (%) | |
| Cardiopatía isquémica | 164 (84.1) |
| Insuficiencia cardiaca | 71 (36.4) |
| Enfermedad valvular | 37 (19) |
| Enfermedad arterial pulmonar | 31 (15.9) |
| Cardiopatía congénita | 4 (2.1) |
| Miocardiopatía dilatada | 17 (8.7) |
| Miocardiopatía restrictiva | 2 (1) |
| Miocardiopatía hipertrófica | 2 (1) |
| Displasia | 15 (7.7) |
| Canal | 2 (1) |
| Comorbilidades n (%) | |
| Dislipidemia | 123 (63.1) |
| Obesidad | 81 (41.5) |
| DM2 | 79 (40.5) |
| Hipertensión | 119 (61) |
| Clínicas n (%) | |
| FEVI (%) | 54 (42-63) |
| Clase funcional | |
| 1 | 92 (47.2) |
| 2 | 17 (8.7) |
| 3 | 38 (19.5) |
| Farmacológicas n (%) | |
| IECA | 77 (40.1) |
| ARA | 86 (44.1) |
| Antiagregantes | 168 (86.2) |
| Estatinas | 163 (83.6) |
| BB | 143 (73.3) |
| CA | 31 (15.9) |
| Diuréticos | 44 (22.6) |
| BA | 22 (11.3) |
| Zidovudina | 6 (3.1) |
| ARM | 12 (6.2) |
*Los datos se presentan en mediana (p25-p75) y n (%).
DM2: diabetes mellitus tipo 2; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima convertidora de angiotensina; ARA: antagonistas del receptor de angiotensina; BB: betabloqueantes; CA: calcioantagonistas; BA: bloqueantes alfa; ARM: antagonistas de los receptores para mineralocorticoides.
En la tabla 2 se describen las características de la prueba de esfuerzo preintervención y postintervención, en las cuales se muestran las diferencias (iniciales vs. finales) en los MET de 6.4 (4.5-8.8), equivalente a un VO2 de 22.4 ml/kg/min vs. MET finales de 9.6 (7.5-11.7), equivalente a un VO2 de 33.6 ml/kg/min, con un porcentaje de cambio del 43.1% (p < 0.001), en el DP de 17,277.2 ± 5,506.4 vs. 18,062 ± 5,058, con un porcentaje de cambio del 5.7% (p < 0.01), lo cual equivale a un MVO2 de 17.2 (11.9-22.7) ml/kg/min vs. un MVO2 de 18.0 (13.3-23.4) ml/kg/min, con un porcentaje de cambio del 8.3% (p < 0.01).
Tabla 2 Características iniciales, finales y porcentaje de cambio de medidas antropométricas y de la prueba de ejercicio en banda, posterior al programa de rehabilitación cardiaca y prevención secundaria (PRCyPS) de la población de estudio*
| Características | Inicial (n = 193) | Final (n = 193) | Δ (%) | p |
|---|---|---|---|---|
| Antropométricas | ||||
| IMC (kg/m2) | 27.6 (24.7-30) | 27.4 (24.7-30.1) | 0 | 0.50 |
| Prueba de ejercicio | ||||
| VO2 (ml/kg/min) | 22.4 (15.7-30.8) | 33.6 (26.2-40.9) | 43.1 | < 0.001 |
| MET | 6.4 (4.5-8.8) | 9.6 (7.5-11.7) | 42.8 | < 0.001 |
| FCR (bpm) | 53 (37-72) | 60 (44-80) | 18.4 | < 0.001 |
| DP | 17,277.2 ± 5,506.4 | 18,062 5,058 | 5.7 | 0.01 |
| MVO2 (ml/kg/min) | 17.2 (11.9-22.7) | 18 (13.3-23.4) | 8.3 | < 0.01 |
| IEM | 7.5 (5.1-10.1) | 5.7 (4.1-7) | –27.1 | < 0.001 |
*Los datos se presentan en desviación estándar ± media o mediana (p25-p75).
IMC: índice de masa corporal; VO2: consumo máximo de oxígeno: MET: equivalentes metabólicos; DP: doble producto; MVO2: consumo miocárdico de oxígeno; FCR: frecuencia cardiaca de reserva; IEM: índice de eficiencia miocárdica; Δ:% (delta) de cambio.
Punto especial se observó en la variable de interés, donde el cambio del IEM marcó valores de 7.5 (5.1-10.1) vs. 5.7 (4.1-7), con un porcentaje de cambio de –27.1% (p < 0.001).
A partir del cambio reportado en el IEM, y de acuerdo con el punto de corte reportado en deportistas, los valores promedios no superaron el índice mayor a 10, punto de corte normal para el IEM, por lo que se consideró realizar el cálculo de un punto de corte para la población que estudiar, en donde se determinó como variable de éxito (dicotómica) un cambio > 10% de acuerdo con los MET realizados al finalizar el PRCyPS, ya que en la literatura se han reportado incrementos de VO2 del 10-30% después de un programa de rehabilitación cardiaca31. Por lo tanto, el punto de corte elegido para el IEM en nuestra población tuvo un valor de 7.37, con un área bajo la curva de 0.68 (intervalo de confianza del 95% [IC 95%]: 0.61-0.76, p < 0.001), sensibilidad de 0.60 y 1-especificidad de 0.35 (Fig. 1).
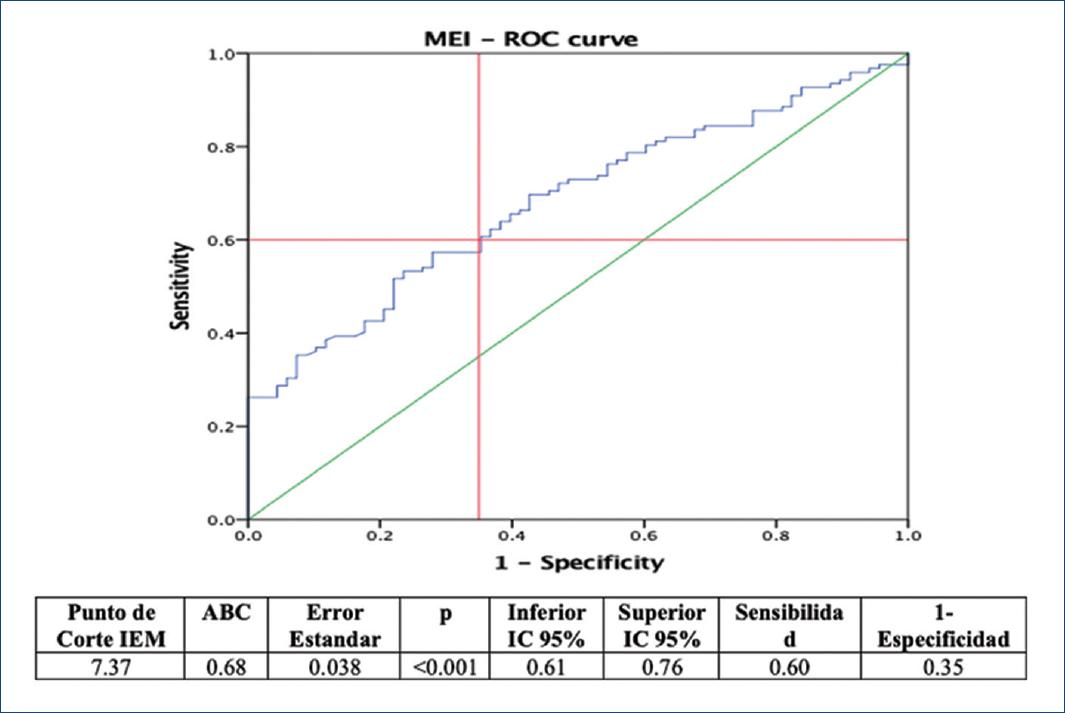
Figure 1 Determinación del punto de corte del índice de eficiencia miocárdica por curva ROC. IEM: índice de eficiencia miocárdica; ABC: área bajo la curva; IC 95%: intervalo de confianza del 95%.
Posteriormente, se categorizó a los pacientes de acuerdo con el nuevo punto de corte: < 7.37 (n = 92) y > 7.37 (n = 101), donde se encontraron diferencias estadísticamente significativas (p < 0.001) al comparar el porcentaje de cambio entre las categorías preintervención y postintervención, observando que el 92.4% de los pacientes con el punto de corte < 7.37 se mantuvo sin cambio, pero el 72.3% de los pacientes con un punto de corte > 7.37 pasaron a la categoría < 7.37, como se muestra en la figura 2.
Discusión
En nuestro estudio, el IEM ha logrado un valor diagnóstico que marca la mejoría de los pacientes con cardiopatía sometidos a un microciclo de entrenamiento dentro de un PRCyPS. En atletas de alto rendimiento y población entrenada sana, este índice es un marcador de adaptación, estableciendo para ellos como un punto de corte de una adecuada eficiencia cardiovascular con un valor de 107. Nuestro problema de investigación se centraba en el desconocimiento del comportamiento de dicho índice en pacientes cardiópatas, independientemente de su patología cardiovascular específica.
Si bien el objetivo del estudio era demostrar si existía una disminución del IEM posterior al término de la fase II del PRCyPS, se logró establecer un punto de corte mediante la curva ROC para determinar de forma cuantitativa el punto exacto sobre el que se valuaría la adaptación en esta población, esto debido a que un porcentaje significativo de la muestra dio como resultado un IEM menor a 10, sin embargo, en estos pacientes esto no traduce adecuada eficiencia cardiovascular, ya que es resultado de valores iniciales bajos de VO2 y MVO2 debido a una respuesta cronotrópica y presora anormales en estos pacientes secundario a toma de fármacos y patología de base15,32,33. Por otra parte, al analizar los resultados de acuerdo con el punto de corte establecido por la curva ROC (IEM de 7.37) se demuestra que en aquellos pacientes con valores de IEM > 7.37, el 72.3% pasaron a la categoría de < 7.37, y aquellos con un IEM < 7.37 el 92.4% se mantuvo sin cambio significativo, demostrando que los pacientes más deteriorados presentan ganancias mas sustanciales de VO2p y de adaptación cardiovascular al entrenamiento. Algunos de los estudios reportados sustentaban la hipótesis de que este cambio sería plausible en pacientes con cardiopatía isquémica y angina, quizás con variaciones en el MVO2 por el comportamiento de la recuperación de la tensión arterial sistólica o de la FC en el postentrenamiento, dado que estas son las variables que determinan el DP sobre el que se basa su subrogación32,34.
Se ha demostrado que las intervenciones que mejoran el rendimiento físico en pacientes con angina al reducir las necesidades de oxígeno del miocardio no se asocian con cambios en el MVO2 máximo tolerado. Sin embargo, el esfuerzo mecánico del miocardio en cualquier nivel dado de trabajo externo disminuye con el entrenamiento y, por lo tanto, se retrasa la consecución del MVO2 limitante de la angina, lo que permite un trabajo de mayor intensidad y duración35-37.
En nuestro estudio se logró demostrar una importante ganancia de los MET posterior a un PRCyPS hasta en un 42.8% respecto a la prueba de esfuerzo inicial, sobrepasando incluso las ganancias reportadas en la literatura que oscilan entre el 10-30%. Si bien existe un aumento el MVO2 de un 8.3% respecto a la prueba inicial, se deduce que este incremento ocurre secundario a una mejor tolerancia al esfuerzo, debido a un incremento en la respuesta presora y cronotrópica, demostrada así también por un aumento de hasta el 18.4% de la frecuencia cardiaca de reserva, con el consecuente aumento del DP al máximo esfuerzo38,39.
No obstante, se puede indicar que pudiera haber existido mayor precisión en los resultados si la medición del VO2p hubiese sido bajo la cuantificación directa del análisis de gases espirados, sin embargo se resalta que la utilidad de este índice hasta ahora validado en atletas utiliza la misma formulación que la empleada en este estudio.
Por otro lado, no se discriminó entre las características de la población en pacientes con cardiopatía isquémica o insuficiencia cardiaca, considerando que el comportamiento del entrenamiento y de las variables expuestas en el estudio (MVO2, VO2p) pudieran tener variaciones según la cardiopatía, además, no se excluyeron pacientes que estuvieran consumiendo betabloqueadores, ya que estos tienen un efecto importante en la FC y por tanto un efecto agregado en la reducción del MVO240. Futuras líneas de investigación podrían validar el punto de corte y el comportamiento del IEM bajo estas últimas consideraciones.
Conclusiones
De acuerdo con los resultados obtenidos en nuestro estudio podemos concluir que los pacientes que son sometidos a un PRCyPS mejoran de manera significativa el IEM y por tanto su eficiencia cardiovascular; estableciendo que una reducción mayor al 27.1% pudiera considerarse como una meta más que evaluar en nuestros programas bajo la validación de un nuevo indicador de adaptación cardiovascular al entrenamiento en estos pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)



