Introducción
La estenosis aórtica (EAo) del adulto es una valvulopatía caracterizada por un crecimiento exponencial en relación con la edad y puede alcanzar una prevalencia del 9.8% en pacientes octogenarios1. Cuando la EAo es grave y aparecen síntomas como disnea, angina o síncope/mareo con esfuerzos, la mortalidad es de 50% a dos años en ausencia de tratamiento quirúrgico o endovascular2. De acuerdo con las guías del ACC/AHA, la EAo grave se define con una velocidad pico (VP) transvalvular aórtica ≥ 4 m/s, un gradiente medio (GM) ≥ 40 mmHg y un área valvular aórtica (AVA) calculada por la ecuación de continuidad < 1 cm2.3 Cuando la VP es < 4 m/s y el GM < 40 mmHg, el índice de volumen sistólico (IVS) < 35 ml/m2 y el AVA < 1 cm2, la EAo se denomina EAo de gradiente bajo, flujo bajo (GB/FB). Si la fracción de expulsión (FE) es < 50% se conoce como EAo GB/FB "típica" y representa 5% a 10% de todas las EAo, con una sobrevida < 50% a tres años con tratamiento médico y una mortalidad quirúrgica a 30 días de 3% a 33%; la disminución de la FE se relaciona con enfermedad coronaria y exceso de poscarga (mismatch)4,5. Si la EAo GB/FB tiene FE ≥ 50% se llama "paradójica" (GB/FBp) con una prevalencia de 10% a 25% de todas las EAo y es más frecuente en mujeres de edad avanzada, con remodelamiento concéntrico del ventrículo izquierdo (VI) y se relaciona con comorbilidades como hipertensión arterial, diabetes y dislipemia. Las guías de la ESC/ASE 20176 agregan como criterio la exigencia de que el GM sea de 30 a 40 mmHg y el AVA ≤ 0.8 cm2 en vez de < 1 cm2. La característica fundamental de la EAo GB/FBp es la reducción del gradiente transvalvular aórtico secundaria a la disminución del IVS en presencia de FE ≥ 50%. Las causas de la reducción del IVS incluyen: a) remodelamiento o hipertrofia concéntrica del VI, b) fisiología restrictiva, c) disfunción longitudinal del VI, d) fibrilación auricular, e) estenosis/insuficiencia mitral, f) insuficiencia tricuspídea grave y g) cortocircuitos adjuntos de izquierda a derecha. En el caso de la disfunción longitudinal que se evalúa con el strain, Doppler tisular o modo M de anillo mitral, puede deberse a la menor contractilidad, un poscarga excesiva o una combinación de ambas. En pacientes con EAo grave y FE disminuida, Carabello7 demostró en 14 pacientes que la disminución de la FE (28% ± 3%) se debía al exceso de la poscarga (afterload mismatch) en 10 pacientes, la cual se incrementaba luego del reemplazo valvular aórtico. En cuatro pacientes, la disminución de la FE se debía a una combinación de menor contractilidad y mayor poscarga. Ballo8 demostró que en 147 pacientes con FE ≥ 55%, la fracción de acortamiento mesoparietal (FAm) decrecía a medida que aumentaba la gravedad de la estenosis y que la reducción de la contractilidad evaluada mediante la relación FAm-estrés de fin de sístole (EFS) se relacionaba con el grado de hipertrofia. La evaluación de la contractilidad en pacientes con GB/FBp no se ha definido por completo. El objetivo de este trabajo fue analizar: a) la prevalencia de la contractilidad disminuida en los pacientes con GB/FBp, b) las variables ecocardiográficas vinculadas con la reducción de la contractilidad y c) la forma en que se relaciona el nivel de contractilidad con los índices de flujo bajo como el IVS y el flujo aórtico.
Material y métodos
Se estudió de modo prospectivo a 30 pacientes con edad promedio de 71 ± 9 años, 12 mujeres y 18 hombres portadores de estenosis valvular aórtica grave con AVA < 1 cm2, gradiente bajo (GM < 40 mmHg), FE normal (≥ 50%) e IVS < 35 ml/m2, a los cuales se les había solicitado eco-Doppler cardíaco. El protocolo recibió aprobación del Comité de Ética del Hospital. Se excluyó a los pacientes que presentaban calcificación del anillo mitral e insuficiencia aórtica o mitral de grado moderado o grave Se consideró antecedentes de hipertensión arterial a la necesidad de tratamiento antihipertensivo previo y de cardiopatía isquémica si el paciente había presentado uno o más de los siguientes criterios: a) antecedentes de IAM, angioplastia o cirugía de revascularización, b) obstrucciones > 50% en las arterias coronarias determinadas por angiografía y c) acinesia en el ecocardiograma. Los datos de la coronariografía se obtuvieron en 17 pacientes y cinco de ellos tuvieron enfermedad coronaria. Todos los pacientes se sometieron a ecocardiograma Doppler completo, además de realizar interrogatorio previo para detectar factores de riesgo coronario y síntomas, exploración física cardiovascular, medición de la presión arterial y registro del pulso carotídeo. El ecocardiograma y el Doppler cardíaco se realizaron con un ecocardiógrafo ESAOTE MyLab 40 con transductor de 2.5-3.5 MHz, con el paciente en decúbito lateral izquierdo y con uso de la derivación DII del electrocardiograma como referencia. Las mediciones del diámetro diastólico del VI (DDVI), diámetro sistólico del VI (DSVI), espesor del septum interventricular en diástole (SIVd) y sístole (SIVs) y espesor de pared posterior en diástole (PPd) y sístole (PPs) se efectuaron desde la vista del eje largo paraesternal izquierdo, perpendicular al eje mayor del ventrículo e inmediatamente por debajo del borde libre de la válvula mitral. El cálculo de la fracción de acortamiento endocárdica (FAe) de VI, espesor parietal relativo (EPR), volumen de fin de la diástole (VFD) (método de Simpson), volumen de fin de la sístole (VFS), FE e IVS se llevó a cabo de acuerdo con los criterios de la ASE9. La FAm del VI se calculó con la fórmula de Koide10:
FAm = [(DDVI + h) - (DSVI + 2a´)/(DDVI + h)] x 100
En este cálculo, h es el espesor diastólico combinado (PPd +SIVd/2) y a´ el punto mesoparietal en sístole calculado a partir de la siguiente fórmula:
a´= 1/2 [√ ((hfs(2 DDVI+h)(DSVI+hfs))/(DDVI + h) + DSVI2) - DSVI]
En la fórmula anterior, hfs es el espesor sistólico combinado (PPs +SIVs)/2.
La masa del VI se calculó de acuerdo con la fórmula de Devereux11 y el índice de masa (IM) como la masa normalizada a la superficie corporal. De acuerdo con el IM y el EPR se clasificó la geometría ventricular como normal, remodelamiento concéntrico, hipertrofia concéntrica e hipertrofia excéntrica12. Con el Doppler continuo se registró el gradiente transvalvular aórtico pico (GP), GM y la integral de la curva de flujo desde las vistas apical, paraesternal derecha, subxifoidea y supraesternal. El AVA efectiva se calculó mediante la ecuación de continuidad de acuerdo con las guías ESC/ASE6. La función longitudinal del VI se determinó mediante el modo M del anillo mitral lateral obtenido desde la vista de cuatro cámaras, tras cuantificar la excursión sistólica del anillo mitral (ESAM)9. Se registró el Doppler tisular pulsado del anillo mitral septal y lateral, al medir la velocidad pico de la onda S y e´. Para cada parámetro evaluado se consideró el promedio de tres mediciones consecutivas. Luego de realizar el ecocardiograma se registró el carotidograma con un transductor de pulso TPW - 01 A conectado a un ecocardiografo TOSHIBA SSH140A y se midió la presión arterial con esfigmomanómetro en el brazo derecho con el paciente en decúbito lateral izquierdo. El carotidograma se calibró de acuerdo con el método utilizado en el laboratorio de los autores13 para obtener la presión de fin de sístole (PFS) (Fig. 1). Como índice de poscarga se calculó el estrés meridional de fin de sístole (EFS) mediante la fórmula14,15):
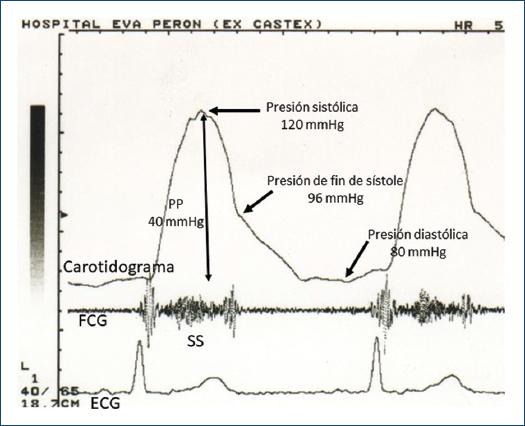
Figura 1 Registro simultáneo del carotidograma, fonocardiograma (FCG) y electrocardiograma (ECG) en un paciente con EAo GB/FBp. Cálculo de la presión de fin de sístole: el carotidograma se calibra tras considerar que la deflexión más alta corresponde a la presión arterial sistólica obtenida con el esfigmomanómetro y la deflexión más baja a la presión arterial diastólica. Si se considera la presión del pulso (diferencia entre presión sistólica y diastólica) (PP) como referencia, se calcula la presión de fin de sístole por interpolación. SS: soplo sistólico.
EFS (g/cm2) = (0.334 x PFS x DSVI)/[PPd x (1 + PPd/DSVI)]
Para la determinación de la relación FAm-EFS normal se estudió a 63 individuos normales con edad promedio de 69 ± 13 años sin antecedentes cardiológicos, factores de riego cardiovasculares o enfermedades sistémicas, con lo que se obtuvo la siguiente ecuación de regresión: FAm = 28.15 - 0.12 x EFS, con un error estándar de estimación (EE) de 3.75% (r = 0.41 p < 0.001). Para un determinado nivel de EFS (poscarga), un valor inferior a la FAm predicha por la ecuación de regresión menos dos veces el EE se consideró como contractilidad disminuida en los pacientes con EAo16. El nivel de contractilidad (NC) se definió como la FAm medida menos la FAm predicha - 2 EE para un determinado valor de EFS, de tal manera que un valor positivo indica contractilidad normal y un valor negativo contractilidad disminuida.
La función diastólica se evaluó mediante la velocidad pico de la onda E (E) del flujo transmitral registrado con Doppler pulsado a nivel del borde libre de la válvula mitral, la relación E/e´ (e´ es el promedio de la velocidad pico de la onda e´ del septum y pared lateral obtenida con Doppler tisular pulsado), el índice de volumen de la aurícula izquierda y la presión sistólica de la arteria pulmonar.
Análisis estadístico: Se realizó con el software SPSS 25. Las variables continuas se expresaron como media ± desviación estándar. Para la comparación de los grupos se utilizó la prueba t de Student y para la correlación el cálculo del coeficiente r (Pearson). Como límite de significación se consideró una p < 0.05. Para determinar las variables independientes del NC, IVS y flujo aórtico se empleó la prueba de regresión lineal múltiple escalonada hacia delante.
Resultados
El 77% (23/30) de los pacientes con GB/FBp tenía hipertensión arterial y tabaquismo, que fueron los factores de riesgo cardiovascular más frecuentes, seguidos por la dislipemia en el 43% (13/30) y la obesidad (índice de masa corporal > 30 kg/m2) en el 40% (12/30). Hasta 21 pacientes (70%) tuvieron síntomas: angina en seis, síncope en dos pacientes, disnea grados I y II (New York Heart Association) en siete, disnea de grados III y IV en seis y nueve (30%) fueron asintomáticos. La presión arterial sistólica promedio fue de 130 ± 23 mmHg, la presión arterial diastólica de 75 ± 11 mmHg, la PFS de 93 ± 17 mmHg y la frecuencia cardíaca de 69 ± 10 latidos por minuto. Comparados con los individuos normales, los pacientes con GB/FBp tuvieron menor VFD, y los espesores parietales, EPR e IM fueron mayores con predominio de la hipertrofia concéntrica en 53% (16/30) con respecto a los otros tipos de geometría ventricular (Tabla 1).
Tabla 1 Parámetros ecocardiográficos
| Normales (n = 63) | GB/FBp (n = 30) | p | |
|---|---|---|---|
| Diámetro diastólico VI (cm) | 4.7 ± 0.4 | 4.8 ± 0.6 | 0.86 |
| Diámetro sistólico VI (cm) | 2.9 ± 0.4 | 3.2 ± 0.5 | 0.77 |
| Espesor septal en diástole (cm) | 0.8 ± 0.1 | 1.3 ± 0.23 | < 0.001 |
| Espesor pared posterior VI en diástole (cm) | 0.8 ± 0.1 | 1.2 ± 0.22 | < 0.001 |
| Espesor parietal relativo | 0.34 ± 0.09 | 0.52 ± 0.12 | < 0.01 |
| Índice de masa (g/m2) | 61 ± 14 | 135 ± 38 | < 0.001 |
| Geometría | |||
| Normal | 63 | 3 | |
| Remodelamiento concéntrico | 7 | ||
| Hipertrofia concéntrica | 16 | ||
| Hipertrofia excéntrica | 4 | ||
| Fracción de acortamiento endocárdica (%) | 38 ± 6 | 34 ± 8 | 0.68 |
| Fracción de acortamiento mesoparietal (%) | 22 ± 5 | 17 ± 5 | < 0.01 |
| Volumen de fin de diástole VI (ml) | 102 ± 8 | 81 ± 30 | < 0.01 |
| Volumen de fin de sístole VI (ml) | 32 ± 7 | 29 ± 16 | 0.17 |
| Fracción de expulsión (%) | 65 ± 4 | 66 ± 9 | 0.68 |
| Índice de volumen sistólico (ml/m2) | 40 ± 4 | 29 ± 5 | < 0.01 |
| Flujo aórtico (ml/s) | 231 ± 15 | 165 ± 25 | < 0.01 |
| Área valvular aórtica (cm2) | 0.68 ± 0.17 | ||
| Gradiente pico (mmHg) | 50 ± 11 | ||
| Gradiente medio (mmHg) | 28 ± 6 | ||
| Estrés de fin de sístole (g/cm2) | 53 ± 12 | 40 ± 21 | 0.21 |
| Nivel contráctil | 1.2 ± 4.2 | ||
| Contractilidad disminuida (n) (%) | 12 (40) | ||
| Excursión sistólica del anillo mitral (cm) | 1.59 ± 0.26 | 1.23 ± 0.27 | < 0.05 |
| Veloc. pico onda S Doppler tisular lateral (cm/s) | 10 ± 2 | 6.7 ± 1.7 | < 0.05 |
| Índice de volumen de AI (ml/ m2) | 29 ± 9 | 46 ± 15 | < 0.01 |
| Relación E/e´ | 5 ± 3 | 13 ± 6 | < 0.01 |
| Presión sistólica de arteria pulmonar (mmHg) | 26 ± 4 | 33 ± 6 | 0.48 |
Función sistólica del VI: No hubo diferencias entre los dos grupos con respecto a la FAe y FE, con la FAm, IVS y flujo aórtico disminuidos en los pacientes con GB/FBp.
Contractilidad: La Figura 2 muestra la correlación inversa entre la FAm y el EFS en los individuos normales y en los pacientes con GB/FBp y se observó que la FAm decrece a medida que aumenta el EFS. Cuarenta por ciento de los pacientes con GB/FB/p (12/30) tuvo valores de FAm-EFS inferiores al valor promedio de los individuos normales - 2 EE lo que indica contractilidad disminuida. El NC promedio en el grupo fue 1.2 ± 4.2.
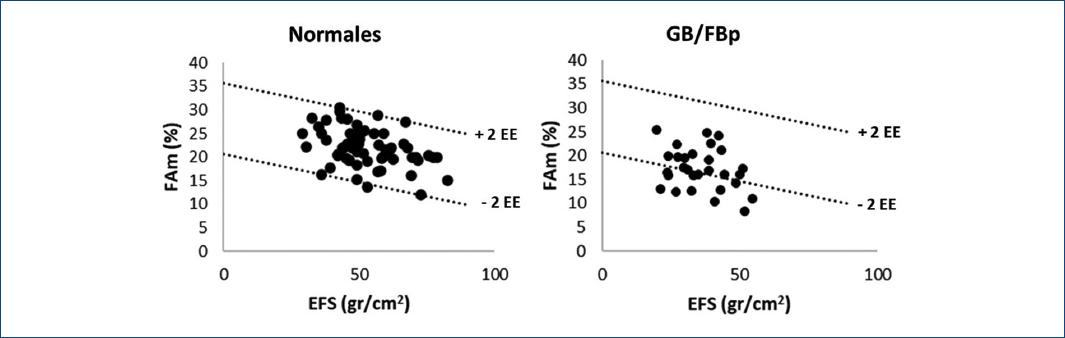
Figura 2 Diagrama de dispersión de la fracción de acortamiento mesoparietal (FAm) en función del estrés meridional de fin de sístole (EFS) en los individuos normales (izquierda) y los pacientes con GB/FBp (derecha). Las líneas de puntos corresponden a + 2 errores estándar (EE) y - 2 EE de la recta de regresión de los individuos normales las cuales definen el intervalo de confianza de la contractilidad normal. Los pacientes que se encuentran por debajo de la línea de -2 EE tienen la contractilidad disminuida.
En los pacientes con GB/FBp, el NC se correlacionó inversamente con el EPR y ello indica que el incremento del grado de hipertrofia concéntrica se corresponde con disminución de la contractilidad. La FAm se correlacionó positivamente con el NC, lo que sugiere que la disminución del NC se vincula con la disfunción mesoparietal (Tabla 2 y Fig. 3) No hubo correlación entre la FE y el NC.
Tabla 2 Coeficientes de correlación r de Pearson
| IVS | Flujo aórtico | Nivel contráctil | |
|---|---|---|---|
| Espesor parietal relativo | - 0.242 | - 0.020 | -0.499** |
| Fracción de acortamiento mesoparietal | 0.293 | 0.131 | 0.814‡ |
| Fracción de expulsión | 0.294 | - 0.166 | 0.208 |
| Índice de volumen sistólico | 0.575** | 0.331 | |
| Flujo aórtico | 0.121 | ||
| Área valvular aórtica | 0.429* | 0.639** | 0.087 |
| Estrés de fin de sístole | 0.064 | 0.058 | -0.070 |
| Nivel contráctil | 0.331 | 0.121 | |
| Excursión sistólica del anillo mitral | - 0.128 | 0.060 | 0.241 |
| Velocidad pico onda S Doppler tisular lateral | 0.218 | 0.202 | 0.309 |
*p < 0.05.
**p < 0.01.
‡p < 0.0001.
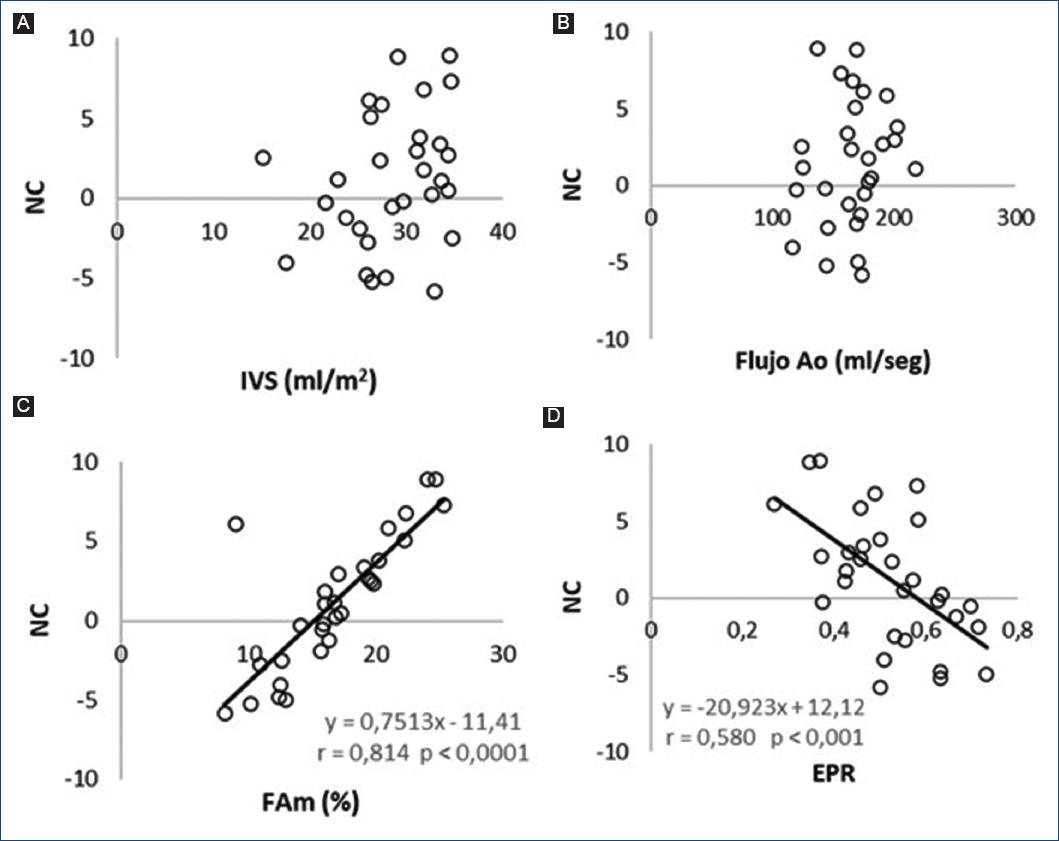
Figura 3 Diagramas de dispersión del nivel contráctil (NC). A: con respecto al índice de volumen sistólico (IVS). B: flujo aórtico. C: fracción de acortamiento mesoparietal (FAm). D: espesor parietal relativo. En C y D se representan las rectas de regresión y su correspondiente ecuación de regresión.
IVS y flujo aórtico: Ambos parámetros se correlacionaron con la gravedad de la EAo evaluada mediante el AVA (Fig. 4) pero no con el NC, lo que sugiere que la disminución de la contractilidad no es el determinante del IVS disminuido en la mayoría de los pacientes.
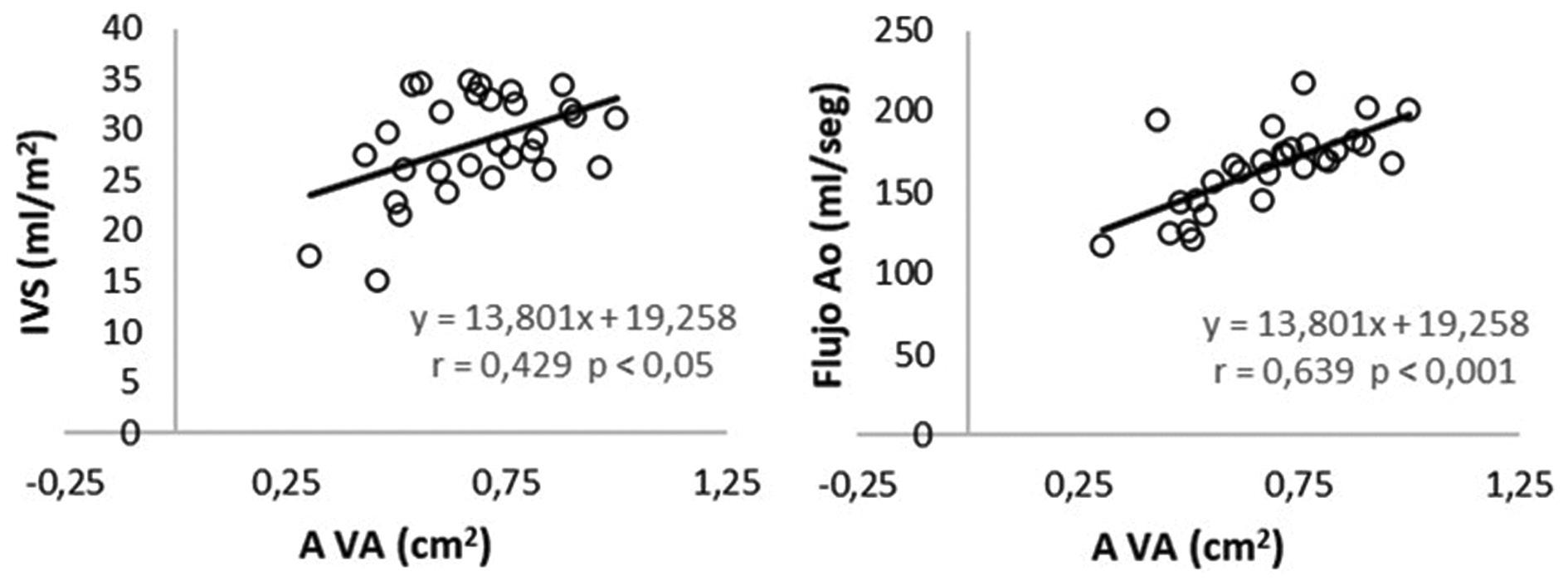
Figura 4 Diagramas de dispersión y rectas de regresión del área valvular aórtica (AVA) y el índice de volumen sistólico (IVS) (izquierda) y del AVA con respecto al flujo aórtico (derecha).
Función longitudinal del VI: La ESAM y la velocidad pico de la onda S del Doppler tisular estuvieron disminuidos con respecto a los individuos normales, pero no se correlacionaron con el NC, IVS y flujo aórtico. El IM se correlacionó inversamente con el ESAM y la velocidad pico de la onda S (r = - 0.47, p < 0.01 y r = - 0.63, p < 0.001, respectivamente). La velocidad pico de la onda S también se correlacionó en forma directa con el AVA (r = 0.40, p < 0.05).
Análisis de regresión lineal múltiple (Tabla 3): La FAm y el EPR fueron variables predictoras independientes del NC. De las variables que tuvieron correlación significativa con el IVS, sólo el AVA fue variable predictora independiente.
Tabla 3 Regresión lineal múltiple
| Variable dependiente: nivel contráctil | |||
|---|---|---|---|
| Coeficiente | Error estándar | P | |
| Fam | 0.67368 | 0.06968 | 0.00001 |
| EPR | -15.8944 | 2.72402 | 0.00001 |
| Variable dependiente: índice de volumen sistólico | |||
| Coeficiente | Error estándar | P | |
| AVA | 12.2964 | 5.38903 | 0.0321 |
| Variable dependiente: flujo aórtico | |||
| AVA | Coeficiente | Error estándar | P |
| 94.7728 | 23.7756 | 0.0006 | |
Al comparar a los pacientes con NC ≥ 0 con los de NC < 0 se observó que estos últimos tuvieron mayores espesores de PPd, SIVd y EPR, además de menor DDVI, FAe y FAm (Tabla 4). No hubo diferencias significativas en el IVS entre los dos grupos (27 ± 5 ml/m2 vs. 30 ± 5 ml/m2, p = 0.41 respectivamente) ni en el resto de las variables consideradas.
Tabla 4 Comparación entre contractilidad preservada y disminuida en los pacientes con GB/FBp
| Nivel contráctil < 0 (n = 12) | Nivel contráctil ≥ 0 (n = 18) | P | |
|---|---|---|---|
| Diámetro diastólico VI (cm) | 4.5 ± 0.6 | 5 ± 0.6 | < 0.05 |
| Diámetro sistólico VI (cm) | 3.2 ± 0.5 | 3.1 ± 0.6 | 0.56 |
| Espesor septal en diástole (cm) | 1.4 ± 0.24 | 1.2 ± 0.19 | < 0.05 |
| Espesor pared posterior VI en diástole (cm) | 1.3 ± 0.21 | 1.1 ± 0.20 | < 0.05 |
| Espesor parietal relativo | 0.60 ± 0.10 | 0.47 ± 0.10 | 0.001 |
| Índice de masa (g/m2) | 139 ± 42 | 132 ± 37 | 0.36 |
| Geometría | |||
| Normal | 1 | 2 | |
| Remodelamiento concéntrico | 4 | 4 | |
| Hipertrofia concéntrica | 7 | 9 | |
| Hipertrofia excéntrica | 0 | 3 | |
| Fracción de acortamiento endocárdica (%) | 29 ± 3 | 37 ± 8 | < 0.01 |
| Fracción de acortamiento mesoparietal (%) | 13 ± 3 | 19 ± 4 | < 0.0001 |
| Volumen de fin de diástole VI (ml) | 84 ± 44 | 79 ± 18 | 0.19 |
| Volumen de fin de sístole VI (ml) | 33 ± 23 | 26 ± 10 | 0.12 |
| Fracción de expulsión (%) | 64 ± 10 | 67 ± 7 | 0.56 |
| Índice de volumen sistólico (ml/m2) | 27 ± 5 | 30 ± 5 | 0.41 |
| Flujo aórtico (ml/s) | 154 ± 22 | 172 ± 25 | 0.21 |
| Área valvular aórtica (cm2) | 0.61 ± 0.14 | 0.73 ± 0.18 | 0.11 |
| Gradiente pico (mmHg) | 51 ± 11 | 49 ± 10 | 0.52 |
| Gradiente medio (mmHg) | 29 ± 5 | 27 ± 6 | 0.64 |
| Estrés de fin de sístole (g/cm2) | 36 ± 11 | 41± 26 | 0.39 |
| Nivel contráctil | - 2.9 ± 2.0 | 4.0 ± 2.8 | < 0.0001 |
| Excursión sistólica del anillo mitral (cm) | 1.25 ± 0.39 | 1.47 ± 0.30 | 0.18 |
| Veloc. pico onda S Doppler tisular lateral (cm/s) | 6.3 ± 1.5 | 7.0 ± 1.8 | 0.21 |
| Índice de volumen de AI (ml/m2) | 49 ± 18 | 45 ± 12 | 0.46 |
| Relación E/é | 14 ± 6 | 12 ± 6 | 0.10 |
| Presión sistólica de arteria pulmonar (mmHg) | 34 ± 7 | 33 ± 6 | 0.45 |
En cuanto a la función diastólica, los pacientes con GB/FBp presentaron mayor índice de volumen auricular izquierdo y relación E/e' que los individuos normales. No se observó diferencia en estos parámetros al comparar a pacientes con NC ≥ 0 y NC < 0.
Discusión
Los principales hallazgos de este trabajo son: a) la contractilidad estuvo disminuida en el 40% de los pacientes con GB/FBp a pesar de tener FE preservada, b) el NC se correlacionó con el EPR y la FAm y c) el IVS y el flujo aórtico no mostraron correlación con el NC pero sí con la gravedad de la EAo (AVA).
La contractilidad se define como la capacidad inherente del miocardio de contraerse independientemente de la precarga y la poscarga17. La FE se determina por el movimiento endocárdico desde el final de la diástole hasta el final de la sístole normalizado al volumen de fin de diástole y expresa la función de cámara del VI, mientras que la contractilidad representa la función muscular. Debido a la dependencia que tiene con la poscarga, la FE puede estar disminuida en presencia de contractilidad conservada y normalizarse luego del reemplazo valvular aórtico (afterload mismatch)8. Sin embargo, algunos pacientes pueden tener FE preservada y la contractilidad disminuida9. Ito, et al.18 estudiaron a 455 pacientes de los cuales 290 tenían FE ≥ 60% y 155 FE < 60%. Mediante el sistema FAm-EFS para evaluar la contractilidad, el 24% de los pacientes con FE ≥ 60% y el 50% con FE de 50%-60% mostró contractilidad disminuida, aunque no se analizó a los pacientes con GB/FBp. La evaluación de la contractilidad mediante el sistema FAm-EFS está definida por la relación inversa que existe entre ambos y permite normalizar un parámetro de acortamiento como la FAm para el nivel de poscarga del VI representado por el EFS19,20. La caracterización de la función sistólica por la FAm en forma aislada no permite establecer por sí misma si la reducción se debe a una depresión de la contractilidad o al exceso de poscarga si no se la relaciona con esta última. La FE o FAe sobrestiman la función sistólica (de cámara) en presencia de hipertrofia concéntrica debido al aumento del número de sarcómeros en paralelo que incrementa el movimiento endocárdico; es por esta razón que la FAm es un parámetro más adecuado de acortamiento circunferencial para utilizar en estas circunstancias21. En los pacientes con GB/FBp, el NC se correlacionó en grado significativo con la FAm e inversamente con el EPR. En el análisis de regresión lineal múltiple, la FAm y el EPR fueron variables predictoras independientes del NC. Diversos autores han publicado que el grado de hipertrofia en la EAo se relaciona con mayor grado de fibrosis y deterioro de la función sistólica22-24, en concordancia con los hallazgos de los autores de mayor EPR en los pacientes con NC < 0 en comparación con NC ≥ 0. Cioffi, et al.25 estudiaron a 200 pacientes con EAo asintomática con diversos grados de gravedad y encontraron que la combinación de disfunción circunferencial (FAm < 16.5%) y longitudinal (onda S < 8.5 cm/s) fue de 44% en los pacientes con hipertrofia concéntrica, además de tener mayor disfunción diastólica y menor AVA. En los pacientes con GB/FBp, la FE no se correlacionó con el NC como ya se publicó con anterioridad20,26.
Se ha comunicado que la depresión de la contractilidad es una posible causa de disminución del IVS y flujo aórtico en los pacientes con FB27. En este estudio, el NC no se correlacionó con el IVS ni con el flujo aórtico, que estuvo disminuido en el 40% de los pacientes y preservado en el 60% restante, lo que indicaría que la contractilidad está conservada en la mayoría de los pacientes y no es causante del flujo bajo. Ambos parámetros tuvieron correlación con la gravedad de la EAo representada por el AVA (Fig. 4). Si bien se ha publicado la disminución de la función longitudinal en pacientes con flujo bajo28-30, en este estudio el ESAM y la onda S del Doppler tisular no tuvieron correlación con el NC, IVS y el flujo aórtico, aunque estuvieron disminuidos con respecto a los individuos normales. Ambos parámetros se correlacionaron con el IM en forma inversa. Cromariuc, et al.31 estudiaron a 70 pacientes con EAo en los cuales los cambios en la geometría ventricular como el aumento del IM y el EPR se vincularon con reducción de la función longitudinal evaluada mediante el desplazamiento y el strain longitudinal.
Al comparar a los pacientes con contractilidad preservada (NC ≥ 0) con los que la tenían disminuida (NC < 0), los índices de función longitudinal no mostraron diferencias significativas. Esta consideración puede extenderse también al strain longitudinal global, el cual no sólo está influido por el NC sino también por la poscarga y ello podría limitar su valor para evaluar la contractilidad en este grupo de pacientes32,33.
Limitaciones de estudio: La cardiopatía isquémica no pudo descartarse por completo como la disminución de la contractilidad, si bien se realizó coronariografía en el 57% de los pacientes. El strain por análisis de moteado se registró en pocos pacientes por lo que no se incluyó en el análisis, aunque se evaluó el ESAM y la velocidad pico de la onda S del Doppler tisular que han demostrado tener buena correlación con el strain34.
Conclusiones
La contractilidad estuvo deprimida en el 40% de los pacientes con GB/FBp a pesar de tener FE preservada. El NC mostró correlación con el acortamiento circunferencial (FAm) y la geometría ventricular (EPR). La disminución del IVS y el flujo aórtico que caracteriza a los pacientes con GB/FBp parecen estar relacionados más con la gravedad de la estenosis aórtica y menos con la reducción de la contractilidad.











 nueva página del texto (beta)
nueva página del texto (beta)


