Introducción
El nuevo coronavirus 2 (SARS-CoV-2), agente causante de una neumonía viral severa (COVID-19), tiene una letalidad elevada en pacientes de alto riesgo clínico como consecuencia de complicaciones cardiovasculares, en especial en mayores de 65 años o con antecedentes de enfermedad cardiovascular, afección renal crónica o enfermedad pulmonar obstructiva crónica1-3.
La incidencia de enfermedad tromboembólica venosa (ETEV) en estos pacientes no se ha establecido con claridad aún, aunque se conoce su sólida relación con otras infecciones virales graves4-6. En individuos con COVID-19 grave se ha identificado tromboembolismo pulmonar (TEP) agudo durante la hospitalización del 20.6%7 con una incidencia acumulada de ETEV del 27%6. Se han notificado múltiples casos de pacientes que corroboran este nexo, con consecuencias clínicas deletéreas y mala evolución8,9.
Estas complicaciones trombóticas se sustentan en el desarrollo de un síndrome de respuesta inflamatoria sistémica (SRIS) y la activación de la cascada de la coagulación en el 90% de los pacientes con COVID-19 grave10. Las necropsias practicadas en individuos muertos por COVID-19 han demostrado microtrombosis y macrotrombosis intravasculares pulmonares agregadas a los hallazgos típicos del Síndrome de dificultad respiratoria aguda severa (SARS, Severe Acute Respiratory Syndrome)11, lo que sugiere un posible beneficio clínico de los anticoagulantes en dosis profiláctica o anticoagulante. En fecha reciente, la revisión de 12 casos letales de COVID-19 mostró que el 58% de las necropsias tenía trombosis venosa profunda (TVP), no sospechada en clínica, y el 33% murió por TEP12.
En esta revisión se describen diversos aspectos del diagnóstico y tratamiento del TEP durante esta pandemia con la finalidad de facilitar la atención de estos complejos pacientes.
Métodos
Se realizó una revisión bibliográfica internacional de los artículos publicados en las bases de datos MEDLINE, PubMed y EMBASE. La selección de los artículos se efectuó en función de los siguientes criterios: estudios con metodología cualitativa y cuantitativa, informes de casos, revisiones bibliográficas y declaraciones de instituciones profesionales y sociedades científicas. Se excluyeron los estudios efectuados fuera del ámbito hospitalario (debido al tratamiento intrahospitalario del padecimiento) y los estudios no accesibles a la totalidad del texto. El grupo de autores evaluó las publicaciones identificadas y se identificó información adicional en las referencias bibliográficas de cada publicación.
La búsqueda bibliográfica se basó en la obtención de documentación que suministrara información del tratamiento actualizado y global del TEP y el COVID-19, en particular en pacientes adultos hospitalizados. Para ello se dividió la búsqueda inicial en dos grandes bloques: tratamiento global del TEP (diagnóstico y atención) y tratamiento del COVID-19 (sobre todo en relación con la aparición de fenómenos trombóticos en casos graves).
Las palabras clave utilizadas se eligieron de acuerdo con las terminologías MeSH y DeCS: “embolia pulmonar”, “infecciones por coronavirus”, “trombosis” y “telemedicina” en español, y “pulmonary embolism”, “coronavirus infections”, “thrombosis” y “telemedicine” en inglés.
Del total de referencias encontradas, se seleccionaron 63 documentos de interés: 6 casos clínicos o series de casos, 24 estudios observacionales, 1 estudio de intervención aleatorizado, 11 revisiones bibliográficas, 7 revisiones sistemáticas, 1 metaanálisis, 10 artículos de posición de sociedades científicas, y 3 editoriales o artículos de opinión.
Consideraciones diagnósticas del TEP durante la pandemia por SARS-CoV-2
La sospecha de TEP durante la pandemia por SARS-CoV-2 representa un reto diagnóstico debido a la existencia de similitudes entre ambas anomalías, en especial ante un paciente con disnea o insuficiencia respiratoria como síntoma inicial.
En personas con COVID-19 debe considerarse la presencia concomitante de TEP agudo ante empeoramiento respiratorio inesperado, ausencia de cambios radiológicos significativos, taquicardia sinusal inexplicable, hipotensión o choque no atribuible a taquiarritmia, hipovolemia o sepsis, nuevos cambios indicativos de TEP en el electrocardiograma13 o aparición de signos de TVP. Los métodos de imágenes confirmatorios de TEP son fundamentales para establecer el diagnóstico.
Asimismo, en individuos con disnea o insuficiencia respiratoria, en los que se diagnostica TEP inicial, debe considerarse siempre la posibilidad de infección viral subyacente, sobre todo ante síntomas de vías respiratorias superiores, fiebre o imágenes tomográficas consistentes con infección viral. Si la gravedad de la inestabilidad hemodinámica o la insuficiencia respiratoria en pacientes con diagnóstico de TEP no pueden explicarse completamente por la carga trombótica en la angiotomografía pulmonar (angio-TC) o la afectación de la función del ventrículo derecho (VD) en el ecocardiograma transtorácico (ETT), debe descartarse también la infección por SARS-CoV-2 de modo simultáneo.
La tabla 1 muestra los aspectos esenciales del diagnóstico diferencial de ambas anomalías. En las figuras 1 y 2 se describen los algoritmos diagnósticos del TEP en pacientes con estabilidad e inestabilidad hemodinámicas en el contexto del COVID-19.
Tabla 1 Diagnóstico diferencial entre TEP y COVID-19
| TEP | COVID-19 grave | |
|---|---|---|
| Clínica | ||
| Fiebre | Casi nunca presente/+ (infarto pulmonar) | +++ |
| Vía respiratoria superior | Sin síntomas | Síntomas + (incluidas ageusia y anosmia) |
| Signos de TVP | Casi siempre presentes | Ausentes (no son excluyentes) |
| Laboratorio | ||
| Dímero D | + | -/+++ |
| PCR y ferritina | -/+ | +++ |
| Linfopenia | Casi nunca presente | Casi siempre presente (+++) |
| Troponina | -/++ (estratificación de riesgo) | -/+ (miocarditis por COVID-19) |
| BNP y proBNP | -/+ (estratificación de riesgo) | -/+ (¿insuficiencia cardíaca adjunta?) |
| Radiografía de tórax | ||
| Normal (baja sensibilidad) | Normal (baja sensibilidad) | |
| Signos de Fleisschner, Westermark o Hampton | Opacidades reticulares, consolidaciones | |
| Tomografía de tórax | ||
| Ventana pulmonar | Normal Áreas de hipodensidad vascular Infarto pulmonar (consolidación en cuña) |
Vidrio esmerilado periférico bilateral + posibles engrosamientos pleurales + posibles consolidaciones focales |
| Angiotomografía pulmonar | TEP visible (trombo visible) Dilatación VD, índice VD/VI ≥ 1 |
Sin alteraciones (casi nunca se identifica la microtrombosis local inflamatoria) |
| Ecografía Doppler Ecocardiografía (VD) |
-/+ (dilatación/discinesia VD, índice VD/VI ≥ 1) | -/+ (alteración del VI en miocarditis) |
TEP: tromboembolismo pulmonar agudo; COVID-19: enfermedad por coronavirus-19; TVP: trombosis venosa profunda; PCR: proteína C reactiva; BNP: péptido natriurético cerebral; VD: ventrículo derecho; VI: ventrículo izquierdo.
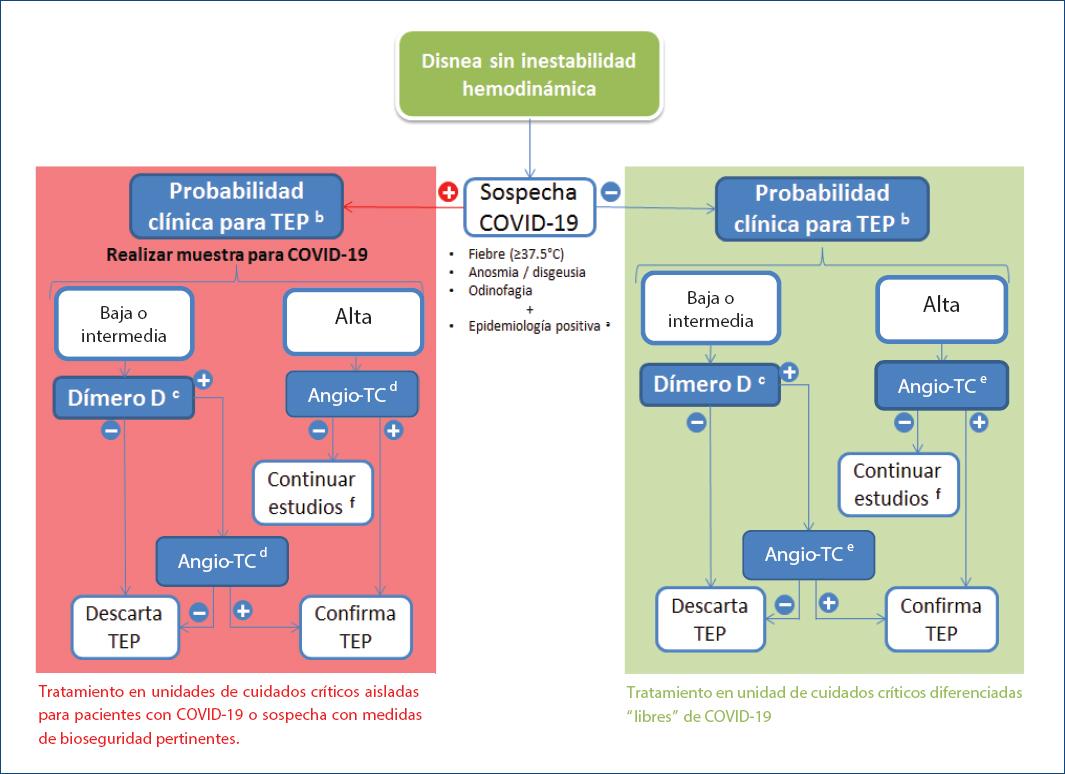
Figura 2 Algoritmo terapéutico en pacientes con estabilidad hemodinámica.aResidencia en zonas con circulación comunitaria, historial de viaje a éstas o contacto con casos confirmados en los últimos 14 días. La definición de caso sospechoso puede variar en cada país, por lo que cada centro debe regirse por las recomendaciones locales.bSegún juicio clínico o escalas validadas antes de la prueba (Wells o Ginebra).cSi el DD del hospital es de moderada sensibilidad, debe restringirse este paso a pacientes sólo de baja probabilidad.dValorar alteraciones del parénquima pulmonar indicativas de COVID-19.eValorar alteraciones del parénquima pulmonar indicativas de COVID-19 para determinar casos sospechosos oligosintomáticos.fEn caso de angiotomografía pulmonar negativa en pacientes con alta probabilidad clínica, considerar pruebas de imagen adicionales.
Sospecha clínica inicial
- Clínica: los pacientes con COVID-19 muestran con frecuencia fiebre, síntomas de vías respiratorias superiores (incluidas anosmia y ageusia), mialgias y artralgias difusas, disnea de rápida progresión, insuficiencia respiratoria, taquicardia (sinusal u otra taquiarritmia), descompensación hemodinámica e incluso hemoptisis1-3,14-17. El empeoramiento de la insuficiencia respiratoria o la descompensación hemodinámica en pacientes infectados, o el desarrollo de signos de TVP, alertan sobre la aparición de TEP.
- Factores de riesgo: los pacientes considerados como población de riesgo para formas graves de COVID-19 (insuficiencia cardíaca, obesidad, enfermedad pulmonar obstructiva crónica, neoplasias activas y otras afecciones crónicas, edad mayor de 65 años, inmunosupresión, entre otros) también tienen riesgo aumentado de TEP17. Un viaje prolongado (sobre todo a zonas de circulación comunitaria del SARS-CoV-2), el antecedente de ETEV, las operaciones o una hospitalización prolongada recientes elevan la probabilidad de embolia pulmonar17-19.
- Anomalías de la coagulación: los trastornos hemostáticos en pacientes con COVID-19 grave incluyen trombocitopenia leve y dímero D (DD) aumentado hasta 3.5 veces o más respecto del máximo valor normal, así como una prolongación del tiempo de protrombina y un acortamiento del tiempo parcial de tromboplastina activada4,20-26. La coagulación intravascular diseminada por COVID-19 grave se vincula con un desenlace adverso4. Estos cambios hemostáticos son consecuencia de la tormenta de citocinas y el desarrollo de trombosis microvascular y macrovascular en el contexto del SRIS, aunque no se descarta un efecto viral directo o secundario a anticuerpos que reaccionan en forma cruzada con factores de la coagulación, o incluso consecuencia del daño hepático resultante27-29.
- Dímero D: los pacientes con COVID-19 grave, con o sin desarrollo de TEP como complicación trombótica, experimentan elevación del DD y en todos los casos es un marcador de evolución desfavorable4,25. Aunque la mayoría de los pacientes infectados con SARS-CoV-2 tiene DD por debajo de 1,000 ng/ml14,15, algunos informes sugieren que valores muy elevados se relacionan sólidamente con la coexistencia de TEP, por lo que podría tratarse de uno de los criterios para establecer una profilaxia antitrombótica de alta intensidad o incluso anticoagulación en casos confirmados de infección viral con DD elevado (un DD > 3.5 veces su valor máximo normal se vincula con un riesgo 18 veces superior de mortalidad)25. En ese sentido, el DD en límites normales puede descartar TEP como complicación trombótica debido a su elevado valor predictivo negativo18,30. Se recomienda el uso de un umbral de DD de acuerdo con la probabilidad anterior a la prueba o la edad para obtener una especificidad mayor18,31.
- Punto de corte regular: 0.5 mg/L
- Punto de corte de alta probabilidad antes de la prueba: 1 mg/L
- Punto de corte ajustado por edad: edad x 0.01 mg/L (pacientes > 50 años)
- Marcadores de inflamación: la infección por SARS-CoV-2 cursa muchas veces con linfopenia y elevación de marcadores inflamatorios, como proteína C reactiva, ferritina, lactato deshidrogenasa e interleucina 6 como efecto del SRIS grave, los cuales se correlacionan con requerimiento de ventilación mecánica y muerte32-34. Estos pacientes con formas graves de la infección tienen mayor probabilidad de sufrir complicaciones con TEP4-10.
2. Métodos complementarios diagnósticos: algunos estudios de imágenes, en particular la angiotomografía y la ecografía Doppler para descartar TVP, pueden ser imposibles en pacientes con SDRA y posición prona. En estos casos graves, la disfunción sistólica del VD en el ETT puede ser un hallazgo sensible para determinar el diagnóstico de TEP35.
- Angiotomografía: es fundamental para el diagnóstico temprano del TEP en pacientes con COVID-19, ya que determina un cambio en la atención terapéutica al detectar trombos macroscópicos intravasculares18,36. La valoración del parénquima pulmonar permite detectar compromiso neumónico viral, con áreas en vidrio esmerilado o consolidación difusa en forma bilateral37. Ante una sospecha clínica elevada de TEP, TVP o trombosis de catéteres, pese a una adecuada tromboprofilaxis en pacientes infectados con SARS-CoV-2, y en especial cuando no es posible realizar estudios para su confirmación, debe iniciarse anticoagulación empírica.
- Centellograma de ventilación/perfusión: se recomienda evitar o diferir hasta que no exista riesgo de transmisión viral en el paciente con COVID-19 o sospecha de él. Si es necesario este estudio, se recomienda valorar sólo la perfusión pulmonar, a fin de delinear dos o más defectos segmentarios en los campos pulmonares38.
- Radiografía de tórax: tiene baja sensibilidad para ambas anomalías. En pacientes con neumonía por COVID-19 pueden identificarse opacidades reticulares y regiones de atenuación en vidrio esmerilado de predominio periférico37,39. En ocasiones, en individuos con TEP, pueden hallarse alguno datos específicos como los signos de Fleisschner (agrandamiento de la arteria pulmonar), Westermark (oligohemia regional) y Hampton (consolidación pulmonar basal sin broncograma aéreo y elevación diafragmática)18,40.
- Ecografía Doppler: el TEP afecta con frecuencia la función o diámetros del VD o induce hipertensión pulmonar aguda, por lo que el ecocardiograma tiene especial importancia diagnóstica en el TEP con inestabilidad hemodinámica en pacientes con COVID-1918. La TVP en la ecografía Doppler venosa de miembros inferiores sustenta este diagnóstico18.
3. Estratificación del riesgo:
- Troponina y BNP: sólo se justifica su prescripción en pacientes con infección por SARS-CoV-2 cuando se sospechen complicaciones cardiovasculares de éste; es un marcador de mal pronóstico41-43, en particular si se diagnosticó TEP como una de esas posibles complicaciones (estratificación del riesgo del episodio embólico)18.
- Ecocardiograma: en la medida que no modifique la conducta clínica del caso (pacientes con TEP y riesgo clínico bajo), se recomienda diferir este estudio hasta que el riesgo de infección lo permita para reducir el contagio del personal que realiza el estudio complementario44.
Consideraciones terapéuticas del TEP durante la pandemia por SARS-CoV-2
Existen algunas consideraciones terapéuticas que deben tenerse en cuenta durante la pandemia a fin de disminuir la morbimortalidad del TEP y reducir al mínimo el riesgo de infección y contagio en el personal de salud, otros pacientes y los familiares.
-
1. Anticoagulación: tanto para la etapa aguda del TEP como para su tratamiento ambulatorio es aconsejable seguir las recomendaciones de las guías de práctica clínica18.
En la etapa aguda del TEP se recomienda priorizar las heparinas de bajo peso molecular (HBPM), dado que no requieren una estricta vigilancia del coagulograma, y con ello reducir el contacto del personal de salud ante un caso sospechoso o confirmado de COVID-19. Además, no se han detectado hasta la fecha interacciones farmacológicas entre las HBPM o la heparina sódica y los fármacos administrados para el tratamiento del COVID-19 (ritonavir, lopinavir)45-47. En caso de trombocitopenia inducida por heparina, el fondaparinux es una opción terapéutica18.
En cuanto a la anticoagulación ambulatoria, los anticoagulantes orales directos (ACOD) no requieren vigilancia de su eficacia y por ende reducen el riesgo de diseminación viral relacionado con la consulta ambulatoria, a diferencia de lo que sucede con los antagonistas de la vitamina K. Estos últimos deben reservarse para el caso de contraindicación para ACOD18,48. Sin embargo, se han notificado interacciones farmacológicas con ritonavir o lopinavir, sobre todo rivaroxabán y en menor medida apixabán, ya que potencian su acción anticoagulante al inhibir a la citocromo P450 3A4 (CYP3A4) y la glucoproteína-P45-47.
2. Apoyo hemodinámico: la insuficiencia aguda del VD con bajo volumen por minuto sistémico (BVMS) es la principal causa de muerte en TEP de alto riesgo, un mecanismo fisiopatológico que puede empeorar con el COVID-19 grave y SARS (microtrombosis pulmonar, inflamación alveolar y elevación de la presión sistólica pulmonar), por lo que el tratamiento de apoyo es fundamental junto con la reperfusión pulmonar18,49. En pacientes intubados, la presión teleespiratoria elevada tiene efectos deletéreos sobre el retorno venoso y la precarga del VD, por lo que se recomiendan valores intermedios en casos de TEP y COVID-19 grave18,50. La expansión con líquidos es útil para aumentar el índice cardíaco18,50 y con frecuencia son necesarios los vasopresores como efecto de la vasoplejía que causa el SRIS18,50. Se pueden considerar los fármacos inotrópicos (dobutamina, dopamina o levosimendán) en pacientes con BVMS18,50. Si se considera el apoyo circulatorio mecánico por la resistencia a los inotrópicos y vasopresores, es preferible el sistema de membrana de oxigenación extracorpórea (ECMO)51.
3. Trombólisis sistémica: las indicaciones para la reperfusión del TEP mediante trombolíticos sistémicos18 son similares en el contexto de la actual pandemia. En casos de COVID-19 grave con coagulación intravascular diseminada y sangrados activos, se deben valorar los riesgos y beneficios de esta terapéutica. No hay evidencia para su utilización en ausencia de ETEV demostrada.
4. Tratamiento percutáneo: las técnicas intravasculares han demostrado similar eficacia que los trombolíticos sistémicos y un mejor perfil de seguridad18,52,53. Sin embargo, su indicación debe limitarse durante la pandemia a pacientes con TEP de alto riesgo y contraindicación de trombolíticos o falla de éstos18,54-56 para reducir el riesgo de contagio del personal de salud. En caso confirmado de COVID-19 debe evitarse o diferirse hasta que el riesgo de infección lo permita, excepto en casos de TEP con descompensación hemodinámica resistente. Las medidas de protección en la sala de hemodinamia deben establecerse según la situación epidemiológica local y la sospecha o confirmación de COVID-19 del paciente de acuerdo con recomendaciones internacionales57-59.
5. Embolectomía quirúrgica: si se considera la necesidad de optimizar los recursos en la pandemia por SARS-CoV-2, en caso de indicación de reperfusión pulmonar y contraindicación para trombolíticos sistémicos, es razonable priorizar las intervenciones intravasculares sobre el tratamiento quirúrgico debido a su menor complejidad, menor tiempo de permanencia en unidades de cuidados intensivos y hospitalización total18,60.
6. Colocación de filtro de vena cava: debe considerarse en casos de TVP proximal o TEP con contraindicación absoluta para anticoagulantes, o bien con recurrencia de ETEV bajo tratamiento anticoagulante óptimo61. En casos sospechosos o confirmados de COVID-19 se debe evitar o diferir hasta que el riesgo de infección lo permita, a menos que la tromboembolia recurrente ponga en riesgo la vida.
7. Consideraciones en el seguimiento ambulatorio: como se mencionó con anterioridad, los ACOD pueden ser los anticoagulantes de elección en el tratamiento ambulatorio. Luego del egreso institucional se recomienda establecer un seguimiento mediante un sistema de telemedicina para reducir el número de pacientes en el ámbito hospitalario62,63.
Puntos de controversia: microtrombos y anticoagulación profiláctica
En pacientes con COVID-19 grave, además del aumento de la incidencia de TEP, se ha reconocido el desarrollo de trombosis in situ o microtrombos (también denominado síndrome tromboinflamatorio microvascular obstructivo de vasos pulmonares por COVID-19)64-66. Este fenómeno de trombosis in situ se vincula al parecer con la reacción inflamatoria local en la circulación pulmonar en relación con el síndrome de activación macrofágica, la desregulación de la reacción inmunitaria pulmonar a través de la inhibición de la expresión del receptor de la enzima convertidora de angiotensina 2 generada por el virus, la desregulación habitual de la respuesta inflamatoria en pacientes ancianos y la activación relacionada de la cascada de la coagulación10,11,26,27,66,67. Los informes post mortem revelan daño alveolar difuso, trombosis microvascular diseminada, edema e infiltración por células inflamatorias en el plano vascular pulmonar en estos pacientes12,66,67. Los microtrombos podrían explicar la elevada mortalidad por SDRA en pacientes con COVID-19 grave sin TEP identificado en la angiotomografía. Es necesario profundizar en el conocimiento de estos hallazgos, ya que un tratamiento anticoagulante en dosis profiláctica de alto riesgo, o en dosis plena en ausencia de diagnóstico de TEP, podría disminuir la mortalidad de los pacientes con infección grave por SARS-CoV-2 y marcadores bioquímicos de trombosis sistémica muy elevados68,69.
Conclusiones
La infección por SARS-CoV-2 se relaciona con el desarrollo de episodios trombóticos, como consecuencia de una activación de la cascada de la coagulación y el SRIS. El diagnóstico y el tratamiento del TEP en pacientes con COVID-19 representan un reto para los agentes de la salud con el objetivo de reducir la morbimortalidad relacionada con la enfermedad; asimismo, es necesario disminuir el riesgo de infección, tanto para los profesionales de la salud como para los pacientes y los familiares.











 nueva página del texto (beta)
nueva página del texto (beta)



