Introducción
El síndrome metabólico (SMet) se caracteriza por resistencia a la insulina, exceso de peso, intolerancia a la glucosa, dislipidemia aterogénica (triglicéridos elevados y colesterol unido a lipoproteínas de alta densidad [C-HDL] bajo), inflamación y estado protrombótico1,2. Los estudios clínicos retrospectivos y los metaanálisis han mostrado que los pacientes con SMet tienen mayor riesgo de enfermedad arterial coronaria (EAC)3,4. La lipoproteína(a) [Lp(a)] es un complejo macromolecular formado por una lipoproteína de baja densidad y la Apo(a), una proteína similar al plasminógeno5 que se une a la fibrina bloqueando la fibrinólisis y aumentando la trombogénesis6,7. Varios estudios han demostrado que la concentración elevada de Lp(a) es un factor de riesgo independiente de EAC8-13. Sin embargo, la asociación con el depósito de calcio en las arterias coronarias es controversial: algunas evidencias son positivas14,15 y otras son negativas16,17. La inconsistencia de los resultados pudiera deberse principalmente a: 1) la amplia variación en la concentración de Lp(a) determinada genéticamente en los grupos étnicos; 2) las prevalencias de los polimorfismos del gen LPA asociados a concentraciones elevadas de Lp(a)18-20; y 3) las diferencias en la prevalencia de obesidad, diabetes, hipertensión y tabaquismo en los grupos estudiados. De acuerdo con la Encuesta Nacional de Salud y Nutrición 2018 (https://ensanut.insp.mx/encuestas/ ensanut2018/ informes.php) en población adulta mexicana, la prevalencia de SMet es del 45%, la de exceso de peso (sobrepeso y obesidad) es del 75.2%, la de diabetes mellitus es del 10.3%, la de hipertensión es del 18.4% y la de tabaquismo es del 7.1%. En un estudio previo en población mexicana, la prevalencia de Lp(a) elevada ≥ 30 mg/dl fue del 14%, y en el 33% de los pacientes con EAC se asoció con infarto agudo al miocardio21. En un estudio en mestizos mexicanos sin antecedentes personales ni familiares de EAC, la prevalencia de calcificación arterial coronaria (CAC) > 0, que es un factor de riesgo independiente de EAC22, fue del 27%23.
Considerando que las prevalencias de SMet y L(a) ≥ 30 mg/dl son elevadas en nuestra población, y que el efecto de la coexistencia de ambos factores de riesgo sobre la aterosclerosis subclínica se desconoce, el propósito de este estudio fue investigar en sujetos sin antecedentes personales ni familiares de EAC la asociación del SMet y la concentración de Lp(a) con la presencia de aterosclerosis subclínica evaluada por el depósito de CAC.
Método
Sujetos estudiados
Se incluyeron 953 sujetos del proyecto Genética de la Enfermedad Aterosclerosa (GEA)24, diseñado en el Instituto Nacional de Cardiología Ignacio Chávez para investigar la asociación de factores genéticos con factores de riesgo cardiovascular tradicionales y emergentes en población mexicana adulta de la Ciudad de México sin antecedentes de EAC prematura, con una edad entre 35 y 70 años, en sujetos reclutados de los donadores que acuden al banco de sangre de dicho Instituto o mediante invitación en centros de salud del área metropolitana de la Ciudad de México. Ninguno de los participantes presentó enfermedad hepática, renal, tiroidea u oncológica. El protocolo de estudio fue aprobado por el Comité de Ética del Instituto Nacional de Cardiología y diseñado de acuerdo con las guías de la Declaración de Helsinki. Todos los participantes firmaron el consentimiento informado.
A todos los sujetos se les aplicaron cuestionarios validados para obtener información demográfica, antecedentes personales y familiares de factores de riesgo para EAC, actividad física y uso de medicamentos. El índice de masa corporal (IMC) se obtuvo con la fórmula: peso (kg) / estatura (m2). El perímetro de la cintura (cm) se midió con una cinta métrica de fibra de vidrio, colocada en el punto medio entre la última costilla y la cresta ilíaca, con una aproximación de 0.5 cm.
La frecuencia cardiaca y la presión arterial sistólica y diastólica se midieron en tres ocasiones con intervalos de 1 minuto, después de 10 minutos de reposo en posición sedente. Para los análisis estadísticos se usó el promedio de la segunda y la tercera mediciones. La hipertensión arterial se definió de acuerdo con las guías del Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure25. Se consideraron fumadores activos los sujetos que fumaban al menos un cigarro al día o siete a la semana durante los 6 meses previos al estudio. La actividad física durante el trabajo y el tiempo libre se evaluó usando un cuestionario validado internacionalmente26.
Las muestras de sangre de los participantes se obtuvieron por la mañana con un ayuno mínimo de 10 horas, sin haber practicado ejercicio antes de la punción venosa y después de 20 minutos en reposo en posición sedente. Los valores de glucosa, colesterol total (CT), triglicéridos (TG), C-HDL, Apo AI y B100 se determinaron en plasma con métodos enzimáticos colorimétricos (Roche/Hitachi, Germany) en un autoanalizador Hitachi 902 (Hitachi LTD, Tokyo Japan). El colesterol unido a lipoproteínas de baja densidad (C-LDL) se calculó con la fórmula de Friedewald modificada por DeLong, et al.27, y el colesterol no HDL se calculó con la diferencia entre el CT menos el C-HDL (colesterol no HDL = CT - C-HDL).
La concentración de insulina se determinó por radioinmunoanálisis (Millipore, St. Charles, Missouri, USA) y la resistencia a la insulina se estimó con el modelo homeostático HOMA-RI (HOMA-RI = insulina [uUI/ml] × glucosa [mmol] / 22.5)28.
La presencia de dislipidemia se definió, de acuerdo con los criterios del National Cholesterol Education Program Adult Treatment Panel III (NCEP-ATP III)1, como hipercolesterolemia (CT ≥ 200 o C-LDL ≥ 160 mg/dl), hipertrigliceridemia (TG ≥ 150 mg/dl) y hipoalfalipoproteinemia (C-HDL < 40 mg/dl en hombres y < 50 mg/dl en mujeres). La precisión y la exactitud en las mediciones de lípidos y lipoproteínas fueron certificadas periódicamente con el programa Lipid Standardization Program of the Center for Disease Control and Prevention (LSP-CDC, Atlanta, GA, USA). Los coeficientes de variación intraanálisis e interanálisis fueron < 3%.
La concentración de Lp(a) se determinó mediante inmunonefelometría cinética con el reactivo N Latex Lp(a) (Siemens Healthcare Diagnostics Products GmbH, Marburg, Germany)29 en un nefelómetro automatizado BN ProSpec® con calibradores, controles y reactivos de la misma marca. Los coeficientes de variación intraanálisis e interanálisis fueron < 6%.
El SMet se definió de acuerdo con las guías NCEP-ATP III1 si el participante presentaba al menos tres de los cinco componentes: 1) circunferencia de cintura ≥ 90 cm en hombres o ≥ 80 cm en mujeres; 2) TG ≥ 150 mg/dl; 3) C-HDL < 40 mg/dl en hombres y < 50 mg/dl en mujeres; 4) presión arterial sistólica ≥ 130 mmHg y diastólica ≥ 85 mmHg, o tratamiento farmacológico antihipertensivo; y 5) glucosa plasmática en ayuno ≥ 126 mg/dl, o diagnóstico o tratamiento previo de diabetes mellitus.
Determinaciones tomográficas
La tomografía computada es un método validado para la medición del tejido adiposo visceral y la CAC30. En este estudio, la tomografía de tórax y abdomen se realizó utilizando un sistema helicoidal multidetector de 64 canales (Somatom Cardiac Sensation 64, Forchheim, Bavaria, Germany) y la interpretaron radiólogos experimentados. Las imágenes del tomógrafo fueron evaluadas para cuantificar el tejido adiposo abdominal total, subcutáneo y visceral31,32. El depósito de CAC se expresó en unidades Agatston (UA)33. Se consideraron todas las áreas con atenuación > 130 unidades Hounsfield, y con la sumatoria de las puntuaciones individuales de las arterias coronarias se obtuvo la puntuación total de Agatston. El coeficiente de correlación intraobservador fue de 0.99 (p < 0.001).
Análisis estadístico
Los datos se expresan como el promedio y la desviación estándar o como la mediana con el rango intercuartílico (RIC) para las variables con distribución asimétrica, y como porcentajes las variables categóricas. La comparación de variables continuas se realizó con la prueba t de Student o con la prueba U de Mann-Whitney, según el tipo de distribución. Las variables categóricas se compararon con la prueba de ji al cuadrado.
El depósito de calcio coronario se analizó como variable categórica (presencia o ausencia de CAC > 0 UA). Para investigar la independencia de las asociaciones entre la Lp(a) ≥ 30 mg/dl, el SMet y la presencia de CAC > 0 UA se realizó un análisis de regresión múltiple ajustado por sexo y edad, y luego ajustado por IMC, TG, C-LDL, diabetes mellitus, hipertensión y tabaquismo. Un valor de p < 0.05 se consideró estadísticamente significativo. Todos los análisis estadísticos se realizaron con SPSS V.16.
Resultados
Las características de los 953 sujetos sin y con SMet se muestran en la tabla 1. El 41.7% (n = 398) de los participantes fueron diagnosticados de SMet. En los sujetos con SMet, el promedio o la mediana de las variables antropométricas, como el IMC, el perímetro de la cintura, el volumen de grasa abdominal visceral y subcutánea, y de las variables bioquímicas, como las concentraciones de lípidos, lipoproteínas, glucosa e insulina, y el índice de resistencia a la insulina (HOMA-RI), fueron significativamente mayores que en aquellos sin SMet, mientras que el promedio del C-HDL fue significativamente menor (p < 0.001) (Tabla 1).
Tabla 1 Características de los sujetos según la presencia o no de síndrome metabólico
| Sin SMet (n = 555) | Con SMet (n = 398) | p | |
|---|---|---|---|
| Edad, años* | 52.7 ± 9.6 | 54.1 ± 8.8 | 0.006 |
| Hombres (%) | 52.1 | 47.9 | < 0.001 |
| IMC, kg/m2* | 27.3 ± 4.1 | 29.9 ± 4.1 | < 0.001 |
| Cintura, cm* | 90.7 ± 11.3 | 98.7 ± 10.4 | < 0.001 |
| GAV, mm3* | 138.2 ± 60.8 | 182.3 ± 61.1 | < 0.001 |
| GAS, mm3* | 112.3 ± 14.4 | 123.7 ± 19.0 | < 0.001 |
| PAS, mmHg* | 112.3 ± 14.4 | 123.7 ± 19.0 | < 0.001 |
| PAD, mmHg* | 69.8 ± 8.3 | 75.4 ± 9.8 | < 0.001 |
| CT, mg/dl* | 188.8 ± 32.9 | 199.2 ± 40.0 | < 0.001 |
| C-LDL, mg/dl* | 115.0. ± 28.3 | 123.7 ± 35.1 | 0.003 |
| TG, mg/dl* | 130.9 ± 58.8 | 236.2 ± 193.7 | < 0.001 |
| C-HDL, mg/dl* | 51.5 ± 13.0 | 38.5 ± 9.6 | <0.001 |
| Glucosa, mg/dl† | 88 (82-93) | 96.5 (88-109.2) | <0.001 |
| Insulina, µIU/ml† | 14.4 (10.6-19.9) | 20.5 (15.6-27.1) | < 0.001 |
| HOMA-RI† | 3.1 (2.2-4.4) | 5.3 (3.8-7.6) | < 0.001 |
| Lp(a), mg/dl† | 5.9 (2.5-13.1) | 3.7 (2.3-9.2) | < 0.001 |
| CAC, UA† | 0.0 (0.0-0.0) | 0.0 (0.0-11.3) | < 0.001 |
| Lp(a) ≥ 30 mg/dl (%) | 10.8 | 7.5 | 0.087 |
| CAC >0 UA (%) | 23.6 | 39.9 | < 0.001 |
| Riesgo ASCVD (% a10 años)† | 1.2 (0.8-2.0) | 1.6 (1-3.2) | < 0.001 |
ASCVD: Enfermedad arterial coronaria; CAC: calcio arterial coronario; C-HDL: colesterol en lipoproteínas de alta densidad; C-LDL: colesterol en lipoproteínas de baja densidad; CT: colesterol total; GAV: grasa abdominal visceral; GAS: grasa abdominal subcutánea; HOMA-RI: resistencia a la insulina; IMC: índice de masa muscular; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SMet: síndrome metabólico; TG: triglicéridos.
*Promedio ± desviación estándar.
†Mediana (rango intercuartílico).
La mediana de Lp(a) fue significativamente más baja en los sujetos con SMet: 3.7 (RIC: 2.3-9.2) vs. 5.9 (RIC: 2.5-13.1); p < 0.001. Comparados con los sujetos sin SMet, la prevalencia de Lp(a) ≥ 30 mg/dl fue más baja en los sujetos con SMet (7.5 vs. 10.8%; p = 0.087). Sin embargo, la prevalencia de aterosclerosis subclínica (CAC > 0 UA) en los sujetos sin SMet fue significativamente menor que la de los sujetos con SMet (23.6 vs. 39.9%; p < 0.001) (Tabla 1).
Como se muestra en la figura 1, la prevalencia de Lp(a) ≥ 30 mg/dl se asocia de manera inversa, y la prevalencia de CAC de manera positiva, con el número de componentes del SMet. El porcentaje de sujetos con Lp(a) elevada disminuyó y el de CAC > 0 UA se incrementó, progresivamente, con la presencia de uno a cinco de los componentes del SMet. Estas relaciones fueron evaluadas con análisis de regresión logística para investigar la independencia de la asociación entre los componentes del SMet y la concentración de Lp(a) ≥ 30 mg/dl y la presencia de CAC > 0 UA. En los sujetos con SMet, con una glucemia ≥ 100 mg/dl o una presión arterial ≥ 130/85 mmHg, el riesgo de CAC > 0 UA fue dos veces mayor que en los sujetos sin SMet (odds ratio [OR]: 2.19, intervalo de confianza del 95% [IC95%]: 1.6-2.6, p < 0.001; OR: 2.4, IC95%: 1.7-3.4, p < 0.001; y OR: 2.1, IC95%: 1.6-3.1, p < 0.001; respectivamente). Los TG ≥ 150 mg/dl, la concentración baja de C-HDL (< 50 mg/dl en mujeres y < 40 mg/dl en hombres) y la obesidad (perímetro de cintura) no se asociaron con mayor riesgo de CAC > 0 UA (Fig. 2).
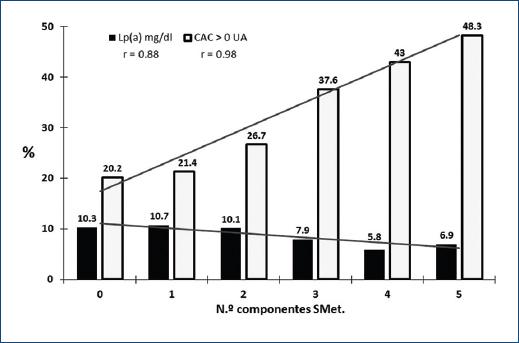
Figura 1 Prevalencia de lipoproteína(a) [Lp(a)] ≥ 30 mg/dl y de calcio arterial coronario (CAC) > 0 UA en población mexicana según el número de componentes del síndrome metabólico (SMet).
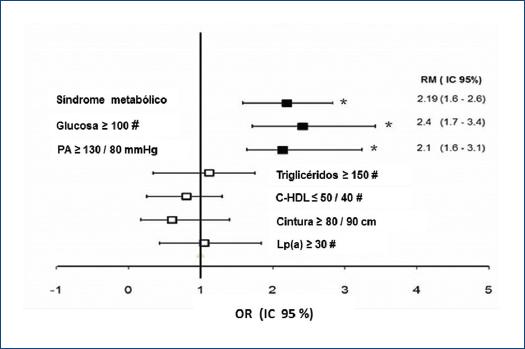
Figura 2 Riesgo de aterosclerosis subclínica (calcio arterial coronario > 0 UA) en sujetos con síndrome metabólico y sus componentes en población mexicana. Análisis de regresión múltiple ajustado por sexo, edad, colesterol en lipoproteínas de baja densidad, tabaquismo y actividad física. C-HDL: colesterol en lipoproteínas de alta densidad; IC95%: intervalo de confianza del 95%; OR: odds ratio; PA: presión arterial.
Discusión
La Lp(a) es un factor de riesgo independiente para EAC34; no obstante, el grado de asociación con la aterosclerosis varía ampliamente entre los diferentes grupos étnicos. En este estudio transversal en 953 mexicanos sin antecedentes personales ni familiares de EAC prematura, la mediana y la prevalencia de Lp(a) ≥ 30 mg/dl fueron significativamente menores en los sujetos con SMet, mientras que la prevalencia de CAC > 0 UA fue significativamente mayor. La prevalencia de CAC > 0 UA se incrementó, progresivamente, con la presencia de uno a cinco de los componentes del SMet. Sin embargo, el porcentaje de sujetos con Lp(a) elevada disminuyó y no se asoció con CAC. Las medidas de adiposidad corporal, como el IMC y la grasa abdominal visceral y subcutánea, y los marcadores cardiometabólicos, como la insulina en plasma y HOMA-RI, fueron significativamente mayores en los sujetos con SMet, pero la glucemia > 100 mg/dl y la hipertensión arterial > 130/85 mmHg fueron los únicos componentes del SMet que se asociaron, de manera independiente y significativa, con la presencia de aterosclerosis subclínica.
El consenso ATP III del año 201435 sugiere que la primera diana terapéutica para el tratamiento de la aterosclerosis es la concentración elevada de C-LDL, y la siguiente debe ser el SMet, debido a que cada uno de sus componentes es un factor de riesgo de EAC. La concentración elevada de Lp(a) es un factor de riesgo emergente para EAC13,36,37. Se ha sugerido que la coexistencia de la Lp(a) elevada con el SMet pudiera potenciar el riesgo de aterosclerosis prematura o acelerar el proceso ateroscleroso38; sin embargo, los estudios en los que se ha investigado esta asociación son escasos y los resultados son controversiales. En la gran mayoría de los estudios se analizan de manera aislada cada uno de los componentes del SMet y su asociación con la concentración de Lp(a). En pacientes cardiópatas con y sin SMet se encontró que los que presentaban SMet tenían concentraciones de Lp(a) 1.8 veces mayores que aquellos sin SMet (mediana de 29.2 vs. 16.2 mg/dl; p < 0.0001) y una prevalencia 2.3 veces mayor de Lp(a) ≥ 30 mg/dl (51.4 vs. 21.6%; p < 0.001)39. En otro estudio se encontró que las concentraciones medias de Lp(a) (5-17 mg/dl) en mujeres, comparadas con los hombres con SMet, se asocian con progresión de la aterosclerosis38. Sin embargo, se ha informado que las concentraciones de Lp(a) son significativamente más bajas en los pacientes con SMet comparados con los sujetos sin SMet, y que la Lp(a) es un predictor de eventos cardiovasculares en sujetos sin SMet40 o que en los sujetos con mayor concentración de Lp(a), el riesgo de SMet es significativamente menor41. Estos autores sugieren que la relación inversa entre el SMet y la Lp(a) pudiera deberse a un sesgo de sobrevida en los sujetos con antecedentes de EAC. La presencia de Lp(a) ≥ 30 mg/dl y de SMet a edades tempranas pudiera aumentar la mortalidad en sujetos jóvenes, lo que explicaría la mayor proporción de Lp(a) baja entre los sobrevivientes con mayor edad41.
Nuestros datos en sujetos sin EAC, agrupados por década de edad, mostraron que desde los 20 hasta los 70 años la prevalencia de Lp(a) elevada es mayor en los sujetos sin SMet, y por tanto no apoya la hipótesis del efecto de sobrevivencia que intenta explicar la relación inversa entre estos dos factores de riesgo de EAC; de hecho, la prevalencia de Lp(a) ≥ 30 mg/dl no se asocia con el SMet ni con la aterosclerosis subclínica en ningún rango de edad. Resultados similares han sido informados por otros investigadores42.
En otros estudios en los que se incluyeron pacientes con EAC43 o con dislipidemias44 se ha observado una asociación inversa entre las concentraciones de Lp(a) con TG elevados y con C-HDL bajo. Los autores sugieren que la asociación pudiera deberse a un mecanismo metabólico compartido entre los tres factores bioquímicos. En el presente estudio se observó una correlación negativa y significativa entre los TG y la Lp(a) (r = −0.073; p = 0.024), que se perdió al agrupar la muestra en sujetos con y sin SMet. Estos resultados confirman lo reportado en otro estudio45 y apoyan los resultados, in vitro, en los que se demuestra que la Lp(a) es ligando del receptor de lipoproteínas de muy baja densidad en las membranas de células del endotelio, los macrófagos, las células espumosas y las células musculares lisas en las placas aterosclerosas. La internalización de la Lp(a) a estas células pudiera contribuir de manera importante al catabolismo de la Lp(a) y al desarrollo de las placas aterosclerosas46. Está bien documentado que la Lp(a) disminuye los efectos del PAI-1 y la formación de plasmina, generando un estado protrombótico. En los sujetos con SMet existen alteraciones en la hemostasia que disminuyen la fibrinólisis y favorecen la coagulación47. Se ha sugerido que el incremento de la concentración del PAI-1 en los sujetos con SMet pudiera disminuir la síntesis de Lp(a)48,49. El mecanismo fisiopatológico de la relación entre el SMet, la Lp(a) y la aterosclerosis se desconoce; sin embargo, un estudio prospectivo en sujetos con SMet y Lp(a) elevada pudiera generar información que permita conocer, al menos en parte, la relación entre estos factores de riesgo cardiovascular.
Este estudio presenta como limitaciones que es de tipo transversal, por lo que solo se pueden establecer asociaciones entre las variables y no es posible establecer la causalidad. El estudio incluyó voluntarios residentes en el área conurbada de la Ciudad de México y no es una muestra representativa de la población mexicana; sin embargo, la prevalencia de los factores de riesgo de EAC observados en este estudio es similar a la encontrada en la Encuesta Nacional de Salud y Nutrición 2016 (ENSANUT MC 2016), estudio aleatorizado y representativo de ámbito nacional50. Entre las fortalezas del estudio se encuentran el tamaño de muestra (mayor que en otros estudios), que los sujetos estudiados son de ambos sexos, con edades de 20 a 70 años y sin antecedentes personales ni familiares de aterosclerosis, lo que disminuye el sesgo en la interpretación de los resultados, y la evaluación de la aterosclerosis subclínica (CAC) en el total de la muestra.
Conclusiones
En este estudio en población mexicana asintomática y sin antecedentes de enfermedad arterial coronaria se encontró: 1) una asociación inversa entre la concentración de Lp(a) con el SMet y sus componentes; 2) la concentración elevada de Lp(a) en sujetos con SMet no se asocia con aterosclerosis subclínica por el CAC; y 3) la elevada prevalencia de sobrepeso, obesidad, diabetes mellitus, presión arterial elevada y dislipidemia aterogénica (TG elevados y C-HDL bajo) que caracteriza la población mexicana pudiera explicar las diferencias con otras poblaciones.











 nueva página del texto (beta)
nueva página del texto (beta)


