Introducción
La hipertensión en el embarazo se define como una presión sistólica (PS) ≥ 140 mmHg, una presión diastólica (PD) ≥ 90 mmHg o ambas en dos ocasiones, al menos con cuatro horas de diferencia1-4. Ésta ha sido la norma de cuidado por muchos años5. En la población no gestante, el American College of Cardiology (ACC) ha cambiado en fecha reciente la definición misma de hipertensión y respaldado umbrales más bajos con el objetivo de reducir la morbilidad cardiovascular a largo plazo6. La aplicación de estos intervalos más bajos en la población embarazada ha posibilitado una mejor detección de resultados adversos maternos y perinatales7,8.
Por otro lado, sólo hasta ahora se han tenido en cuenta los cambios fisiológicos de la presión arterial durante la gestación9 para construir intervalos de referencia para la valoración de mujeres embarazadas10. Sin embargo, los umbrales dependientes de la edad gestacional no se consideran en las guías de práctica clínica11.
Además, un estudio describió los efectos diferenciales de las características maternas y el historial médico sobre la presión arterial media (PAM) en los tres trimestres del embarazo12.
El objetivo de este estudio fue construir valores de referencia de la presión arterial durante la gestación, ajustados por características maternas específicas de la población.
Materiales y métodos
Población de estudio
Se realizó un estudio transversal en embarazos de feto único, vivo, intrauterino, de concepción espontánea y normal al momento de la ecografía fetal regular en un centro médico y laboratorio de medicina maternofetal de la Ciudad de México; la inclusión fue consecutiva de las embarazadas que concedieron su consentimiento para participar. Se incluyó a mujeres sanas de cualquier origen étnico; no se incluyó a pacientes con hipertensión crónica, diabetes, lupus eritematoso sistémico, síndrome antifosfolípidos ni otras enfermedades, incluso si no representaban un riesgo cardiovascular. Se excluyó a los embarazos con anomalías fetales cromosómicas, estructurales o del crecimiento intrauterino. No se incluyó a embarazos de fetos múltiples porque se han documentado diferencias en ellos para la presión arterial13 y la función cardíaca14; esto es motivo de otra investigación. El estudio obtuvo la aprobación de los comités científico y bioética de dicho centro, con apego a la Declaración de Helsinki de la Asociación Médica Mundial para las investigaciones médicas en seres humanos.
Características de las pacientes
Las características clínicas se obtuvieron por cuestionario autoadministrado, verificadas por interrogatorio médico, e incluyeron edad materna, origen étnico (caucásico/hispano, afrocaribeño, sur asiático, este asiático u otro/mixto), hábito de fumar durante el embarazo (fumadora, nunca o abandono), antecedentes familiares de preeclampsia en la madre o la hermana de la paciente (sí o no) y antecedentes obstétricos que incluyan paridad (paridad o nuliparidad si no había embarazos previos de ≥ 24 semanas de gestación) y embarazo previo con preeclampsia (sí o no); estas definiciones operativas son las que emplea la Fundación de Medicina Fetal15 (nótese que la categoría "nulípara" no es igual a "primer embarazo"; los abortos y nacimientos < 24 semanas no tienen interés operacional).
El peso y la estatura maternos se obtuvieron con báscula y estadímetro clínicos convencionales analógicos calibrados. La edad de la gestación se estableció por ecografía o por fecha de última menstruación corroborada por ecografía.
Método estandarizado para medir la presión arterial en el embarazo
De acuerdo con las recomendaciones internacionales11 desarrolladas por la Fundación de Medicina Fetal12,16-18 y adoptadas en fecha reciente por la Federación Internacional de Ginecología y Obstetricia19, se especifica el uso de dispositivos electrónicos automatizados para evitar sesgo humano y de intercambiabilidad por auscultación20. En vez de establecer un número fijo de lecturas, se toman las necesarias para alcanzar el estado basal de la embarazada; en un estudio se notificó que hay casos que requieren cuatro o más lecturas18; las mediciones son simultáneas en ambos brazos para evitar el sesgo de las diferencias entre ambos brazos21, descritas aun en embarazos normales22. La modificación forzosa para este estudio fue el uso en todas las embarazadas del brazalete mediano (22-32 cm) único proporcionado con cada dispositivo, al margen de la circunferencia braquial, por lo cual ésta no se midió en este estudio; los de otros calibres para dichos dispositivos no están disponibles en el mercado local.
Las lecturas de presión arterial se realizaron después de un periodo de cinco minutos de reposo en posición sedente y con los brazos de la embarazada al nivel del corazón. En la sede del estudio hay sillas ex profeso con descansabrazos ajustables en ambos lados y respaldo; se observaron las recomendaciones conocidas sobre las condiciones y posición para las lecturas11. Se realizó un mínimo de tres mediciones braquiales consecutivas en ambos brazos por intervalos de un minuto hasta que la diferencia entre presiones sistólicas fuera ≤10 mmHg e ≤6 mmHg en las diastólicas; este criterio define el estado basal de la embarazada. Los dispositivos electrónicos automáticos fueron del mismo modelo durante todo el estudio y cumplieron con el requisito de calibración. Se utilizaron dos dispositivos idénticos por cada paciente para medir simultáneamente en ambos brazos. La PAM para cada medición y en cada brazo se calculó con base a la fórmula conocida PD + (PS-PD)/3. La PAM de estudio resulta del promedio de las últimas dos mediciones estables16. En este trabajo se agregaron las presiones sistólica (PS) y diastólica (PD) para estudio.
Los dispositivos electrónicos automáticos empleados en este estudio fueron marca Omron® (Japón), modelo HEM-7121 que cumple con el requisito 510(k) de la FDA.
El personal médico, paramédico y de enfermería encargado de las lecturas recibió capacitación para el uso de los dispositivos electrónicos, sobre el protocolo estandarizado, y se supervisó durante el estudio.
Análisis estadístico
Se aplicó estadística descriptiva para las distribuciones globales de las PS, PD y PAM en el embarazo y generar las ecuaciones generales. Los intervalos de referencia por semanas de gestación para las presiones arteriales PS, PD y PAM se elaboraron de modo similar a lo publicado por otros autores10,18 siguiendo el método de Royston y Wright23. Los múltiplos de la mediana (MoM) corregidos por gestación y peso materno se calcularon de manera habitual24. Las curvas se ajustaron a ecuaciones polinómicas mediante regresión de los cuadrados-mínimos; el modelo se seleccionó con base en los índices de bondad de ajuste, el análisis de residuales, la inspección y la simplicidad.
Se evaluaron los efectos de las características maternas y del embarazo sobre la PA mediante regresión lineal múltiple; el análisis fue escalonado para detectar efectos de confusión e interacción. El mejor modelo para cada PA se seleccionó con base en los índices de rendimiento, la congruencia clínica y el análisis de residuales. El modelo para calcular el percentil multivariado se basa en el método de Royston y Wright23 modificado: la mediana se obtuvo de todas las variables incluidas en el modelo final y no sólo por edad de gestación; se analizó la consistencia del modelo en cada variable independiente.
Los supuestos de normalidad que requirieron una corroboración formal se evaluaron con la prueba de Shapiro-Wilk25,26; con base en el resultado se aplicaron estadísticos paramétricos, no paramétricos o se transformaron las variables antes de su análisis. Para el análisis multivariado se corroboraron adicionalmente los supuestos de varianzas similares, relación lineal y colinealidad, al transformar la variable en caso necesario. El nivel de significancia fue α = 0.05 para las pruebas estadísticas del valor de p.
La base de datos se creó desde los programas Astraia® (Alemania) y Excel® (EE.UU.); DOI: 10.6084/m9.figshare.12264152. El análisis estadístico se realizó en los programas Excel® (EE.UU.) y MATLAB® (EE.UU.), con sus debidas licencias.
Resultados
La muestra poblacional se integró entre enero de 2017 y julio de 2018; quedó conformada por 1,056 mujeres que cumplieron todos los criterios de inclusión. Se obtuvo un total de 1,915 mediciones entre 5 y 41 semanas de gestación; las características de la población estudiada se presentan en la Tabla 1 y no hubo población indígena.
Tabla 1 Características demográficas de la muestra poblacional
| Variable | Valor | |
|---|---|---|
| Edad materna en años, mediana (IQ) | 33.0 | (29.0; 36.0) |
| Peso materno en kg, mediana (IQ) | 65.0 | (58.4; 73) |
| Estatura materna en cm, mediana (IQ) | 160.0 | (156; 164) |
| Índice de masa corporal, mediana (IQ) | 25.3 | (23; 28.1) |
| Etnia | ||
| Caucásico/hispano, n (%) | 1601 | (83.6%) |
| Afrocaribeño, n (%) | 3 | (0.2%) |
| Sur asiático, n (%) | 1 | (0.1%) |
| Este asiático, n (%) | 24 | (1.3%) |
| Otro, mixto, n (%) | 286 | (14.9%) |
| Paridad | ||
| Nulípara, n (%) | 1,041 | (54.4%) |
| Paridad sin preeclampsia, n (%) | 843 | (44.0 %) |
| Paridad con preeclampsia previa, n (%) | 31 | (1.6%) |
| Hábito de fumar | ||
| Fumadora, n (%) | 8 | (0.4%) |
| Dejó de fumar, n (%) | 224 | (11.7%) |
| No fuma, n (%) | 1,680 | (87.7%) |
| Antecedente familiar de preeclampsia, n (%) | 56 | (2.9%) |
En 416 embarazos (21.7%) se requirieron cuatro o más lecturas para conseguir la definición operativa en este estudio del estado inicial de la embarazada.
La presión arterial global tuvo una distribución normal y se presenta en la Tabla 2. La fórmula para calcular el percentil crudo de la presión arterial en el embarazo sigue la ecuación de Gauss (p. ej., percentiles 5° y 95°, Tabla 2).
Tabla 2 Presión arterial (mmHg) general en el embarazo
| Variable | Valor | p5 | p95 |
|---|---|---|---|
| Presión arterial sistólica, promedio ± DE | 102.7 ± 9.30 | 87.4 | 118.0 |
| Presión arterial diastólica, promedio ± DE | 67.2 ± 7.38 | 55.1 | 79.3 |
| Presión arterial media, promedio ± DE | 79.0 ± 7.44 | 66.8 | 91.3 |
La edad de gestación mostró una relación cuadrática en forma de "U" con las presiones arteriales, y fue menor en el segundo trimestre. Los nomogramas por semanas de gestación se representan en la Figura 1 y los intervalos de referencia se enlistan en la Tabla 3. El modelo para el percentil de cada presión arterial por edad de gestación y para los MoM corregidos por peso materno se presenta en la Tabla 4.
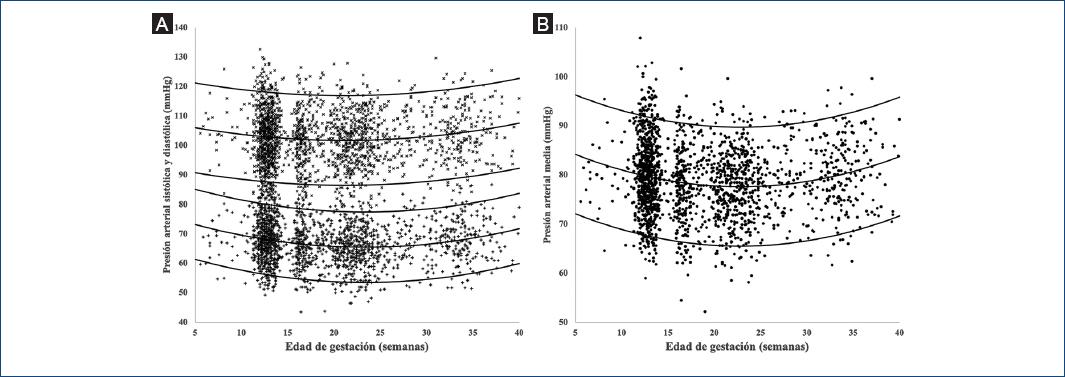
Figura 1 Diagrama de dispersión. A: Presión arterial sistólica (x) con diastólica (+). B: Presión arterial media contra edad gestacional en esta población. Se muestran las medianas calculadas, con los respectivos percentiles 5º y 95º.
Tabla 3 Intervalos de referencia de la presión arterial por edad de gestación
| Semana de gestación | PS | PD | PAM | ||||||
|---|---|---|---|---|---|---|---|---|---|
| p5 | Mediana | p95 | p5 | Mediana | p95 | p5 | Mediana | p95 | |
| 5 | 90.9 | 106.1 | 121.3 | 61.4 | 73.3 | 85.2 | 72.1 | 84.2 | 96.3 |
| 6 | 90.3 | 105.6 | 120.8 | 60.5 | 72.5 | 84.4 | 71.4 | 83.5 | 95.6 |
| 7 | 89.9 | 105.1 | 120.3 | 59.8 | 71.7 | 83.6 | 70.7 | 82.8 | 94.9 |
| 8 | 89.4 | 104.6 | 119.9 | 59.0 | 71.0 | 82.9 | 70.1 | 82.2 | 94.3 |
| 9 | 89.0 | 104.2 | 119.4 | 58.3 | 70.3 | 82.2 | 69.5 | 81.6 | 93.7 |
| 10 | 88.6 | 103.8 | 119.1 | 57.7 | 69.6 | 81.6 | 68.9 | 81.0 | 93.1 |
| 11 | 88.3 | 103.5 | 118.7 | 57.1 | 69.1 | 81.0 | 68.4 | 80.5 | 92.6 |
| 12 | 88.0 | 103.2 | 118.4 | 56.6 | 68.5 | 80.4 | 68.0 | 80.1 | 92.2 |
| 13 | 87.7 | 102.9 | 118.1 | 56.1 | 68.0 | 79.9 | 67.5 | 79.6 | 91.7 |
| 14 | 87.4 | 102.6 | 117.9 | 55.6 | 67.5 | 79.5 | 67.2 | 79.2 | 91.3 |
| 15 | 87.2 | 102.4 | 117.6 | 55.2 | 67.1 | 79.1 | 66.8 | 78.9 | 91.0 |
| 16 | 87.0 | 102.2 | 117.5 | 54.8 | 66.8 | 78.7 | 66.5 | 78.6 | 90.7 |
| 17 | 86.9 | 102.1 | 117.3 | 54.5 | 66.5 | 78.4 | 66.2 | 78.3 | 90.4 |
| 18 | 86.7 | 102.0 | 117.2 | 54.2 | 66.2 | 78.1 | 66.0 | 78.1 | 90.2 |
| 19 | 86.7 | 101.9 | 117.1 | 54.0 | 66.0 | 77.9 | 65.8 | 77.9 | 90.0 |
| 20 | 86.6 | 101.8 | 117.0 | 53.8 | 65.8 | 77.7 | 65.7 | 77.8 | 89.9 |
| 21 | 86.6 | 101.8 | 117.0 | 53.7 | 65.7 | 77.6 | 65.6 | 77.7 | 89.8 |
| 22 | 86.6 | 101.8 | 117.0 | 53.6 | 65.6 | 77.5 | 65.6 | 77.6 | 89.7 |
| 23 | 86.6 | 101.8 | 117.1 | 53.6 | 65.5 | 77.5 | 65.5 | 77.6 | 89.7 |
| 24 | 86.7 | 101.9 | 117.1 | 53.6 | 65.5 | 77.5 | 65.6 | 77.7 | 89.8 |
| 25 | 86.8 | 102.0 | 117.2 | 53.6 | 65.6 | 77.5 | 65.6 | 77.7 | 89.8 |
| 26 | 87.0 | 102.2 | 117.4 | 53.7 | 65.7 | 77.6 | 65.7 | 77.8 | 89.9 |
| 27 | 87.1 | 102.3 | 117.6 | 53.9 | 65.8 | 77.8 | 65.9 | 78.0 | 90.1 |
| 28 | 87.3 | 102.5 | 117.8 | 54.1 | 66.0 | 78.0 | 66.1 | 78.2 | 90.3 |
| 29 | 87.6 | 102.8 | 118.0 | 54.3 | 66.3 | 78.2 | 66.3 | 78.4 | 90.5 |
| 30 | 87.8 | 103.1 | 118.3 | 54.6 | 66.5 | 78.5 | 66.6 | 78.7 | 90.8 |
| 31 | 88.1 | 103.4 | 118.6 | 54.9 | 66.9 | 78.8 | 66.9 | 79.0 | 91.1 |
| 32 | 88.5 | 103.7 | 118.9 | 55.3 | 67.2 | 79.2 | 67.3 | 79.4 | 91.5 |
| 33 | 88.8 | 104.1 | 119.3 | 55.7 | 67.7 | 79.6 | 67.7 | 79.8 | 91.9 |
| 34 | 89.2 | 104.5 | 119.7 | 56.2 | 68.1 | 80.1 | 68.1 | 80.2 | 92.3 |
| 35 | 89.7 | 104.9 | 120.1 | 56.7 | 68.6 | 80.6 | 68.6 | 80.7 | 92.8 |
| 36 | 90.2 | 105.4 | 120.6 | 57.2 | 69.2 | 81.1 | 69.2 | 81.3 | 93.3 |
| 37 | 90.7 | 105.9 | 121.1 | 57.9 | 69.8 | 81.7 | 69.7 | 81.8 | 93.9 |
| 38 | 91.2 | 106.4 | 121.6 | 58.5 | 70.4 | 82.4 | 70.3 | 82.4 | 94.5 |
| 39 | 91.7 | 107.0 | 122.2 | 59.2 | 71.1 | 83.1 | 71.0 | 83.1 | 95.2 |
| 40 | 92.3 | 107.6 | 122.8 | 59.9 | 71.9 | 83.8 | 71.7 | 83.8 | 95.9 |
Tabla 4 Modelo de la presión arterial por edad de gestación y corrección por peso
| Término | Cálculo | ES | valor T | valor p | RECM* | r2 | F vs. K** |
|---|---|---|---|---|---|---|---|
| PS | |||||||
| Gestación | |||||||
| Constante | 109.12 | 1.7865 | 61.1 | < 0.001 | 9.2571 | 0.0088 | 9.47 |
| Semanas† | -0.6916 | 0.1760 | -3.9 | < 0.001 | |||
| (Semanas)^2 | 0.01632 | 0.0039 | 4.2 | < 0.001 | |||
| Desviación estándar | 9.2522 | ||||||
| MoM Peso | |||||||
| Constante | 0.820 | 0.0115 | 71.3 | < 0.001 | 0.0847 | 0.1154 | 251 |
| kg | 0.002701 | 0.0002 | 15.8 | < 0.001 | |||
| PD | |||||||
| Gestación | |||||||
| Constante | 78.10758 | 1.4021 | 55.7 | < 0.001 | 7.2652 | 0.0302 | 30.8 |
| Semanas | -1.07643 | 0.1381 | -7.8 | < 0.001 | |||
| (Semanas)^2 | 0.023022 | 0.0031 | 7.5 | < 0.001 | |||
| Desviación estándar | 7.2614 | ||||||
| MoM Peso | |||||||
| Constante | 0.856 | 0.0143 | 59.9 | < 0.001 | 0.1052 | 0.0511 | 104 |
| kg | 0.00216 | 0.0002 | 10.2 | < 0.001 | |||
| PAM | |||||||
| Gestación | |||||||
| Constante | 88.45 | 1.4198 | 62.3 | < 0.001 | 7.3572 | 0.0225 | 23 |
| Semanas | -0.9481 | 0.1399 | -6.8 | < 0.001 | |||
| (Semanas)^2 | 0.02079 | 0.0031 | 6.7 | < 0.001 | |||
| Desviación estándar | 7.3534 | ||||||
| MoM Peso (recíproco) | |||||||
| Constante | 1.385 | 0.0557 | 24.9 | < 0.001 | 0.0889 | 0.0863 | 91.4 |
| 1/kg | -39.707 | 7.1454 | -5.6 | < 0.001 | |||
| (1/kg)^2 | 932.096 | 226.525 | 4.1 | < 0.001 |
*Raíz del error cuadrático medio.
r2= coeficiente ajustado de determinación para la ecuación polinómica.
**Estadístico-F vs. modelo constante: todos con valor p < 0.001.
†Edad de gestación en semanas + días/7.
Para el análisis multivariado se excluyeron tres registros de etnia africana y una del sur asiático por número insuficiente. La relación entre PS y PD fue de tipo lineal con una correlación r = 0.71 (Pearson, p < 0.001), constante de 42.8 (IC95, 40.1, 45.5) y coeficiente de 0.89 (IC95, 0.85, 0.93). La correlación r entre PS y PD fue menor al valor crítico de 0.8 de colinealidad. Se desarrollaron modelos multivariados para las presiones PS, PD y PAM, incluida la PD en el modelo de la PS y viceversa; sólo la edad de gestación requirió transformación cuadrática, centrada en el valor crítico mínimo de cada presión arterial.
Los coeficientes de cada modelo final multivariado y sus estadísticos se presentan en las Tablas 5 a 7 para PS, PD y PAM, respectivamente. Los efectos de confusión se identificaron durante el proceso escalonado de cada modelo; se comentan a continuación (los coeficientes intermedios no se muestran).
Tabla 5 Modelo multivariado de la presión arterial sistólica en el embarazo
| Término | Cálculo | ES | valor T | valor p |
|---|---|---|---|---|
| Valor medio esperado | ||||
| Intersección | 18.7195 | 9.3639 | 2.0 | 0.046 |
| Presión diastólica | 1.1901 | 0.1136 | 10.5 | < 0.001 |
| Peso materno | 0.5418 | 0.1182 | 4.6 | < 0.001 |
| Presión diastólica:peso | -0.0054 | 0.0017 | -3.2 | 0.001 |
| Edad materna | 0.0359 | 0.0314 | 1.1 | 0.252 |
| Estatura materna | -0.0591 | 0.0359 | -1.6 | 0.100 |
| Paridad† | ||||
| Preeclampsia previa | 20.1042 | 7.8066 | 2.6 | 0.010 |
| Edad:preeclampsia previa | -0.5302 | 0.2261 | -2.3 | 0.019 |
| Nulípara | -15.8734 | 7.3952 | -2.1 | 0.032 |
| Estatura:nulípara | 0.1028 | 0.0461 | 2.2 | 0.026 |
| Fuma | -35.6249 | 14.2488 | -2.5 | 0.012 |
| Peso:fuma | 0.5711 | 0.2283 | 2.5 | 0.012 |
| Dejó de fumar | 6.2387 | 2.7398 | 2.3 | 0.023 |
| Peso:dejó de fumar | -0.0937 | 0.0404 | -2.3 | 0.020 |
| Antecedente familiar de preeclampsia | 1.4381 | 0.8565 | 1.7 | 0.093 |
| Desviación estándar | 6.2315 |
* Raíz del error cuadrático medio = 6.254.
R-cuadrado: 0.551, ajustado: 0.548.
Estadístico-F vs. Modelo constante: 166, valor p < 0.001.
†Grupo de referencia: caucásico/hispano con paridad sin preeclampsia.
La distribución MoM fue 1.000 ± 0.061 DE (Shapiro-Wilk = 0.9975, p = 0.004).
El puntaje Z tuvo distribución 0 ± 1.0 DE (Shapiro-Wilk = 0.9981, p = 0.024).
Tabla 6 Modelo multivariado de la presión arterial diastólica en el embarazo
| Término | Cálculo | ES | valor T | valor p |
|---|---|---|---|---|
| Valor medio esperado | ||||
| Intersección | -82.3298 | 33.2113 | -2.5 | 0.013 |
| Presión sistólica | 1.5106 | 0.3217 | 4.7 | < 0.001 |
| Estatura materna | 0.5902 | 0.2068 | 2.9 | 0.004 |
| Presión sistólica:estatura | -0.0061 | 0.0020 | -3.0 | 0.003 |
| Gestación† | -0.0911 | 0.0509 | -1.8 | 0.074 |
| Estatura:gestación | 0.0007 | 0.0003 | 2.2 | 0.027 |
| Edad materna | -0.0614 | 0.0391 | -1.6 | 0.116 |
| Peso materno | -0.000003 | 0.0121 | 0.0 | 1.000 |
| Fuma | 31.2338 | 11.5455 | 2.7 | 0.007 |
| Peso:fuma | -0.4958 | 0.1850 | -2.7 | 0.007 |
| Dejó de fumar | -9.6010 | 4.0611 | -2.4 | 0.018 |
| Presión sistólica:dejó de fumar | 0.0889 | 0.0395 | 2.2 | 0.025 |
| Paridad‡ | ||||
| Preeclampsia previa | 14.4581 | 5.4690 | 2.6 | 0.008 |
| Peso:preeclamp sia | -0.1799 | 0.0725 | -2.5 | 0.013 |
| previa | 12.9214 | 6.2079 | 2.1 | 0.038 |
| Nulípara | -0.1013 | 0.0375 | -2.7 | 0.007 |
| Estatura:nulípara | -0.0105 | 0.0041 | -2.5 | 0.012 |
| Gestación:nulípara Edad:nulípara | 0.1248 | 0.0513 | 2.4 | 0.015 |
| Etnia‡ | ||||
| Otro, mixto. | -19.1500 | 8.0731 | -2.4 | 0.018 |
| Estatura:otro, mixto | 0.1161 1.5075 |
0.0508 0.6625 |
2.3 2.3 |
0.022 0.023 |
| Nulípara:otro, | -25.1961 | 12.1923 | -2.1 | 0.039 |
| mixto | 0.2729 | 0.1205 | 2.3 | 0.024 |
| Este asiático | ||||
| Presión sistólica:este asiático | ||||
| Desviación estándar | 5.0355 |
*Raíz del error cuadrático medio = 5.065.
R-cuadrado: 0.533, ajustado: 0.528.
Estadístico-F vs. modelo constante: 98.1, valor p < 0.001.
†Edad de gestación en semanas, centrada en 23s 3d y con transformación cuadrática. Gestación = ((semanas + días/7)-(23 + 3/7))^2.
‡Grupo de referencia: caucásico/hispano con paridad sin preeclampsia. La distribución MoM fue 1.000 ± 0.075 DE (Shapiro-Wilk = 0.9990, p = 0.356). El puntaje Z tuvo distribución 0 ± 1.0 DE (Shapiro-Wilk = 0.9985, p = 0.081).
Tabla 7 Modelo multivariado de la presión arterial media en el embarazo
| Término | Cálculo | ES | valor T | valor p |
|---|---|---|---|---|
| Valor medio esperado | ||||
| Intersección | 68.3306 | 4.5517 | 15.0 | < 0.001 |
| Peso materno | 0.1898 | 0.0155 | 12.3 | < 0.001 |
| Gestación† | 0.0319 | 0.0044 | 7.2 | < 0.001 |
| Edad materna | -0.0495 | 0.0533 | -0.9 | 0.353 |
| Estatura materna | -0.0176 | 0.0279 | -0.6 | 0.527 |
| Paridad‡ | ||||
| Preeclampsia previa | 62.3303 | 28.8721 | 2.2 | 0.031 |
| Estatura:preeclampsia previa | -0.3593 | 0.1803 | -2.0 | 0.046 |
| Nulípara | -4.5627 | 2.3367 | -2.0 | 0.051 |
| Gestación:nulípara | -0.0185 | 0.0058 | -3.2 | 0.002 |
| Edad:nulípara | 0.2047 | 0.0699 | 2.9 | 0.003 |
| Etnia‡ | ||||
| Este asiático | -1.8627 | 2.4780 | -0.8 | 0.452 |
| Gestación:este asiático | 0.0669 | 0.0308 | 2.2 | 0.030 |
| Otro, mixto | -1.4160 | 0.6598 | -2.1 | 0.032 |
| Nulípara:otro, mixto | 2.3129 | 0.8998 | 2.6 | 0.010 |
| Dejó de fumar | -0.8939 | 0.4967 | -1.8 | 0.072 |
| Antecedente familiar de preeclampsia | 1.6792 | 0.9484 | 1.8 | 0.077 |
| Desviación estándar | 6.9064 |
*Raíz del error cuadrático medio = 6.934. R-cuadrado: 0.139, ajustado: 0.133. Estadístico-F vs. modelo constante: 20.5, valor p < 0.001.
†Edad de gestación en semanas, centrada en 22s 6d y con transformación cuadrática. Gestación = ((semanas + días/7)-(22 + 6/7))^2.
‡Grupo de referencia: caucásico/hispano con paridad sin preeclampsia. La distribución MoM fue 1.000 ± 0.087 DE (Shapiro-Wilk = 0.9985, p = 0.091). El puntaje Z tuvo distribución 0 ± 1.0 DE (Shapiro-Wilk = 0.9985, p = 0.091).
La PD fue el principal factor determinante de la PS, al nulificar el efecto de la gestación en ésta y con efecto de confusión sobre las características maternas de peso, edad, estatura, etnia, paridad, dejar de fumar y antecedente familiar de preeclampsia. El peso materno, segundo determinante de la PS (valores T), tuvo efecto de confusión sobre la edad de gestación y las características maternas, excepto la estatura. En el modelo final quedaron excluidas la edad de gestación (F = 0.4566, p = 0.499), la etnia (otro, mixto F = 0.3798, p = 0.538) y el este asiático (F = 0.8114, p = 0.368).
La PS, principal factor determinante de la PD, tuvo efecto de confusión sobre todas las variables maternas y de gestación. La variable con el mayor efecto estadístico sobre la PAM fue el peso materno y no se le encontraron variables de confusión; por el contrario, el peso materno tuvo efecto de confusión para la edad materna, etnia, preeclampsia previa, fumar, dejar de fumar y antecedente familiar de preeclampsia. La edad de gestación fue la segunda en efecto estadístico sobre la PAM, independiente del peso materno, y tuvo efecto de confusión para edad materna, estatura y fumar. No hubo efecto de confusión ni de interacción entre peso materno y edad de gestación. La etnia tuvo efecto de confusión sobre la estatura materna y el antecedente familiar de preeclampsia sobre el grupo étnico diverso y mixto. Por su parte, la paridad fue variable de confusión para la edad materna, fumar y el antecedente familiar de preeclampsia. La única característica excluida del modelo final de la PAM fue el hábito de fumar (F = 0.1741, p = 0.677).
Del análisis de residuales se determinó una desviación estándar constante en cada modelo para calcular el percentil personalizado de cada presión; se muestran en su respectiva tabla. Los modelos se han codificado en archivo, DOI: 10.6084/m9.figshare.12268328.
Discusión
Las distribuciones generales de PS, PD y MAP resultaron por debajo de los estándares convencionales con o sin embarazo1-4,11, similar a lo descrito en mujeres no gestantes de una población diferente a ésta27. Nótese que el umbral de "presión arterial elevada" según el ACC6, 120/80 mmHg, equivale al percentil 97° tanto en esta población de embarazadas como en las mujeres no gestantes del estudio referido27; además, se ha demostrado que este umbral de 120/80 mmHg tiene valor en la predicción de preeclampsia y otros desenlaces perinatales adversos en otros estudios7,8. Por lo tanto, se deben revisar los criterios diagnósticos de hipertensión en el embarazo. Este estudio propone una definición estadística de normalidad; sin embargo, se requieren otros longitudinales para responder de forma satisfactoria este aspecto.
No está previsto responder en este estudio la utilización de sólo tres lecturas o las que sean necesarias; sin embargo es llamativo que alrededor de una quinta parte de los casos necesitó cuatro o más lecturas para conseguir la definición operativa, aquí establecida para el estado basal de la embarazada. La significancia de este hallazgo puede ser motivo de otro estudio.
El sesgo esperado en los valores de la presión arterial por el uso forzoso del brazalete único11 no afecta la validez de los modelos porque el ajuste por peso materno podría corregir el efecto de la circunferencia braquial28. Esta hipótesis debe ser objeto de otro estudio.
La relación entre la PS y la PD con la edad de gestación se expresa aquí mediante ecuaciones polinómicas, similar a lo hecho en un metaanálisis10. Las curvas para PD resultaron casi idénticas entre ambos estudios, no así las de presión PS. Esto podría deberse a comportamiento consistente a lo largo de la gestación humana para la PD, mas no para la PS, según lo explican los modelos multivariados, en los que la edad de gestación sólo mantiene efecto significativo para la presión PD. Aunque la PS puede expresarse por gestación, esta relación pierde significancia frente a las características maternas, sus principales determinantes; este hallazgo es congruente con otro estudio, en el cual se cuantificó el volumen sistólico a lo largo de la gestación, pero también se determinó en particular por características maternas29. Por lo tanto, los cambios fisiológicos del embarazo como el volumen circulante, la viscosidad sanguínea, el ritmo cardíaco y las resistencias periféricas se reflejan sobre todo en la PD, la cual a su vez explica aproximadamente 50% de la variación en la PS (esta cuantificación es única en las publicaciones médicas). Al corregirse este efecto, la PS refleja entonces el estado cardiovascular con el que se embaraza la mujer, pero no de origen poblacional o étnico, sino del historial médico: ginecoobstétrico y tabaco.
La relación cuadrática aquí descrita entre la PAM y la gestación es similar a lo publicado por el grupo que diseñó el método estandarizado original18: fue menor en el segundo trimestre con varianza constante a lo largo de la gestación. Es posible estandarizar la medición de la presión arterial a lo largo del embarazo.
Similar a las PS y PD, las características maternas, sobre todo el peso materno, tuvieron efecto determinante sobre la PAM, no secundario o de corrección a la gestación, como sería esperable12,24. Aunque los intervalos de referencia de la presión arterial se construyen de acuerdo con la gestación10,18, deben corregirse por características maternas.
Los efectos de las características maternas sobre la PAM que han descrito otros especialistas12 tienen similitudes con estos hallazgos; impresionan las diferencias de origen poblacional.
Por diseño no es posible diferenciar entre el efecto fisiológico y el predictivo para preeclampsia previa12, antecedente familiar de preeclampsia12,15 y dejar de fumar30. La aplicación de los modelos presentados aquí debe ser transversal (diagnóstica).
Las investigaciones futuras precisarán lo anterior y otros aspectos, entre ellos el efecto del momento en que se dejó de fumar31, el alcance de su aplicación y la utilidad en otros grupos como diabéticas e hipertensas y la relación de COVID-19 con preeclampsia32.
Conclusiones
Es necesario revisar los criterios diagnósticos para hipertensión en el embarazo. Es factible crear intervalos de referencia estandarizados de la presión arterial a lo largo de la gestación. La personalización por características maternas mejora la precisión del modelo, ya que son los principales determinantes de la presión arterial de la embarazada. La PS podría representar en particular el estado cardiovascular con el que se embaraza la mujer, mientras que la PD podría reflejar de manera primordial la adaptación materna a la gestación.











 nueva página del texto (beta)
nueva página del texto (beta)


