La cardiomiopatía hipertrófica (CMH) es la enfermedad cardiaca hereditaria más frecuente y la segunda causa de muerte cardiaca súbita (MCS) después de la enfermedad coronaria1.
Una de las variantes más infrecuentes es la CMH apical (CMHA). La estratificación del riesgo de CMHA y el implante de un cardiodesfibrilador (CD) como prevención primaria es una decisión compleja, que en la mayoría de los casos no está incluida en los modelos de estratificación europeo y americano.
Presentamos el caso de una paciente mujer de 41 años, sin antecedentes cardiovasculares y en evaluación prequirúrgica por colecistectomía. No describe palpitaciones ni síncope.
En el electrocardiograma presentó ritmo sinusal, complejos QRS de amplitud incrementada y cambios difusos en la repolarización (Fig. 1A).
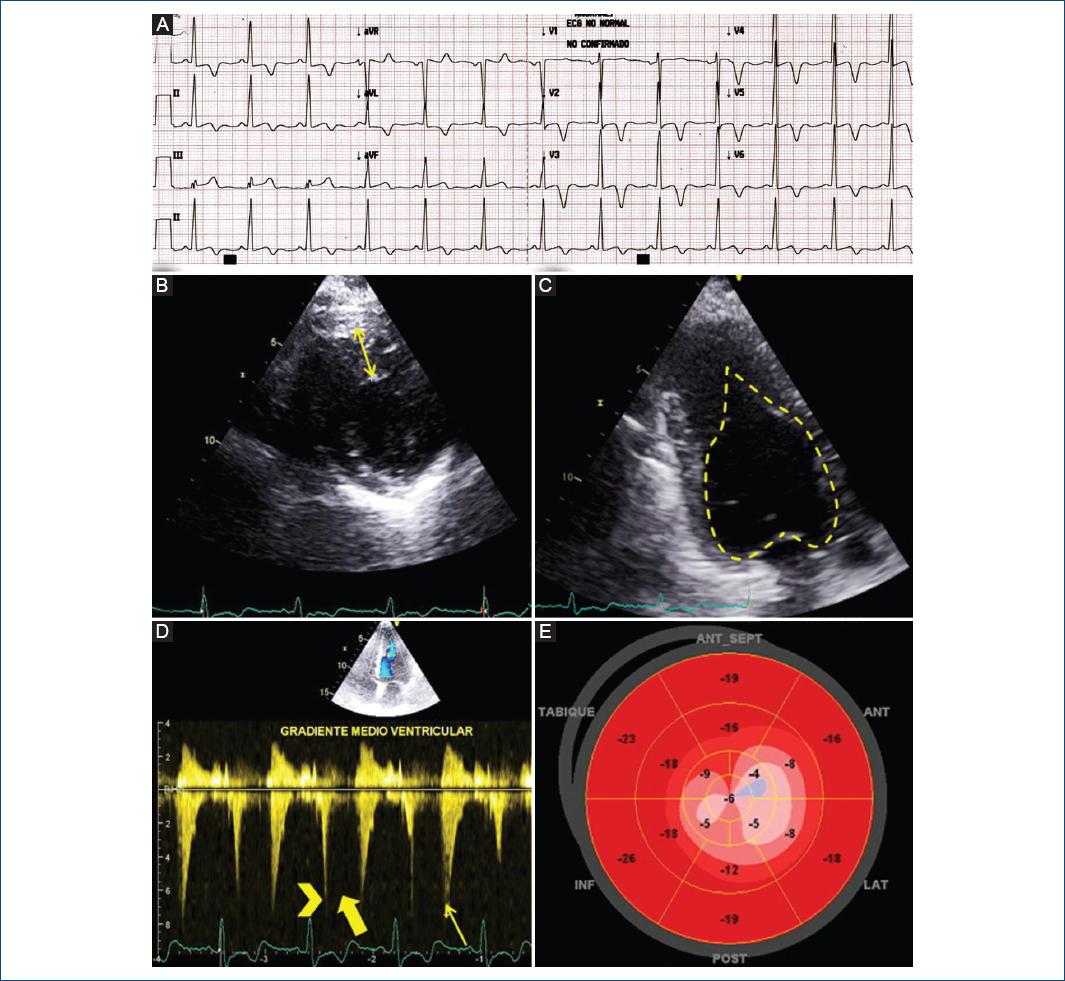
Figura 1 A: electrocardiograma. Onda S profunda en V1 (13 mm) y onda R alta en V5 (28 mm); ondas T negativas (–8 mm en V3) desde V2 a V6, DI y aVL; ausencia de ondas Q en derivadas laterales; elevación del punto J (1 mm) en DIII y aVF, con patrón rR´ en DIII y onda R empastada en aVF. Ecocardiografía. B: eje corto paraesternal izquierdo a nivel apical, grosor máximo telediastólico de 21 mm. C: vista apical de 3 cámaras, se aprecia la cavidad ventricular en forma de «haz de espadas» en telediástole y engrosamiento apical y medioventricular. D: turbulencia medioventricular con gradiente máxima señalada por la cabeza de flecha, seguido de un vacío de señal Doppler en mesosístole (flecha gruesa) y un flujo de jet paradójico en protodiástole (flecha delgada). E: ojo de buey. Alteración segmentaria a predominio apical.
En la ecocardiografía transtorácica, el grosor parietal máximo del ventrículo izquierdo (VI) se observó a nivel apical (21 mm), con extensión al tercio medioventricular (Fig. 1 B y C). La gradiente del tracto de salida del VI se estimó en 8 mmHg y la gradiente medioventricular fue 33 mmHg (Fig. 1D). La deformación global longitudinal (DGL) resultó en –12% (Fig. 1E).
De acuerdo con el modelo de estratificación europeo, el riesgo de MSC estimado para los siguientes cinco años fue del 2.06% (bajo riesgo); según el modelo americano, no se identificaron factores de riesgo convencionales. Ambas herramientas no recomendaron el implante de CD como prevención primaria.
La evaluación con resonancia magnética encontró acinesia apical y obliteración de la cavidad ventricular en sístole (Fig. 2 A y B), presentando realce tardío de gadolinio (RTG) en las zonas de máxima hipertrofia, cuantificado en un 23.9% (Fig. 2C).
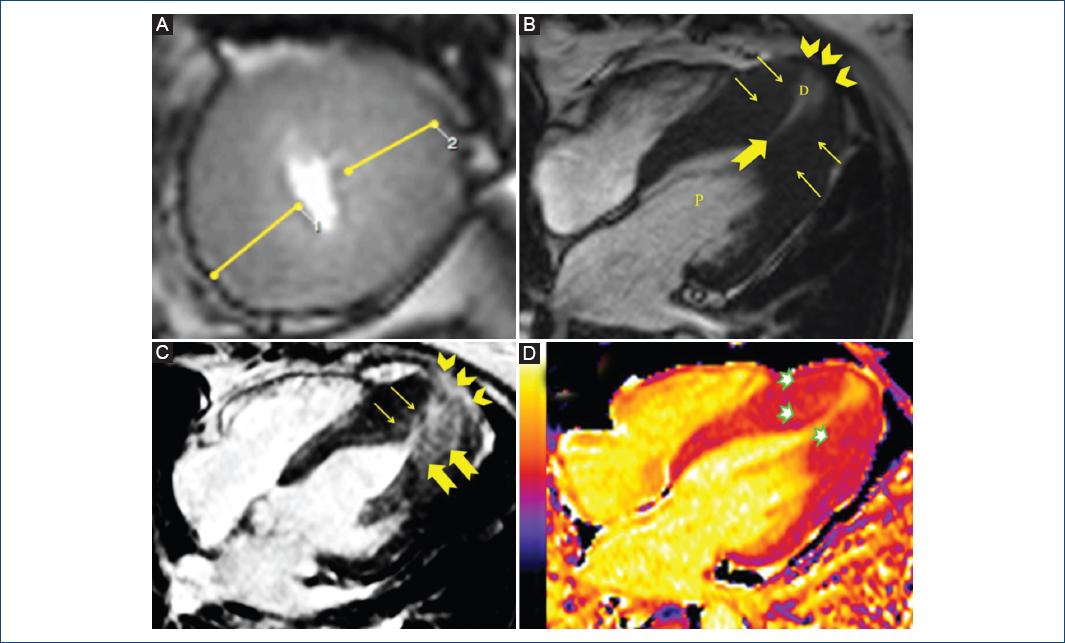
Figura 2 Resonancia magnética cardiaca. A: eje corto apical, grosor parietal máximo en 23 mm. B: vista de cuatro cámaras. Aneurisma apical (cabeza de flechas) de 17 mm, sin presencia de trombo. La hipertrofia apical se extiende hasta la base de los músculos papilares (flechas delgadas) con obstrucción medioventricular por coaptación de la pared anterolateral y septal en sístole (flecha gruesa), lo cual genera una cavidad proximal (P) y otra distal (D). C: realce tardío de gadolinio (RTG). Se observa un patrón de RTG no isquémico parcheado localizado en ápice y borde aneurismático (cabeza de flechas) con extensión a áreas contiguas de la porción distal de pared anterolateral (flechas gruesas) e inferoseptal (flechas delgadas). D: T1 mapping. Incremento de señal hasta valores de 1,077-1,104 ms en zonas de máxima hipertrofia. Los rangos de normalidad fueron entre 960-1,060 ms.
El estudio de perfusión miocárdica no mostró isquemia inducible. La región apical presentó un mayor brillo del trazador (Fig. 2D).
Considerando que en nuestro caso las guías clínicas son insuficientes para la estratificación del riesgo y basados en la presencia de una CMHA con aneurisma apical (AA), RTG extenso, obstrucción medioventricular y alteración de la DGL, recomendamos el implante de un CD y el inicio de anticoagulación.
La CMHA constituye el 4% de los diferentes fenotipos de CMH y tiene una mortalidad cardiaca del 0.5%/año2. Sin embargo, ningún esquema de estratificación del riesgo individualiza a este tipo de pacientes.
La asociación con AA, observada hasta en el 20% de los casos, y la presencia de un fenotipo apical con extensión medioventricular (CMHA tipo B), como lo observado en nuestra paciente, está asociada a un riesgo de MCS tres veces mayor y a una mayor probabilidad de progresión a insuficiencia cardiaca3,4.
La evaluación de la CMH mediante resonancia magnética y la cuantificación del RTG tienen un valor especial en el subgrupo de pacientes definidos como de «riesgo bajo» (sin factores de riesgo convencionales). El RTG se correlaciona significativamente con eventos de MCS, una extensión de RTG > 15% se asocia a un riesgo incluso mayor al 6%/5años5. En forma especial, los pacientes con CMHA y AA presentan un incremento significativo del riesgo incluso con la presencia de RTG > 5%6.
La incorporación del RTG y la presencia de AA como variables independientes identificó prospectivamente al 95% de pacientes que desarrollaron arritmias potencialmente letales, previniendo casi todos los casos de MCS7. En la actualidad la resonancia magnética no solo juega un rol en la identificación de los diferentes patrones morfológicos de la CMH, sino que además es una herramienta útil en la estratificación del riesgo para muerte súbita, en especial en aquellos pacientes definidos como de «bajo riesgo» según los esquemas de estratificación8.
La estratificación del riesgo de los pacientes con CMHA para complicaciones cardiovasculares debe ser realizada en forma individualizada, al constituir un grupo con características especiales que incluyen factores de riesgo aún no reconocidos en las guías actuales.











 nueva página del texto (beta)
nueva página del texto (beta)


