Introducción
El conducto arterioso permeable (CAP) es la cardiopatía congénita que se presenta con mayor frecuencia en niños recién nacidos (RN) prematuros. Es el más común de los defectos cardiacos congénitos1-4 y afecta a uno de cada 5,000 RN a término5. La incidencia global en RN prematuros es del 50-70%, llegando a afectar hasta al 80% de los RN pretérmino de muy bajo peso (< 1000 g)6-8. Está íntimamente relacionado con la morbimortalidad de los RN prematuros, por lo cual se considera un importante problema de salud pública.
Los RN con más alto riesgo de presentar CAP son los que desarrollan síndrome de dificultad respiratoria (SDR), taquipnea transitoria del RN (TTRN), neumonía intrauterina, síndrome de aspiración de meconio o hipertensión pulmonar persistente del RN6-8. El diagnóstico solo con datos clínicos es difícil, ya que los síntomas y signos se pueden confundir con algunos problemas respiratorios del RN o con septicemia, lo cual hace que el diagnóstico de un CAP hemodinámicamente significativo (CAP-HP) sea tardío.
Las unidades de cuidados intensivos neonatales cada vez tienen mayor éxito en la sobrevida de los pacientes prematuros. Esto se debe a que el diagnóstico no invasivo de cardiopatías con equipos portátiles de ecocardiografía Doppler es de fácil acceso a dichas unidades. Por ende, el diagnóstico temprano de CAP se ha incrementado de manera importante.
Un diámetro de CAP > 1.5 mm, con una relación flujo pulmonar/flujo sistémico > 1.5, es un índice altamente predictivo de que el CAP no se va a cerrar y de que, por lo tanto, un alto porcentaje de estos casos desarrollarán un CAP-HP, lo que permite tomar decisiones tempranas para el tratamiento. En la actualidad, el tratamiento de elección es el cierre farmacológico, con buenos resultados en diferentes estudios. Sin embargo, en caso de que este cierre no se logre, se puede realizar el cierre percutáneo mediante cateterismo por parte de un cardiólogo intervencionista, o el cierre quirúrgico con toracotomía por parte de un cirujano pediatra cardiovascular9-15.
En este estudio mostramos nuestros resultados con el cierre quirúrgico del CAP en aquellos pacientes que no respondieron al cierre farmacológico o que tenían alguna contraindicación para este.
No existen publicaciones en las que se comparen las tasas de éxito o fracaso en el cierre del CAP realizado por un cirujano pediatra general en comparación con un cirujano pediatra cardiovascular16.
El objetivo de este trabajo es demostrar que el cierre quirúrgico del CAP puede llevarse a cabo con éxito por cirujanos pediatras sin especialidad en cirugía cardiovascular, lo cual facilita el manejo de la cardiopatía congénita más frecuente. El motivo es la falta de un servicio de cirugía cardiovascular pediátrica o de intervencionismo en los hospitales de segundo y tercer nivel en México, así como en muchos países semejantes al nuestro.
Método
Estudio descriptivo en el cual se analizó a pacientes con CAP, con especial atención en el cierre quirúrgico y su evolución, complicaciones y mortalidad. Se realizó en el Hospital General de Occidente, un centro hospitalario público de segundo nivel que presta atención de salud a la población pediátrica abierta.
Los criterios de inclusión fueron tener diagnóstico de CAP que requiriera corrección quirúrgica. Se excluyeron del estudio los pacientes sin expediente completo. Para la recolección de la información se revisaron en forma retrospectiva los expedientes de enero de 2001 a diciembre de 2018, que supusieron un total de 227 cierres quirúrgicos de CAP. Se encontraron 224 expedientes completos; el resto, tres pacientes, no tenían el expediente completo o ya estaba depurado, por lo cual fueron excluidos.
Las variables revisadas fueron el sexo, la edad gestacional, el motivo de ingreso, el tratamiento farmacológico, la edad y el peso en el momento de la cirugía, el tipo de abordaje, el tiempo quirúrgico, la valoración de hipertensión pulmonar, la imposibilidad para extubar al paciente, el tiempo de extubación tras la cirugía, las complicaciones y la mortalidad.
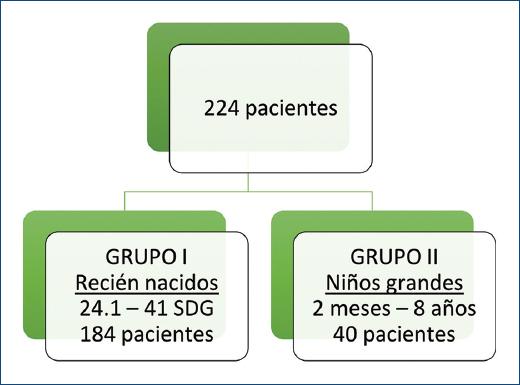
De la población estudiada, se dividió a los pacientes en dos grupos (Fig. 1):
– Grupo I: recién nacidos de 24.1 hasta 41 semanas de edad gestacional.
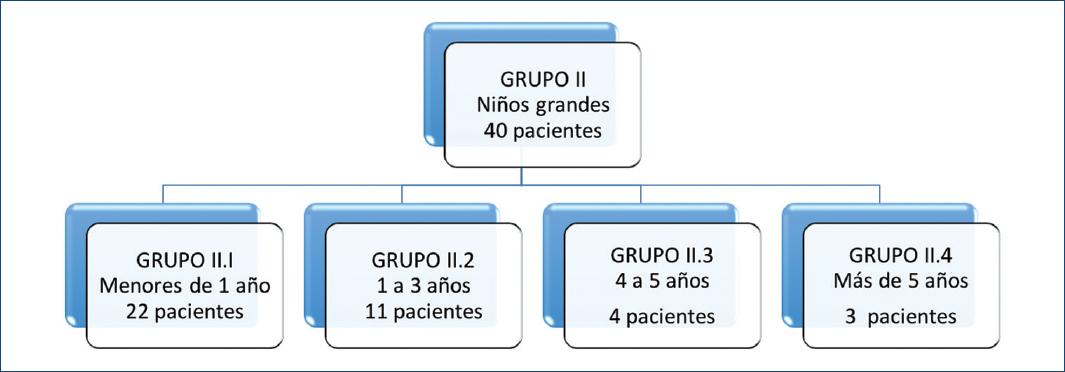
– Grupo II: niños grandes, que incluía pacientes con edades desde 2 meses hasta 8 años.
Los pacientes del grupo I ingresaron a la unidad de cuidados intensivos neonatal por prematuridad y algún problema asociado: respiratorio (SDR o TTRN), sepsis neonatal, hipoxia neonatal, desnutrición asimétrica u otros. Los pacientes del grupo II ingresaron por datos clínicos de repercusión hemodinámica, falla para crecer o infecciones respiratorias frecuentes, y durante su abordaje diagnóstico se encontró el CAP.
Los pacientes que entraban en el protocolo de cierre eran aquellos con datos clínicos y ecocardiográficos de CAP-HP. Los datos clínicos eran dependencia de oxígeno, deterioro respiratorio, imposibilidad de extubación, requerir aumento en los parámetros de ventilación mecánica, descompensación hemodinámica e hipoperfusión de órganos diana (insuficiencia renal aguda o enterocolitis necrotizante). Los datos en el ecocardiograma Doppler que en el momento del estudio se tomaron en cuenta fueron la presencia de un conducto con un diámetro > 1.5 mm y una relación flujo pulmonar/flujo sistémico > 1.5. Debe considerarse también la relación aurícula izquierda/aorta > 1.5 con datos añadidos como el robo diastólico en la aorta descendente.
Los pacientes dentro del protocolo de cierre se dividieron en dos grupos:
– Grupo A: pacientes sometidos inicialmente a cierre farmacológico con inhibidores de la ciclooxigenasa o prostaglandinas (o ambos); si no había respuesta ecocardiográfica, los pacientes se sometían a cierre quirúrgico.
– Grupo B: pacientes con alguna contraindicación para el cierre farmacológico que pasaban directamente a cierre quirúrgico.
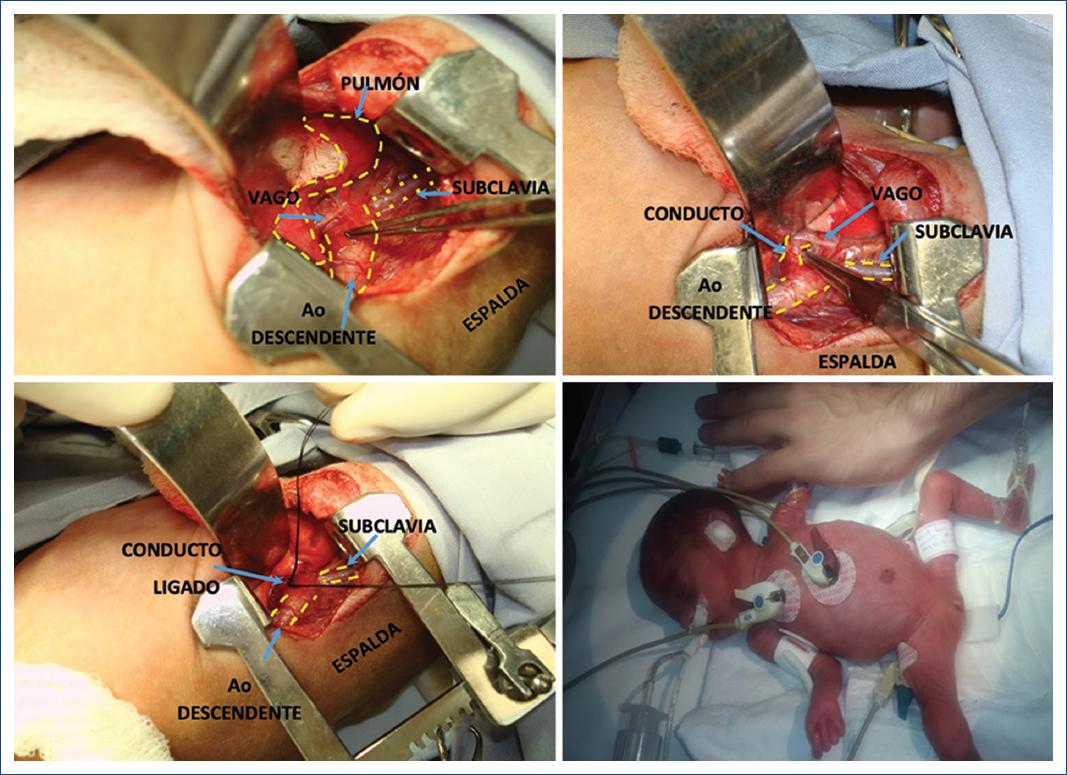
La técnica quirúrgica utilizada en los pacientes de ambos grupos fue por toracotomía posterolateral izquierda, con abordaje extrapleural inicialmente y en caso de desgarro de la pleura se completa intrapleural. Se identifica el conducto teniendo como referencia primordial el nervio vago y el laríngeo recurrente, se diseca con cuidado en todo su diámetro y se hace doble ligadura con seda 3-0 o 4-0 sin sección del conducto en los pacientes del grupo I, y con sección y sutura en los pacientes del grupo II. Con el abordaje extrapleural no se dejó tubo pleural; con el intrapleural, se dejó un tubo pleural por 24 horas.
En los casos toracoscópicos el abordaje es con tres puertos de 3 mm: línea clavicular posterior, quinto espacio intercostal, por el cual se introduce la óptica, y bajo visión directa se introducen otros dos puertos, uno en la línea clavicular posterior séptimo u octavo espacio intercostal, y el otro en la línea clavicular media séptimo espacio intercostal. Se hace un abordaje intrapleural y el conducto se liga con una grapa Haemolock de 5 mm, dejando un tubo intrapleural por 24 horas (Fig. 2).
Se obtuvo la aprobación del procedimiento quirúrgico por medio de consentimiento informado, firmado por los representantes legales de los pacientes.
Resultados
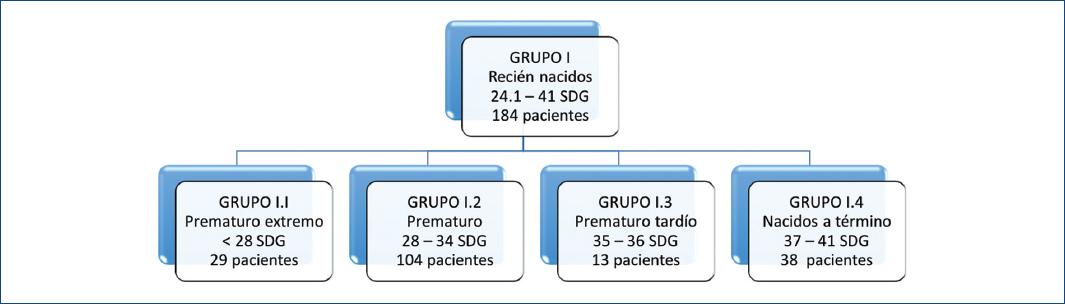
De los 227 pacientes operados, se incluyeron 224 con expedientes completos y se dividieron en dos grupos (I y II) según la edad. En el grupo I hubo 184 pacientes (Fig. 3). El motivo de ingreso a la unidad de cuidados intensivos neonatal de los pacientes del grupo I fue por prematuridad y algún problema asociado, encontrando que el más frecuente era SDR asociado a sepsis en 49 pacientes (27%). Los diagnósticos incluidos en otros problemas fueron síndrome dismórfico, producto macrosómico, parto fortuito, hipoglucemia, ictericia por incompatibilidad de grupo ABO, policitemia, hernia diafragmática izquierda, atresia duodenal y malformación anorrectal (Fig. 4).
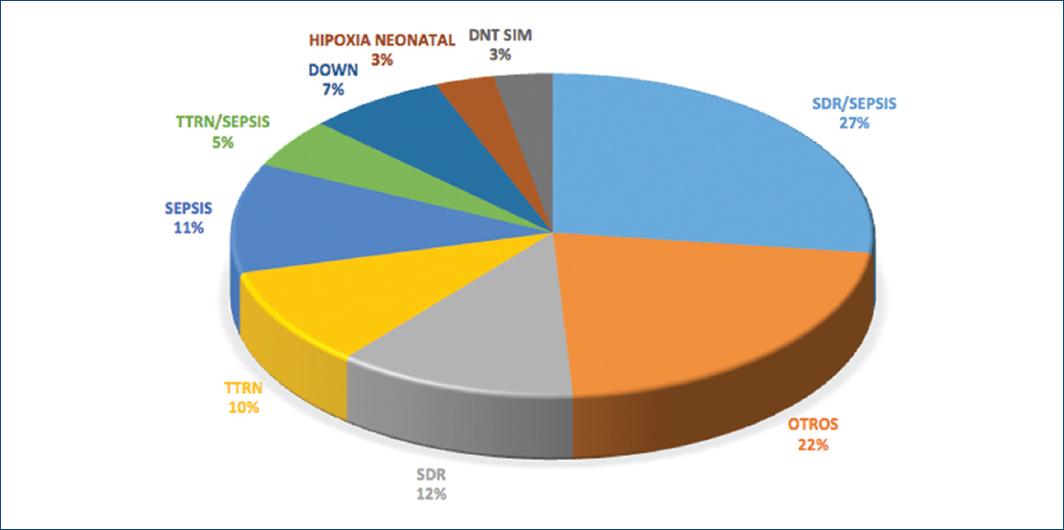
Figura 4 Diagnóstico de ingreso en los pacientes del grupo I. DNT SIM: desnutrición simétrica; SDR: síndrome de dificultad respiratoria; TTRN: taquipnea transitoria del recién nacido.
El peso de los pacientes varió entre 500 g y 5 kg (Fig. 5), y en cuanto al sexo, fueron 81 (44%) niñas y 103 (56%) niños.
Con respecto al cierre farmacológico, se dividieron en dos grupos (Fig. 6):
– Grupo A: 86 pacientes (46%) se sometieron a cierre farmacológico a base de paracetamol, ibuprofeno, ketoprofeno o indometacina, con un primer ciclo de 3 días. En caso de no haber respuesta ecocardiográfica se intentó un segundo ciclo de 3 días con paracetamol en 29 pacientes, finalmente sin lograr el cierre, por lo que fueron sometidos a cirugía.
– Grupo B: 98 pacientes (54%) tuvieron alguna contraindicación para el cierre farmacológico y pasaron directamente a cierre quirúrgico.
Tenían algún grado de hipertensión pulmonar 102 (56%) pacientes, de los cuales en 32 (31%) era leve, en 65 (63%) era moderada y en 5 (6%) era grave. Cursaron sin hipertensión arterial pulmonar 82 (44%) pacientes.
De los 184 pacientes de nuestra casuística del grupo I, 19 (10%) tenían cardiopatía asociada: 8 (4%) comunicación interventricular, 5 (3%) comunicación interauricular, 4 (2%) pseudocoartación aórtica pero sin gradiente significativo, y 2 (1%) canal auriculoventricular (uno de estos últimos tuvo que ser operado del conducto para ofrecerle mayor tiempo de vida y poder ser operado en una institución de tercer nivel).
En los pacientes del grupo I se reporta un tiempo quirúrgico de 30 a 45 minutos en el 5% de los pacientes y de 45 minutos a 1 hora en el 28%. El abordaje extrapleural fue el preferido y se realizó en 141 pacientes (77%).
Los pacientes con CAP cursan con imposibilidad para la extubación por la congestión pulmonar secundaria al aumento del flujo pulmonar que produce el conducto; por lo tanto, el tiempo de extubación tras la cirugía se tomó como un parámetro de éxito del tratamiento quirúrgico, y encontramos que la mayoría de los pacientes (59; 32%) fueron extubados en los primeros 5 días, 26 (14%) a los 6-10 días, 10 (5.5%) a los 11-15 días, 3 (1.5%) a los 16-20 días y 8 (4.5%) tras más de 20 días. No se logró extubar a 23 pacientes (12.5%) por presentar complicaciones graves inherentes a su prematuridad y sus diagnósticos de ingreso, y fallecieron. El resto, 55 pacientes (30%), se extubaron en quirófano (Fig. 7).
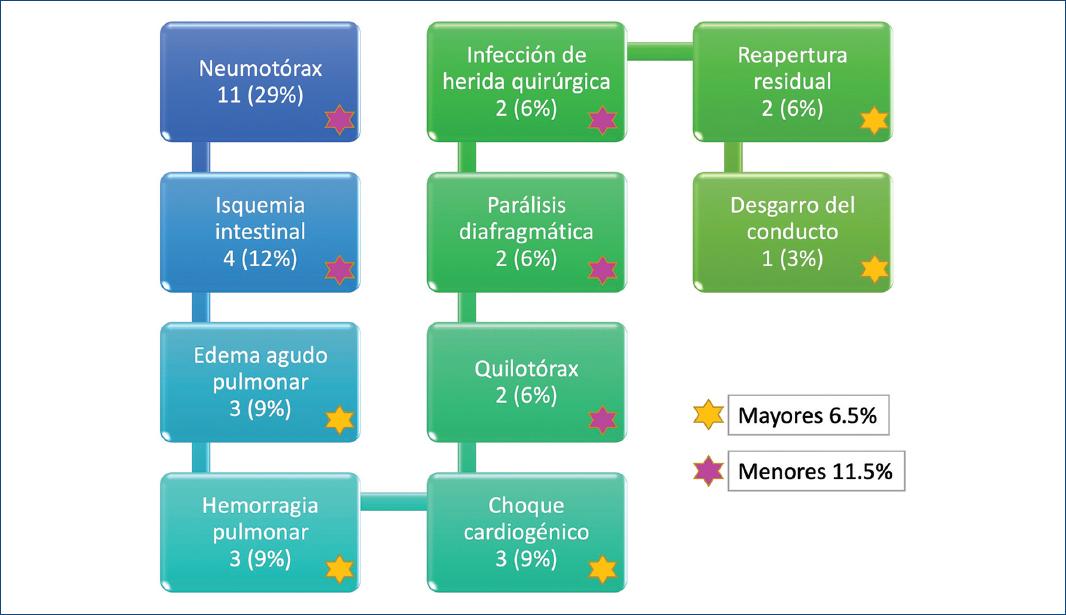
Las complicaciones del grupo I estuvieron presentes en 33 pacientes, que representan el 18% de los RN. Solo el 6.5% tuvieron complicaciones mayores secundarias a los cambios hemodinámicos posteriores al cierre del conducto: 11 pacientes (29%) con neumotórax que se resolvió con la colocación de una sonda pleural; 4 (12%) con isquemia intestinal no grave que se resolvió con reposo intestinal y antibioticoterapia; 3 (9%) con edema agudo pulmonar manejado con restricción de líquidos y diurético; 3 (9%) con hemorragia pulmonar; 3 (9%) con choque cardiogénico manejado con aminas; 2 (6%) con quilotórax manejados con sonda pleural, ayuno, nutrición parenteral total con aporte de triglicéridos de cadena media y octreotida; 2 (6%) con parálisis diafragmática que se corrigieron, cuando sus condiciones lo permitieron, por medio de plicatura diafragmática; 2 (6%) con infección o dehiscencia de herida quirúrgica que se resolvieron con curaciones; 2 (6%) con fuga residual del conducto observada en el ecocardiograma de control; y 1 (3%) con desgarro del conducto que se reparó en el momento sin repercusión hemodinámica (Fig. 8).
Fallecieron 23 pacientes (12.5%), y las principales causas de defunción fueron: 6 (26%) por falla orgánica múltiple, 4 (17%) por choque séptico, 3 (13%) por secuelas neurológicas debidas a hemorragia interventricular, 3 (13%) por hemorragia pulmonar, 2 (9%) por edema agudo pulmonar, 2 (9%) por choque cardiogénico, 1 (4%) por quilotórax, 1 (4%) por coagulación intravascular diseminada y 1 (4%) por insuficiencia renal aguda. Ninguna de las defunciones sucedió en el transoperatorio y cabe mencionar que las causas de muerte eran inherentes a la prematuridad.
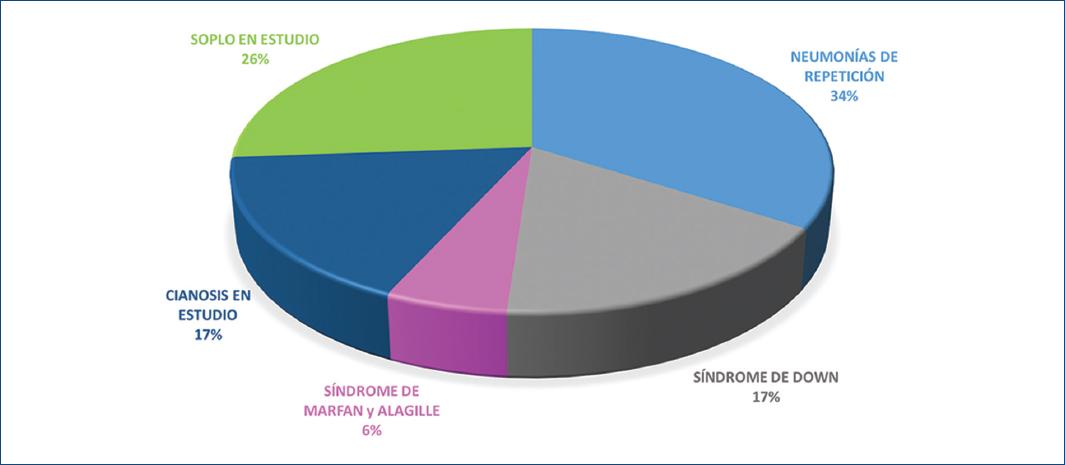
En la figura 9 se muestra la distribución por edades en el grupo II. Los motivos de ingreso en el grupo II fueron: 12 pacientes con neumonías de repetición, 9 con soplo en estudio, 6 con síndrome de Down, 6 con cianosis en estudio y 5 con falla para crecer. En estos pacientes, durante su abordaje diagnóstico el ecocardiograma reportó el CAP. Hubo dos pacientes con síndrome de Marfan y síndrome de Alagille que tenían CAP y fueron ingresados para su corrección quirúrgica (Fig. 10).
En el grupo II, el peso de los pacientes varió entre 3 y 19 kg (Fig. 11). En cuanto al sexo, fueron 23 (57%) niñas y 17 (43%) niños.
Ninguno de los pacientes del grupo II fue sometido a cierre farmacológico por la edad. Tenían algún grado de hipertensión pulmonar 12 pacientes (30%), de los cuales en 2 (17%) era leve, en 7 (58%) era moderada y en 3 (25%) era grave. Cursaron sin hipertensión arterial pulmonar 28 pacientes (70%).
De los 40 pacientes de nuestra casuística del grupo II, solo 1 (2.5%) tenía una comunicación interventricular como cardiopatía asociada al CAP. En el 82% se realizó un abordaje quirúrgico extrapleural, en el 12% transpleural y en el 6% toracoscópico.
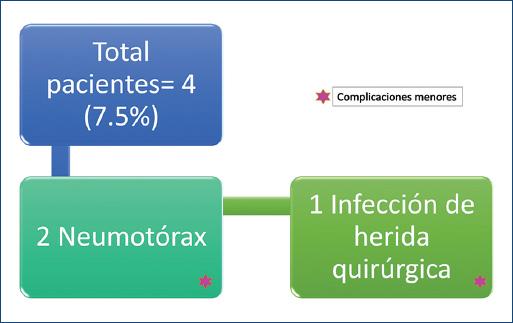
El tiempo de extubación se reporta en la mayoría de los pacientes en quirófano: 34 pacientes (85%). Del resto, 4 (10%) se extubaron en los primeros 5 días, 1 (2.5%) a los 6-10 días, 1 (2.5%) a los 11-15 días y 1 (2.5%) no pudo extubarse por presentar complicaciones graves, y falleció (Fig. 12). Las complicaciones del grupo II se reportan en 3 pacientes (7.5%), todas ellas menores: 2 pacientes con neumotórax que se resolvió con la colocación de una sonda pleural y 1 paciente con infección o dehiscencia de la herida quirúrgica que se resolvió con curaciones (Fig. 13). En este grupo de niños mayores, un paciente falleció por choque séptico que no respondió al manejo hemodinámico intensivo.
Discusión
En México existen hospitales de segundo y tercer nivel que cuentan con unidades de cuidados intensivos neonatales sin unidades cardiovasculares1-3. El CAP es la cardiopatía congénita que con más frecuencia se encuentra en estas unidades y su resolución habitualmente se intenta por cierre farmacológico. Algunos autores señalan una morbimortalidad del 24% en los pacientes con cierre quirúrgico frente al 13% en aquellos con cierre farmacológico17-20. Sin embargo, un porcentaje variable de RN con CAP-HS no responden al cierre farmacológico o tienen alguna contraindicación formal para intentarlo; es en estos en quienes se debe hacer un cierre quirúrgico, y en muchas de las unidades de cuidados intensivos neonatales no se cuenta con un cirujano cardiovascular pediátrico.
En este estudio no analizamos la evolución de los pacientes con cierre farmacológico, pero cuando este tratamiento falló o no se pudo llevar a cabo por alguna contraindicación, lo tomamos como un parámetro indicativo de cierre quirúrgico, y analizamos únicamente la evolución de los pacientes a los que se les hizo corrección quirúrgica por parte de un cirujano pediatra.
Aunque sabemos que en los niños de más de 2 kg de peso el intervencionismo para el cierre del CAP es factible, en la mayoría de nuestras unidades que disponen de terapia intensiva neonatal no se cuenta con sala de hemodinamia e intervencionismo, ni con presupuesto para los dispositivos, y las unidades que sí cuentan con el equipo no darían abasto para atender a todos los RN con CAP-HS.
Las complicaciones reportadas en la literatura atribuidas a la cirugía propia del CAP son intraoperatorias y posoperatorias tardías. Las intraoperatorias incluyen sangrado o hemorragia (4-10%), desgarro ductal (2-2.5%) y lesión del nervio laríngeo recurrente con parálisis de cuerdas vocales (1-8%). En nuestro estudio solo tuvimos desgarro ductal en un caso, que representa el 0.4%, y se resolvió en quirófano sin complicaciones graves; en nuestro estudio, dicho incidente muestra una incidencia menor que en la literatura revisada. Las complicaciones posoperatorias reportadas en la literatura son neumotórax (1-13%), quilotórax (1-4%), infección sistémica (7-8%) e infección de la herida (1-2%); todas presentes y similares en frecuencia a las encontradas en nuestro estudio. Llama la atención que las complicaciones de nuestros casos se asemejan a las de la literatura revisada, y la mayoría son complicaciones menores que fueron resueltas de inmediato21-26.
El cierre quirúrgico del CAP en nuestro hospital fue una opción muy útil y con baja morbimortalidad, por lo cual consideramos que es un procedimiento relativamente sencillo con complicaciones mínimas, que puede llevarse a cabo en un hospital de segundo nivel. Nuestros resultados son muy satisfactorios, con una sobrevida global del 92%.
En nuestra serie, la mortalidad fue del 10.7% (24 pacientes), siendo todas las muertes no relacionadas con el procedimiento quirúrgico en sí.
Demostramos con este estudio la factibilidad de realizar estas cirugías por un cirujano pediatra, haciendo hincapié en que la mortalidad es equiparable o incluso menor que la reportada en la literatura por centros donde sí tienen cirujanos cardiovasculares pediátricos.
Conclusiones
En los hospitales pediátricos o generales que no cuenten con un servicio de cirugía cardiovascular pediátrica o de hemodinamia para el cierre percutáneo, el cierre quirúrgico del CAP puede ser llevado a cabo por un cirujano pediatra que tenga experiencia en este tipo de intervenciones. El procedimiento es seguro, fácil de realizar, reproducible y con mínimas complicaciones.











 nueva página del texto (beta)
nueva página del texto (beta)