Introducción
La fibrilación auricular (FA) es la arritmia cardíaca más común del adulto en la práctica clínica. En la actualidad se calcula una incidencia global de 1 a 2% en la población general, cerca de 33.5 millones de personas1. Alrededor de 1 de cada 5 accidentes cerebrovasculares se debe a FA, casi siempre éstos son graves y producen discapacidad a largo plazo o muerte2.
La clasificación CHA2DS2-VASc es una herramienta utilizada de forma amplia para valorar el riesgo de sufrir un episodio embólico y es esencial para identificar a los pacientes que se benefician del tratamiento anticoagulante3. El ecocardiograma transtorácico constituye una herramienta útil y es sin duda la técnica básica de valoración en los pacientes con FA; sin embargo, tiene una capacidad limitada para la detección de trombos en la aurícula izquierda (AI) y la orejuela izquierda (OI)4. El ecocardiograma transesofágico (ETE) es la modalidad de imagen más empleada en pacientes con FA antes de procedimientos de ablación de venas pulmonares o en el cierre percutáneo de la OI5. En fecha reciente, Nucifora, et al. han propuesto la ecocardiografía tridimensional para la valoración de la morfología de la OI6.
La resonancia magnética (RM) cardíaca es una modalidad de imagen no invasiva alternativa en los casos en los que la ETE no es factible, pero su costo elevado y escasa disponibilidad dificultan su uso7.
Los avances actuales en la tomografía cardíaca multidetector (TCMD) permiten una gran resolución espacial y temporal, con imágenes tridimensionales que hacen posible una valoración no invasiva cuantitativa y multiparamétrica de la aurícula y la orejuela izquierdas. Ya existen estudios comparativos entre ETE y TCMD en la identificación de trombos intracavitarios, en los que la TCMD mostró mejor precisión diagnóstica. No obstante, no se ha realizado la comparación de estos dos métodos en pacientes con FA8. El volumen indexado de la aurícula izquierda (VIAI) y la fracción de expulsión de la aurícula izquierda (FEAI) ya se han valorado en pacientes con afección coronaria por TCMD9 y en la población sana10. Burrell, et al. encontraron un incremento del VIAI en los pacientes con FA en relación con un grupo control (p < 0.001). Además, señalaron que ante la presencia de FA hay una disminución de la contractilidad y la función de la OI que se manifiesta en la forma de una disminución de las velocidades de flujo y dilatación de la OI11. Mügge, et al. demostraron que existe correlación entre la disminución de la fracción de expulsión de la orejuela izquierda (FEOI) y la formación de trombos mediante ETE en pacientes con FA12. Di Biase, et al. clasificaron en cuatro categorías la morfología de la OI: ala de pollo, que es la más común en la población sana (48%), seguida por la de cactus (30%), manga de viento (19%) y coliflor (3%)13. Bosi, et al. demostraron en modelos anatómicos in vitro que la morfología de la OI se relaciona con la hemodinamia del flujo sanguíneo y sugirieron que a menor velocidad de flujo, mayor posibilidad de episodios trombóticos. Estos especialistas encontraron que la morfología en coliflor posee la velocidad de flujo más baja y la de tipo manga de viento se relaciona con una velocidad de flujo mayor14.
Hoy en día, el método más utilizado para cuantificar la velocidad de flujo de la OI es el ETE, si bien este método es invasivo y conlleva ciertas complicaciones. Yasuoka, et al. condujeron un estudio en el que correlacionaron la velocidad de flujo de la OI obtenida por ETE y TCMD, y encontraron buena correlación entre ambos métodos15. Un metaanálisis reciente que incluyó 19 estudios con 2,955 pacientes mostró una sensibilidad del 96%, una especificidad del 92% y un sólido valor predictivo negativo de la TCMD para la detección de trombos (96 a 100%)16. Wu, et al. propusieron que los pacientes sin evidencia de trombos por TCMD no requieren ETE para su confirmación17. Además, la TCMD ha demostrado en fecha reciente ser superior al ecocardiograma transtorácico y transesofágico en cuanto a la valoración del tamaño de la AI, un importante predictor de recurrencia de la FA18.
La TCMD posibilita una valoración completa en los pacientes con FA; hasta el momento no existen estudios que evalúen de modo simultáneo la FEAI, la FEOI, el volumen indexado de la AI y OI, la morfología de la OI, la velocidad de flujo de la OI y la presencia de trombo en la OI por TCMD. Esta valoración multiparamétrica ofrece mayor información al médico para optimizar el tratamiento y permitir una reestratificación del riesgo tromboembólico de los pacientes con FA, lo que podría modificar la calidad de vida y el pronóstico de estos pacientes. Este estudio abrirá nuevos horizontes en la investigación relacionada con este tema, ya que las publicaciones médicas son escasas y es previsible que sirva de referencia para futuras investigaciones.
Material y métodos
Estudio prospectivo comprendido entre el 1 de marzo del 2018 y el 1 de abril del 2019 realizado en el Hospital General Dr. Miguel Silva de la ciudad de Morelia, Michoacán, México. El estudio recibió aprobación del comité de ética con número de registro Conbioética-16-CEI-004-20161212, en el cual se incluyó a un total de 84 pacientes. De ellos, 54 tenían diagnóstico de FA y 30 eran del grupo de control. Este último grupo se integró con pacientes sometidos a TCMD por sospecha clínica de cardiopatía isquémica y no padecían FA; estos controles presentaban algún factor de riesgo (hipertensión arterial, diabetes mellitus, dislipidemia, tabaquismo, alcoholismo u obesidad).
Ambos grupos se parearon por edad y género. En todos los pacientes se evaluó la escala de CHA2DS2-VASc para calcular el riesgo tromboembólico. Se incluyeron el peso y la talla para calcular el índice de masa corporal (IMC), así como otras variables clínicas como tabaquismo, alcoholismo, hipertensión arterial (HAS), diabetes mellitus (DM), dislipidemia y antecedente de episodio vascular cerebral o ictus transitorio (EVC/IT). Se excluyó a los pacientes con enfermedad valvular, miocardiopatías, enfermedades congénitas, enfermedades autoinmunitarias, insuficiencia renal o alergia al medio de contraste. Todos los pacientes se sometieron a TCMD para obtener las imágenes tal y como lo describieron Gweon, et al.19 Se utilizaron tomógrafos de 32 y 64 cortes (General Electric) y se administró medio de contraste (Iopamiron® 370). Se administró betabloqueador con metoprolol por vía oral antes del estudio con el objetivo de lograr una frecuencia cardíaca de 60 latidos/min. Las estructuras tridimensionales de la AI y OI se reconstruyeron con la técnica de procesamiento de volumen rendering para valorar el volumen indexado y la fracción de expulsión de la AI y OI. Se calcularon las variables velocidad de flujo y volumen de la AI y OI, así como la presencia de trombos. La morfología de la OI se evalúo en reconstrucciones multiplanares y la clasificaron dos expertos en imagen cardíaca, que estaban cegados a los datos clínicos de los pacientes.
Un especialista en imágenes cardiovasculares efectuó el análisis de las imágenes obtenidas mediante una estación de trabajo GE (CardioIQ Express, versión 8; General Electric Medical Systems). Para determinar la velocidad de flujo de la OI se obtuvo una imagen bidimensional de dicha estructura y con posterioridad se determinaron dos puntos distintos en la OI (distal y proximal) (Fig. 1, B y E); el punto proximal se obtuvo en el centro del orificio de la OI, mientras que el punto distal fue el punto 7/8 de una línea recta trazada desde el punto de flexión de la pared posterior de la OI hasta el punto distal más anterior de la OI. Una vez conseguidos estos dos valores, se llevó a cabo una relación del punto distal sobre el punto proximal, y el resultado fue una relación de unidades Hounsfield. Yasuoka describió y aprobó con anterioridad este método15, la morfología de la OI se evaluó de acuerdo con la clasificación de Di Biase13 y el volumen indexado de la OI se calculó a partir de los volúmenes máximo y mínimo de la OI que se determinaron con la técnica de procesamiento de volumen rendering. La FEOI se calculó con la siguiente fórmula: EF = (Vmáx − Vmín)/Vmáx), con base en el método de Boucebci20.
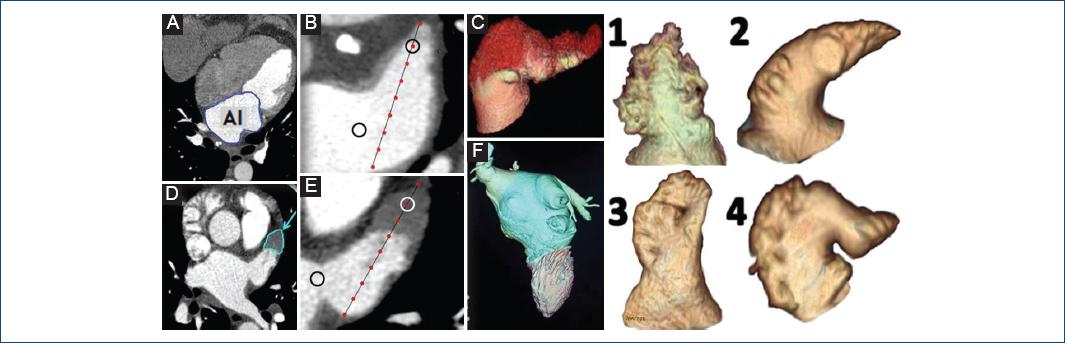
Figura 1 Parámetros por tomografía cardíaca multidetector. A: Volumen indexado de la aurícula izquierda (AI). B: Velocidad de flujo de la orejuela izquierda (OI) en un paciente del grupo control. C: Reconstrucción tridimensional del trombo en la OI. D: Trombo en la OI (flecha). E: Velocidad de flujo de la OI en un paciente del grupo de fibrilación auricular. F: Reconstrucción tridimensional de AI aneurísmica. Reconstrucción tridimensional de los diferentes tipos de morfología de OI: 1) coliflor, 2) manga de viento, 3) cactus, 4) ala de pollo.
Análisis estadístico
Se aplicó un análisis de varianza de una vía o bien H de Kruskal-Wallis con post hoc de Dunn en variables continuas, como edad, peso, índice de masa corporal, y todas las características cuantitativas radiológicas agrupadas por el tipo de OI, tanto en el grupo de FA como en los controles; se aplicó contraste estadístico de promedios entre la FA y los controles y, dentro del grupo de FA, entre los dos subgrupos de FA (paroxística vs. permanente) con t de Student con una y dos colas, respectivamente; se analizó el coeficiente de correlación lineal producto del momento de Pearson para los dos grupos en conjunto con la velocidad de flujo de OI respecto de las demás variables cuantitativas y se aplicaron las pruebas de c2 o F exacta de Fisher para el contraste de frecuencias en cuadrado latino de 2 x 2; en todos los casos, la probabilidad estadísticamente significativa del error alfa fue < 0.05, según el programa de SigmaPlot 12.5 (CR) 2003-2013.
Resultados
Se analizó a 84 individuos, 54 de ellos con FA: 21 (38.9%) con FA paroxística y 33 (61.1%) con FA permanente. La edad media en el grupo de FA fue de 67 ± 14 años y 55.6% correspondía a hombres. La tabla 1 describe las características clínicas de ambos grupos. Se encontró una correlación inversa entre la FEAI y la edad (r = -0.43, p < 0.001), al igual que con la FEOI (r = -0.33, p < 0.001).
Tabla 1 Características clínicas del grupo de control y el grupo de fibrilación auricular
| Grupo de control (n = 30) | Grupo FA (n = 54) | p | |
|---|---|---|---|
| Edad (años) | 54.83 ± 15 | 67.43 ± 14 | < O.OO1 |
| Género masculino | 53.3% | 55.6% | N/S |
| IMC | 27.9 ± 5 | 28 ± 5 | N/S |
| Hipertensión arterial | 43.3% | 46.3% | N/S |
| Dislipidemia | 23.3% | 24.1% | N/S |
| Diabetes mellitus | 6.7% | 25.9% | < O.OO1 |
| Tabaquismo | 36.7% | 31.5% | N/S |
| Alcoholismo | 23.3% | 22.2% | N/S |
| Antecedente de EVC/IT | 0% | 33.3% | < O.OO1 |
| Anticoagulación | 0% | 42.6% | < O.OO1 |
| Antiagregación plaquetaria | 0% | 53.7% | < O.OO1 |
| Tipo de FA | |||
| FA paroxística | 38.9% | ||
| FA permanente | 61.1% | ||
| Escala CHADS2 | 1.7 ± 1.2 | ||
| Escala CHA2DS2-VASc | 2.8 ± 1.7 |
IMC: índice de masa corporal; EVC: episodio vascular cerebral; IT: ictus transitorio; FA: fibrilación auricular.
La morfología de tipo coliflor fue la más frecuente en el grupo de FA (33.3%), mientras que la de tipo cactus predominó en los controles (37%). En el análisis del VIAI y la FEAI se encontraron diferencias significativas entre ambos grupos (p < 0.001), y asimismo se documentaron diferencias con la FEOI y la velocidad de flujo de la OI entre casos y controles (p < 0.001).
Los parámetros evaluados por TCMD se consignan en la tabla 2. La velocidad de flujo de la OI fue más baja en el grupo de FA respecto del grupo control (0.34 ± 0.16 cm/s vs. 0.87 ± 0.08 cm/s) (p < 0.001). En los pacientes con FA, la velocidad de flujo de la OI fue más baja en quienes tuvieron trombo en la OI, pero no se encontró diferencia estadística en relación con los que no sufrieron trombo (0.32 ± 0.14 vs. 0.35 ± 0.17 cm/s; p= NS) (Fig. 2).
Tabla 2 Variables por tomografía cardíaca multidetector
| Grupo control (n = 30) | Grupo FA (n = 54) | p | |
|---|---|---|---|
| Calificación de calcio (UA) | 10.8 ± 24 | 59.26 ± 142 | N/S |
| VIAI (ml/m2) | 40.3 ± 9 | 67.3 ± 27.4 | < O.OO1 |
| Volmáx AI (ml) | 75.2 ± 20 | 116.4 ± 49 | < O.OO1 |
| Volmín AI (ml) | 53.4 ± 19.3 | 96.6 ± 42.8 | < O.OO1 |
| FEAI (%) | 29.8 ± 12.5 | 16.2 ± 7.7 | < O.OO1 |
| Volmáx OI (ml) | 10.8 ± 4.4 | 12.6 ± 5.7 | N/S |
| Volmín OI (ml) | 8.5 ± 3.7 | 11 ± 5.4 | < O.OO1 |
| FEOI (%) | 21.1 ± 9 | 13.87 ± 7.7 | < O.OO1 |
| VFOI (cociente UH)> | 0.72 ± 0.20 | 0.34 ± 0.16 | < O.OO1 |
| Morfología de la OI | N/S | ||
| Coliflor | 20.0% | 33.3% | |
| Manga de viento | 26.7% | 27.8% | |
| Ala de pollo | 16.7% | 16.7% | |
| Cactus | 37% | 22.2% | |
| Trombo (%) | 0% | 42.5% | < O.OO1 |
VIAI: volumen indexado de la aurícula izquierda; Volmáx AI: volumen máximo de la aurícula izquierda; Volmín AI: volumen mínimo de la aurícula izquierda;
FEAI: fracción expulsión de la aurícula izquierda; Volmáx OI: volumen máximo de la orejuela izquierda; Volmín OI: volumen mínimo de la orejuela izquierda;
FEOI: fracción expulsión de la orejuela izquierda; VFOI: velocidad de flujo de la orejuela izquierda.

Figura 2 A: Velocidad de flujo de la orejuela izquierda (OI) en sujetos con fibrilación auricular (FA) en comparación con los controles. B: Velocidad de flujo de la OI en pacientes con FA con y sin trombo. Grupo de FA contra grupo control (p < 0.01; prueba T de Student).
En el análisis del grupo de FA se observó que el VIAI fue mayor en los pacientes que presentaron trombo en la OI en relación con los que no lo tuvieron (82 ± 32.7 vs. 48.3 ± 14.9 ml/m2 respectivamente; p < 0.001). La FEAI fue menor en quienes mostraron trombo en la OI respecto de los individuos sin él (14.1 ± 7.9 vs. 23.6 ± 11.8%; p < 0.001); los mismos resultados se obtuvieron con la FEOI (11.6 ± 6.2 vs. 18.2 ± 9 %; p = 0.002) (Fig. 3).
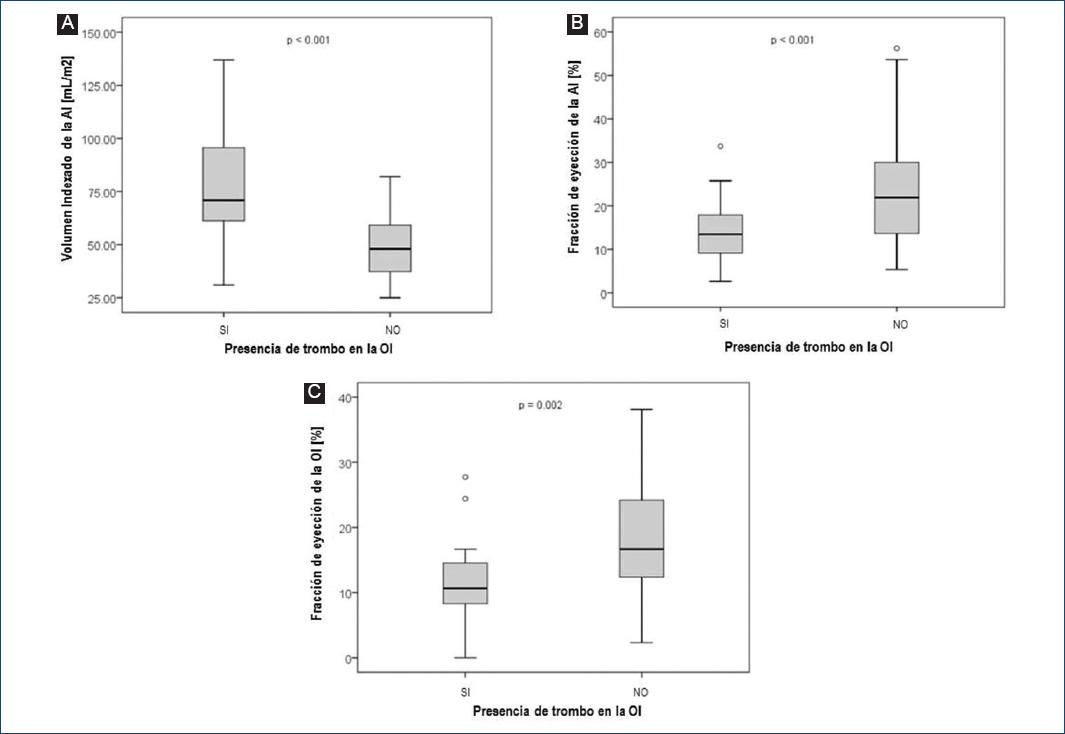
Figura 3 Diferencias entre el volumen indexado de la aurícula izquierda y las fracciones de expulsión de la aurícula y la orejuela izquierda en pacientes con y sin trombo (prueba T de Student).
Se identificaron algunas diferencias importantes en cuanto a la morfología de la OI en el grupo de FA; la morfología de tipo coliflor fue la más común en los pacientes en los que se detectó trombo en la OI (p = <0.01); con posterioridad se comparó la morfología de tipo coliflor con las formas distintas de ésta en los pacientes con trombo en la OI y se observaron 5.9 vs. 7.4% (p < 0.001); OR, 4.7; y IC95%, 1.7 a 12.4, respectivamente. La morfología de tipo manga de viento se vinculó con ausencia de trombo (p < 0.05) (Fig. 4). Se comparó una calificación CHA2DS2-VASc alta respecto de baja a moderada con la presencia de trombo en la OI, con hallazgo de trombo en 16.7 vs. 9.3% (p = 0.056); OR, 2.4; IC95%, 0.93 a 6.2, respectivamente.
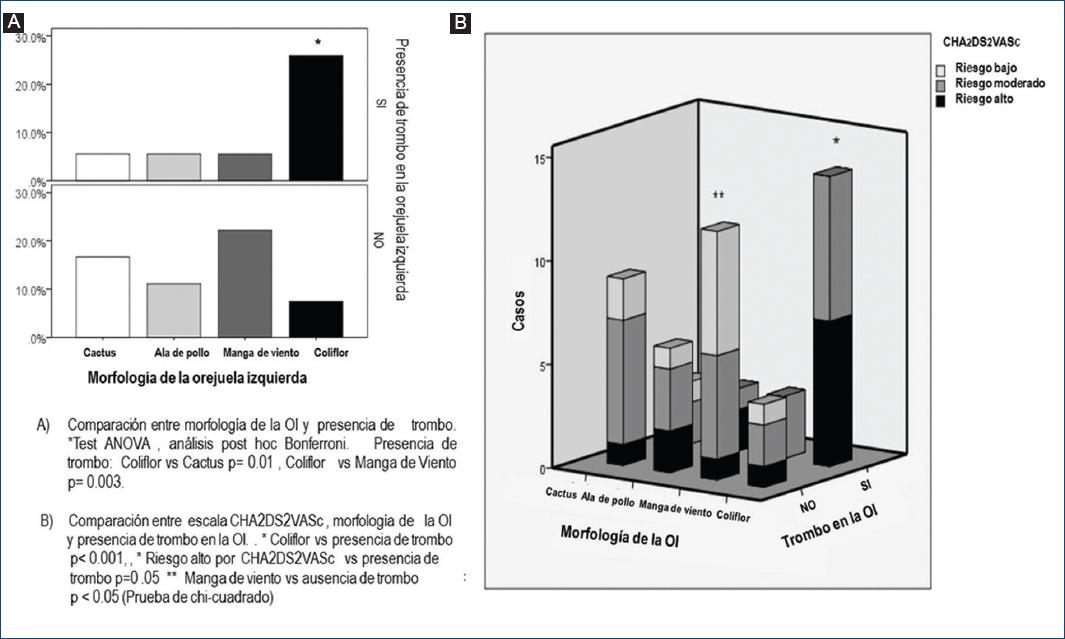
Figura 4 Comparación entre los diferentes tipos de morfología de la orejuela izquierda y la escala CHA2DS2-VASc.
En el grupo de FA, 23 pacientes (42.6%) tenían tratamiento anticoagulante. De estos individuos, 10 (43.5%) presentaron trombo en la OI, mientras que en los no anticoagulados 13 (41.9%) tuvieron trombo en la OI (p < 0.01).
Discusión
En la actualidad, el ETT y el ETE son las modalidades de imagen más utilizadas para la valoración de estratificación del riesgo en pacientes con FA; sin embargo, este último es un método invasivo que supone riesgos potenciales20. El ETE se considera la norma de referencia2 en la identificación de trombos en la FA. La TCMD es un método no invasivo que permite una valoración multiparamétrica en pacientes con FA; no obstante, su papel no está bien definido, ya que existen pocos estudios al respecto y, hasta la fecha, ninguna publicación ha evaluado en forma integral a pacientes con FA mediante TCMD. En esta población de estudio se incluyó a un total de 84 pacientes y la media de edad de los enfermos con FA fue de 67 años contra 55 años en el grupo control. A pesar de que no se tuvo el mismo número de muestra para ambos grupos, este parámetro fue significativo (p < 0.001) y concuerda con las publicaciones médicas en las que la edad promedio de la FA se halla alrededor de la séptima década de la vida. Esto es importante porque existe un incremento de la FA cuanta mayor sea la edad21. Las características basales entre ambos grupos de esta población de estudio (tabaquismo, alcoholismo, hipertensión arterial sistémica y dislipidemia) no mostraron diferencias significativas.
En cuanto al tratamiento de pacientes con FA se identificó que sólo 42.6% (23 pacientes) se encontraba bajo tratamiento anticoagulante, mientras que 53.7% (29 pacientes) consumía antiagregantes plaquetarios. Esto probablemente se debía a que un gran porcentaje de estos pacientes acudió por primera vez a la consulta externa de cardiología en la que se estableció el diagnóstico y se inició tratamiento. La dilatación de la AI es un marcador de episodios cardiovasculares adversos, como ictus, insuficiencia cardíaca o incluso la muerte. Pavón, et al. mencionan que el VIAI debe ser una medida sistemática de valoración de crecimiento auricular por su alta sensibilidad y especificidad. Además, refleja una elevación de la presión de llenado ventricular izquierdo y por tanto es un importante predictor de mal pronóstico en pacientes con FA22. En este estudio, los autores encontraron que el VIAI fue marcadamente mayor en la población de FA respecto del grupo control, a pesar de que los controles también registraron valores alterados de VIAI (40.3 ± 9 ml/m2; p < 0.001). Esto es importante puesto que la FA causa per se crecimiento auricular, lo que favorece un aumento de la presión de llenado y con ello se establece un ciclo de autoperpetuación de la arritmia. En consecuencia, la restauración del ritmo sinusal previene y revierte la dilatación auricular en estos pacientes, al normalizar las presiones de llenado y el gasto cardíaco, lo cual mejora el pronóstico del paciente22. En cuanto a la morfología de la OI, en este estudio no se identificaron diferencias significativas entre ambos grupos, probablemente debido al número pequeño de la muestra. No obstante, se observó que la morfología en coliflor fue la más relacionada con la presencia de trombos en la OI. Se encontró que los tipos en manga de viento y ala de pollo eran los menos vinculados con la presencia de trombos. Estos resultados coinciden con los de Bosi, et al., quienes encontraron que la OI de tipo coliflor tenía una velocidad de flujo menor que el resto de las morfologías y, si bien éste es un estudio en modelos anatómicos, proporciona un análisis importante sobre la fisiopatología de la trombogénesis en la OI14. En los pacientes con FA se reconoció una marcada disminución de la velocidad de flujo de la OI en relación con los controles (p < 0.001). Esto puede explicarse por las diferencias anatómicas de cada orejuela (los ángulos que poseen los lóbulos principales respecto de los ostium, el número de trabeculaciones y el número de lóbulos). La forma en ala de pollo revela un ángulo obtuso que permite una velocidad de flujo mayor (vaciamiento más rápido); algunos estudios han descrito que es la que menos se relaciona con la presencia de trombos. Las orejuelas de tipo coliflor poseen un ángulo agudo respecto del ostium que dificulta su vaciamiento y por ende da lugar a que esta forma se vincule las más de las veces con la formación de trombos23. En cuanto a la fracción de expulsión de la AI y OI en la población general, se ha demostrado una correlación inversa (a mayor edad, menor fracción de expulsión); Handke, et al.24 encontraron resultados similares. En este estudio se observó que la fracción de expulsión fue menor en el grupo de FA en relación con los controles (p < 0.001) y, dentro del grupo de FA, la fracción de expulsión fue menor cuando existían trombos en la OI (p < 0.001); esto puede considerarse un criterio de peor pronóstico en este grupo de pacientes. Otra variable clínica analizada fue la valoración de la escala CHA2DS2-VASc, en la cual se identificó que en la población con FA predominó un valor alto y el tipo que se vinculó con este parámetro fue el de coliflor. Además, en el grupo de FA, 18 pacientes tenían antecedentes de un episodio vascular (EVC o IT). En este subgrupo de pacientes, el tipo de coliflor predominó sobre los demás, lo cual apoya una vez más la teoría de que esta fisonomía de la orejuela es la más trombogénica.
La limitación principal del estudio es la misma que ha enfrentado la mayoría de los autores que han publicado sobre este aspecto, es decir, el tamaño de la muestra. Pese a ello, en esta investigación preliminar los autores registraron resultados significativos. Una de las ventajas para la realización de este estudio fue la integración de un equipo multidisciplinario formado por cardiólogos clínicos, especialistas en imagen cardiovascular y radiólogos.
En la actualidad, el ETE se realiza para descartar la presencia de trombos en la OI antes de procedimientos invasivos de la FA con fines terapéuticos, como es la oclusión de la orejuela izquierda o la ablación de las venas pulmonares; sin embargo, es importante mencionar que este método es invasivo y existe el riesgo de potenciales complicaciones con el procedimiento, además de un mayor costo en comparación con la TCMD20. Ésta es un método no invasivo que se utiliza hoy en día. Algunas desventajas de este método en relación con los otros son los costos, el uso de medio de contraste y la exposición a la radiación. No obstante, la TCMD tiene a su favor una mejor resolución espacial y temporal respecto de otros métodos, lo cual es de importancia en este estudio para la determinación correcta de la morfología de la orejuela. Además, con los nuevos tomógrafos, la dosis de radiación es cada vez menor (3-8 mSv)25.
De este estudio se desprende que los pacientes con FA pueden requerir, junto con una valoración clínica con la escala CHA2DS2-VASc, electrocardiograma, vigilancia Holter y ecocardiograma, además de una TCMD, ya que es posible obtener información como la morfología de la OI, parámetros de función auricular y de la OI, así como la velocidad de flujo, que tienen al parecer un papel importante en la trombogénesis de la OI. Luego de obtener estos parámetros a través de este método es posible seleccionar el tratamiento más conveniente para cada paciente, lo que resulta una aplicación importante y novedosa, y elegir a los enfermos aptos para la oclusión de la orejuela OI.
Este estudio detalla los hallazgos de forma descriptiva respecto de la TCMD y no fue posible determinar la sensibilidad, la especificidad y la tasa de falsos positivos y negativos dado que no se comparó con la norma de referencia actual, esto es, el ETE. Es importante comparar dichos métodos en futuras investigaciones y determinar estos parámetros, ya que las publicaciones son escasas acerca de este tema.
Conclusiones
La TCMD es un método no invasivo que permite una valoración integral, útil y precisa en la reestratificación del riesgo tromboembólico en pacientes con FA y proporciona información relevante para tomar decisiones en el tratamiento y el pronóstico de los pacientes con FA. Este protocolo debe implementarse en el abordaje de estudio de los pacientes con FA.











 nueva página del texto (beta)
nueva página del texto (beta)


