Introducción
El conducto arterioso permeable (CAP) se ha asociado con una morbilidad significativa en los recién nacidos prematuros (RNP), y especialmente en los de muy bajo peso al nacer. En un CAP hemodinámicamente significativo (CAP-hs) existe un cortocircuito importante del circuito sistémico al pulmonar, que resulta en un aumento del flujo sanguíneo pulmonar y una reducción del flujo sanguíneo sistémico. El robo diastólico en la circulación sistémica puede ocasionar un alto riesgo de hemorragia intraventricular, enterocolitis necrosante y anormalidades en la perfusión renal1. El aumento del flujo sanguíneo pulmonar contribuye al empeoramiento del síndrome de dificultad respiratoria y más tarde a la displasia broncopulmonar.
La aparición de los síntomas depende de la magnitud del cortocircuito izquierda-derecha a través del CAP y de la capacidad del RNP para manejar la sobrecarga de volumen. Los hallazgos clínicos, como un soplo continuo y pulsos saltones, no siempre están presentes, en especial en los prematuros con muy bajo peso al nacer y soporte ventilatorio, donde el CAP podría ser «silencioso». A la fecha, las evaluaciones clínicas y radiológicas utilizadas para diagnosticar un CAP-hs tienen limitaciones sustanciales, y el tratamiento temprano del CAP-hs en los RNP ha demostrado que mejora la sintomatología, reduce la duración del soporte ventilatorio, disminuye la necesidad de ligadura quirúrgica y acorta los días de estancia hospitalaria2,3.
Actualmente, la ecocardiografía se considera el método de referencia para el diagnóstico de un CAP-hs y desempeña un papel esencial en la evaluación y el impacto de la circulación del RNP, así como en el diseño de opciones de tratamiento. Existe un claro consenso en cuanto a los criterios ecocardiográficos que deben ser evaluados4.
Los péptidos natriuréticos son sintetizados y liberados dentro de la circulación sanguínea por los cardiomiocitos, con propiedades natriuréticas y vasodilatadoras5. El péptido natriurético cerebral de tipo B (BNP) es sintetizado en los ventrículos del corazón y liberado en respuesta a la sobrecarga de volumen y presión, por lo que desempeña un importante papel en la regulación del volumen de líquido extracelular6. Se ha estudiado como un posible marcador en el diagnóstico y el manejo de una hemodinámica significativa del CAP7. Se ha demostrado que la determinación de los valores de BNP en los primeros días de vida puede ser útil para evaluar el compromiso hemodinámico y contribuir en la toma de decisiones. Sin embargo, los valores de BNP sugeridos en estos estudios se encuentran dentro de un amplio rango, lo que dificulta la definición de un punto de corte absoluto8-10. Existe poca información sobre los valores normativos del BNP en los RNP sin CAP, lo que dificulta determinar si la prematuridad y su comorbilidad, como el síndrome de dificultad respiratoria, el miocardio inmaduro y otras afecciones, tienen efecto sobre las concentraciones séricas de BNP11,12. Los valores de BNP son más altos en los primeros 3 días de vida, con cifras mayores en los RNP que en los recién nacidos de término, pero disminuyen progresivamente y son similares hacia el mes de edad13-15.
El objetivo primario del presente estudio fue evaluar la utilidad del BNP como marcador de sobrecarga hemodinámica del CAP en el RNP con edad gestacional < 32 semanas o peso < 1500 gramos. El objetivo secundario fue identificar el mejor punto de corte para las concentraciones séricas de BNP, que mejor prediga un CAP con repercusión hemodinámica que requiera tratamiento farmacológico o quirúrgico, o ambos.
Método
Pacientes
Estudio retrospectivo, observacional y descriptivo, realizado en la unidad de cuidados intensivos neonatales (UCIN) del Hospital General Tláhuac, Secretaría de Salud de la Ciudad de México, en el periodo comprendido entre julio de 2018 y junio de 2019. Se incluyeron 29 recién nacidos (16 mujeres y 13 hombres) con una edad gestacional < 32 semanas y un peso al nacer < 1500 gramos, dentro de las primeras 24 horas del nacimiento. Se excluyeron los recién nacidos con defectos cardiacos congénitos mayores, anomalías cromosómicas, sepsis confirmada, insuficiencia renal, hipertensión pulmonar persistente y muerte dentro de los 3 días posteriores a su ingreso a la UCIN. El estudio fue aprobado por el comité de investigación institucional y se obtuvo el consentimiento informado de los padres.
Ecocardiograma
A todos los RNP incluidos en el estudio se les efectuó un ecocardiograma transtorácico con Doppler color bidimensional entre el tercer y el quinto días de vida, para evaluación del CAP y descartar una cardiopatía congénita. Se utilizó un ultrasonido Phillips 5500 (Phillips Medical Systems, NA, Bothell, WA) con un transductor de 8 MHz que incorpora flujo color y Doppler de onda continua y pulsada. Si se observó un CAP, el punto de constricción máxima del chorro de flujo de color se midió en milímetros, para evaluar el tamaño del conducto. Un CAP significativo se demostró por ecocardiografía tomando en cuenta la presencia de flujo ductal, con cortocircuito de izquierda a derecha (gradiente transductal < 20 mmHg) y flujo retrógrado en la aorta descendente. Para estimar la magnitud del cortocircuito de izquierda a derecha a través del CAP, los diámetros de la aurícula izquierda y la raíz aórtica se midieron en la vista paraesternal de eje corto a nivel de la válvula aórtica y se calculó la relación Ai/Ao (aurícula izquierda/aorta). Se midieron las dimensiones del ventrículo izquierdo en sístole y en diástole, para calcular la función sistólica por fracción de acortamiento y la fracción de eyección. Se midió el flujo regurgitante tricuspídeo para calcular la presión arterial pulmonar sistólica y se utilizó una vista sagital subcostal para obtener imágenes de la arteria mesentérica superior. La evaluación del CAP se realizó tomando en cuenta las recomendaciones del Neonatologist Performed Echocardiography (NPE) y la American Society of Echocardiography4,16,17.
Se diagnosticó CAP-hs si el RNP cumplió los criterios ecocardiográficos y tenía al menos tres de los siguientes seis signos clínicos de disfunción cardiovascular: 1) soplo sistólico o continuo en el borde paraesternal izquierdo; 2) hiperactividad precordial; 3) pulsos periféricos saltones; 4) taquicardia en reposo; 5) deterioro inexplicable del estado respiratorio; y 6) aumento del flujo pulmonar y cardiomegalia o signos de edema pulmonar en la radiografía de tórax. Los criterios ecocardiográficos fueron4,16: 1) diámetro del CAP > 1.5 mm; 2) relación Ai/Ao > 1.4; 3) turbulencia diastólica (cortocircuito de izquierda a derecha) en el Doppler de la arteria pulmonar; 4) relación diámetro del CAP/peso > 1.4 mm/kg; 5) flujo retrógrado > 30% de la diástole en la aorta descendente; y 6) velocidad del Doppler transductal < 2 m/s. Las mediciones las realizó un único observador, cardiólogo pediatra ecocardiografista con 20 años de experiencia en esta técnica. La concordancia intraobservador evaluada mediante el índice Kappa en el presente estudio fue del 100% en una submuestra de 15 estudios. Los prematuros con CAP-hs fueron tratados con paracetamol, ibuprofeno o cirugía, dependiendo de su estado clínico (grupo con intervención). Se realizó un segundo ecocardiograma transcurridas 72 horas para determinar si hubo cambios asociados al tratamiento.
Medición de la concentración plasmática del BNP
Se tomaron muestras de sangre (0.5 ml) para BNP en plasma mediante aspiración con catéter arterial o venoso, o mediante muestreo de sangre venosa junto con otras muestras de sangre habituales para evitar punciones adicionales y un muestreo de sangre excesivo. La sangre se recogió coincidiendo en el tiempo con el ecocardiograma transtorácico. Las muestras se analizaron con el kit diagnóstico BNP (Alere Triage® BNP assay; Werfen Co, IL, USA) y los resultados se expresaron en pg/ml.
En los pacientes con sospecha de CAP se realizó interconsulta al servicio de cardiología pediátrica para corroborar el diagnóstico y el operador del estudio ecocardiográfico reportó los resultados, emitiendo recomendaciones terapéuticas. Los datos que incluyeron cambios en el peso corporal, el estado cardiorrespiratorio y la ingesta y salida de líquidos se recabaron cada tercer día, y los datos sobre la duración de la estadía y la prevalencia de enterocolitis necrosante, displasia broncopulmonar, hemorragia intraventricular y mortalidad se recabaron de los expedientes clínicos y de la base de datos de la UCIN.
Análisis estadístico
El análisis descriptivo se realizó utilizando el paquete estadístico SPSS (Statistics for Windows, versión 20.0), con cálculos de medidas de tendencia central (media, mediana) y dispersión (desviación estándar, rangos intercuartílicos [RIQ]) para las variables cuantitativas de acuerdo con el tipo de distribución, y frecuencias y porcentajes para las variables cualitativas. La distribución de los datos se evaluó mediante su visualización con relación al histograma, así como de acuerdo con los valores de asimetría, curtosis y la prueba de Shapiro-Wilk, considerando valores de p < 0.05 como una distribución no paramétrica. Utilizamos la prueba exacta de Fisher para comparar variables categóricas, y la prueba U de Mann-Whitney para comparar variables continuas. Para la comparación de los subgrupos se utilizó la prueba U de Mann-Whitney. Se consideró un valor p < 0.05 para establecer la significancia estadística. Se utilizo la prueba de Spearman (rs) para correlacionar los valores de BNP y los hallazgos ecocardiográficos. Finalmente, se identificó mediante curvas ROC (receiver operating characteristic) el mejor punto de corte de los valores de BNP asociados con CAP-hs. Se determinaron el área bajo la curva (AUC), la sensibilidad y la especificidad para el mejor punto del corte.
Resultados
Durante el periodo de estudio se obtuvo una muestra de 29 RNP, con unas medianas de edad gestacional de 29.0 semanas (RIQ: 3.9) y de peso al nacer de 1080 gramos (RIQ: 350). Los datos demográficos y las características clínicas de los pacientes se exponen en la tabla 1, y el algoritmo de actuación diagnóstico-terapéutica se muestra en la figura 1.
Tabla 1 Datos demográficos y parámetros clínicos de los recién nacidos prematuros y comparación de variables entre los subgrupos
| Parámetro | Grupo total (n = 29) | Subgrupo CAP - hs (n = 16) | Subgrupo CAP - nhs (n =13) | p |
|---|---|---|---|---|
| Edad gestacional (sem)* | 29.0 (3.9) | 27.6 (5.3) | 29.0 (2.5) | 0.46 |
| Peso al nacer (g)* | 1080 (350) | 990 (403) | 1210 (313) | 0.27 |
| Sexo femenino† | 17 (58.6) | 9 (56.3) | 8 (61.5) | 0.77 |
| Uso de esteroide antenatal† | 15 (51.7) | 7 (43.8) | 8 (61.5) | 0.34 |
| Operación cesárea† | 24 (82.7) | 4 (25) | 1 (7.7) | 0.61 |
| Apgar 5 minutos* | 8 (1.0) | 8 (1.0) | 9 (1.0) | 0.002 |
| PA sistólica (mmHg)‡ £ | 54 ± 9 | 53 ± 7 | 55 ± 9 | 0.32 |
| PA diastólica (mmHg)‡ | 33 ± 8 | 28 ± 6 | 35 ± 8 | 0.001 |
| Robo diastólico en AoD < 30%† | 18 (62.1) | 14 (87.5) | 4 (30.8) | 0.002 |
| Aporte de líquidos (ml/kg/día)‡ | 147 ± 31 | 159 ± 36 | 142 ± 29 | 0.07 |
| Diámetro del CAP (mm) | 2.1 (1.58)* 2.2 ± 0.9‡ | 2.8 (0.95)* 2.84 ± 0.69‡ | 1.3 (0.68)* 1.42 ± 0.41‡ | 0.0001 |
| Relación CAP/peso (kg) | 1.6 (1.93)* 1.99 ± 1.14‡ | 2.81 (1.97)* 2.69 ± 1.1‡ | 1.02 (0.51)* 1.13 ± 0.29‡ | 0.0001 |
| Valor sérico de BNP (pg/ml) | 473 (661.5)* 684 ± 890.1£ | 751 (817)* 1061.9 ± 105.7£ | 121.0 (284.2)* 219.9 ± 227.8£ | 0.0001 |
AoD: aorta descendente; BNP: péptido natriurético cerebral tipo B; CAP: conducto arterioso permeable; CAP-hs: CAP hemodinámicamente significativo; CAP-nhs: CAP no hemodinámicamente significativo; PA: presión arterial.
*Mediana (rango intercuartílico).
†Número (%).
‡Media (± desviación estándar).
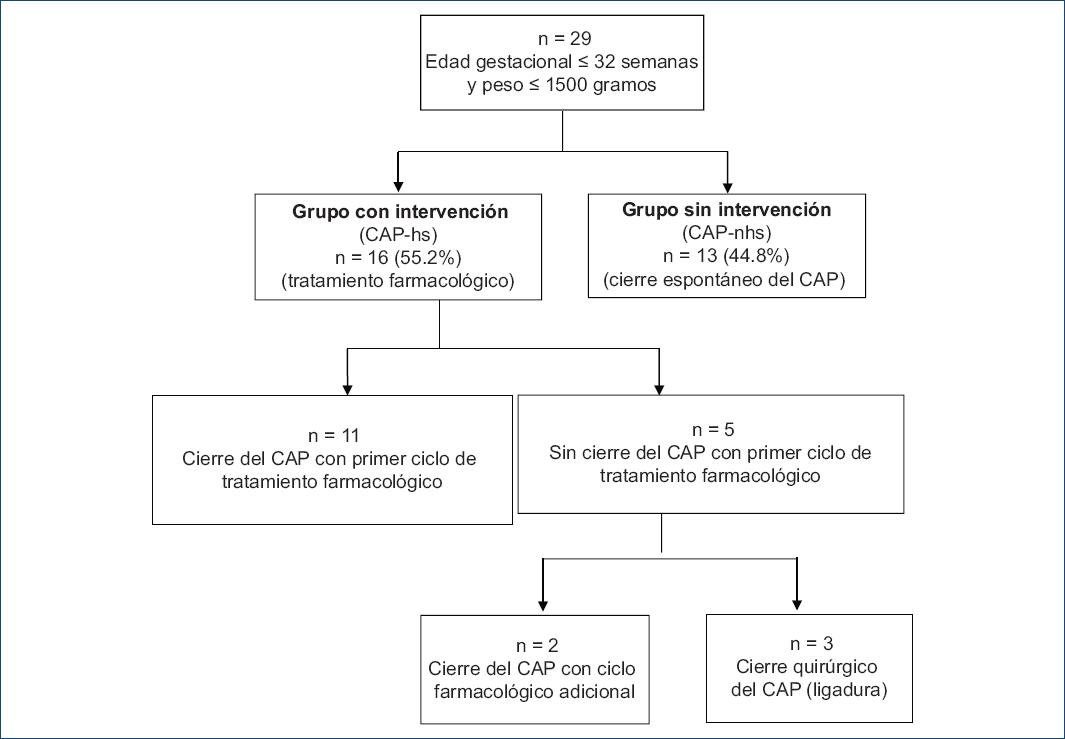
Figura 1 Diagrama de flujo de los pacientes incluidos en el estudio. CAP: conducto arterioso permeable; CAP-hs: CAP hemodinámicamente significativo; CAP-nhs: CAP no hemodinámicamente significativo.
Los pacientes se dividieron en dos subgrupos: el primero correspondiente a 16 pacientes con CAP-hs (mediana de edad gestacional: 27.6 semanas; mediana de peso: 990 g) y el segundo con 13 pacientes con CAP no hemodinámicamente significativo (CAP-nhs) (mediana de edad gestacional: 29.0 semanas; mediana de peso: 1210 g). No hubo diferencias significativas entre los subgrupos en cuanto a los datos relativos a edad gestacional, peso al nacimiento, sexo, uso de esteroide antenatal, líquidos administrados, presión sistólica sistémica ni tipo de parto.
La mediana del valor del BNP para el grupo total (n = 29) fue de 473 pg/ml (RIQ: 661.5) y la concentración del BNP en el subgrupo con CAP-hs fue significativamente más alta que en el subgrupo con CAP-nhs (mediana de 751 vs. 121 pg/ml; p = 0.0001). Además, se observó significancia estadística en las variables de Apgar a los 5 minutos, presión arterial diastólica, robo diastólico en la aorta descendente, diámetro del CAP y relación CAP/peso en kilogramos. Como ya se ha mencionado, los casos con hipertensión pulmonar, sepsis o enfermedad cardiaca congénita fueron excluidos debido al posible incremento del valor del BNP no relacionado con CAP-hs.
El 71.7% de los pacientes mostró CAP en la primera evaluación ecocardiográfica, con una correlación significativa entre los hallazgos ecocardiográficos y el valor basal del BNP (Tabla 2). Se observó una correlación positiva entre la relación CAP/peso y valor del BNP (rs= 0.71; intervalo de confianza del 95% [IC95%]: 0.45-0.87; p < 0.001) (Fig. 2). El mejor punto de corte del BNP para predecir CAP-hs fue de 486.5 pg/ml, con una sensibilidad del 81%, una especificidad del 92% y un AUC de 0.93 (IC95%: 0.84-1.0; p < 0.001) (Fig. 3).
Tabla 2 Correlación entre los valores séricos de péptido natriurético cerebral tipo B y variables ecocardiográficas
| Parámetros ecocardiográficos | Correlación con valores iniciales de BNP (pg/ml) rs (IC95%) | p |
|---|---|---|
| Relación Ai/Ao | 0.64 (0.38-0.81) | < 0.001 |
| Diámetro del CAP | 0.66 (0.23-0.91) | 0.007 |
| Diámetro AoD | 0.03 (-0.47-0.56) | 0.91 |
| Relación CAP/AoD | 0.84 (0.49-0.96) | < 0.001 |
| Relación CAP/peso en kg | 0.71 (0.45-0.87) | < 0.001 |
| Gradiente del CAP | 0.11 (-0.56-0.73) | 0.69 |
| Relación flujo TSVI/flujo AMS | 0.45 (-0.08-0.80) | 0.09 |
| Relación flujo VM/VT | 0.11 (-0.40-0.68) | 0.69 |
| Robo diastólico en AoD > 30% | 0.35 (-0.25-0.83) | 0.20 |
| PSP × IIT | 0.61 (0.06-0.87) | 0.01 |
Ai/Ao: aurícula izquierda/aorta; AMS: arteria mesentérica superior; AoD: aorta descendente; BNP: péptido natriurético cerebral tipo B; CAP: conducto arterioso permeable; IC95%: intervalo de confianza del 95%; PSP × IIT: presión sistólica pulmonar por índice de insuficiencia tricuspídea; rs: prueba de Spearman;
TSVI: tracto de salida del ventrículo izquierdo; VM: válvula mitral; VT: válvula tricúspide.
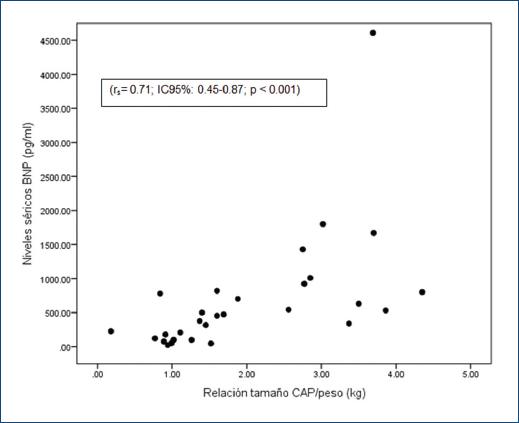
Figura 2 Correlación positiva entre la relación CAP/peso y el valor del péptido natriurético cerebral tipo B. BNP: péptido natriurético cerebral tipo B; CAP: conducto arterioso permeable; IC95%: intervalo de confianza del 95% rs: prueba de Spearman.
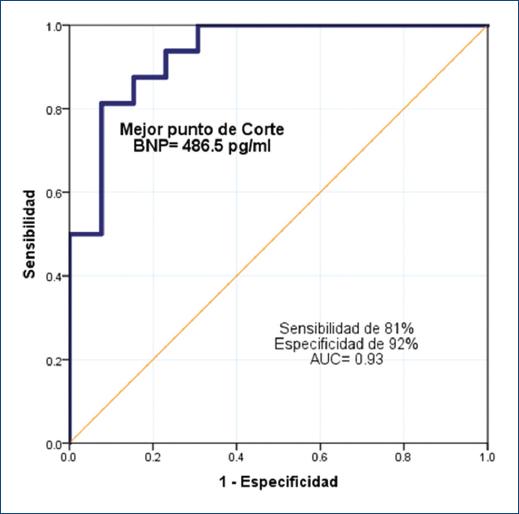
Figura 3 Curva ROC del valor del péptido natriurético cerebral tipo B sérico en recién nacidos prematuros con conducto arterioso hemodinámicamente significativo (CAP-hs). Se calculó un punto de corte de 486.5 g/ml para detectar un CAP-hs, basados en la curva ROC. BNP: péptido natriurético cerebral tipo B; AUC: área bajo la curva.
Los pacientes del subgrupo con CAP-hs (n = 16) recibieron intervención (cierre farmacológico o cirugía): 10 con ibuprofeno (62.5%), 6 con paracetamol (37.5%) y finalmente 3 pacientes requirieron una ligadura quirúrgica debido a falla del tratamiento farmacológico. El cierre farmacológico del CAP se logró con un primer ciclo en 11 pacientes (68.7%), mientras que en 2 pacientes el cierre se logró con un segundo ciclo (Fig. 1). En los pacientes con CAP-hs (n = 16) se observó una caída importante entre la mediana de los valores de BNP basales y finales (751.50; RIQ: 817 vs. 211.5; RIQ: 268 pg/ml, respectivamente; p = 0.01), con un porcentaje de descenso del 69.5 ± 18.3%. En los pacientes que requirieron intervención quirúrgica, la mediana del valor inicial del BNP fue casi tres veces mayor (1800; RIQ: 2940 pg/ml) en comparación con aquellos que solo requirieron tratamiento farmacológico (630; RIQ: 394.5 pg/ml).
Los pacientes del subgrupo con CAP-nhs (sin intervención) mostraron una caída similar y progresiva en las medianas de los valores del BNP basales y finales (630; RIQ: 394.5 vs. 172.0; RIQ: 224 pg/ml, respectivamente; p = 0.002), con un porcentaje de descenso del 69.5 ± 19.1%. Se corroboró el cierre espontáneo del CAP por ecocardiografía, con una media de edad de 2.1 semanas.
Discusión
A pesar de la alta prevalencia del CAP, en un 60-70% de los RNP, y en especial en los de muy bajo peso al nacer, no hay métodos universalmente aceptados para diagnosticar un CAP-hs, lo que aumenta el riesgo de desarrollar patologías propias de esta población y ser una causa importante de morbimortalidad3. Una de las principales razones de esta situación es la naturaleza dinámica del tejido ductal y su variada sensibilidad a sustancias vasoconstrictoras y vasodilatadoras en el RNP. Así mismo, los factores que alteran la resistencia vascular pulmonar y sistémica pueden influir en el grado de cortocircuito ductal, independientemente de su tamaño15,18. Las estrategias para conseguir su cierre son aún motivo de debate y continúa la controversia sobre los criterios de tratamiento y el momento idóneo de realizarlo19-21.
El RNP con CAP-hs puede no desarrollar signos clínicos y, si los desarrolla, suele ser a partir del tercer día de vida, cuando mejora la enfermedad pulmonar1-3,6. Debido al retraso en la aparición de los síntomas clínicos, diversos autores han propuesto el tamizaje sistemático mediante ecocardiografía a las 48-72 horas de vida, tomando en cuenta que el estudio ecocardiográfico deberá incluir la evaluación de las características del CAP, los índices de sobrecirculación pulmonar en condiciones de carga del ventrículo izquierdo y los índices de hipoperfusión sistémica4. Hoy en día, la ecocardiografía es el principal método utilizado para detectar el CAP-hs en los RNP4,16,17. En el presente trabajo, el 71.7% de los pacientes presentaron CAP en el primer ecocardiograma, cifra superior a lo reportado22.
Algunos estudios han evaluado el uso potencial de los péptidos natriuréticos (marcadores cardiacos) en la medicina pediátrica y neonatal5. Aunque el BNP no reemplaza al ecocardiograma en el diagnóstico del CAP, puede obviar la necesidad de realizar ecocardiogramas repetidos para confirmar el cierre ductal postratamiento9,23. Los valores del BNP en los RNP son más altos que en los nacidos a término en los primeros días tras el nacimiento9-12. Su medición es un método que proporciona información inmediata y valiosa para el diagnóstico y el manejo del CAP en los RNP, porque sus valores son más altos en presencia de un CAP significativo13,15.
Diversos autores refieren que el BNP podría ser un parámetro fiable para predecir la ausencia o la presencia de CAP9-12; en nuestra muestra se encontró una fuerte asociación entre los valores del BNP y la presencia de CAP. En este trabajo, el 55.2% de los pacientes evidenció un CAP-hs con cifras superiores de BNP a las encontradas en aquellos con CAP-nhs dentro de los 3-5 días de vida23-25. Los RNP sin CAP o con CAP-nhs muestran variaciones considerables en la concentración sanguínea de BNP, con un pico máximo a las 24-48 horas de vida y una posterior caída hacía el quinto día de vida13-15. Cuando el CAP está presente en los RNP, la concentración de BNP es más alta y refleja la magnitud del cortocircuito a través del CAP, y puede considerarse que el BNP es capaz de diferenciar a aquellos con afectación hemodinámica10-12,25. No obstante, una de las limitaciones del presente trabajo fue que solo se evaluaron los valores del BNP y no los del NT-proBNP (propéptido natriurético cerebral amino-terminal), del cual se sabe que tiene unas mayores sensibilidad y especificidad (88 y 92% vs. 90 y 84%, respectivamente)8. Sin embargo, a la luz de los hallazgos del presente trabajo se puede evidenciar la posibilidad de que las asociaciones identificadas sean aún más fuertes si se evalúan mediante el marcador NT-proBNP en RNP24.
Se pudo elaborar una curva ROC para calcular el punto de corte del BNP y predecir un CAP-hs. El mejor valor de corte del BNP fue de 486.5 pg/ml, con una sensibilidad del 81%, una especificidad del 92% y un AUC de 0.93 (IC95%: 0.84-1.0; p < 0.001). Flynn, et al.9 mostraron que el mejor valor de corte del BNP fue de 300 pg/ml. Una revisión sistemática para evaluar la seguridad diagnóstica del BNP en el CAP-hs menciona la amplia variedad de características de los pacientes y de los ensayos, con diversos valores de corte predictivos de diagnóstico y tratamiento8.
En consonancia con otras series6,22-25, observamos que el porcentaje de disminución de los valores de BNP se correlacionan bien con el cierre farmacológico del CAP, prediciéndolo con fiabilidad si esta caída es significativa. Así mismo, constatamos que cifras muy altas e iniciales de BNP se relacionan con una mayor incidencia de ligadura del conducto, aunque la utilidad clínica para predecir el tratamiento quirúrgico se ve limitada26-28.
Conclusiones
Las concentraciones séricas del BNP se relacionaron con la sobrecarga hemodinámica producida por el CAP en los RNP. Se pudo identificar un punto de corte óptimo del BNP con buena sensibilidad y especificidad para predecir CAP-hs.
La presencia de elevación del BNP apoyó los datos ecocardiográficos y la necesidad de tratamiento médico o quirúrgico, y su disminución informó de la buena sensibilidad que los valores de BNP muestran tras el cierre del CAP. Aunque la ecocardiografía seguirá siendo el método principal de diagnóstico, nuestros hallazgos permiten proponer al BNP como una herramienta adicional a esta en el diagnóstico y el seguimiento evolutivo del CAP.











 text new page (beta)
text new page (beta)


