Introducción
Aunque la relación entre presión arterial (PA) y eventos vasculares es positiva y lineal desde valores relativamente bajos, establecer un claro punto de corte para el diagnóstico y seguimiento de la hipertensión arterial (HTA) tiene sus ventajas, tanto para los médicos como para los pacientes1. Por estas razones, desde finales de la década de 1970 han surgido los primeros consensos para el manejo de esta entidad2,3. La IV Declaración Conjunta del Comité Nacional para la detección, evaluación y tratamiento de la HTA (conocidacomo JNC IV por sus siglas en inglés) del año 1988 establecía como puntos de corte para diagnóstico y tratamiento de HTA cifras ≥ 160/90 mmHg de presión arterial sistólica (PAS) y diastólica (PAD), respectivamente4. En el año 1993 se publicó la JNC V la cual modificó estos valores por cifras ≥ 140/90 mmHg5, las cuales perduraron sin cuestionamientos hasta años recientes. En noviembre de 2017 se publicó la última guía para el diagnóstico y tratamiento de la HTA elaborada por múltiples sociedades científicas de diferentes especialidades de EE.UU.6, la cual estableció un nuevo punto de corte para el diagnóstico de HTA, fijándose dicho valor en 130/80 mmHg. El elemento de mayor peso para impulsar la modificación de las metas fue el ensayo clínico conocido con el acrónimo SPRINT (Systolic Blood Pressure Intervention Trial)7. Este estudio recibió numerosos cuestionamientos prácticos8 y metodológicos9-11, al tiempo que se ha criticado la técnica empleada para la toma de PA12-15. La discusión respecto a las nuevas metas en HTA llevó a que se multipliquen los metaanálisis intentando responder este interrogante16-18. Sin embargo, en lugar de saldar el conflicto, las nuevas publicaciones han contribuido a perpetuarlo, ya que los diferentes análisis han mostrado resultados opuestos. Esto se explica fundamentalmente por la heterogeneidad de los criterios de inclusión empleados a la hora de seleccionar los estudios a metaanalizar. Por otra parte, la mayoría de estas publicaciones se han centrado en los beneficios del tratamiento intensivo de la HTA, pero sin ponderar los riesgos que esta intervención supone. Por ello, en el marco del desarrollo de la Guía Nacional de Práctica Clínica para el diagnóstico y tratamiento de la HTA del Ministerio de Salud de la Nación Argentina resolvimos realizar un metaanálisis a fin de ponderar los umbrales terapéuticos más adecuados para el tratamiento de personas con HTA.
Materiales y métodos
Criterios de inclusión
Se incluyeron ensayos clínicos aleatorizados (ECA) que se hayan propuesto como objetivo primario comparar metas intensivas y habituales de PA, con al menos 1,000 participantes por grupo, y con seguimiento igual o superior a 12 meses.
Se definieron como metas intensivas de PA valores iguales o menores a 130/80 mmHg y metas habituales valores similares o menores a 140/90 mmHg. Se excluyeron estudios con un diseño no aleatorizado, e informes repetidos de un mismo ECA, si estos no agregaban información a la brindada por la comunicación original del estudio. Asimismo se excluyeron aquellos ECA en los cuales la rama control presentó promedios de cifras tensionales mayores a 145/95 mmHg. Para la comunicación de la metodología19 y los resultados se siguieron las recomendaciones PRISMA20.
Búsqueda bibliográfica
Se realizó una búsqueda de ECA, sin restricciones temporales y utilizando los idiomas inglés, portugués y español. Dicho proceso fue realizada en simultáneo por dos operadores experimentados (S.G.Z. y A.R.), quienes seleccionaron los estudios a incluir. Las diferencias fueron resueltas por consenso. Se emplearon como motores de búsqueda Medline, LILACS, Google académico y la base de datos de la colaboración Cochrane.
Puntos finales evaluados
De los estudios seleccionados se recabó la ocurrencia de mortalidad total, mortalidad cardiovascular y eventos cardiovasculares: síndromes coronarios agudos (agrupando infarto agudo de miocardio [IAM] con y sin elevación del segmento ST y angina inestable), accidentes cerebrovasculares(ACV) isquémicos y hemorrágicos, y accidente isquémico transitorio. Como efectos adversos se valoraron: caídas, síncope, hipotensión arterial, insuficiencia renal aguda y los efectos adversos «serios», entendidos como tal todos aquellos eventos que ocasionaron una consulta a sala de emergencias o guardia, o que requirieron la internación de los participantes, independientemente de que los ECA hayan utilizado otra definición operativa para estos eventos. Para la identificación de estos puntos finales se utilizaron las definiciones previstas por los investigadores de cada ensayo.
Evaluación del riesgo de sesgo
Se llevó adelante una evaluación del riesgo de sesgo de los estudios incluidos, de acuerdo con las recomendaciones del Manual Cochrane21,22. Los dominios evaluados fueron: generación de secuencia aleatoria, asignación oculta, cegamiento del personal y los participantes, cegamiento de los evaluadores, evaluación incompleta de datos de resultado, reporte selectivo y un último dominio para otros sesgos potenciales. El riesgo de sesgo fue valorado de forma categórica en: bajo riesgo, riesgo incierto y alto riesgo siguiendo las recomendaciones para tal fin21-23.
Registro
El presente metaanálisis fue registrado en PROSPERO con el número de identificación: CRD42020149134.
Análisis estadístico
Por tratarse de ensayos clínicos se empleó como medida sumaria riesgos relativos (RR) y sus respectivos intervalos de confianza (IC). Para metaanalizar los datos, y debido a las diferencias de los estudios seleccionados, se optó por un modelo de efectos aleatorios, como describieron Dersimonian y Laird24. Se evaluó la heterogeneidad de estos mediante el cálculo de la varianza entre los estudios (tau cuadrada) y el índice I cuadrado (I2)25. El análisis de datos fue realizado empleando Review Manager 5.3.
Resultados
Se identificaron 530 artículos potencialmente relevantes, de los cuales se excluyeron 246 por encontrarse duplicados, cinco por no ser ECA y 275 por no cumplir los criterios de inclusión. Finalmente se analizaron cuatro ensayos clínicos (Fig. supl. 1): SPRINT7, ACCORD (Action to Control Cardiovascular Risk in Diabetes)26, HOPE-3 (Heart Outcomes Prevention Evaluation-3)27 y SPS3 (Secondary Prevention of Small Subcortical Strokes)28, con un total de 29.820 participantes. La edad media de los participantes de los estudios fue 65 ±7.9 años; el 42.2% eran mujeres y el 22% eran diabéticos. El resto de las características de los ECA incluidos se resumen en la tabla 1. Algunas características adicionales relevantes de los ensayos clínicos individuales incluidos en la revisión se encuentran puntualizadas en la tabla 2. Se procedió a valorar la calidad de la evidencia de los estudios de acuerdo con los lineamientos antes mencionados (Fig. supl. 2). En el anexo I se detallan los motivos por los cuales se consideró que algún dominio de cada ensayo poseía un riesgo de sesgo incierto o alto.
Tabla 1 Características de los estudios incluidos
| Características | ACCORD ACCORD Study Group, 201026 | SPS3 SPS3 Study Group, 201328 | SPRINT SPRINT Research Group, 20157 | HOPE-3 Lonn, et al., 201627 |
|---|---|---|---|---|
| Año de publicación | 2010 | 2013 | 2015 | 2016 |
| Participantes (n) | 4,733 | 3,020 | 9,361 | 12,705 |
| Edad (DE) | 62.2 ± 6.9 | 63 ± 10.8 | 67.9 ± 9.5 | 65.8 ± 6.4 |
| PA ingreso (mmHg) | 139/76 | 143/79 | 140/78 | 138/82 |
| Mujeres (%) | 2,258 (47.7) | 1,118 (37) | 3,332 (35.6) | 5,874 (46.2) |
| Diabéticos (%) | 4,733 (100) | 1,106 (36.6) | 0 (0) | 731 (5.8) |
| Índice de masa corporal (kg/m2) | 32.1 ± 5.6 | 29.2 ± 6.8 | 29.9 ± 5.8 | 27.1 ± 4.8 |
| Enfermedad coronaria (%) | 33.7%* | 11% | 20.1% | 0% |
| Enfermedad cerebrovascular (%) | 100% | 0% | 0% | |
| Metas de PA en el estudio | PAS < 120 | PAS < 130 | PAS < 120 | Dosis fija de fármaco |
| Diferencia de PA al final del seguimiento (mmHg) | 14.2/6.1 | 11/-† | 14.8/7.6 | 6/3 |
| Seguimiento promedio (años) | 4.7 | 3.7 | 3.26‡ | 5.6 |
| Tipo de estudio | Abierto | Abierto | Abierto | Doble ciego |
| Riesgo cardiovascular estimado de los pacientes incluidos | Alto | Alto | Alto | Intermedio |
*No se encuentra discriminado enfermedad coronaria y cerebrovascular.
†No se encuentra informado el valor de PAD.
‡Detenido prematuramente por beneficio. PA: presión arterial; DE: desviación estándar; PAS: presión arterial sistólica; ACCORD: Action to Control Cardiovascular Risk in Diabetes; SPS3: Secondary Prevention of Small Subcortical Strokes; SPRINT: Systolic Blood Pressure Intervention Trial; HOPE-3: Heart Outcomes Prevention Evaluation-3.
Tabla 2 Características adicionales de los estudios incluidos
| Estudio | Detalles |
|---|---|
| ACCORD ACCORD Study Group, 201026 |
- Hemoglobina glucosilada promedio de los participantes: 8.3 ± 1.1% (sin diferencias entre grupos) |
| SPS3 SPS3 Study Group, 201328 |
- El 98.6% de los participantes fueron enrolados por un accidente cerebrovascular isquémico y el 1.4% por un accidente isquémico transitorio |
| SPRINT SPRINT Research Group, 20157 |
- Detenido prematuramente por beneficio |
| - Se empleó una estrategia no habitual de toma de PA | |
| - En la rama control al 87% de los participantes se les redujo el tratamiento antihipertensivo que realizaban, encontrándose los participantes asintomáticos | |
| - Existió significativamente mayor proporción de uso de diuréticos en la rama intensiva | |
| HOPE-3 Lonn, et al., 201627 |
- Dosis fija de candesartán 16 mg + hidroclorotiazida 12.5 mg |
| - Un análisis de subgrupos preespecificado encontró beneficios con la reducción de PA entre los participantes con mayores valores de PA (tercio superior de la muestra) |
PA: presión arterial; ACCORD: Action to Control Cardiovascular Risk in Diabetes; SPS3: Secondary Prevention of Small Subcortical Strokes; SPRINT: Systolic Blood Pressure Intervention Trial; HOPE-3: Heart Outcomes Prevention Evaluation-3.
La figura suplementaria 3 esquematiza la calidad global de la evidencia; se observa que el dominio con mayor riesgo de sesgo es «Cegamiento del personal y los participantes», ya que tres de los cuatro ensayos fueron abiertos.
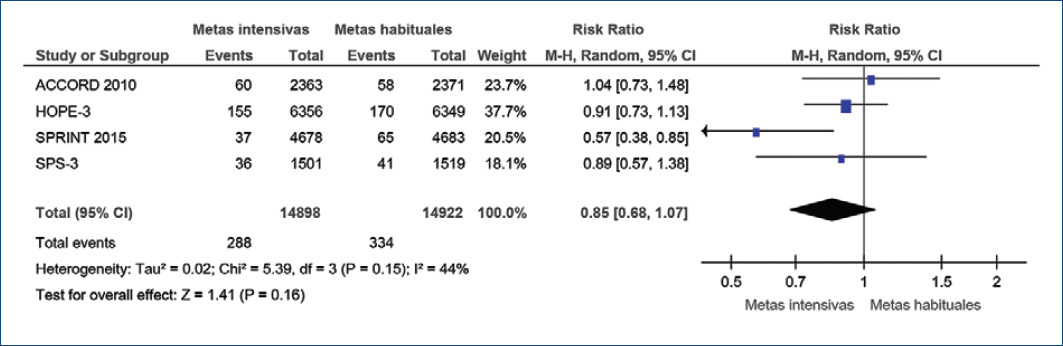
Analizados globalmente los cuatro estudios (SPRINT, HOPE-3, ACCORD y SPS3) mostraron una tendencia no significativa hacia una reducción de la mortalidad cardiovascular con el empleo de metas intensivas de PA (RR: 0.89; IC95%: 0.68-1.07; p=0.16), con moderada heterogeneidad (I2: 44%) (Fig. 1).
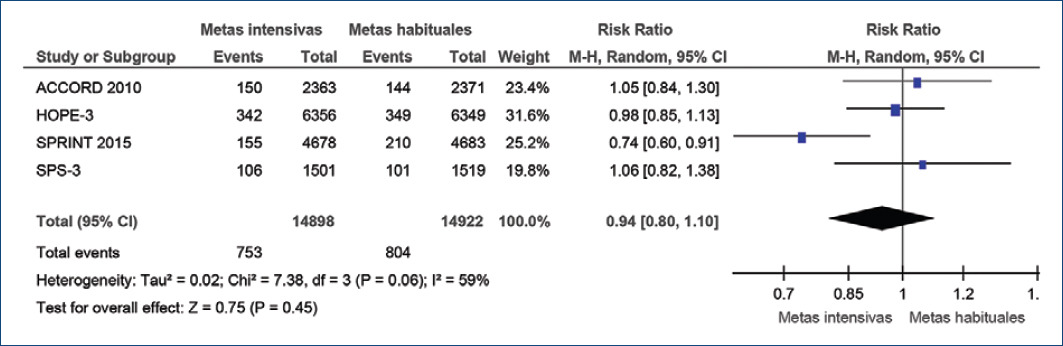
Las metas intensivas tampoco redujeron la mortalidad total (RR: 0.94; IC95%: 0.8-1.1; p=0.45) (Fig. 2).
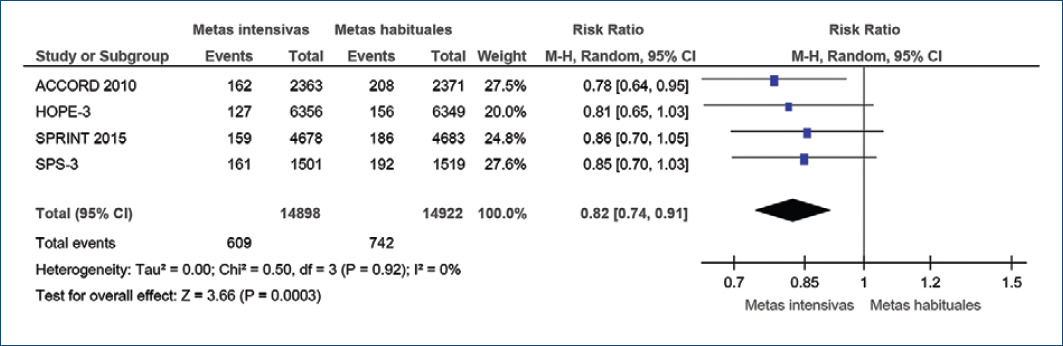
Al analizar los eventos cardiovasculares en su conjunto, las metas intensivas los redujeron de forma significativa (RR: 0.82; IC95%: 0.70-0.91; p=0.0003), sin evidencia de heterogeneidad (I2: 0%) (Fig. 3).
A fin de valorar adecuadamente la relación riesgo-beneficio de las diferentes metas de control de PA se analizaron los efectos adversos ocurridos en las diferentes ramas de tratamiento. Un estudio (HOPE-3) no reportó la necesidad de atenciones no programadas por parte de los participantes del ensayo debido al empleo de tratamiento farmacológico, y por tanto no pudo ser incluido para tal fin. En los restantes tres estudios los eventos adversos serios fueron más frecuentes en la rama intensiva, siendo esto más notorio en aquellos ECA que fijaron metas más bajas de PA (ACCORD y SPRINT). Globalmente las metas intensivas se asociaron a un riesgo incrementado de eventos adversos serios (RR: 1.98; IC95%: 1.59-2.46; p<0.0001; I2: 14%) (Fig. 4).
Debido a que la insuficiencia renal constituye una preocupación mayor a la hora de fijar metas más exigentes de control de PA, se analizó esto como desenlace independiente. Se observó una tendencia no significativa hacia un mayor riesgo en los episodios de deterioro de la función renal con las metas intensivas (p=0.08), pero con marcada heterogeneidad entre los ensayos analizados (Fig. 5).
Debe remarcarse que la heterogeneidad respecto al riesgo de deterioro de la función renal no fue solamente estadística, sino que existieron marcadas diferencias en las definiciones clínicas. Así, mientras que en el ACCORD esto fue categorizado como valores de creatinina mayores a 3.3 mg/dl o necesidad de diálisis, en el SPRINT fue definido como la codificación dentro de los tres primeros diagnósticos al egreso hospitalario.
Por último se comparó la ocurrencia de síncopes y caídas atribuibles al tratamiento farmacológico, observando un incremento del riesgo en el grupo de metas intensivas (RR: 2.39; IC95%: 1.56-3.67; p<0.0001), con baja heterogeneidad (I2: 28%) (Fig. 6).
Similar a lo observado en el análisis de los efectos adversos graves, puede apreciarse cómo los estudios con metas más bajas de PA (ACCORD y SPRINT vs. HOPE-3 y SPS3) aportaron la mayor cantidad de eventos para este desenlace.
A fin de valorar el impacto de los pacientes diabéticos en estos resultados se llevó a cabo un análisis de sensibilidad excluyendo el estudio ACCORD, sin encontrar diferencias a excepción del riesgo de insuficiencia renal, lo cual se tornó significativo (datos no mostrados).
Si bien la evaluación del sesgo de publicación tiene limitaciones en contexto de metaanálisis con menos de 10 estudios21,22, esta se realizó, no sugiriendo sesgos importantes para la presente revisión (Fig. supl. 4).
Discusión
Nuestro metaanálisis sugiere que las metas intensivas de control de PA reducen eventos cardiovasculares mayores, con una tendencia no significativa hacia la reducción de mortalidad cardiovascular y total, y un incremento en el riesgo de efectos adversos. Si bien los beneficios del tratamiento antihipertensivo se ha demostrado hace décadas29, en los últimos años los resultados del estudio SPRINT7 y el cambio en las cifras tensionales para diagnosticar HTA de la última Guía multisociedades de EE.UU. para el manejo de esta patología6 han generado notable controversia respecto a las metas terapéuticas más beneficiosas. Así algunos metaanálisis han respaldado el cambio de objetivos terapéuticos, planteando que cifras tensionales menores a 130 mmHg de PAS tendrían beneficios en eventos cardiovasculares y reducirían la mortalidad de los pacientes tratados30-34. Al analizar los resultados de estos metaanálisis se deben tener presentes cuatro aspectos: a) incluyeron estudios con pacientes con un amplio rango de valores de PA (incluso por encima de 180 mmHg) y con objetivos terapéuticos que variaron desde menos de 120 mmHg hasta menos de 160 mmHg de PAS; b) incluyeron estudios de pequeñas dimensiones (inclusive menos de 250 participantes); c) algunos de los estudios incluidos tenían como objetivos primarios puntos finales subrogados (como progresión de la disfunción renal) sin haber evaluado desenlaces fatales, y d) incluyeron estudios que no comunicaron efectos adversos del tratamiento, o que se limitaron a informar del porcentaje de pacientes que abandonaron el tratamiento por estos. El único ECA que encontró reducción en la mortalidad cardiovascular y total con metas intensivas de PA fue SPRINT, pero llamativamente esto ocurrió sin demostrar diferencias en la ocurrencia de IAM y ACV9-15.
Debido a que los efectos adversos de los fármacos en ocasiones ocurren tardíamente, y que el cálculo del tamaño muestral de los ECA se hace para detectar los componentes del punto final primario, pero no los efectos adversos, estos suelen estar subrepresentados en la mayoría de los ensayos. Sumando el no reporte de estos, existe el riesgo de sobrevalorar la intervención, magnificando los beneficios y omitiendo las consecuencias indeseables asociadas a esta.
Dos metaanálisis35,36 del año 2014 encontraron que si bien la reducción de la PA producía beneficios similares en todos los grupos de participantes, aquellos con mayor riesgo basal experimentaban también mayor reducción absoluta en los eventos. Otro metaanálisis reciente37 encontró resultados similares: a iguales descensos en la PA, los pacientes de mayor riesgo cardiovascular obtenían mayores beneficios en términos absolutos. Por tanto, incluir estudios donde los participantes presentaban valores muy elevados de PA al ingreso, o en los cuales la rama control tenía objetivos terapéuticos menos estrictos que los actualmente recomendados (<140/90 mmHg) podría ser una fuente potencial de sesgos a la hora de valorar el beneficio de dos metas de PA. Esto motivó que en el presente metaanálisis se hayan incluido únicamente ECA en donde los participantes del grupo control tuvieron valores promedio de PAS con cifras de 140 a 145 mmHg. Por otro lado, en patologías de alta prevalencia los estudios de pequeñas dimensiones conllevan dos riesgos: a) que se traten de subpoblaciones particulares que no representen adecuadamente el universo de individuos con la enfermedad, y b) que exista sesgo de publicación para estudios positivos. A fin de evitar estas fuentes de error se incluyeron solamente estudios de medianas o grandes dimensiones y con seguimiento promedio de al menos 12 meses.
Tres metaanálisis recientes encontraron resultados similares a los nuestros16,38,39. Saiz, et al.16 incluyeron seis estudios con 9,795 pacientes y comunicaron que las metas intensivas redujeron eventos cardiovasculares, hospitalización y muerte por insuficiencia cardiaca, sin reducir la mortalidad total o cardiovascular. No encontraron un incremento en la tasa de eventos adversos mayores en el grupo asignado a tratamiento intensivo, pero sí más abandono de medicación por efectos adversos en general. Xie, et al.38 incluyeron 19 estudios con 44,989 participantes, encontrando que las metas intensivas de PA reducirían eventos cardiovasculares, albuminuria y la progresión de retinopatía, sin impacto en la mortalidad total, la mortalidad cardiovascular, la insuficiencia cardiaca y la progresión a enfermedad renal terminal. Respecto a los efectos adversos, no encontraron un aumento significativo en los efectos adversos serios, pero sí en la ocurrencia de hipotensión grave. Brunström y Carlberg39 incluyeron 74 estudios con 306,273 participantes. De acuerdo con sus resultados el impacto en la reducción de eventos variaría según los niveles de PA basales: en los estudios donde los participantes tenían valores de PAS mayores a 160 mmHg el tratamiento antihipertensivo redujo eventos cardiovasculares y muerte, mientras que en los estudios con cifras basales entre 140 y 159 mmHg el tratamiento solo redujo eventos cardiovasculares. En cambio en los estudios donde los participantes presentaban valores basales de PA menores a 140 mmHg, el tratamiento antihipertensivo solo redujo eventos cardiovasculares cuando los sujetos tenían historia de enfermedad coronaria. En el presente estudio se analizaron con mayor profundidad la ocurrencia de distintos eventos adversos, entendiendo que la elección de metas antihipertensivas habituales e intensivas debiera ser una decisión individualizada, sopesando los beneficios y riesgos potenciales, con resultados que avalan las recomendaciones de la Sociedad Europea de Cardiología40.
Algunos de los metaanálisis antes mencionados incluyeron entre los eventos cardiovasculares la ocurrencia de insuficiencia cardiaca con las distintas metas de PA. De hecho en SPRINT la insuficiencia cardiaca fue uno de los componentes del punto final primario donde se observó mayor diferencia entre grupos7. Sin embargo, tanto en este estudio como en otros los grupos con tratamiento intensivo recibieron mayor proporción de diuréticos12. Debido a esto resulta complejo determinar si las metas intensivas de PA reducen per se la ocurrencia de insuficiencia cardiaca o si esta observación se encuentra confundida por el tratamiento farmacológico.
En nuestro metaanálisis el 22% de los pacientes incluidos (n=6,570) eran diabéticos. De estos, la mayor proporción provienen del estudio ACCORD, el cual fue realizado exclusivamente entre individuos con esta afección. Si bien ACCORD no mostró beneficios en el punto final primario analizado, tampoco aportó indicios de un peor pronóstico con metas intensivas. Al excluir a los participantes de este estudio de nuestro análisis, no encontramos diferencias sustanciales en los resultados. Esto hace suponer que los resultados generales de nuestro análisis muy probablemente puedan aplicarse a los pacientes con esta enfermedad.
Finalmente otro aspecto debatible es incluir en el presente metaanálisis estudios con pacientes de riesgo cardiovascular alto e intermedio. Si aceptamos que la PA es una variable continua y que, por tanto, su relación con el riesgo cardiovascular es lineal, uno esperaría que el impacto en su reducción sea similar pero de menor magnitud en individuos con menor riesgo. Esto se observa en nuestro metaanálisis con los resultados de HOPE-3. Si bien esto podría haber disminuido el estimador global de los efectos analizados, aumenta la validez externa de estos, ya que en la práctica cotidiana no siempre resulta tan sencillo estimar con precisión el riesgo futuro de cada persona individual.
Limitaciones
La primer gran limitación del presente trabajo es no disponer de las bases de datos de los estudios incluidos. No realizar un metaanálisis de datos individuales impide llevar adelante algunos análisis de sensibilidad, como una valoración más pormenorizadade los pacientes diabéticos o delinear mejor las características de los sujetos más susceptibles a desarrollar efectos adversos con las metas intensivas de control de PA. En segundo lugar, si bien utilizar criterios de inclusión rigurosos limitan algunos sesgos ya mencionados, conllevan riesgo de incurrir en otros, como sesgo de selección. De hecho, nuestro metaanálisis es el que posee menor número de estudios incluidos entre los recientemente realizados. Sin embargo, al incluir estudios de grandes dimensiones posee un número de participantes superior al de otras publicaciones. Además de lo antes mencionado, debe tenerse presente que estos datos no son aplicables a pacientes octogenarios, por ser una población francamente subrepresentada en la mayoría de los ensayos clínicos. De hecho, el único estudio disponible hasta la fecha en estos pacientes fijó metas de PAS de 150 mmHg. Debido a que el horizonte temporal de los ensayos clínicos es limitado, no es posible determinar el impacto a mediano o largo plazo que podría tener optar por metas intensivas o conservadoras de PA. Si bien es dable suponer que la reducción de eventos no fatales podría tener un impacto beneficioso en la disminución de eventos fatales a largo plazo, no es posible respaldar esta inferencia con los datos disponibles actualmente. Por otro lado, esta limitación es aplicable tanto a los beneficios como al riesgo de desarrollo de eventos indeseables en el seguimiento.
Conclusión
Nuestros datos sugieren que las metas intensivas de PA con valores de presión sistólica próximos a 130 mmHg reducen los eventos cardiovasculares, sin impacto en la mortalidad a corto plazo, y con un incremento en el riesgo de eventos adversos. Asimismo, no encontramos evidencia que sugiera la necesidad de fijar metas de control de presión diferentes en individuos diabéticos y no diabéticos.
Debido a ello se debe reforzar el control de la PA para todos los sujetos hipertensos, considerando emplear metas intensivas en aquellos individuos que pertenezcan a subgrupos de mayor riesgo cardiovascular, con bajo riesgo de efectos adversos.
Nuevos estudios son necesarios para evaluar el impacto a mediano y largo plazo de las distintas metas antihipertensivas.











 nueva página del texto (beta)
nueva página del texto (beta)