Introducción
La trombosis venosa profunda (TVP) es una enfermedad que presenta una incidencia anual de un caso cada 1,000 habitantes-año1,2. Su evolución puede predisponer a diferentes complicaciones como tromboembolia pulmonar (TEP), hemorragias, TVP recurrente y/o desarrollo de graves secuelas postrombóticas3.
Una de las complicaciones crónicas más relevantes es el síndrome postrombótico (SPT), que se caracteriza clínicamente por dolor crónico, edema y pesadez de la extremidad afectada. En casos severos pueden desarrollarse úlceras venosas. El SPT se manifiesta entre el 17 y el 35% dentro del primer año, llegando a tener una incidencia acumulada a los dos años del 50%4.
Se conoce que el SPT es el resultado de la hipertensión venosa que sigue al desarrollo de la incompetencia valvular (consecuencia del daño sufrido por las válvulas venosas en el momento del episodio trombótico agudo y la fase de recanalización venosa), al reflujo y a la obstrucción venosa. En estas fases actúan diferentes componentes inflamatorios que representan uno de los factores determinantes del desarrollo de SPT5. En este contexto, las estatinas podrían ayudar a disminuir la inflamación crónica por su efecto pleiotrópico y antiinflamatorio, generada al actuar sobre la regulación, la disminución en la expresión y secreción de diferentes factores proinflamatorios6,7. De esta manera, podrían disminuir el desarrollo consiguiente de SPT en los pacientes que hayan tenido una TVP8.
Debido a que el SPT es generado en gran medida por el proceso inflamatorio que se genera en las venas afectadas por la TVP y como las estatinas presentan un potente efecto pleiotrópico que actúa disminuyendo la inflación, nos preguntamos si existe asociación entre el consumo de estatinas (CE) y el desarrollo de SPT luego del primer episodio de TVP.
Materiales y métodos
Se diseñó una cohorte retrospectiva conformada por pacientes adultos con un primer episodio de TVP, incluidos en el Registro Institucional de Enfermedad TromboEmbólica (RIET) del Hospital Italiano de Buenos Aires (HIBA) entre junio de 2006 y diciembre de 2017. Se excluyeron los pacientes que se negaron al consentimiento informado oral del RIET y aquellos que no tuvieran seguimiento telefónico.
El HIBA es un hospital universitario de alta complejidad de la Ciudad Autónoma de Buenos Aires que funciona como una red integrada de salud en Argentina. Cuenta con 18 centros de atención ambulatoria, con aproximadamente 750 camas. En su sistema de atención, ofrece servicios médicos integrales a una población de 150,000 afiliados a la prepaga institucional (Plan de Salud del Hospital Italiano [PSHIBA]), que garantiza la atención en forma exclusiva y completa dentro de este sistema. Toda la información se centraliza en una historia clínica electrónica (HCE) única9,10, que concentra toda la información administrativa (p. ej., estudios, solicitud de turnos, turnos ambulatorios, internaciones, consumo de fármacos) y toda su información clínica (problemas de salud, diagnósticos clínicos, evoluciones médicas, resultados de laboratorios y estudios, entre otros). Los problemas de salud o comorbilidades son codificados automáticamente mediante un servidor de terminología con tesauro local que mapea y codifica la información con el vocabulario controlado SNOMED-CT11-14.
Todas las variables de este estudio fueron recolectadas de la información contenida en la evaluación sistemática del RIET, representando una base de datos secundaria de alta calidad. El RIET funciona desde el 2006, como un registro prospectivo de casos incidentes de enfermedad tromboembólica venosa (ETV) diseñado y conducido por el Área de Investigación en Medicina Interna del Servicio de Clínica Médica. En el mismo se incluyen pacientes correspondientes a todas las coberturas médicas (no restringido a PSHIBA). Las TVP se diagnostican por ecografía Doppler venoso de miembros inferiores. Las venas incluidas fueron: plexo sóleo o venas gemelares con afección del cayado, venas tibiales posteriores y anteriores, vena poplítea, vena femoral (femoral superficial), cayado de la safena, vena ilíaca externa, vena glútea inferior y superiores, y vena ilíaca interna.
A los fines de este estudio, el grupo expuesto estuvo constituido por pacientes que se encontraron consumiendo estatinas15: atorvastatina, rosuvastatina, simvastatina, pravastatina, fluvastatina y lovastatina. Se definió consumidor de estatina (CE) aquel paciente que posee registro de compra en farmacia y/o posee registro en la HCE de estatinas dentro de los 30 días antes y hasta 180 días posterior al diagnóstico del primer episodio de TVP.
Todos los pacientes fueron seguidos de manera prospectiva mediante la revisión sistemática de la HCE y la información obtenida por medio del seguimiento telefónico sistemático del RIET. El inicio del seguimiento fue la fecha índice del primer episodio de TVP. Se los siguió hasta la fecha de: muerte, pérdida de seguimiento o fin administrativo del estudio.
Se recolectaron los eventos SPT con estrategia múltiple, mediante: a) adaptación del cuestionario de Villalta en las evaluaciones telefónicas16, y b) revisión de HCE (para detectar problema codificado o diagnóstico clínico). Se detectaron los casos de fallecimiento y sus fechas utilizando bases de datos secundarias (bases de internaciones para detectar las muertes intrahospitalarias) y captura primaria (la baja por fallecimiento desde el padrón, dato restringido únicamente a pacientes del PSHIBA; y la reportada por familiares en el seguimiento telefónico, independiente de la cobertura).
Según el cálculo de tamaño muestral, para una potencia del 80%, con una probabilidad de error alfa de aproximadamente un 5% y un test bilateral, se requieren mínimo 100 pacientes en cada grupo, asumiendo una incidencia de 0.5 para el desarrollo del SPT en el grupo de no consumidores de estatinas (NCE) y del 0.3 para el grupo de CE. A su vez, se evaluó la asociación entre CE y SPT ajustado por propensity score (PS). Para evaluar esta asociación, se requieren 10 eventos por variable incluida en el modelo. Considerando un modelo multivariante, con al menos seis variables, se requieren 60 eventos de SPT.
La PS se realizó con la intención de resolver el natural sesgo de confusión por indicación del CE debido al diseño observacional sin aleatorización de la exposición. Teniendo en cuenta que la población general presenta una alta tasa de mortalidad y pudiendo interferir esta con el desarrollo de SPT, realizamos un análisis de sensibilidad con modelos de regresión que consideran eventos competitivos. Se utilizaron modelos de regresión de Fine y Gray17,18 considerando al fallecimiento como evento competitivo. Las variables utilizadas para la PS fueron las siguientes: edad (odds ratio [OR]: 1.01; IC 95%: 1.00-1.03), sexo femenino (OR: 0.88; IC 95%: 0.61-1.25), hipertensión arterial (HTA) (OR: 0.86; intervalo de confianza [IC] 95%: 0.57-1.30), enfermedad coronaria (OR: 2.26; IC 95%: 1.33-3.84), diabetes (DBT) (OR: 1.30; IC 95%: 0.78-2.14), dislipidemia (DLP) (OR: 8.76; IC 95%: 5.91-12.97), accidente cerebrovascular (ACV) (OR: 1.78; IC 95%: 1.07-2.96), insuficiencia cardiaca congestiva (ICC) (OR: 1.09; IC 95%: 0.65-1.82) e insuficiencia renal crónica (IRC) (OR: 0.87; IC 95%: 0.52-1.45). Se presentan las subhazard ratios (sHR) con sus IC 95%.
Se describieron las variables cuantitativas como media y desviación estándar (DS) o mediana e intervalo intercuartílico (RIC), según distribución observada y las variables categóricas como frecuencia absoluta y porcentaje. Se compararon las proporciones entre ambos grupos con el test de chi cuadrado o exacto de Fisher, según supuestos. Se compararon las medias con la t test y las medianas con el test de Mann-Whitney. Para evaluar la hipótesis principal del estudio, se estimó el tiempo al evento del desarrollo de SPT en ambos grupos con el método de Kaplan-Meier. Para esto, se consignaron las siguientes fechas: primer evento de TVP, último seguimiento, SPT y fallecimiento. Se consideró como fecha de fin de seguimiento lo que ocurriera primero: el desarrollo del SPT, la muerte o la fecha de último contacto. El tiempo al evento para ambas variables dependientes se evaluó en meses. Se estimaron las densidades de incidencias en ambos grupos y se presentaron con sus IC 95% por cada 100 personas/año. Se estimaron las razones de incidencias entre CE y NCE, y se presentaron con sus IC 95%. Se estimaron los HR con sus IC 95%: utilizando un modelo de regresión de riesgos proporcionales de Cox bivariado. Se consideraron como potenciales confundidores las variables estadísticamente asociadas al desarrollo del SPT y aquellas consideradas de importancia clínica como confundidores. Se utilizó un modelo de riesgos proporcionales de Cox multivariado para ajustar por estos potenciales confundidores. Las variables confusoras utilizadas para el ajuste fueron la siguientes: edad, sexo, antiinflamatorios no esteroideos (AINE), corticosteroides, inmovilidad, tratamiento anticoagulante, HTA, DBT, DLP, IRC, enfermedad coronaria, ACV, ICC y enfermedad oncológica. Se consideró estadísticamente significativa una p < 0.05. Se utilizó el software estadístico STATA 13.
El estudio se llevó a cabo en total acuerdo con la normativa ética nacional e internacional vigente. Todos los datos del estudio fueron tratados con máxima confidencialidad. El protocolo de este proyecto fue evaluado y aprobado por el comité de ética institucional (número 2453).
Resultados
De un total de 1,393 pacientes potencialmente incluibles, con primer episodio de TVP confirmada e incluidos en el RIET, 488 fueron excluidos debido a la falta de seguimiento telefónico o fallecimiento en el mismo episodio (Tabla 1). Se incluyeron 905 pacientes para el análisis, de los cuales 273 fueron CE y 632 NCE (Fig. 1).
Tabla 1 Comparación entre incluidos vs. excluidos (por falta de seguimiento)
| Incluidos (n = 905) | Excluidos (n = 488) | p valor | |
|---|---|---|---|
| Embolia pulmonar concomitante a la TVP | 20.77% (188) | 21.11% (103) | 0.884 |
| Estatina | 30.17% (273) | 16.39% (80) | 0.001 |
| Edad, en años* | 78 (16) | 76 (16) | 0.001 |
| Sexo femenino | 63.54% (575) | 60.25% (294) | 0.227 |
| Índice de masa corporal† | 27.28 (6.02) | 27.42 (5.42) | 0.675 |
| Comorbilidades | |||
| Score de Charlson* | 2 (3) | 2 (4) | 0.417 |
| Tabaquismo | 6.74% (61) | 7.17% (35) | 0.761 |
| Hipertensión arterial | 61.55% (577) | 65.16% ( 318) | 0.183 |
| Enfermedad coronaria | 9.06% (82) | 7.58% (37) | 0.346 |
| Diabetes | 10.28% (93) | 12.70% (62) | 0.169 |
| Dislipidemia | 45.41% (411) | 47.13% (230) | 0.540 |
| Accidente cerebro vascular | 9.72% (88) | 5.94% (29) | 0.015 |
| Insuficiencia cardiaca | 9.94% (90) | 10.66% (52) | 0.676 |
| Insuficiencia renal crónica | 10.94% (99) | 8.61% (42) | 0.168 |
| Enfermedad oncológica | 28.84% (261) | 33.40% (163) | 0.078 |
| EPOC | 10.72% (97) | 11.07% (54) | 0.842 |
| Consumo de AINE | 23.43% (212) | 23.98% (117) | 0.818 |
*Mediana (rango intercuartílico).
†Media (± desviación estándar). TVP: trombosis venosa profunda; EPOC: enfermedad pulmonar obstructiva crónica; AINE: antiinflamatorios no esteroideos.
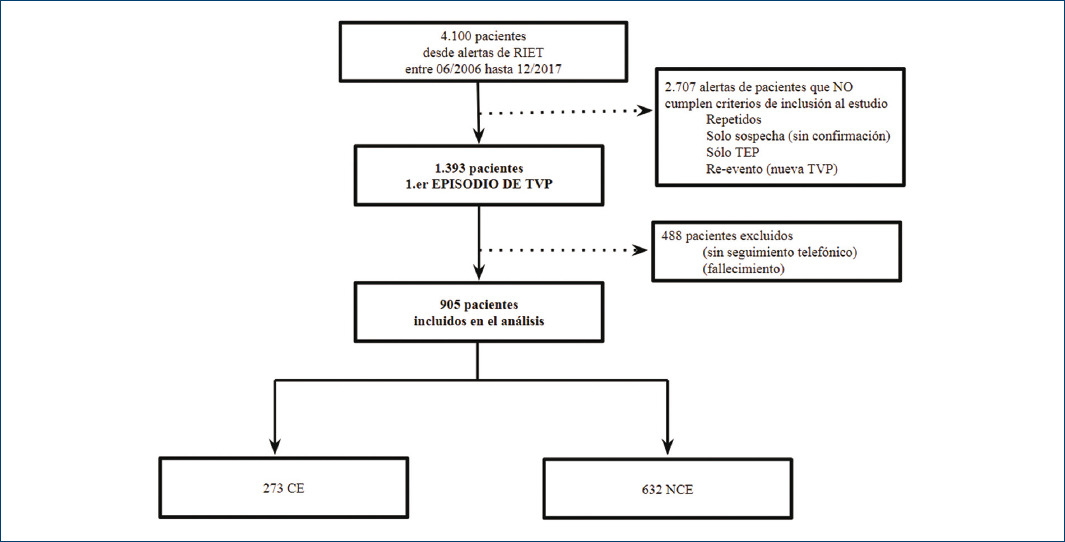
Figura 1 Diagrama del flujo de inclusión de los pacientes en el estudio.RIET: Registro Institucional de Enfermedad TromboEmbólica; TEP: tromboembolia pulmonar; CE: consumidores de estatinas; NCE: no consumidores de estatinas; TVP: trombosis venosa profunda.
Con respecto a las diferencias basales entre los pacientes CE y NCE, las diferencias estadísticamente significativas fueron: mayor edad (77.46 vs. 73.65 años; p < 0.001), mayor tasa de HTA (76.92 vs. 54.91%; p < 0.001), de enfermedad coronaria (18.32 vs. 5.06%; p < 0.001), de DBT (16.12 vs. 7.75%; p < 0.001), de dislipemia (80.95 vs. 30.06%; p < 0.001), de ACV (17.58 vs. 6.33%; p < 0.001), de insuficiencia cardiaca (15.02 vs. 7.75%; p < 0.001), de IRC (14.29 vs. 9.49%; p = 0.034) y de consumo previo de AINE (28.94 vs. 21.04%; p = 0.010), en todos los resultados de los CE con respecto a los de los NCE respectivamente. En la tabla 2 se presentan todas las características evaluadas y la comparación entre CE y NCE.
Tabla 2 Características basales de los pacientes incluidos con TVP por grupo CE o NCE
| CE (n = 273) | NCE (n = 632) | p | |
|---|---|---|---|
| Relacionadas al paciente | |||
| Edad, en años* | 77.46 (9.68) | 73.65 (15.33) | < 0.001 |
| Sexo femenino | 59.34% (162) | 65.35% (413) | 0.085 |
| Índice de masa corporal* | 27.43 (5.64) | 27.21 (6.19) | 0.334 |
| Comorbilidades | |||
| Tabaquismo | 5.86% (16) | 7.12% (45) | 0.488 |
| Hipertensión arterial | 76.92% (210) | 54.91% (347) | < 0.001 |
| Enfermedad coronaria | 18.32% (50) | 5.06% (32) | < 0.001 |
| Diabetes | 16.12% (44) | 7.75% (49) | < 0.001 |
| Dislipidemia | 80.95% (221) | 30.06% (190) | < 0.001 |
| Accidente cerebrovascular | 17.58 (48) | 6.33% (40) | < 0.001 |
| Insuficiencia cardiaca | 15.02% (41) | 7.75% (49) | < 0.001 |
| Insuficiencia renal crónica | 14.29% (39) | 9.49% (60) | 0.034 |
| Inmovilidad | 61.90% (169) | 57.28% (362) | 0.195 |
| Enfermedad oncológica | 25.27% (69) | 30.38% (192) | 0.120 |
| EPOC | 13.55% (37) | 9.49% (60) | 0.070 |
| Consumo de AINE | 28.94% (79) | 21.04% (133) | 0.010 |
| Consumo de corticosteroides | 24.91% (68) | 24.84% (157) | 0.983 |
| Consumo de cilostazol | 2.93% (8) | 1.27% (8) | 0.081 |
| Relacionadas con ETV | |||
| Embolia pulmonar concomitante | 23.44% (64) | 19.62% (124) | 0.193 |
*Media (± desviación estándar). CE: consumidores de estatinas; NCE: no consumidores de estatinas; TVP: trombosis venosa profunda; EPOC: enfermedad pulmonar obstructiva crónica; AINE: antiinflamatorios no esteroideos; ETV: enfermedad tromboembólica venosa.
La mayoría de los pacientes (51%) recibía atorvastatina. La tabla 3 muestra detalles sobre sobre el CE, con las frecuencias de cada fármaco y las dosis.
Tabla 3 Detalles sobre consumo de estatinas en el grupo de consumidores de estatinas (CE)
| Tipo de estatina | CE (n = 273) |
|---|---|
| Rosuvastatina | 24.91% (68) |
| 5 mg | 22.05% (15) |
| 10 mg | 64.70% (44) |
| 20 mg | 13.25% (9) |
| Atorvastatina | 51.28% (140) |
| 10 mg | 52.14% (73) |
| 20 mg | 47.86% (67) |
| Simvastatina | 23.81% (65) |
| 10 mg | 46.15% (30) |
| 20 mg | 47.69% (31) |
| 40 mg | 6.16% (4) |
El grupo CE tuvo mayor tasa de anticoagulación comparado con el grupo NCE (91 vs. 86%; p = 0.036). El tipo de anticoagulante más prescrito fue antagonistas de la vitamina K (AVK). Menos del 1% en ambos grupos recibieron nuevos anticoagulantes orales (NOA). El 91.21% (249) de los CE se encontraban anticoagulados (50.92% con heparina de bajo peso molecular, 54.21% con AVK y 0.37% con NOA), mientras que el 86.23% (545) del grupo NCE se encontraba anticoagulado (49.37% con heparina de bajo peso molecular, 46.20% con AVK y 0.63% con NOA), con diferencia significativa (p = 0.036).
La cantidad de eventos de SPT detectados durante el seguimiento fue de 18 en el grupo CE y 51 en el grupo NCE. La mediana de tiempo de seguimiento global de la cohorte fue de 15 meses (RIC: 0-38). La tabla 4 muestra los eventos detectados en el seguimiento.
Tabla 4 Cantidad de eventos evaluados durante al seguimiento por grupo CE y NCE
| CE (n = 273) | NCE (n = 632) | p* | |
|---|---|---|---|
| SPT | 18 | 51 | 0.412 |
| RETV | 30 | 68 | 0.403 |
| Fallecimiento | 120 | 322 | 0.047 |
| Mediana de seguimiento a la última fecha de contacto, en meses | 17 (IIC 0-44) | 15 (IIC 0-36.5) | 0.177 |
*p valor estimado de test de Log Rank. CE: consumidores de estatinas; NCE: no consumidores de estatinas; SPT: síndrome postrombótico; RETV: recurrencia de enfermedad tromboembólica venosa.
Asociación entre consumo de estatinas y síndrome postrombótico
La densidad de incidencia de SPT en el grupo CE fue de 3.69 (IC 95%: 2.22-6.12) por cada 100 personas/año, y de 4.68 (IC 95%: 3.43-6.38) por cada 100 personas/año en el grupo NCE. La razón de densidad de incidencias fue de 0.79 (IC 95%: 0.4-1.46) para los CE con respecto a los NCE. La tabla 5 presenta las incidencias acumuladas anuales para ambos grupos. No se pudo estimar la mediana de tiempo al evento porque ninguna de los dos grupos tuvo un 50% de incidencia acumulada de eventos SPT. La mediana de tiempo al desarrollo de SPT fue 9 meses, siendo de 8 meses en el grupo NCE y 11 meses en CE. En la figura 2 se presenta el gráfico de Kaplan Meier para desarrollo de SPT entre CE y NCE (log rank test: p = 0.412).
Tabla 5 Incidencias acumuladas de SPT estimadas con el método de Kaplan Meier, en ambos grupos, CE y NCE
| Incidencia acumulada de SPT (meses) | CE (% con IC 95%) | NCE (% con IC 95%) |
|---|---|---|
| 12 | 5.03 (2.54-9.85) | 4.62 (2.85-7.47) |
| 24 | 7.57 (4.22-13.38) | 7.9 (5.24-11.82) |
| 36 | 10.69 (6.05-18.52) | 12.58 (8.69-18.03) |
| 48 | 12.59 (7.19-21.55) | 18.57 (13.13-25.91) |
| 60 | 17.19 (8.92-31.65) | 22.59 (15.58-32.09) |
CE: consumidores de estatinas; NCE: no consumidores de estatinas; SPT: síndrome postrombótico; IC: intervalo de confianza.
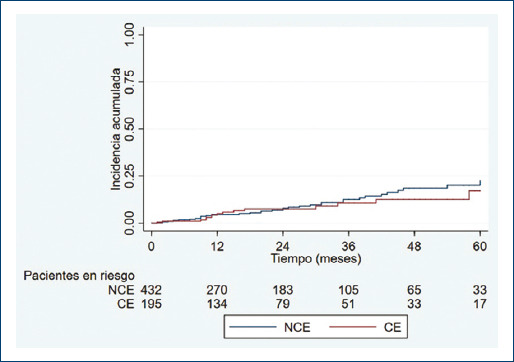
Figura 2 Incidencia acumulada de SPT estimada en función del tiempo para los pacientes con CE (rojo) y NCE (azul).SPT: síndrome postrombótico; CE: consumidores de estatinas; NCE: no consumidores de estatinas.
La HR cruda del CE fue de 0.78 (IC 95%: 0.43-1.41; p = 0.414) para el desarrollo de SPT. La HR del CE ajustada por edad, sexo, AINE, corticosteroides, inmovilidad, tratamiento anticoagulante, HTA, DBT, DLP, IRC, enfermedad coronaria, ACV, ICC y enfermedad oncológica fue de 0.45 (IC 95%: 0.13-1.5; p = 0.196) para el desarrollo de SPT. La HR del CE ajustada por edad, sexo, AINE, corticosteroides, inmovilidad, tratamiento anticoagulante, enfermedad oncológica y la PS fue de 0.52 (IC 95%: 0.17-1.66; p = 0.272) para el desarrollo de SPT.
La tabla 6 presenta los resultados del análisis univariante y multivariante por regresión de Cox al SPT, con los HR estimados crudos y ajustados, con sus respectivos IC95%.
Tabla 6 Asociación entre el consumo de estatinas y el desarrollo de SPT. Modelo de regresión de Cox
| HR | IC 95% | p | |
|---|---|---|---|
| Edad, por cada aumento en 1 año | 0.99 | (0.97-1) | 0.1 |
| Sexo femenino | 1.56 | (0.86-2.84) | 0.144 |
| AINE | 0.86 | (0.47-1.59) | 0.639 |
| Corticosteroides | 1.18 | (0.62-2.24) | 0.619 |
| Inmovilidad | 3.03 | (1.57-5.87) | 0.001 |
| Recibió tratamiento anticoagulante | 1.1 | (0.32-3.8) | 0.883 |
| Enfermedad oncológica | 0.87 | (0.42-1.78) | 0.702 |
| CE vs. NCE cruda | 0.78 | (0.43-1.41) | 0.414 |
| CE vs. NCE ajustado* | 0.45 | (0.13-1.5) | 0.196 |
| CE vs. NCE ajustado por† PS | 0.52 | (0.17-1.66) | 0.272 |
*Ajustada por edad, sexo, AINE, corticosteroides, inmovilidad, tratamiento anticoagulante, HTA, DBT, dislipidemia, IRC, enfermedad coronaria, ACV, ICC y enfermedad oncológica.
†Ajustada por edad, sexo, AINE, corticosteroides, inmovilidad, tratamiento anticoagulante, enfermedad oncológica y PS para consumo de estatinas. SPT: síndrome postrombótico; HR: hazard ratio; IC: intervalo de confianza; AINE: antiinflamatorios no esteroideos; CE: consumidores de estatinas; NCE: no consumidores de estatinas; PS: propensity score.
Considerando los eventos competitivos como análisis de sensibilidad, la sHR cruda del CE fue de 0.84 (IC 95%: 0.46-1.51; p = 0.555) para el desarrollo de SPT. La sHR del CE ajustado por edad, sexo, AINE, corticosteroides, inmovilidad, tratamiento anticoagulante, enfermedad oncológica y la PS fue de 0.45 (IC 95%: 0.14-1.46; p = 0.184) para el desarrollo de SPT.
Asociación entre consumo de estatinas y fallecimiento
La tabla 7 muestra las incidencias acumuladas por grupos, cada 12 meses. La mediana de tiempo de seguimiento al fallecimiento de la cohorte global fue de 15 meses, siendo de 15 meses en el grupo NCE y 17 meses en el de CE.
Tabla 7 Incidencias acumuladas de fallecimiento, estimadas con el método de Kaplan Meier, en ambos grupos, CE y NCE
| Incidencia acumulada de fallecimiento (meses) | CE (% con IC 95%) | NCE (% con IC 95%) |
|---|---|---|
| 12 | 11.36 (7.63-16.74) | 14.41 (11.42-18.1) |
| 24 | 14.86 (10.39-21.04) | 20.45 (16.79-24.77) |
| 36 | 18.58 (13.26-25.7) | 27.56 (23.09-32.7) |
| 48 | 20.79 (14.96-28.49) | 34.58 (29.33-40.47) |
| 60 | 27.13 (19.57-36.85) | 36.47 (30.98-42.6) |
IC: intervalo de confianza; CE: consumidores de estatinas; NCE: no consumidores de estatinas.
En la figura 3 se presenta el gráfico de Kaplan Meier para mortalidad entre CE y NCE (log rank test: p = 0.046). La HR cruda del CE para fallecimiento fue de 0.71 (IC 95%: 0.5-0.99; p = 0.049). La HR del CE ajustada por edad, sexo, AINE, corticosteroides, inmovilidad, tratamiento anticoagulante, enfermedad oncológica, score de comorbilidades de Charlson y la PS fue de 0.62 (IC 95%: 0.4-0.98; p = 0.04).
Discusión
En nuestro estudio no encontramos asociación entre el CE y el desarrollo del SPT, y se trata de un estudio pragmático, que representa el escenario más parecido al seguimiento habitual de los pacientes en el mundo real. Este tipo de diseño aumenta la validez externa, aunque tienen mayor variabilidad en sus mediciones y procesos (p. ej., la adherencia, las dosis, las diferentes estatinas, las comorbilidades de los pacientes, el seguimiento irregular), y requieren mayores tamaños muestrales. Cabe destacar que la gran limitante de este trabajo radica en el baja potencia estadística basada en la baja incidencia del SPT. Por medio de estrategia múltiple de recolección se detectaron 69 casos en total, 18 en el grupo CE y 51 en el grupo de NCE, y solo 8 detectados mediante la historia clínica, pero esto podría explicar la falta de significancia estadística.
El efecto de las estatinas sobre la ETV se observó por primera vez en el estudio JUPITER19, que exploró como objetivo secundario el efecto de la rosuvastatina sobre la disminución de ETV en pacientes con proteína C reactiva (PCR) elevada, evidenciando una reducción del riesgo del 43% de TVP en pacientes tratados con rosuvastatina (OR: 0.57; IC 95%: 0.37-0.86). Si bien la validez externa es limitada, motivó diferentes estudios posteriores sobre este argumento. La plausibilidad biológica de los posibles mecanismos que expliquen una asociación entre el CE y el SPT se basan en su definición y origen, tratándose del resultado de la hipertensión venosa que sigue al desarrollo de la incompetencia valvular, al reflujo y a la obstrucción venosa. La incompetencia valvular es la consecuencia del daño sufrido por las válvulas venosas en el momento del episodio trombótico agudo y la fase de recanalización venosa. En estas fases actúan diferentes componentes inflamatorios que son uno de los factores determinantes del desarrollo de SPT. Por un lado las células endoteliales microvasculares que son metabólicamente activas expresan diferentes moléculas de adhesión intracelular de clase 1 (ICAM-1), moléculas de adhesión vascular de clase 1 (VCAM-1) y menor expresión de selectina E que las células endoteliales normales20. Los leucocitos circundantes, en su mayoría neutrófilos, linfocitos T, monocitos y macrófagos potencian la respuesta inflamatoria al expresar ciertas moléculas de adhesión y al secretar mediadores inflamatorios como la interleucina (IL) 1, IL-6, IL-8, P-selectina, la proteína quimiotáctica de monocitos 1 (MCP-1), factor de necrosis tumoral (TNF) beta 1 (TNF-b1) y alfa (TNF-a). Por otra parte, la liberación y activación de las células leucocitarias actúan sobre las células intersticiales, que como respuestas a los mediadores liberados por las células endoteliales vasculares y los leucocitos, estimulan el reclutamiento y la activación de macrófagos, fibroblastos y la expresión de diferentes proteínas del tejido conectivo, con la posterior reparación del tejido dañado. Debido a que el SPT es consecuencia de una gran reacción inflamatoria, nos parece importante destacar que las estatinas, hipolipemiantes pero con un efecto pleiotrópico y antiinflamatorio, podrían ayudar a disminuir la inflamación crónica generada al actuar sobre la regulación, la disminución en la expresión y secreción de diferentes factores proinflamatorios como ICAM-1, VCAM-1, IL-1, IL-6, IL-8, TNF-b1 y TNF-a6,21. De esta manera, al actuar sobre estos diferentes componentes de la inflamación podrían disminuir el desarrollo del SPT en los pacientes que hayan tenido una TVP8.
En esta misma línea, San Norberto, et al. realizaron un ensayo con 234 pacientes con diagnóstico de ETV sin TEP22, y como objetivo secundario evaluaron el efecto de las estatinas sobre el grado de SPT. El grupo de pacientes tratados con rosuvastatina presentó una reducción de los niveles de PCR y de la incidencia de SPT (38.3 vs. 48.5%; p = 0.019), luego de tres meses de seguimiento. A diferencia de nuestro estudio, en este tenían menor cantidad de comorbilidades y nosotros incluimos pacientes con TEP concomitante; la menor carga de ETV podría favorecer el efecto de la rosuvastatina y explicar sus resultados sin significancia estadística, pero con misma dirección de la asociación (estatinas como protectoras), en consistencia con nuestros resultados (HR cruda: 0.78; IC 95%: 0.43-1.41; p = 0.414).
Con respecto a detección del SPT, en el estudio de Ghanima, et al.23 y en el de San Norberto, et al. se utilizó entrevista clínica estructurada con escala de Villalta (considerando SPT una puntuación > 5 o si presentaba úlcera venosa)22, mientras que en nuestro estudio se identificaron por medio de una adaptación del cuestionario de Villalta16 y por revisión sistemática de HCE. Si bien la evaluación telefónica es más factible y práctica, es probable que solo detecte los casos graves o sintomáticos de SPT. Esta diferencia en los métodos de detección podría explicar la diferencia observada entre el SPT en nuestra cohorte del 7.62%, siendo inferior comparada con estos estudios, donde rondan el 40%. Adicionalmente, debido a que la frecuencia de SPT en nuestro estudio fue menor a la esperada, la ausencia de diferencias estadísticamente significativas podría deberse a falta de potencia para detectar diferencias entre los CE y NCE.
En referencia al CE, en nuestra cohorte la estatina de mayor frecuencia de uso fue la atorvastatina, 51.28% en una dosis de 10 mg por día, en contraste con otros estudios que describen el uso de rosuvastatina24,25.
Nuestros resultados con respecto a la recurrencia de enfermedad tromboembólica venosa (RETV) se asemejan al estudio de Delluc, et al.26, una cohorte prospectiva de 432 pacientes con un primer evento de ETV. En el análisis multivariante el riesgo de RETV asociado con la exposición a estatinas fue de 1.02 (IC 95%: 0.36-2.91) mientras que en nuestra cohorte la HR del CE ajustada fue de 0.74 (IC 95%: 0.37-1.49). Si bien ambos estudios fueron no estadísticamente significativos, ellos seleccionaron una población con menos comorbilidades que la nuestra, ya que excluyen la ETV secundaria. Asimismo, ellos realizaron una evaluación más activa del consumo de fármacos hipolipemiantes, tuvieron en cuenta el tiempo de anticoagulación y el sitio de trombosis, aspectos que nosotros no pudimos evaluar.
Nuestros resultados del análisis de sensibilidad fueron consistentes con el análisis principal y esta concordancia aumenta la robustez y consistencia de nuestros hallazgos.











 nueva página del texto (beta)
nueva página del texto (beta)



