Introducción
El tratamiento actual de las cardiopatías congénitas, junto con el avance de las técnicas de imagen no invasivas, el desarrollo de nuevos procedimientos quirúrgicos y el intervencionismo hemodinámico, ha contribuido al incremento de la sobrevida de los pacientes, pero también a la necesidad de mayores reintervenciones1. Por esa razón es importante aplicar nuevas técnicas que reduzcan la morbimortalidad y favorezcan un mayor tiempo sin intervenciones.
Las técnicas quirúrgicas que incluyen la continuidad entre el ventrículo derecho y la arteria pulmonar se acompañan a menudo de disfunción del tracto de salida del ventrículo derecho en el postoperatorio tardío2. Esta alteración fisiológica, sumada a la disfunción crónica de la válvula pulmonar, puede ocasionar efectos deletéreos en la función ventricular derecha, dilatación y predisposición a arritmias potencialmente letales, con un efecto negativo en la calidad de vida, la progresión sintomática y la disminución de la capacidad de ejercicio3. La intervención temprana con el objetivo de restituir la funcionalidad valvular pulmonar puede prevenir e incluso revertir este proceso.
El implante percutáneo de la válvula pulmonar es una alternativa menos invasiva que la quirúrgica para el reemplazo valvular, que puede usarse en pacientes seleccionados4. Desde su descripción en el año 2000 hasta la fecha, diferentes centros mundiales incorporaron esta práctica con más de 10,000 válvulas percutáneas implantadas en todo el mundo5. Los resultados a corto y mediano plazos muestran una tasa elevada de procedimientos exitosos con adecuada función valvular pulmonar6 y bajas tasas de reintervención con mejoría de la clase funcional (NYHA) y los parámetros hemodinámicos7,8. Las causas principales de disfunción se relacionan con estenosis por constricción elástica temprana (recoil) y pérdida de la fuerza radial por fractura del stent 9,10.
Numerosos estudios muestran que la resolución de la disfunción del tracto de salida del ventrículo derecho, a través del implante percutáneo valvular pulmonar, corrige los procesos de remodelación del ventrículo derecho y el grado de insuficiencia tricuspídea, además de mejorar la función biventricular6,11,12.
El objetivo de esta descripción de casos clínicos es mostrar la experiencia, en un centro colombiano para el tratamiento de enfermedades cardiovasculares, del implante valvular pulmonar percutáneo en dos pacientes con cardiopatía congénita corregida de manera inicial con homoinjerto aórtico en posición pulmonar y que desarrollaron con posterioridad doble lesión valvular pulmonar (estenosis e insuficiencia).
Caso 1
Paciente masculino de 16 años de edad, de 50 kg de peso, con antecedente de doble tracto de salida del ventrículo derecho, estenosis pulmonar, situs inversus abdominoauricular y dextrocardia, a quien se le realizó al principio una operación de Kawashima-Rastelli a los tres años de edad con un injerto valvular aórtico en posición pulmonar de 19 mm de diámetro. Durante el seguimiento ambulatorio se identificó deterioro progresivo de la clase funcional NYHA II, con desarrollo de disfunción del injerto, a los 13 años del implante, y doble lesión: estenosis pulmonar progresiva e insuficiencia pulmonar moderada. Durante el último control se registró un ecocardiograma que reveló un homoinjerto con estenosis grave, gradiente máximo de 77 mmHg y medio de 47 mmHg e insuficiencia moderada. Además, se observó una dilatación leve e hipertrofia ventricular derecha. Con estos hallazgos se solicitó resonancia magnética cardíaca. Se evidenció un ventrículo derecho dilatado con aneurisma del tracto de salida y un diámetro diastólico de 55 mm, fracción regurgitante de 27%, volumen telediastólico de 152 cm3/m2, telesistólico de 49 cm3/m2 y fracción de expulsión del 63%; un ventrículo izquierdo dilatado, con un volumen telediastólico de 84 cm3/m2 y una fracción de expulsión del 60% sin alteraciones segmentarias en la contractilidad.
Tras considerar el deterioro de la clase funcional y los hallazgos en los estudios, el paciente resultó elegible para implante de válvula pulmonar por vía percutánea. El procedimiento (véase la descripción más adelante) de implante valvular percutáneo se realizó en el laboratorio de hemodinamia bajo anestesia general, intubación orotraqueal y cuidado de anestesia cardiovascular; se obtuvieron coronariografias selectivas anteriores al implante para evaluar de forma detallada la anatomía coronaria, como se muestra en la figura 1. No se presentaron complicaciones durante el procedimiento. A continuación ingresó a la unidad de cuidados intensivos pediátricos durante un día sin necesidad de apoyo hemodinámico o ventilatorio. El ecocardiograma al siguiente dia posterior al implante valvular señaló homoinjerto en posición pulmonar, stent en adecuada posición, válvula Melody permeable y buena movilidad con un gradiente máximo de 25 mmHg y medio de 13 mmHg, sin insuficiencia valvular pulmonar. Recibió el alta al segundo día de hospitalización.
Caso 2
Paciente de 18 años de vida, de 50 kg de peso, con antecedente de cardiopatía congénita tipo tetralogía de Fallot, que requirió fístula de Blalock-Taussig en el período neonatal y luego operación de Rastelli. Se implantó homoinjerto en posición pulmonar de 20 mm de diámetro y se identificó estenosis del homoinjerto que requirió angioplastia pulmonar al año siguiente, con buenos resultados hemodinámicos. Se continuó seguimiento ambulatorio en el cual, durante su evolución, desarrolló una doble lesión de estenosis pulmonar moderada e insuficiencia libre, por lo cual se solicitaron estudios complementarios para evaluar las implicaciones hemodinámicas y definir un plan cardiovascular. El ecocardiograma identificó una estenosis moderada del homoinjerto en posición pulmonar con gradiente máximo de 85 mmHg y medio de 56 mmHg, insuficiencia libre pulmonar y dilatación del ventrículo derecho. La resonancia cardíaca delineó un ventrículo derecho dilatado, con hipocinesia difusa, fracción regurgitante de 25%, fracción de expulsión del 57%, volumen telediastólico de 103 ml/m2 y volumen telesistólico de 35 ml/m2. El ventrículo izquierdo mostró un tamaño normal, sin hipertrofia ni alteraciones de la contractilidad, fracción de expulsión del 61%, volumen telediastólico de 64 ml/m2 y volumen telesistólico 25 ml/m2, con fracción de regurgitación de 25%.
Se analizó en una junta médico-quirúrgica y, con base en los hallazgos de imágenes cardíacas, se consideró al paciente apto para implante percutáneo de válvula Melody. Se realizó el procedimiento en las mismas condiciones que el caso anterior y no se documentaron complicaciones durante el procedimiento. El ecocardiograma intracardíaco no reveló fuga paravalvular ni insuficiencia pulmonar. Se lo trasladó a la unidad de cuidados intensivos, donde permaneció por un día para vigilancia hemodinámica; el paciente presentó evolución clínica favorable, sin trastornos en el ritmo cardíaco o episodios de hipoperfusión. Con posterioridad se lo envió a la sala de hospitalización y egresó al segundo día de estancia hospitalaria.
Descripción de la técnica del procedimiento
Se efectúa cateterismo cardíaco derecho e izquierdo, con acceso femoral percutáneo. Se utiliza un catéter wedge para medir las presiones en la circulación derecha y un catéter helicoidal para angiografías en el VD. Se realiza intercambio por una guía Lunderquist de 0.35 x 260 cm y sobre ésta se avanza un balón Atlas, el cual se expande en el tracto de salida del VD con coronariografía selectiva simultánea para descartar una compresión extrínseca (Fig. 2). El tracto de salida y el homoinjerto se preparan con implantación de un stent cubierto CP sobre un balón Numed BIB (balloon in balloon), como se muestra en la figura 3. Luego se prepara la válvula Melody (en uno de los casos tras acoplar un stent Andra XL adicional sobre esta prótesis) y se avanza con el sistema ENSAMBLE hasta la landing zone creada con el CP stent cubierto. Se infla el balón interno, se verifica una posición adecuada (Fig. 4) y luego se infla el externo para incidir de manera satisfactoria en la válvula. Se obtienen angiografías de control en la arteria pulmonar y el ventrículo derecho (Fig. 4) y se repiten las coronariografías de control para descartar compresión. Los principales resultados obtenidos en el laboratorio de hemodinamia se presentan en la tabla 1 y para cada uno de los pacientes notificados.

Figura 2 Imagen fluoroscópica realizada después del implante percutáneo valvular. No se demostró compresión extrínseca.

Figura 3 Angiografía del tracto de salida del ventrículo derecho. Implante de un stent cubierto CP sobre un balón Numed BIB (balloon in balloon) en el tracto de salida del ventrículo derecho sobre el homoinjerto aórtico en posición pulmonar.
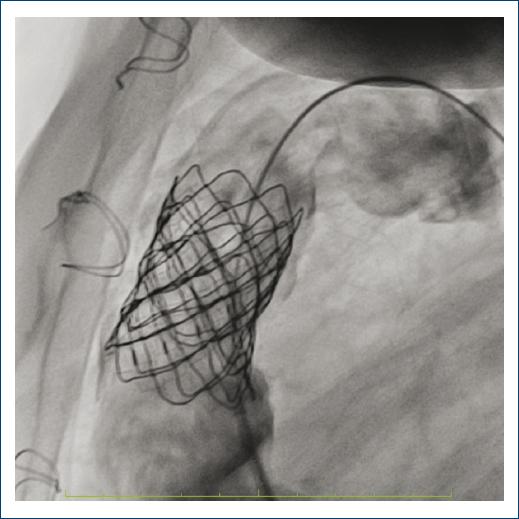
Figura 4 Imagen de válvula Melody implantada. Angiografía del conducto del tracto de salida del ventrículo derecho. Verificación de una posición adecuada de la válvula implantada.
Tabla 1 Valores hemodinámicos
| Estudio hemodinámico, caso 1 | ||||
|---|---|---|---|---|
| Cavidad | PS* | PD* | PD2* | PM* |
| VD* | 54 | 10 | ||
| Ao. desc.* | 81 | 46 | 52 | |
| Postimplantación de válvula Melody 22 | ||||
| AP* | 34 | 16 | 23 | |
| VD* | 35 | 0 | 10 | |
| Ao. desc.* | 100 | 65 | 61 | |
| Tiempo de cateterismo, 130 minutos | ||||
| Tiempo de fluoroscopia: 23-26 minutos | ||||
| Estudio hemodinámico, caso 2 | ||||
| AD* | 10 | |||
| VD* | 88 | 0 | 13 | |
| AP* | 25 | 10 | 15 | |
| RDAP* | 25 | 8 | 16 | |
| RIAP* | 20 | 10 | 15 | |
| Cuña izquierda | 8 | |||
| Cuña derecha | 10 | |||
| TSVD* | 85 | |||
| VI* | 90 | 0 | 8 | |
| Ao. asc.* | 95 | 62 | 77 | |
| Ao. desc.* | 90 | 60 | 78 | |
| Postimplantación de válvula Melody 22 | ||||
| VCS* | 8 | |||
| AD* | 8 | |||
| VD* | 48 | 0 | 10 | |
| AP* | 23 | 8 | 17 | |
| RDAP* | 22 | 6 | 17 | |
| Cuña | 8 | |||
| Intrastent | 22 | 10 | 14 | |
| Aorta | 110 | 70 | 84 | |
| Tiempo de cateterismo: 160 minutos | ||||
| Tiempo de fluoroscopia: 68 minutos | ||||
VD: ventrículo derecho; Ao. desc.: aorta descendente; AP: arteria pulmonar;
PS: presión sistólica; PD1: presión diastólica; PD2: presión de final de la diástole;
PM: presión media; VCS: vena cava superior; AD: aurícula derecha; RDAP: rama derecha de la arteria pulmonar; RIAP: rama izquierda de la arteria pulmonar;
TSVD: tracto de salida del ventrículo derecho; VI: ventrículo izquierdo;
Ao. asc.: aorta ascendente.
El seguimiento ambulatorio de los dos pacientes se realizó al mes del procedimiento con ecocardiograma y electrocardiograma, y luego a los seis meses y al año tras el procedimiento. Ninguno requirió reintervención. No se presentaron alteraciones en el ritmo cardíaco. Uno de los pacientes con clase funcional NYHA II en el momento del implante refirió mejoría en la tolerancia al ejercicio un mes después de la intervención. Los dos pacientes recibieron tratamiento antiagregante plaquetario con ácido acetilsalicílico durante los primeros seis meses posteriores al procedimiento. La evaluación ecocardiográfica ambulatoria mostró una mejoría significativa de los volúmenes pulmonares y la evaluación de la funcionalidad del ventrículo derecho medida por TAPSE. No se observó insuficiencia pulmonar residual ni fractura de la válvula Melody. No se registraron complicaciones tardías relacionadas con el implante percutáneo al año de seguimiento.
Discusión
Los procedimientos quirúrgicos para las cardiopatías congénitas que incluyen el tracto de salida del ventrículo derecho y la arteria pulmonar implican muchas veces la implantación de un conducto para restituir la conexión entre el ventrículo derecho y la arteria pulmonar. En pacientes pediátricos, estos conductos deben reemplazarse con frecuencia y muestran una vida útil limitada que varía según sean la edad del paciente y el material utilizado13 debido al crecimiento somático y la degeneración del conducto que puede ocasionar estenosis o insuficiencia. Esto representa una remodelación ventricular con subsiguiente dilatación y consecuencias deletéreas para la funcionalidad ventricular derecha14 y ello eleva la morbilidad inherente y la necesidad de reintervenciones quirúrgicas en períodos menores de 10 años15.
Los avances tecnológicos en el tratamiento intervencionista percutáneo han revolucionado la atención de los pacientes con cardiopatías congénitas. El implante percutáneo valvular pulmonar se describió de forma original en el año 200016 y lo aprobó la Food and Drug Administration (FDA) como un dispositivo de uso humano en enero de 2010 para tratar conductos disfuncionales en el tracto de salida del ventrículo derecho7. Es una alternativa novedosa y menos invasiva que el procedimiento quirúrgico de recambio valvular pulmonar.
Hoy en día existen dos dispositivos aprobados para el implante de válvula pulmonar percutánea: la válvula Melody (Medtronic) es un dispositivo diseñado de tejido yugular bovino, con una válvula central de valvas naturales que se abren y coaptan bajo condiciones óptimas de presión y está suturada sobre un stent de platino-iridio que se encuentra sobre un CP stent con guía fluoroscópica y un sistema de liberación “balón en balón” (BIB) Ensemble™, que cuenta con una funda integrada que protege a la válvula durante la liberación controlada. El sistema se encuentra disponible en el comercio con diámetro externo de 18, 20 y 22 mm17. La válvula Edwards SAPIEN XT es una válvula elaborada con tejido pericárdico bovino en un stent de acero inoxidable de 14 a 16 mm, con un dispositivo de sellado que cubre la parte proximal del stent con el objetivo de evitar que se presenten fugas paravalvulares, e incluye al sistema de liberación Nova Flex™ que estabiliza el cuerpo del balón durante la implantación. Se encuentra disponible en 23, 26 y 29 mm de diámetro. Esta válvula utiliza el sistema de liberación que requiere guías hidrofílicas 22-24 Fr y los datos sobre la funcionalidad de la válvula SAPIEN XT son limitados en la actualidad por un número bajo de pacientes18,19.
La evidencia en el implante valvular percutáneo con válvula Melody proviene de estudios analíticos y descriptivos multicéntricos, con gran experiencia sobre todo en EE.UU. y Europa, con resultados excelentes a corto y mediano plazos8,20. En Latinoamérica se ha documentado la práctica en centros de referencia de cardiología intervencionista en Brasil y Argentina, y se ha observado que la técnica es factible, segura y eficaz2.
Este informe de casos describe por primera vez la experiencia del implante valvular pulmonar percutáneo en un centro colombiano de alta complejidad para el tratamiento de enfermedades cardiovasculares, y cuenta con un equipo multidisciplinario capacitado en el tratamiento intervencionista de las cardiopatías congénitas, con resultados exitosos a corto plazo.
Según las recomendaciones actuales de la American Heart Association (AHA), se recomienda el reemplazo percutáneo de la válvula pulmonar en pacientes con conductos quirúrgicos de ventrículo derecho a arteria pulmonar, con regurgitación moderada a grave o estenosis, que producen sobrecarga de presión o volumen al ventrículo derecho, siempre que el paciente cumpla con los criterios de inclusión o exclusión para la válvula disponible21. En el caso específico de la válvula Melody se requiere además un diámetro circunferencial del homoinjerto de 16 a 22 mm. Los dos casos notificados satisfacen estos requisitos: son portadores de homoinjerto aórtico en posición pulmonar de 19 y 20 mm de diámetro, respectivamente, tienen peso superior a 30 kg, mostraron doble lesión de la válvula moderada a grave y fracción de regurgitación mayor de 25% con dilatación e hipertrofia ventricular derecha y relaciones entre los volúmenes de final de la diástole (VD/VI) mayores de 1.7. De manera adicional se identificó en el seguimiento deterioro progresivo de la clase funcional NYHA en uno de los casos.
El procedimiento se practicó en el laboratorio de hemodinamia, con oxígeno al 100% bajo intubación orotraqueal, con cuidado de anestesiología cardiovascular, previo consentimiento informado. Las vías de acceso fueron la venosa femoral y la arterial para angiografía aórtica y coronariografía selectivas, con el fin de detectar alguna anatomía coronaria susceptible de compresión. Se administraron heparina intravenosa y profilaxis antibiótica. El conducto se dilató previamente con balones de diámetros progresivos y se realizaron coronariografías selectivas durante la prueba de balón en el tracto de salida del ventrículo derecho en ambos casos, sin registrarse cambios hemodinámicos, angiográficos o electrocardiográficos que sugirieran defectos de perfusión. La válvula implantada percutánea en los dos casos fue una Melody de 22 mm, sobre el conducto quirúrgico, liberada por el sistema Ensemble diseñado para este fin. Se siguieron de modo riguroso las recomendaciones para el implante. Los datos hemodinámicos inmediatos posteriores al implante de la válvula Melody se encuentran en la tablas 1 para cada paciente, respectivamente.
Las complicaciones agudas perioperatorias se han descrito en las publicaciones médicas en un 6% con un 2.7% de complicaciones que ponen en peligro la vida del paciente o requieren intervención inmediata, como ruptura del conducto, perforación y obstrucción de arterias pulmonares, lesiones o desplazamiento valvular y compresión de arterias coronarias debido a la intervención del tracto de salida del VD con la localización del stent7,20. Esta última se acompaña de alta mortalidad temprana y de ahí la importancia de conocer la anatomía coronaria, que permita realizar una planificación anterior al implante valvular y evitar desenlaces desfavorables. En los dos casos expuestos se realizó coronariografía selectivas antes y después del implante valvular percutáneo para evaluar compresión extrínseca y no se documentaron complicaciones durante el procedimiento.
La intervención se consideró exitosa en los dos casos y la válvula Melody implantada tuvo una localización adecuada, con disminución del gradiente pico del ventrículo derecho a arteria pulmonar y de la relación de las presiones entre el ventrículo derecho y la aorta, con insuficiencia pulmonar residual leve y gradiente encontrado entre el ventrículo derecho y la arteria pulmonar menor de 35 mmHg. En ninguno de los dos casos fue necesario el explante en las siguientes 24 horas del procedimiento7.
En el seguimiento a corto plazo se ha relacionado el desarrollo de endocarditis bacteriana como primera causa de explante quirúrgico y mortalidad secundaria a sepsis; la tasa anual informada es del 2.4% paciente-año18. La mayoría de los casos revela una adecuada respuesta al tratamiento antimicrobiano, incluidos mecanismos fisiopatológicos como alteraciones en el patrón de flujo por el gradiente residual, trombosis in situ e inadecuada administración de profilaxis antibiótica durante el procedimiento, así como mayor adhesión bacteriana en la pared venosa yugular bovina para algunas sepas de S. aureus22. En la institución de los autores se adoptó el protocolo de antibioticoterapia profiláctica durante los procedimientos de intervención hemodinámica con cefalosporinas de primera generación, además de la implementación de adecuadas técnicas de asepsia y antisepsia. No se documentaron endocarditis en ninguno de los casos.
Los trastornos del ritmo cardíaco también se han notificado en las publicaciones médicas, en particular aparición de novo tras el implante, sobre todo extrasístoles ventriculares o taquicardia ventricular no sostenida, de carácter transitorio y autolimitadas en la mayor parte de los casos23. En la experiencia de los autores no se presentaron alteraciones en el ritmo cardíaco.
El procedimiento ha presentado resultados promisorios en los diferentes estudios, con tasas elevadas de éxito24. La sobrevida se ha determinado en 98% a cinco años, con ausencia de reintervención en 98 ± 1% a los tres años y de 91 ± 3% a los cinco años, con períodos libres más cortos en pacientes con mayores gradientes de obstrucción en el tracto de salida del ventrículo derecho7. La tasa de ausencia de disfunción de la válvula implantada transcatéter en un registro de seguimiento a un año se informó en 96.9%7 y en 86.4% a los 27 meses10. Las causas principales de disfunción se han relacionado con estenosis por el recoil y fractura del stent por pérdida de la fuerza radial9,10. Los factores relacionados con ruptura son pacientes con tractos de salida del ventrículo derecho muy obstruidos, compresión externa por la pared torácica cuando la válvula implantada se localiza directamente detrás de la pared, menor edad en el momento de la intervención y menor diámetro angiográficos del conducto; por el contrario, se ha descrito como factor protector un sitio de implante protegido por una bioprótesis valvular o un stent previo10,25, este último el caso de los dos pacientes expuestos.
Este informe sustenta la noción de que el reemplazo valvular pulmonar percutáneo es un procedimiento de intervención útil en el tratamiento de la obstrucción del tracto de salida del ventrículo derecho y regurgitación pulmonar postoperatoria, relacionados con efectos deletéreos como remodelación y disfunción ventricular derecha, así como insuficiencia valvular tricúspide progresiva. Al restaurar la función valvular pulmonar con implante percutáneo, mejora la tolerancia al ejercicio, se reducen los volúmenes del ventrículo derecho y mejora la funcionalidad biventricular al mejorar el llenado del ventrículo izquierdo26, además de producir reducciones clínicamente relevantes en la insuficiencia tricúspide que persisten aun después de cinco años de seguimiento12.
Conclusión
El reemplazo valvular pulmonar percutáneo se considera una alternativa atractiva a la sustitución valvular quirúrgica para restaurar la función pulmonar en pacientes con disfunción del tracto de salida del ventrículo derecho; es seguro, eficaz y menos invasivo, con tasas actuales de éxito y resultados optimistas en el seguimiento a corto y mediano plazos en pacientes seleccionados, que pueden además adoptar los cardiólogos pediatras intervencionistas capacitados.
La incidencia notificada en las publicaciones médicas de episodios adversos sirve como base para disminuir y tratar si es posible los factores de riesgo relacionados con desenlaces inadecuados. Se necesita un seguimiento prolongado para evaluar la incidencia de complicaciones tardías.











 text new page (beta)
text new page (beta)



