Introducción
La insuficiencia cardíaca es un problema de salud pública mundial. Es la principal causa de ingresos hospitalarios en adultos en países desarrollados1. El envejecimiento de la población y el incremento de la prevalencia de enfermedades no contagiosas (hipertensión, diabetes, hipercolesterolemia, etc.) hacen que la insuficiencia cardíaca sea cada vez más frecuente en este país y en el mundo2.
Sin embargo, el fenotipo clínico de la insuficiencia cardíaca se halla en cambio. La insuficiencia cardíaca con fracción de expulsión preservada (ICFEp) representa una categoría cada vez más frecuente en la práctica clínica y constituye hasta el 60% de los casos3. La ausencia de cardiomegalia, lo esporádico de los síntomas, la presentación muchas veces similar a la de otros diagnósticos diferenciales y la tasa elevada de falsos positivos en los resultados de biomarcadores convierten a la ICFEp en un reto diagnóstico, aun en manos del especialista en cardiología. Además de ello, la ausencia de datos sobre la epidemiología y el pronóstico de la ICFEp en pacientes mexicanos hacen que esta enfermedad sea un problema pobremente delimitado y que represente una carga considerable de salud en México.
Esta revisión de ICFEp expone la epidemiología, delimita los principales factores de riesgo y mecanismos fisiopatológicos, identifica las características clínicas/paraclínicas y los criterios diagnósticos, y expresa un llamado a realizar investigación en México.
Epidemiología de la ICFEp
La insuficiencia cardíaca (IC) representa un problema de salud pública global con > 37.7 millones de individuos afectados en todo el mundo. Tan sólo en EE.UU. se diagnostican 550,000 nuevos casos cada año1,2.
Las guías de insuficiencia cardíaca (IC) de la Sociedad Europea de Cardiología clasifican la IC en tres grupos de acuerdo con la fracción de expulsión (FE)3,4: insuficiencia cardíaca con FE preservada (ICFEp), caracterizada por una FE > 50%; insuficiencia cardíaca con FE limítrofe o intervalo intermedio, caracterizada por FE de 40-49% (ICFEri), y la insuficiencia cardíaca con FE reducida, reconocible por FE menor que 40%3 (ICFEr) (Tabla 1). Estudios epidemiológicos indican que más de la mitad de los pacientes con IC tienen FE preservada y esta proporción permanece en aumento5. El incremento de esta entidad se debe de forma mayoritaria al incremento de la esperanza de vida y a la mayor prevalencia de factores de riesgo como hipertensión y diabetes, con un aplanamiento de la tasa de hospitalizaciones por ICFEr y un mayor número de las hospitalizaciones por ICFEp6.
Tabla 1 Clasificación de la insuficiencia cardíaca según la fracción de expulsión del ventrículo izquierdo1
| ICFEr | ICFEri | ICFEp | ||
|---|---|---|---|---|
| Criterios | 1 | Signos y/o síntomas | Signos y/o síntomas | Signos y/o síntomas |
| 2 | FEVI menor que 40% | FEVI 40-49% | FEVI ≥ 50% | |
| 3 | - | 1. Valores elevados de péptidos natriuréticos* 2. Al menos un criterio adicional: a. Cardiopatía estructural relevante (HVI/dilatación AI) b. Disfunción diastólica (véase más adelante) | 1. Valores elevados de péptidos natriuréticos* 2. Al menos un criterio adicional: a. Cardiopatía estructural relevante (HVI/dilatación AI) b. Disfunción diastólica (véase más adelante) |
aBNP ≥ 35 pg/ml y/o NT-proBNP ≥ 125 pg/mL.
A pesar de esto, en Latinoamérica la información sobre epidemiología y pronóstico de ICFEp es escasa. Un metaanálisis reciente que incluyó sobre todo a estudios de Sudamérica mostró una incidencia similar a la informada en estudios norteamericanos, con una tasa de 310 casos/100,000 personas/año, y una prevalencia de 1.01%7. Sin embargo, se muestran datos escasos de ICFEp debido a que la mayor parte de los estudios incluye en especial a pacientes con FE reducida.
Un estudio mexicano de Méndez, et al. señaló que hasta 33% de los pacientes tenía FE conservada y registró una mortalidad global (ICFEr y ICFEp) de 11% a un año8. Una revisión sistemática de Bocchi, et al. encontró datos variables en cuanto a prevalencia, desde 0 hasta 37% en pacientes seguidos de forma ambulatoria y de 20 a 45.7% en individuos hospitalizados9.
Los pacientes con insuficiencia cardíaca y FE preservada muestran diferencias epidemiológicas respecto de los sujetos con FE reducida10,11. Habitualmente tienen una edad más avanzada, son mujeres en una mayor proporción y existe una mayor prevalencia de hipertensión arterial, hipertrofia ventricular y fibrilación auricular. El antecedente de infarto de miocardio es menos frecuente, en tanto que no hay diferencias significativas en cuanto a la frecuencia de diabetes o insuficiencia renal. Tampoco hay diferencias en relación con la presentación clínica, aunque en algunos estudios se ha observado que los pacientes con ICFEp poseen una mejor clase funcional basal6y una mejor percepción de su propia calidad de vida12. Sin embargo, la tasa de reingresos hospitalarios y el costo sanitario global13 son similares a los que representa la insuficiencia cardíaca con FE reducida.
Existe controversia acerca de las tasas de mortalidad de ICFEr, dado que algunos estudios muestran que los pacientes con ICFEr tienen un menor riesgo de muerte cardiovascular que los pacientes con ICFEp14,15, mientras que otros señalan lo contrario. Sin embargo, la mortalidad por cualquier causa es todavía alta en pacientes con ICFEp, con una tasa de 121/1,000 pacientes-año en comparación con 141/1,000 pacientes-año en el grupo de ICFEr16.
Tribouilloy, et al. documentaron una tasa de supervivencia de cinco años después de un primer episodio de hospitalización de 43% en pacientes con ICFEp, no diferente en los pacientes con FE reducida (43 vs. 46%; p = 0,95)17. Shah, et al., en una cohorte de 39 982 pacientes de Medicare en EE.UU., publicaron que la mortalidad a cinco años por ICFEr fue ligeramente menor (71.3%) en comparación con ICFEri (75.7%) y ICFEp (75.7%), así como las tasas de rehospitalización, las cuales fueron ligeramente menores en el grupo de ICFEr (82.2%) en comparación con las del grupo de ICFEp (84%)1.
Por lo anterior, y a pesar de la variabilidad de tasas de mortalidad en diferentes estudios, se confirma el problema creciente de salud que significa la insuficiencia cardíaca y que las tasas de mortalidad en las tres categorías de fracción de expulsión son similares.
Fisiopatología de la ICFEp
Los mecanismos fisiopatológicos de ICFEp son un área de creciente interés en cardiología. Si bien las primeras investigaciones se centraron en la importancia de la disfunción diastólica en la fisiopatología de la ICFEp, múltiples anomalías no relacionadas con ésta contribuyen a la secuencia de eventos que suceden en esta entidad18 (Fig. 1). Estas anomalías incluyen disfunción sistólica en reposo y exacerbada por el ejercicio, acoplamiento ventricular-vascular deteriorado, vasodilatación anormal inducida por el ejercicio y mediada por el flujo, incompetencia cronotrópica e hipertensión arterial pulmonar.
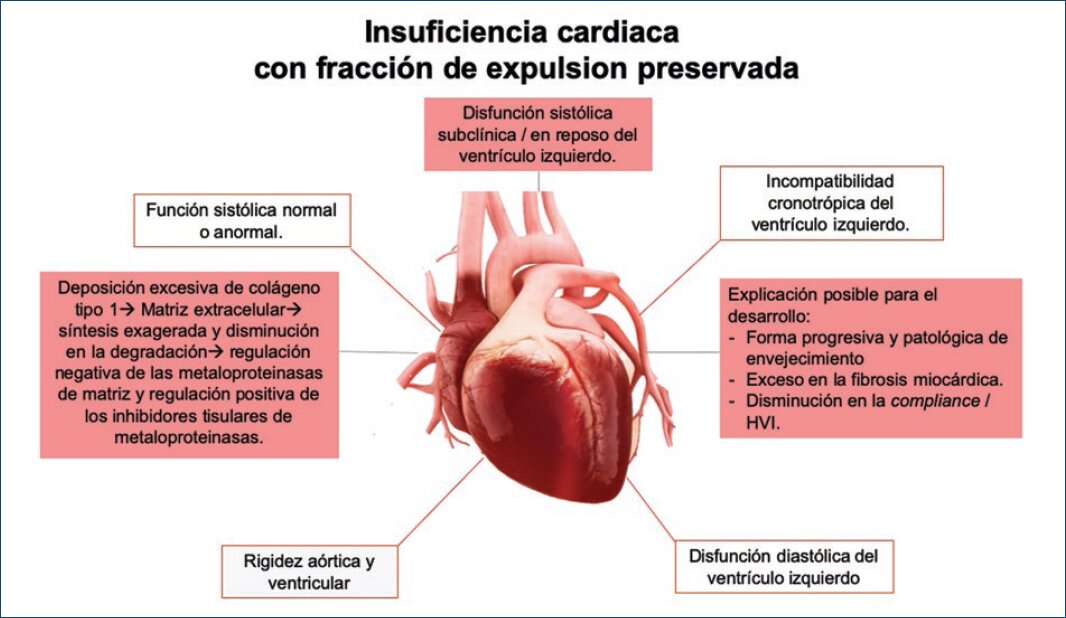
Figura 1 Diagrama esquemático que representa los diferentes mecanismos fisiopatológicos que intervienen en el desarrollo de ICFEp.
Un estudio del grupo Cardiovascular Health Study en EE.UU. demostró que los biomarcadores que reflejan fibrosis miocardica como el péptido carboxilo terminal del procolágeno tipo I, el telopéptido carboxilo terminal del colágeno tipo I y el péptido amino terminal del procolágeno tipo III están significativamente elevados en pacientes ancianos con ICFEp y que éstos se correlacionan con el diagnóstico de ICFEp incluso más que el péptido natriurético N-terminal protipo B (NTproBNP) o variables clínicas19. Estos resultados sugieren que la fibrosis miocardica es un factor importante en el desarrollo de la ICFEp.
Asimismo, la incompetencia cronotrópica y disminución de la reserva diastólica durante el estrés se han correlacionado de forma inversa con la distancia de caminata de los 6 minutos. También se ha documentado que la elevación de la presión sistólica de la arteria pulmonar en ejercicio > 45 mmHg logró identificar a la ICFEp con una sensibilidad de 96% y especificidad del 95%20-22. Este tipo de condiciones fisiopatológicos demostradas han abierto la puerta para buscar nuevas formas terapéuticas que puedan tener efecto en la supervivencia y mejoría de la calidad de vida.
Síntomas y calidad de vida en ICFEp
Los signos y síntomas de la IC suelen ser inespecíficos y no permiten diferenciar con claridad la IC de otras entidades clínicas (Tabla 2). En un estudio reciente en el que se comparó la prevalencia de los síntomas en pacientes con ICFEp contra ICFEr se demostró que las diferencias clínicas entre ICFEp/ICFEr parecen estar relacionadas con la edad y el género más que con el tipo de IC per se. Con base en el historial de síntomas, no fue posible diferenciar la ICFEp respecto de la ICFEr23.
Tabla 2 Signos y síntomas de la insuficiencia cardíaca ordenados por su frecuencia/infrecuencia y su especificidad o inespecificidad. (Adaptado a partir de Ponikowski, et al.4).
| Síntomas | Signos |
|---|---|
| Típicos | Más específicos |
| Disnea | Presión venosa yugular elevada |
| Ortopnea | Reflujo hepatoyugular |
| Disnea paroxística nocturna | Tercer ruido (S3) |
| Disminución de la capacidad de ejercicio | Impulso apical desplazado |
| Fatiga, astenia, mayor tiempo de recuperación tras el ejercicio Edema pretibial | |
| Menos típicos | Menos específicos |
| Tos nocturna, Sibilancias, Sensación de hinchazón, Pérdida de apetito, Confusión (sobre todo en el anciano), Depresión, Palpitaciones, Mareo, Síncope | Ganancia de peso (2 kg/sem), Pérdida de peso (en IC avanzada), Caquexia, Soplo cardíaco, Edema periférico (escrotal, tobillo, sacro), Crepitaciones pulmonares, Derrame pleural, Taquicardia, Pulso irregular Taquipnea, Respiración de Cheyne-Stokes, Hepatomegalia, Ascitis, Extremidades frías, Oliguria, Presión de pulso estrecha |
Los pacientes con ICFEp sufren intolerancia progresiva al ejercicio que altera de forma notable la actividad física de la vida diaria y causa un deterioro de los componentes de la calidad de vida mental y social24. En un estudio reciente se encontró que los pacientes ≥60 años hospitalizados con IC descompensada tienen alteraciones amplias y marcadas de la función física y altas tasas de fragilidad y cognición alterada: estas irregularidades son similares en ICFEp e ICFEr. Además, la depresión fue común y la calidad de vida se reducía y, de manera remarcable, ambas fueron peores en los pacientes con función sistólica preservada en comparación con la reducida25. Una intervención efectiva sobre este punto es el entrenamiento con ejercicio, que ha demostrado mejorar el estado emocional, las dimensiones físicas y sociales de la calidad de vida, así como los síntomas de depresión en comparación con la atención habitual26.
Biomarcadores en ICFEp
Los péptidos natriuréticos son los biomarcadores fundamentales en la IC. Su valor clínico se ha demostrado en todo el espectro de la función sistólica del VI, tanto ICFEp como ICFEri/ICFEr. Aunque en menor medida, en comparación con los pacientes con una reducción más acusada de la FE, tanto el BNP como el NT-proBNP se encuentran elevados y son elementos clave en el diagnóstico de ICFEp4. Los valores predictivos negativos son muy similares y altos (0.94-0.98), sea en casos agudos o en no agudos, pero los valores predictivos positivos son bajos en presentación crónica (0.44-0.57) y aguda (0.66-0.67)4. Por lo tanto, el uso de BPN se recomienda para descartar la IC, pero no para establecer el diagnóstico. Además, sus valores aumentan con otras anomalías morfológicas y funcionales cardíacas (que incluyen hipertrofia, fibrosis y disfunción diastólica)27. No existe un corte claro para distinguir la ICFEp de la ICFEr. Las propiedades pronósticas del BNP y el NT-proBNP se mantienen independientemente del grado de la disfunción sistólica del VI28. Las concentraciones circulantes de péptidos natriuréticos están influidos por varias afecciones cardíacas y extracardíacas, así como por la presencia de comorbilidades como fibrilación auricular y enfermedad renal que aumentan en grado significativo los valores plasmáticos de estos péptidos29.
Además de los péptidos natriuréticos, los pacientes con ICFEp han mostrado cifras significativamente más elevadas de biomarcadores de inflamación y fibrosis como sST2, hs-CRP y cistatina-C, en comparación con los pacientes con ICFEr quienes presentan mayores valores de NT-proBNP y troponina de alta sensibilidad29. Se ha demostrado el valor pronóstico para mortalidad del sST2 en ICFEp y es comparable al de ICFEr, sobre todo en entornos agudos. El Gal-3 participa en los procesos de inflamación cardiovascular, proliferación de fibroblastos y fibrosis, y el GDF-15 es un marcador de lesión celular e inflamación. Ambos circulan en concentraciones más altas en pacientes con ICFEp, con propiedades de diagnóstico y pronóstico para un mayor riesgo de muerte y hospitalización por IC30.
La activación de vías proinflamatorias es un elemento fundamental en la fisiopatología de ICFEp, en la que se observan cifras elevadas de citocinas inflamatorias, como TNF-α, IL-, IL-6, IL-8 y CRP. Los valores circulantes de receptores de TNF-α (TNFR1 y TNFR2) se relacionan con la gravedad de la disfunción diastólica y los síntomas. Existen otros biomarcadores participantes con la mayoría de los mecanismos fisiopatológicos, entre ellos el ADM, MR-proADM, el factor de von Willebrand, o la activación de RAAS, pero su efecto pronóstico y diagnóstico aún está bajo investigación31,32.
Estudios de imagen en ICFEp
El diagnóstico clínico de ICFEp tiene que apoyarse en mediciones objetivas de disfunción cardíaca en reposo o durante el ejercicio mediante ecocardiografía. Las directrices recientes de la Sociedad Europea de Cardiología (ESC) definen la ICFEp como una FEVI ≥ 50% y existencia de al menos uno de los siguientes criterios adicionales: cardiopatía estructural relevante (hipertrofia ventricular izquierda o agrandamiento de la aurícula izquierda) o disfunción diastólica4. Por otro lado, mediante técnicas invasivas es posible determinar parámetros hemodinámicos en reposo para evaluar las presiones de llenado (presión de enclavamiento pulmonar ≥ 15 mmHg o presión telediastólica ventricular izquierda ≥ 16 mmHg), seguido de la evaluación de estos parámetros durante el ejercicio para evaluar cambios en las presiones de llenado, la presión arterial sistólica (PAS) pulmonar, el volumen latido y el gasto cardíaco33,34. Es importante destacar que existe controversia en cuanto a los índices ecocardiográficos para diagnosticar ICFEp: las pautas de la ESC no especifican cuántas medidas de la función diastólica deben ser anormales para establecer un diagnóstico de disfunción diastólica, pero la Sociedad Americana de Ecocardiografía, la Asociación Europea de Imagen Cardiovascular y la Sociedad Británica de Ecocardiografía incluyen criterios para el diagnóstico de la disfunción diastólica35-37. La figura 2 resume las recomendaciones de diferentes sociedades para el diagnóstico de disfunción diastólica e ICFEp.

Figura 2 Compilación de las recomendaciones de diferentes sociedades para el diagnóstico de ICFEp y disfunción diastólica. *En presencia de signos y síntomas de IC; **En presencia de signos y síntomas de IC, valores positivos de péptidos natriuréticos y anomalías estructurales documentadas por imagen cardiovascular (incluida la disfunción diastólica). ASE: American Society of Echocardiography; BSE: British Society of Echocardiography; ESC: European Society of Cardiology; FEVI: fracción de expulsión del ventrículo izquierdo; AI: aurícula izquierda; HVI: hipertrofia del ventrículo izquierdo; ICFEr: insuficiencia cardíaca con fracción de expulsión reducida; ICFEri: insuficiencia cardíaca con fracción de expulsión en límite intermedio; ICFEp: insuficiencia cardíaca con fracción de expulsión preservada.
Tratamiento de ICFEp
Múltiples estudios clínicos de varios grupos de fármacos, incluidos los inhibidores de la enzima convertidora de angiotensina (IECA), antagonistas del receptor de angiotensina II (ARA-II), bloqueadores β (BB) y antagonistas de mineralocorticoides, han fallado en reducir tasas de mortalidad y, en algunos, tasas de rehospitalización38-45 (Tabla 3). En un metaanálisis de Shah, et al., en el que se incluyeron estudios como I-PRESERVE, PEP-CHF y CHARM-Preserved, no se identificó beneficio en cuanto a mortalidad y rehospitalizaciones en el grupo de fármacos que inhiben al sistema renina-angiotensina-aldosterona como lo son IECA y ARA-II46,47.
Tabla 3 Resumen de estudios clínicos en intervenciones terapéuticas en ICFEp (adaptado a partir de Ponikowski, et al.4)
| Estudio clínico | Intervención | Criterios mayores de inclusión | Media de seguimiento | Objetivos primarios |
|---|---|---|---|---|
| PEP-CHF38 | Perindopril vs. placebo | Índice de movilidad segmentaria > 1.4 (correspondiente a FEVI > 40%), IC sintomática tratada con diurético, disfunción diastólica por ecocardiografía, edad > 70 años | 2.1 años | No hubo diferencia en el combinado de mortalidad por todas las causas ni hospitalizaciones por eventos cardiovasculares (36% vs. 37%, p = 0.35) |
| I-PRESERVE39 | Irbesartán vs. placebo | FEVI > 45%, clase NYHA III-IV corroborada, o NYHA II con hospitalización en los últimos seis meses por IC, edad > 60 años | 4.1 años | No hubo diferencia en el combinado de mortalidad por todas las causas ni hospitalización por IC (24 vs. 25%, p = 0.54) |
| CHARM Preserved40 | Candesartán vs. placebo | FEVI > 40%, clase NYHA II a IV, antecedente de hospitalización cardiovascular | 3 años | Tendencia a una reducción de la mortalidad cardiovascular combinada u hospitalización por IC del 11% (22% vs. 24%, p = 0.12 no ajustada y p = 0.051 ajustada) |
| Aldo-DHF41 | Espironolactona vs. placebo | FEVI > 50%, clase NYHA II-III, VO2 pico menor que 25 ml/min/kg, disfunción diastólica en ecocardiograma o fibrilación auricular, edad > 50 años | 1 año | Reducción de E/e × de 1.5 (p menor que 0.001). Sin cambios en VO2 pico (p = 0.81) |
| TOPCAT42 | Espironolactona vs. placebo | FEVI > 45%, >1 signo de IC, >1 síntoma de IC, hospitalización reciente en los últimos 12 meses o BNP > 100 pg/ml o NT-proBNP > 360 pg/ml, edad > 50 años | 3.3 años | Sin diferencia en combinado de muerte cardiovascular, paro cardíaco abortado u hospitalización por IC (19% vs. 20%, p = 0.14) |
| SENIORS43 | Nebivolol vs. placebo | IC confirmada así como hospitalización en los últimos 12 meses por IC y/o FEVI menor que 35% en los últimos seis meses, edad > 70 años, 36% con FEVI > 35% | 1.8 años | Reducción en el combinado de mortalidad por cualquier causa u hospitalización cardiovascular del 14% (31% vs. 35%, p = 0.04) |
| DIG-PEF44 | Digoxina vs. placebo | IC con FEVI > 45%, ritmo sinusal | 3.1 años | Sin diferencia en el combinado de mortalidad por IC u hospitalización por IC (21% vs. 24%, p = 0.14) |
| PARAMOUNT45 | Sacubitril/valsartán vs. valsartán | IC con FEVI > 45%, clase NYHA II-III, NT-proBNP > 400 pg/ml | 12 semanas | Reducción de NT-proBNP; índice de cambio a sacubitril/valsartán de 0.77. Intervalo confianza de 65%, 0.64-0.92 (p = 0.005) |
| RELAX46 | Sildenafilo vs. placebo | IC con FEVI > 45%, clase NYHA II-IV, VO2 pico menor que 60% valor de referencia, NT-proBNP > 400 pg/ml o presiones de llenado del VI elevadas | 24 semanas | Sin cambio en VO2 pico (p = 0.90) |
VI: ventrículo izquierdo; FEVI: fracción de expulsión del ventrículo izquierdo; NYHA: clase funcional de la New York Heart Association; NT-proBNP: fragmento N-terminal del péptido natriurético tipo B; IC: insuficiencia cardiaca.
Las guías actuales de la ESC de insuficiencia cardíaca recomiendan el uso de diuréticos, con evidencia IB, en pacientes con ICFEp e ICFEr cuando se encuentren congestionados para el alivio de los síntomas. A su vez, hacen mención de que el nebivolol, espironolactona, digoxina y candesartán podrían disminuir la tasa de rehospitalizaciones, si bien no emiten recomendación clara al respecto4.
En la actualización de 2017, enfocada en el tratamiento de falla cardíaca de la guía ACC/AHA 2013, se menciona el control de la presión arterial y el uso de diuréticos para aliviar síntomas de sobrecarga de volumen, así como el control de afecciones adyacentes como la cardiopatía isquémica y la fibrilación auricular48. Además de estas medidas generales y resultados indirectos, ningún tratamiento farmacológico ha demostrado reducir la mortalidad en la ICFEp.
Necesidad de estudios en México
La insuficiencia cardíaca es un problema grave de salud en México. El envejecimiento poblacional y el incremento de la prevalencia de factores de riesgo como hipertensión y dislipidemia hacen suponer que el número de casos de ICFEp va en ascenso. Sin embargo, la ausencia de estudios regionales o nacionales magnifica la gravedad del problema. En la actualidad no se dispone de estudios prospectivos que delimiten la epidemiología, presentación clínica, factores de riesgo, pautas de tratamiento ni pronóstico de los pacientes con ICFEp en este país49.
Si se considera que las tasas de hipertensión, diabetes, obesidad y dislipidemia se equiparan a las de EE.UU. y superan a las de otros países del mundo, es posible que la tasa de hospitalizaciones y muerte a causa de ICFEp sea al menos similar a los registros de dichos países. Pese a que la última edición de las Guías de Práctica Clínica del CENETEC para el tratamiento de la IC ya incluye la definición de ICFEp, no se hace referencia a ningún dato o registro local en cuanto al pronóstico de estos pacientes.
Es por esto que la generación de datos locales con la finalidad de conocer el perfil, factores de riesgo, normas de tratamiento y pronóstico de los pacientes mexicanos con ICFEp debe ser un área a explorarse por los grupos de investigación cardiovascular de México.
Conclusiones
La insuficiencia cardíaca es un problema creciente en este país. La insuficiencia cardíaca con fracción de expulsión preservada representa un fenotipo que implica mayores dificultades en el diagnóstico y en el cual se carece de opciones terapéuticas que hayan demostrado modificar el pronóstico a futuro. Es necesario realizar estudios en México dedicados a conocer la epidemiología, presentación clínica, los patrones de tratamiento y el pronóstico de esta enfermedad.











 nueva página del texto (beta)
nueva página del texto (beta)


