Introducción
El manejo postoperatorio inmediato en cirugìa cardíaca debe realizarse en terapia intensiva cardiovascular, y requiere un equipo multidisciplinario con cardiólogos y/o médicos especialistas en medicina crítica con alta especialidad en terapia intensiva cardiovascular, así como con conocimientos avanzados en ecocardiografía crítica y ultrasonografía crítica (pulmonar, accesos vasculares, Doppler transcraneal, etc.). La detección temprana de complicaciones derivadas de la cirugía, la circulación extracorpórea y comorbilidades asociadas influyen de manera directa en el pronóstico del paciente. El uso de la ecocardiografía, transtorácica y transesofágica, ayuda al diagnóstico diferencial en los pacientes con inestabilidad hemodinámica, es un método a la cama del paciente, seguro, de bajo costo, y que debe estar disponible en todas las unidades de cuidados intensivos cardiovasculares1.
El acceso inmediato a la ecocardiografía las 24 horas del día, los 7 días de la semana, es clave para manejar la labilidad hemodinámica que es común después de la cirugía cardíaca. La ecocardiografía transesofágica es esencial para diagnosticar la causa de la inestabilidad hemodinámica en pacientes ventilados después de la cirugía cardíaca. Un estudio ecocardiográfico puede respaldar un diagnóstico de falla del ventrículo izquierdo (VI), hipovolemia e isquemia miocárdica, o identificar complicaciones quirúrgicas cardíacas como taponamiento, obstrucción dinámica del tracto de salida del VI secundaria a movimiento sistólico de la valva de la válvula mitral anterior o fallo agudo del ventrículo derecho (VD). La ecografía pulmonar realizada al mismo tiempo que la ecografía transtorácica (ETT) agrega información diagnóstica significativa que incluye la identificación de edema pulmonar, derrame pleural, consolidación y neumotórax2.
Por lo antes mencionado, los médicos intensivistas cardiovasculares deben tener formación y adiestramiento básico-avanzado en ecocardiografía crítica (transtorácica y transesofágica)2,3.
Generalidades
La recuperación de la homeostasis es uno de los objetivos primarios en el cuidado intensivo postoperatorio de la cirugía cardíaca, misma que se ve afectada por los cambios generados por el uso de la circulación extracorpórea, así como el fenómeno de isquemia-reperfusión en el corazón, hipotermia, trastornos en el sistema de coagulación, y efectos adversos de la terapia transfusional por sangrado4.
La valoración clínica debe complementarse con ultrasonografía enfocada, siguiendo protocolos establecidos para determinar la causa primaria del estado de choque y resolución de esta, así como posibles complicaciones a otros órganos.
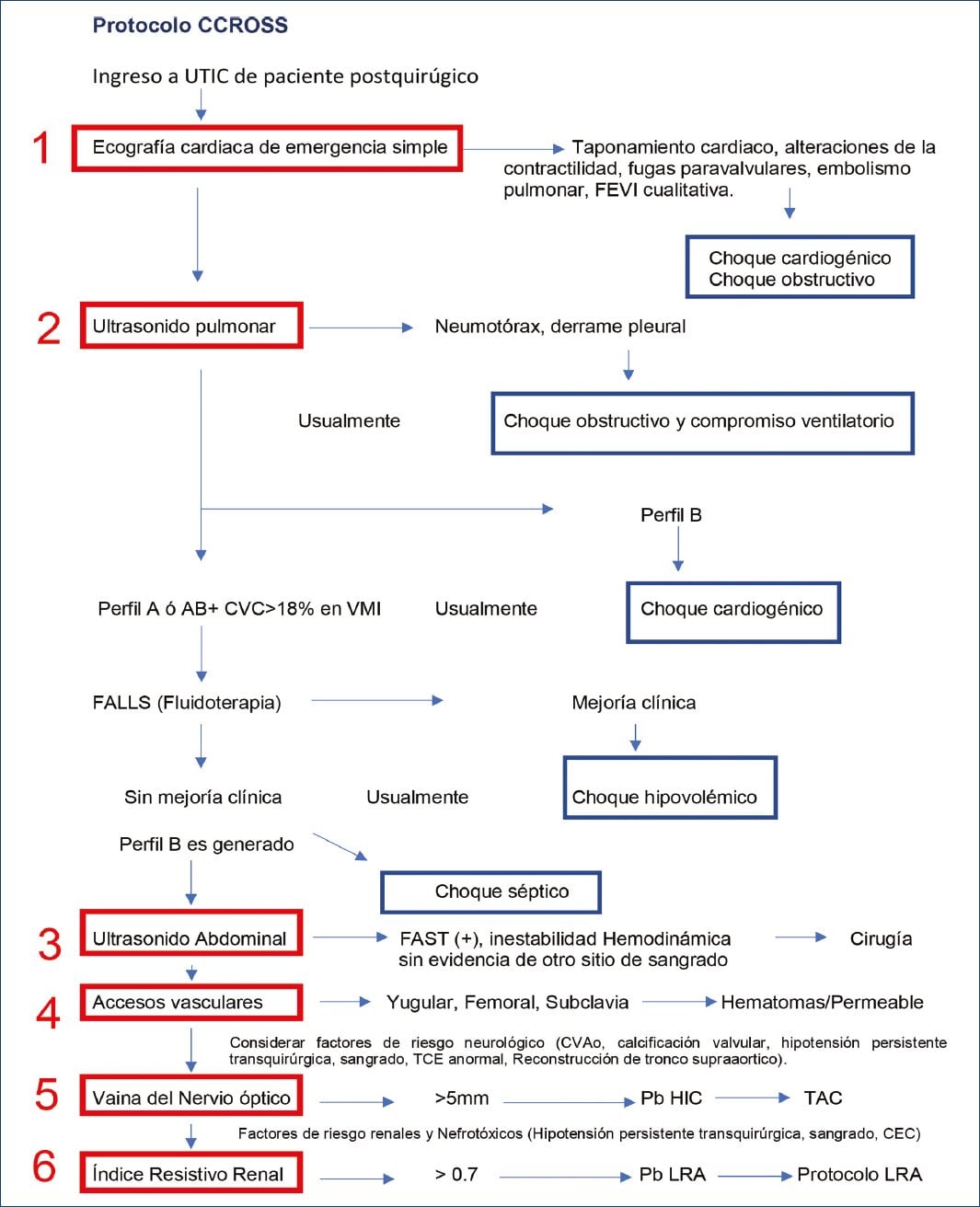
En el Instituto Nacional de Cardiología Ignacio Chávez de la Ciudad de México se propone un protocolo ultrasonográfico enfocado a pacientes posquirúrgicos cardiovasculares, que tiene como objetivo detectar etiología del estado de choque y posibles complicaciones en el posquirúrgico inmediato, así como su rápida resolución. El algoritmo desarrollado se basa en la adaptación de un protocolo específico para pacientes operados de cirugía cardíaca, enfocado a un análisis secuencial para la detección de choque (cardiogénico, hipovolémico, obstructivo), valvulopatías, alteraciones de la movilidad, disfunción protésica y valoración hemodinámica no invasiva. Por otro lado, determina afecciones en otros sistemas, tales como eventos vasculares cerebrales de tipo hemorrágico o isquémico secundario a procedimiento quirúrgico, bomba de circulación extracorpórea, anticoagulación y predecir lesión renal aguda, mediante el índice resistivo renal.
Es importante determinar el tipo de choque y sus causas5:
Choque cardiogénico. Hipoperfusión tisular, secundario a colapso circulatorio por falla de bomba cardíaca, infarto de miocardio, miocarditis fulminante, síndrome poscardiotomía, etc.
Choque hipovolémico. Con efecto de precarga cardíaca inadecuada secundario a pérdida del intravascular, por ejemplo; hemorragia postoperatoria, hemorragia gastrointestinal, uso excesivo de diuréticos, etc., poco aporte hídrico.
Choque distributivo. Coexiste una precarga cardíaca inadecuada debido a vasodilatación y fuga vascular; ejemplos típicos son el síndrome vasopléjico posbomba, el síndrome de respuesta inflamatoria sistémica posoperatoria, sepsis y la reacción anafiláctica.
Choque obstructivo. Precarga cardíaca inadecuada debido a obstrucción del retorno venoso; por ejemplo, taponamiento pericárdico, neumotórax a tensión, hipertensión intraabdominal u obstrucción del flujo sanguíneo arterial (p. ej., embolia pulmonar).
Alteraciones cardiohemodinámicas
El injerto de derivación aortocoronaria (ACBG) por estenosis de la arteria coronaria izquierda, enfermedad triple vaso y angina refractaria al tratamiento médico, es el procedimiento quirúrgico más común. Otros procedimientos quirúrgicos, junto con el ACBG o solo, incluyen reparación o reemplazo de válvulas, reparación de defectos congénitos o adquiridos y reparación o reemplazo de la raíz aórtica. Menos comunes son la extirpación de tumores intracardíacos y la aneurismectomía del VI6.
Mundialmente se reporta una mortalidad global de la revascularización miocárdica del 3.2%. Esta parece ser influenciada por la edad, siendo en los menores de 70 años del 2.6% y en los mayores de 70 años del 6%. La mortalidad en la cirugía valvular es aún mayor, siendo del 5 al 9%. Sin embargo, la mortalidad de los pacientes con cambio valvular mitral por isquemia es del 30%7.
La disfunción miocárdica es una consecuencia de isquemia o infarto perioperatorio, misma que requiere intervenciones específicas y posible revascularización. Corresponde al 5% de los pacientes estables y al 10% de los inestables, con una mortalidad del 10%7,8.
Sangrado mediastinal
Es una complicación que ocurre en el 5 al 25% de los pacientes, de los cuales se reintervienen entre el 2 y el 4%9,10. Dentro de las causas de bajo gasto se debe descartar el sangrado quirúrgico activo de las líneas de sutura o arterial. Si el sangrado es mayor de 10 ml/kg en la primera hora, 8 ml/kg en la segunda hora, 6 ml/kg en la tercera hora, o si suma más de 20 ml/kg en las 4 primeras horas o se produce un aumento súbito de la cantidad de sangrado, cumple los criterios de reintervención9,10. Christensen define como sangrado severo posquirúrgico el mayor a 200 ml/h a 1,500 ml en las primeras 8 h11.
Otra definición alternativa considera el sangrado > 400 ml en la primera hora, 300 ml en la primeras dos horas y 200 ml durante tres horas consecutivas12.
Así mismo, otro panel de expertos define el sangrado severo posquirúrgico como la pérdida de sangre a través de tubo endopleural mayor a 1,001-2,000 ml/h en las primeras 12 h o transfusión de 5-10 unidades de paquetes globulares o plasma fresco congelado13.
Taponamiento cardíaco
Debe sospecharse en el contexto de bajo gasto cardíaco postoperatorio. Este puede resultar de una colección relativamente pequeña de líquido pericárdico posterior con compresión asociada de una cámara cardíaca adyacente o una cámara localizada. En el periodo postoperatorio temprano, las colecciones pericárdicas suelen ser de sangre o coágulo sin drenar. El diagnóstico puede ser complicado, ya que signos clásicos, como el pulsus paradoxus, suelen estar ausentes, según la literatura su incidencia es del 1.9%. Se pueden encontrar colecciones posteriores en el 66% de los casos y difusas en el 34% de los pacientes. El colapso de la aurícula derecha es evidente en el 34%, de VD en el 27%, y el colapso ventricular izquierdo diastólico está presente hasta en el 65% de los casos. El hallazgo más frecuente es la disminución de flujo diastólico mitral y aórtico durante la inspiración10. La presión venosa central no necesita elevarse, aunque la presión venosa central en aumento frente a la hipotensión y el bajo gasto cardíaco con aumento progresivo de vasopresores e inotrópicos, debe ser sospecha de tamponade. La sospecha de acumulación de líquido pericárdico también se justifica cuando cesa bruscamente el drenaje del tubo torácico, situación a la que nos vemos enfrentados en los pacientes posquirúrgicos. La ecocardiografía de emergencia puede ser útil, aunque la sensibilidad de la ecocardiografía transtorácica es pobre, e incluso un ecocardiograma transtorácico «normal» no puede excluir el tamponade, por lo que está indicado un ecocardiograma trasesofágico14,15. Sin embargo, la exploración física y el comportamiento hemodinámico son la principal clave de sospecha de esta patología.
Falla de ventrículo izquierdo
Puede deberse a disfunción transitoria («aturdimiento») como resultado de un tiempo prolongado de bomba de circulación extracorpórea (BCE) y tiempos de pinzamiento aórtico, malperfusión coronaria, patología valvular y cambios en la poscarga o precarga. Instrumentos como la ecocardiografía puede ayudar a evaluar el estado del volumen y también a identificar anomalías de la pared segmentaria compatibles con isquemia y estenosis de la válvula o insuficiencia. La optimización de la precarga y la poscarga es esencial. Se puede indicar angiografía coronaria o reintervención quirúrgica para su revascularización. Si estas medidas no logran restaurar una perfusión adecuada, se debe considerar el soporte mecánico circulatorio15,16.
Falla de ventrículo derecho
Puede ser provocada por un aturdimiento post bypass, una malperfusión coronaria o una falla del VI. El VD es susceptible a cambios agudos en la poscarga y la precarga, y un aumento repentino en cualquiera de ellos puede precipitar una falla aguda del VD. El catéter de flotación de arteria pulmonar y ecocardiograma transtorácico son extremadamente útiles para evaluar la función de VD15,17.
Choque poscardiotomía
Se define como un índice cardíaco less than 2.2 l/min/m2, con adecuada precarga. Puede ser secundario a fracaso ventricular izquierdo y/o derecho y asociarse o no a congestión pulmonar. La presión arterial es normal o baja, con cuadro clínico compatible con bajo gasto cardiaco (GC): oliguria (diuresis inferiores a 0.5 ml/kg/h), saturación venosa central less than 60% (con saturación arterial normal) y/o lactato >3 mmol/l, sin hipovolemia. Tiene una incidencia del 8 al 10% con una mortalidad de hasta el 70%. Su diagnóstico diferencial es recalentamiento, anemia extrema, reacción alérgica, efecto farmacológico, sepsis hiperaguda, insuficiencia suprarrenal, hipertiroidismo o pancreatitis. Se caracteriza por disminución en las concentraciones de vasopresina endógenas. Su manejo incluye la optimización de la precarga y la utilización de vasopresores como noradrenalina y vasopresina15,18.
Está demostrado que la cirugía cardíaca incrementa el estado metabólico, lo cual produce desequilibrio entre el aporte y la demanda, especialmente en presencia de disfunción cardíaca y reserva cardiovascular limitada. El soporte cardiovascular posquirúrgico tiene como objetivo minimizar cualquier alteración sistémica o local entre el aporte y el consumo de oxígeno (VO2). Un incremento del VO2 entre el 10y el 20% ocurre en las primeras horas del posquirúrgico y permanece hasta las 48 h, especialmente en pacientes con soporte mecánico ventilatorio, dolor, ansiedad y delirio1,19.
Alteraciones pulmonares
Las complicaciones respiratorias son frecuentes en los pacientes posquirúrgicos de cirugía cardíaca y pueden ser consecuencia de factores inflamatorios secundarios a BCE, factores mecánicos y hemodinámicos (edema pulmonar cardiogénico por falla ventricular izquierda, valvulopatía mitral residual estenosis o insuficiencia)20.
Los cambios posquirúrgicos en la función pulmonar se relacionan con múltiples factores: anestesia general, relajación neuromuscular, esternotomìa y drenajes mediastìnicos y pleurales, edema pulmonar por hemodilución, sobrecarga de fluidos y disminución en la presión oncótica, edema intersticial provocado por la respuesta inflamatoria sistémica, daño pulmonar provocado por las transfusiones o por disfunción ventriculary compromiso hemodinámico15,20.
La disfunción pulmonar por la respuesta inflamatoria es bien tolerada en la mayorìa de los pacientes y se manifiesta con la disminución de la PaO2/FiO2, de la distensibilidad alveolar y aumento del agua pulmonar total. Los pacientes que desarrollan lesión pulmonar aguda se benefician de medidas de protección alveolar y en su caso de medidas de reclutamiento alveolar, para disminuir complicaciones secundarias a lesión pulmonar asociada a ventilación mecánica21,22.
Es frecuente también la aparición de derrames pleurales que no se deben puncionar a menos que causen deterioro respiratorio, o bien derrames pleurales mayores del 50%23.
El desarrollo de atelectasia posquirúrgica es etiológicamente multifactorial24,25:
Compresión del lóbulo inferior izquierdo en la disección de la arteria mamaria izquierda.
Parálisis frénica izquierda que ocurre en el 2.1% de los pacientes que reciben hipotermia tópica con la consecuente disfunción mecánica.
Atelectasias residuales después del colapso al suspender la ventilación mecánica durante la BCE.
Disminución del surfactante alveolar. La predisposición a atelectasias se incrementa en el postoperatorio por la presencia de dolor y los tubos de drenaje.
La tromboembolia pulmonar ocurre en el 3.2% de los pacientes, casi exclusivamente en los de revascularización, con una mortalidad del 19%24,25.
Se debe por lo tanto valorar la etiología de las alteraciones respiratorias, tanto clínicamente como mediante la utilización del ultrasonido pulmonar enfocado, sustentadas en el consenso internacional basado en la evidencia en ultrasonografía enfocada en pulmón, publicado por Volpicelli26.
Protocolo CCROSS (Cardiac, Cerebral, Renal, Optic nerve, lung ultraSound Study)
En el Instituto Nacional de Cardiología Ignacio Chávez se propone un protocolo ultrasonográfico enfocado a pacientes posquirúrgicos cardiovasculares, con el objetivo de detectar etiologías causales del estado de choque en estos pacientes. Se basa en la implementación de protocolos descritos en la literatura, utilizados en pacientes en estado de choque, abarcando: choque hipovolémico; consecuencia de sangrado por mala técnica quirúrgica o coagulopatía inducida, hemotórax, choque cardiogénico; posbomba, o por compromiso incidental de circulación coronaria, infarto perioperatorio, choque obstructivo, y neumotórax incidental por colocación de dispositivos transquirúrgicos. Por otro lado, también se persigue determinar afecciones en otros sistemas, tales como eventos vasculares cerebrales de tipo hemorrágico o isquémico secundario a procedimiento quirúrgico, bomba de circulación extracorpórea, anticoagulación, y al mismo tiempo y de forma temprana, predecir lesión renal aguda, mediante el índice resistivo renal.
Protocolo RUSH y protocolo FALLS
El Protocolo RUSH (Rapid Ultrasound in Shock) y el protocolo FALLS (Fluid Administration Limited by Lung Sonography) se basan en el manejo del choque de origen no determinado basado en la observación y hallazgos del ultrasonido torácico, mediante la evaluación de tres pasos27 (Fig. 1):
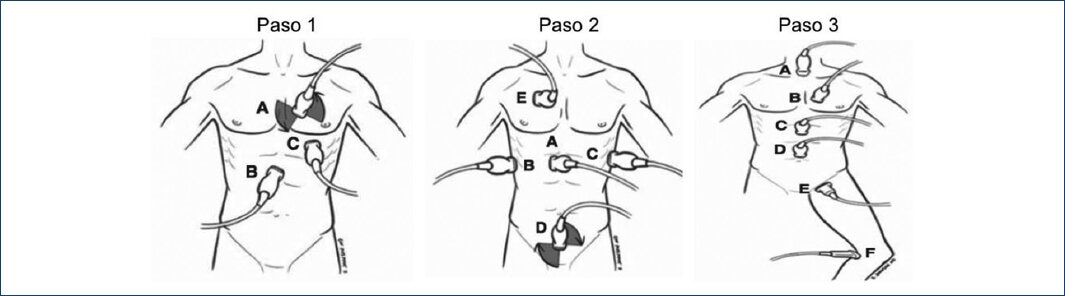
Figura 1 Ultrasonido rápido en choque (RUSH). Paso 1, evaluación de la «bomba»: vista paraesternal eje corto/largo (A), vista subxifoidea (B), vista apical (C). Paso 2, evaluación del «tanque»: eje largo IVC (A), vista pleural FAST (B), vista pleural FAST (C), pelvis/FAST (D), edema pulmonar, neumotórax (E). Paso 3, evaluación de las «tuberías»: aorta supraesternal (A), aorta paraesternal (B), aorta epigástrica (C), aorta supraumbilical (D), femoral (E), poplítea (F) (adaptado de Perera, et al., 201027).

Figura 2 Las cuatro vistas del escaneo Focus Assesment with Sonography for Trauma (FAST). A: cuadrante superior derecho. B: cuadrante superior izquierdo. C: vista suprapúbica. D: vista subxifoidea del corazón (adaptado de Giraldo-Restrepo, et al., 201532).eFAST: extendido a ápices pulmonares.

Figura 3 Vaina del nervio óptico (VNO). A: línea de referencia vertical desde la unión del nervio óptico con el globo ocular a 3 mm. B: corte transversal perpendicular de la VNO.

Figura 4 Curva obtenida por ultrasonografía Doppler del flujo sanguíneo. En la parte superior de la figura, patrón de flujo de arterias interlobares y arcuatas.
La «bomba», llamada así a la determinación de la funi#x00F3;n cardíaca, de tal forma que el primero en evaluar es el espacio pericaírdico, para determinar si el paciente tiene derrame que comprometa el estado hemodinámico. Segundo, se evalúa el VI para analizar la contractilidad global, determinación del tamańo y estado de la contractilidad en caso de choque cardiogénico. Tercero, se centra en determinar el tamańo relativo del VI en comparación con el ventrìculo derecho, lo cual es primordial para descartar compromiso de cavidades derechas e interdependencia ventricular27.
El «tanque», concepto conferido a determinar la condición de volumen intravascular mediante la vena cava inferior, por medio del tamańo y el índice de colapsabilidad, lo cual nos hace sospechar de choque hipovolémico y respuesta a volumen positivo27,28.
Las «tuberías», el último concepto que permite la evaluación de las grandes arterias y venas del cuerpo, conocido como «las tuberìas rotas u obstruidas», en busca de aneurisma abdominal y/o trombosis venosa profunda, esta última cuando existe falta de compresión venosa total poplítea o femoral, misma que además sugiere en un paciente hipotenso tromboembolia pulmonar masiva28.
Protocolo BLUE
El protocolo BLUE (Bedside Lung Ultrasound in Emergency) permite el diagnóstico de insuficiencia respiratoria aguda. El edema pulmonar, embolia pulmonar, neumonía, enfermedad pulmonar obstructiva crónica, asma y el neumotórax producen perfiles específicos, que pueden ser sospechados por medio de la implementación de este protocolo29 (Figura 5).
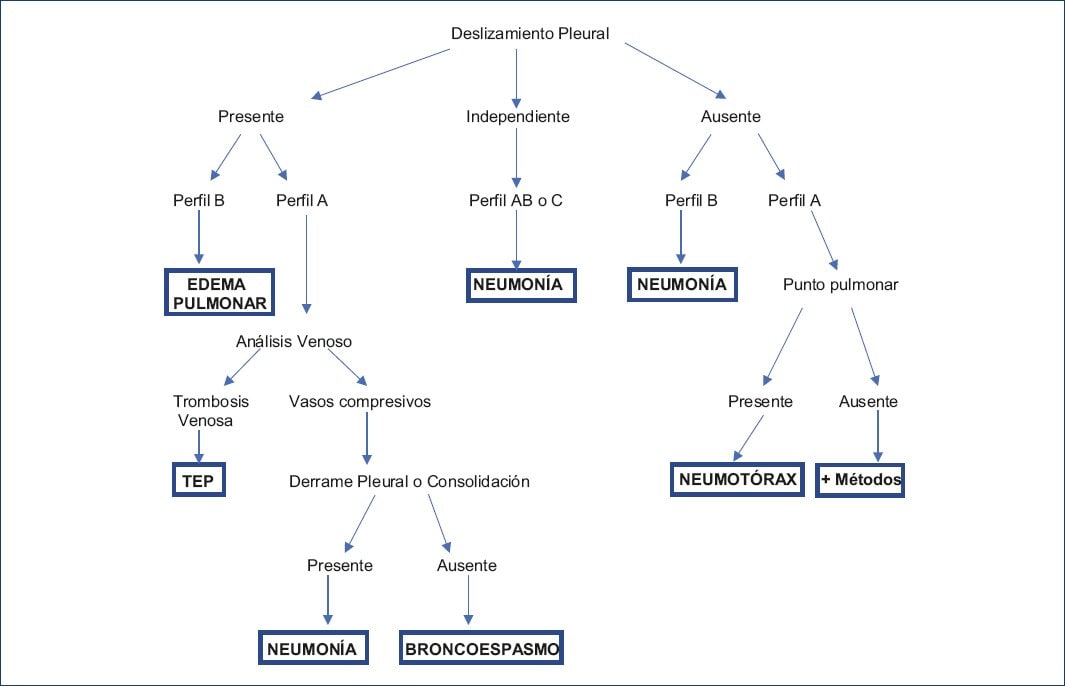
Figura 5 Protocolo BLUE. Algoritmo para valorar la insuficiencia respiratoria aguda de acuerdo con los patrones ultrasonográficos pulmonares. Perfil A: presenta deslizamiento pleural y líneas A. Perfil AB: perfil B, deslizamiento pleural en asociación con líneas B. Perfil B: presencia de líneas B, semideslizamiento pleural. Perfil C: presencia de consolidaciones o áreas de atelectasia, asociada o no a derrame pleural (adaptada de Lichtenstein, 201429).
Protocolo FALLS
El Protocolo FALLS (Fluid Administration Limited by Lung Sonography) adapta el protocolo BLUE a la falla circulatoria aguda. Realiza la búsqueda secuencial de choque obstructivo, cardiogénico, hipovolémico y distributivo mediante ecocardiografía simple en tiempo real y luego ecografía pulmonar para evaluar un parámetro directo de la volemia clínica: la aparición de líneas B, que sugieren la presencia de síndrome intersticial, se considera como el punto final para la terapia de fluidos30,31 (Figura 6).

Figura 6 Administración de líquidos limitada por ecografía pulmonar: el lugar de la ecografía pulmonar en la evaluación de la insuficiencia circulatoria aguda (protocolo FALLS) (adaptada de Lichtenstein, 201230).
FAST y eFAST
FAST y eFAST (extended Focused Assessment with Sonography for Trauma) puede ayudar a identificar líquido libre sugestivo de hemoperitoneo, hemotórax, hemopericardio, neumotórax, hemotórax y atelectasia32-35. La sensibilidad varía entre el 69 y el 98% para la detección de líquido libre, y del 63% para la detección de lesión de órgano sólido32, en cuanto a la especificidad es alta para la detección de líquido libre y órganos sólidos (94-100%). La sensibilidad de eFAST para el neumotórax y el hemotórax es más alta que la de la radiografía de tórax (11-21 frente a 43-77%)32,33. Se evalúa la ventana hepatorrenal, esplenorrenal, pélvica, subxifoidea y ápices pulmonares32-34 (Fig. 2).
Protocolo CCROSS, complicaciones neurológicas y medición ultrasonográfica de la vaina del nervio óptico
Las complicaciones neurológicas han sido una preocupación importante a lo largo de la historia de la cirugía cardíaca36.
Se producen complicaciones neurológicas, que incluyen ictus isquémico, lesión cerebral hipóxica isquémica, delirio y deterioro cognitivo, que conllevan una alta morbilidad y mortalidad. Por otra parte la hipertensión intracraneal, como complicación frecuente en los enfermos con lesión cerebral aguda, requiere de un diagnóstico y tratamiento temprano y oportuno para asegurar una mejor evolución37,38.
La incidencia de ictus isquémico postoperatorio (predominantemente tromboembólico) es de hasta el 4% para la revascularización coronaria y puede aumentar al 10% para los reemplazos valvulares y los procedimientos combinados, y este puede aumentar aún más con la presencia de fibrilación auricular perioperatoria39.
El delirio, a menudo del tipo hipoactivo, se desarrolla en el 25 al 50% de los pacientes después de una cirugía cardíaca y se asocia con deterioro cognitivo y aumento de la mortalidad40.
Existen factores de riesgo para el accidente cerebrovascular temprano y tardío después de la cirugía cardiovascular41,42 (Tabla 1):
Tabla 1 Factores de riesgo para el accidente cerebrovascular (ACV) temprano y tardío después de la cirugía cardiovascular
| ACV temprano o intraoperatorio | Enfermedad vascular periférica y de carótidas | - Cirugía cardíaca previa | Condición clínica inicial deteriorada | Disfunción ventricular izquierda | Estenosis de la circunfleja > 70% | Derivación de la arteria coronaria con corazón detenido | Derivación de la arteria coronaria con hipotermia y paro circulatorio | Elevación de creatinina preoperatoria | Aterosclerosis aórtica | Mayor tiempo en bypass cardiopulmonar | Edad avanzada |
| ACV tardío o postoperatoria | Estenosis principal izquierda | Diabetes | Uso disminuido de la arteria torácica | Sexo femenino | Angina inestable | Fibrilación auricular postoperatoria | Soporte inotrópico | ||||
| Ambos, temprano y tardío | Edad avanzada | Área de superficie corporal baja | Fibrilación auricular preoperatoria | ACV antiguo | Derivación de la arteria coronaria con hipotermia y paro circulatorio |
En la actualidad, disponemos de otras formas de valoración neurológica, más tempranas y menos invasivas, como lo es la medición del nervio óptico. Este es una prolongación del sistema nervioso central y, por lo tanto, está recubierto por meninges y lìquido cefalorraquìdeo, concepto anatómico que explica el papiledema que se presenta con el incremento en la presión intracraneana (PIC) y fundamento de los cambios en el diámetro de la vaina del nervio óptico como reflejo de las fluctuaciones de la PIC38.
En 1965 se realizó el primer reporte de ultrasonografìa del ojo. Hansen y Helmke postularon en 1997 por qué el incremento del diámetro de la vaina del nervio óptico (DVN) tiene una estrecha correlación con el incremento de la PIC43.
Recientemente se ha propuesto que la medición del diámetro de la vaina del nervio óptico a través de la ventana ocular puede ser un método no invasivo para la detección de hipertensión endocraneana, mediante la utilización de un transductor lineal de alta frecuencia (7-10 mhz). La explicación de esta medición se encuentra en que la porción más distal del nervio óptico está recubierta por la duramadre, formando una membrana conocida como vaina del nervio óptico44.
Ultrasonográficamente, el nervio óptico se identifica como la estructura hipoecoica de trayecto regular posterior al globo ocular. El estándar de medición requiere trazar una lìnea vertical que se inicia en la unión del nervio óptico con el globo ocular; esta lìnea es simplemente una referencia y debe medir 3 mm. Posteriormente se traza una lìnea horizontal de borde a borde del nervio óptico, esta segunda lìnea es la que mide el valor en milìmetros del nervio óptico43,44. Para la mayorìa de los autores revisados 5 mm es el punto de corte para que el estudio se considere positivo para hipertensión endocraneana45 (Fig. 3).
Protocolo CCROSS y complicaciones renales e índice resistivo renal
La extracción hepatoesplénica y renal de oxígeno se incrementan hasta en un 50% en el posquirúrgico inmediato de cirugía cardíaca. La lesión renal aguda es una de las complicaciones más frecuentes en el enfermo grave, ocurre en un 30% de los pacientes posquirúrgicos cardíacos, que se asocia a una elevada morbimortalidad46.
Los factores de riesgo asociados con la aparición de lesión renal aguda después de cirugía cardíaca incluyen: edad, hipertensión arterial previa, lesión renal preexistente, transfusión sanguínea, soporte inotrópico, duración de BCE, pinzamiento aórtico, hipoxia y hemodilución severa47.
La evaluación de la lesión renal aguda se realiza de manera convencional por medio de variables estáticas, las cuales se basan en marcadores tardìos de lesión renal como el volumen urinario, el filtrado glomerular y, aún más tardío, el nivel de creatinina. El ìndice resistivo renal (IRR) es un marcador de evaluación ultrasonográfica temprana de lesión renal aguda que se caracteriza por ser accesible, reproducible, cuantificable, dinámico y con una elevada sensibilidad, especificidad y capacidad pronóstica48.
Anatómicamente, las arterias renales derecha e izquierda son ramas directas de la aorta abdominal y se dividen a nivel del hilio renal en posterior y anterior; estas se dividen en arterias segmentarias y a su vez en arterias interlobares localizadas periféricamente rodeando las pirámides renales que al llegar a la unión corticomedular se dividen en arterias arcuatas. Son precisamente estas últimas ramas arteriales donde se mide la velocidad de flujo arterial. Se utiliza una técnica ultrasonográfica modo 2D para localizar el rińón y la técnica Doppler color para visualizar la irrigación renal. Se localizan las arterias de la unión corticomedular renal, y utilizando Doppler pulsado se genera una curva, la cual tiene un pico sistólico seguido de una meseta y finalmente el pico diastólico, el cual genera una curva caracterìstica49 (Fig. 4).
El IRR medido por ultrasonografìa Doppler fue descrito por Pourcelot con la siguiente fórmula:
El IRR es una herramienta útil para evaluar la resistencia vascular renal y se considera normal un rango comprendido de 0.60 a 0.70. Se recomienda la medición seriada (tres ocasiones) y hacer un promedio, no debe existir variabilidad > 10% para que se considere normal y reproducible50.
Existen otras variables que pueden generar confusión y modificar el valor del IRR. Destacan la disminución de la distensibilidad arterial, el incremento de la presión arterial, la frecuencia cardíaca, la edad, la presión intraabdominal y la existencia de lesión renal aguda (LRA), por lo que se debe poner especial atención en estas, ya que son variables que se alteran durante el posquirúrgico, incluida la cirugía cardíaca51.
Conclusiones
Esta revisión se realizó con el objetivo de plantear la necesidad de la creación de un nuevo protocolo ultrasonográfico enfocado en la valoración inicial de los pacientes posoperados de cirugía cardíaca, los cuales representan un reto para el clínico que se desenvuelve en la terapia intensiva cardiovascular. Actualmente, el ultrasonido es una herramienta de gran ayuda para el abordaje y toma de decisiones en los pacientes en estado crítico. Diversas sociedades han creado sus protocolos de abordaje, por lo que en el Instituto Nacional de Cardiología Ignacio Chávez, específicamente en la terapia intensiva cardiovascular, ha creado el protocolo CCROSS (Cardiac, Cerebral, Renal, Optic nerve, lung ultraSound Study)para el abordaje inicial de estos pacientes y se encuentra llevando a cabo actualmente un estudio para su validación, reproducibilidad y eficacia (Figuras 7 y 8).
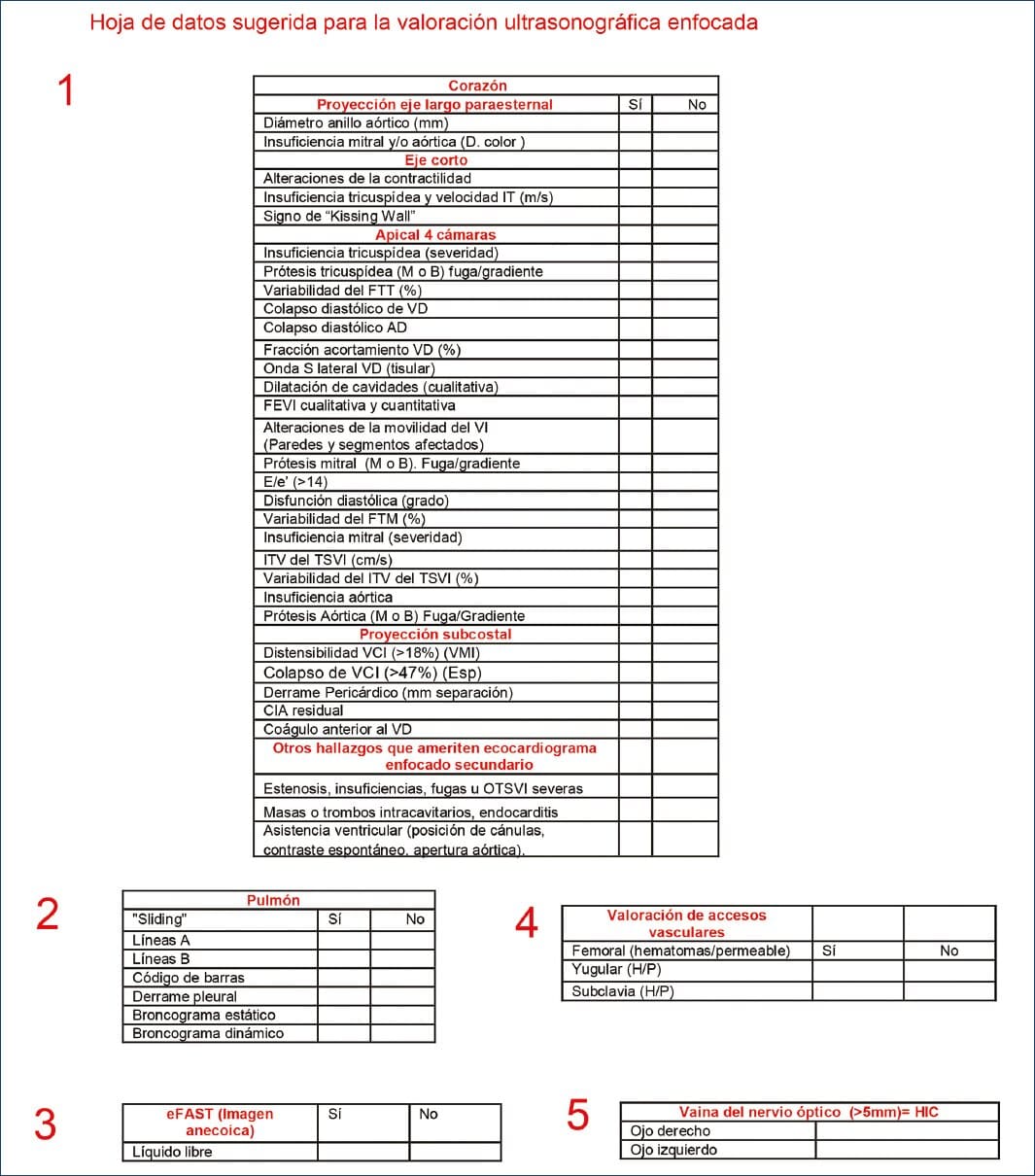
Figura 8 Hoja de datos sugerida para la valoración ultrasonográfica enfocada.IT: insuficiencia tricuspídea; M: mecánica: B: biológica; FTT: flujo transtricuspídeo; VD: ventrículo derecho; VI: ventrículo izquierdo; AD: aurícula derecha; FEVI: fracción de eyección del ventrículo izquierdo; ITV de TSVI: variabilidad del tracto de salida del ventrículo izquierdo; VCI: vena cava inferior; CIA: comunicación interauricular; OTSVI: obstrucción del tracto de salida del ventrículo izquierdo; H/P: hematoma, permeable.











 nova página do texto(beta)
nova página do texto(beta)