Introducción
La incidencia de la persistencia del conducto arterioso (PCA) en recién nacidos pretérminos se encuentra aumentada, especialmente en aquellos con peso menor de 1,000 gramos (59%) o con menos de 30 semanas de gestación (52%)1-6.
La ecocardiografía transtorácica es el estándar de oro para su diagnóstico. El impacto en la oxigenación de los tejidos dependerá de su significancia hemodinámica. En 2009 Sehgal, et al. definieron la persistencia de conducto arterioso (PCA) hemodinámicamente significativo (PCAHs) mediante criterios ecocardiográficos específicos7,8. La gran variabilidad de la repercusión hemodinámica del conducto a lo largo del tiempo hace necesario una monitorización continua del estado circulatorio del neonato, especialmente en los prematuros.
El índice de perfusión (IP), que se define como el radio de los componentes pulsátil y no pulsátil del flujo sanguíneo en un tejido periférico, se mide por medio de oximetría de pulso y representa la «fuerza» del pulso arterial. Se ha propuesto como un parámetro indirecto y no invasivo útil para la valoración del paciente en diversas situaciones, sobre todo del estado hemodinámico, principalmente sepsis o choque9-12.
Bajo la premisa de que con la PCA existe robo sanguíneo, se han hecho estudios intentando demostrar que el incremento del IP (ΔIP), es decir, el IP preductal menos el IP posductal, se encuentra incrementado en pacientes con PCAHs.
En 2013, Vidal, et al. determinaron que con la medición de un solo IP (posductal) no era suficiente para diferenciar pacientes con y sin PCAHs13, sin embargo, el mismo año Khositseth, et al., en Tailandia y con una muestra de 30 neonatos, encontraron que el ΔIP se encontraba incrementado. Fijando un punto de corte de ΔIP > 1.05, establecieron una sensibilidad (S) del 67%, una especificidad (E) del 100%, un valor predictivo positivo (VPP) del 100% y un valor predictivo negativo (VPN) del 86%14. Tres años después, Balla, et al. en la India encontraron la misma diferencia y determinaron con una muestra de 27 pacientes (10 sin y 17 con PCAHs) al día 1 con un punto de corte de ΔIP > 0.85: S = 80%, E = 94%, VPP = 88.9% y VPN = 88.9%, con una razón de verosimilitud positiva (RVP) de 13.33. Para el día 3 de vida y un punto de corte ΔIP > 0.95 se encontraron valores similares de sensibilidad, E = 88.2%, VPP = 80% y VPN = 88.2%, así como una RVP=6.7814.
No se han llevado a cabo estudios que validen estos resultados para el empleo sistemático de este tipo de monitorización en la unidad de cuidados intensivos neonatales (UCIN) en recién nacidos pretérmino para el escrutinio de PCA. El objetivo de nuestro estudio fue comparar los valores del ΔIP, medido con oximetría de pulso, con la PCA diagnosticado por ecocardiograma transtorácico a las 24 y 72 h de vida extrauterina en recién nacidos prematuros.
Material y métodos
Población
De julio de 2017 a junio de 2018 se reclutaron 43 recién nacidos pretérmino que ingresaron a la UCIN del Hospital Central Dr. Ignacio Morones Prieto. Se decidió no incluir a un paciente que presentó ventrículo izquierdo hipoplásico y se eliminaron 2 pacientes a quienes no se pudieron realizar el ecocardiograma o la medición del IP, además de no incluir a una paciente que tuvo sepsis temprana severa12, cuya madre tenía antecedente de corioamnionitis, quedando un total de 39 neonatos para su análisis. La edad gestacional de los neonatos, calculada por método de Capurro o Ballard, según fuera adecuado, osciló entre 26 y 34.2 semanas de gestación (mediana: 30.5; media: 30.5 ± 2.4 semanas), y su peso entre 0.66 y 1.8 kg (mediana: 1.1; media: 1.14 ± 0.3 kg).
Se realizó ecocardiograma transtorácico y medición de IP pre y posductal simultáneo, en dos ocasiones, a las 24 y 72 h de vida extrauterina previo consentimiento informado de sus padres o tutores. Para el cálculo de tamaño de muestra se tomó como base el estudio tailandés de Khositseth del 2013, siendo requerido al menos 8 pacientes por grupo (con y sin PCA), con una significancia (a) de 0.05 y una potencia (β) de 0.8 para probar la diferencia. Se definió PCAHs según Sehgal, et al. como cualquiera de los siguientes hallazgos: a) diámetro transductal > 1.5 mm, b) relación aurícula izquierda/aorta > 1.4:1, o c) flujo diastólico retrógrado en la aorta descendente > 30%7,8.
Dispositivos y variables
Todos los ecocardiogramas fueron realizados transtorácicamente por un solo cardiólogo pediatra, con un coeficiente de correlación intraclase intraobservador de 0.92 (IC 95%: 0.88-0.95), utilizando un ecógrafo Doppler color portátil SonoSite® TITAN, midiendo el diámetro de la aurícula izquierda, la raíz aórtica, la relación aurícula izquierda:aorta, el flujo de la aorta descendente y el diámetro del conducto arterioso (DCA) en caso de persistencia.
Para la medición del IP se usó el oxímetro de pulso Masimo SET® Radical-7 rainbow, registrado por un solo observador (ILB), en modalidad neonatal, midiendo simultáneamente a la ecocardiografía, con dos oxímetros independientes, el IP preductal (mediante un sensor colocado en la muñeca/mano derecha) y posductal (sensor colocado en tobillo/pie derecho), durante 10 minutos continuos, registrando la medición cada 20 segundos, y realizando un promedio de los 30 datos obtenidos en dicho periodo. Definimos el ΔIP como el IP preductal menos el IP posductal (Fig. 1). Las demás variables fueron tomadas de forma ordinaria por neonatólogos y enfermeras, tal como se registran en el expediente clínico del área de neonatología15.
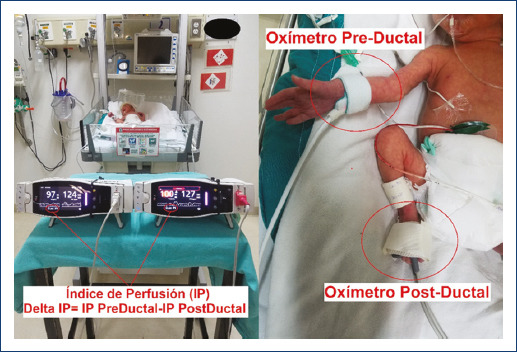
Figura 1 Fotografía de procedimiento de medición de índice de perfusión y su incremento.IP: índice de perfusión; Preductal: sensor colocado anterior a la presencia anatómica del conducto arterioso, es decir brazo derecho; Posductal: sensor colocado posterior a la presencia anatómica del conducto arterioso, es decir pie derecho.
Análisis estadístico
Se usó el programa R Studio® 3.5. Se probó normalidad de las variables continuas con la prueba de Shapiro-Wilk, según fuera apropiado; se expresan como media ± desviación estándar o mediana [rango intercuartílico]. Las variables categóricas como valor absoluto y porcentaje. Se empleó la prueba de t de Student o U de Mann-Whitney para variables continuas y la Y2 o prueba exacta de Fisher para variables categóricas. Se realizaron, además, correlaciones para las variables continuas por método de rho de Spearman, y para las correlaciones donde se encontró significancia estadística se realizó regresión lineal para predicción de valores.
Resultados
De los 39 pacientes analizados, 22 correspondieron al sexo masculino (56.4%) y 17 al sexo femenino (43.6%). Catorce pacientes (35.9%) tuvieron diagnóstico de PCA en las primeras 24 h, 2 de ellos sin significancia hemodinámica, mientras que solo en 9 (23%) persistió a las 72 h, 7 de ellos hemodinámicamente significativos. Ninguno de los neonatos presentó apertura del conducto previamente cerrado. La Tabla 1 muestra las características clínicas y hemodinámicas de los pacientes. No se encontraron malformaciones cardíacas distintas a PCA. El diámetro del conducto a las 24 h en los 14 pacientes fue de 1.93 ± 0.8 mm (rango: 0.3-4 mm) y los 9 pacientes con PCA a las 72 h de 2.22 ± 1.3 mm (rango: 0.2-4 mm). Diez de los pacientes (25.9%) fallecieron durante su internamiento, ninguno atribuida a causas cardíacas. Las causas fueron hemorragia intraventricular severa, sepsis neonatal tardía y choque séptico.
Tabla 1 Estadística descriptiva de nuestra muestra
| Variable | n = 39 (%) | Mediana [Q1, Q3] | Media ± DE | Rango |
|---|---|---|---|---|
| Edad gestacional (semanas) | 30.2 [29, 32.6] | 30.5 ± 2.4 | 26 a 34.2 | |
| Peso (kg) | 1.1 [0.9, 1.38] | 1.14 ± 0.3 | 0.66 a 1.8 | |
| Sexo (hombre) | 22 (56.4) | |||
| Esteroide prenatal | 16 (41) | |||
| Administración de surfactante | 22 (56.4) | |||
| Sospecha de sepsis temprana | 19 (48.7) | |||
| Tratamiento de PCA | 4 (10) | |||
| Días de estancia hospitalaria | 30 [20, 48.5] | 38.95 ± 28.7 | 4 a 140 | |
| Mortalidad | 10 (25.6) | |||
| Diagnóstico PCA a las 24 h | 14 (35.9) | |||
| IP preductal 24 h | 1.2 [0.85, 1.53] | 1.36 ± 0.9 | 0.27 a 4.15 | |
| IP posductal 24 h | 0.94 [0.65, 1.48] | 1.11 ± 0.7 | 0.32 a 3.35 | |
| ΔIP 24 h | 0.24 [0.06, 0.49] | 0.24 ± 0.8 | 2.12 a 2.76 | |
| Diámetro CA 24 h (mm) | 14 | 1.85 [1.6, 2.15] | 1.93 ± 0.8 | 0.3 a 4 |
| Relación AI: AO 24 h | 1.2 [1.1, 1.3] | 1.24 ± 0.2 | 0.9 a 2.2 | |
| Flujo aorta desc. 24 h (m/s) | 0.78 [0.56, 0.9] | 0.74 ± 0.3 | 0.25 a 1.9 | |
| Raíz aórtica 24 h (mm) | 6.8 [6.3, 7.3] | 6.67 ± 0.9 | 6.3 a 7.3 | |
| Aurícula izquierda 24 h (mm) | 8.4 [7.1, 9] | 8.4 ± 1.4 | 5.7 a 11.4 | |
| Diagnóstico PCA a las 72 h | 9 (23) | |||
| IP preductal 72 h | 1.31 [0.95, 1.84] | 1.44 ± 0.7 | 0.3 a 3.7 | |
| IP posductal 72 h | 0.97 [0.64, 1.24] | 1.07 ± 0.6 | 0.4 a 3.2 | |
| ΔIP 72 h | 0.27 [0, 0.63] | 0.27 ± 0.7 | 1.6 a 2.5 | |
| Diámetro CA 72 h (mm) | 9 | 2.7 [1.2, 3] | 2.22 ± 1.3 | 0.2 a 4 |
| Relación AI: AO 72 h | 1.2 [1.1, 1.3] | 1.23 ± 0.2 | 1 a 1.7 | |
| Flujo aorta desc. 72 h (m/s) | 0.8 [0.68, 0.9] | 0.76 ± 0.2 | 0.2 a 1.3 | |
| Raíz aórtica 72 h (mm) | 6.8 [6, 7.4] | 6.7 ± 1.2 | 4 a 8.8 | |
| Aurícula izquierda 72 h (mm) | 8.4 [7.5, 9.1] | 8.38 ± 1.4 | 4.7 a 11 |
Q1, Q3: cuartil 1, cuartil 3 (rango intercuartílico); DE: desviación estándar; PCA: persistencia de conducto arterioso; IP: índice de perfusión; DIP: incremento de índice de perfusión; desc.: descendente; CA: conducto arterioso; AI: aurícula izquierda; Ao: aorta.
En el análisis bivariante, comparando pacientes con y sin diagnóstico de PCA a las 24 y 72 h, como se observa en las Tablas 2 y 3, no se encontraron diferencias significativas en características basales como edad gestacional, peso, sexo, administración de esteroide prenatal, administración de surfactante o sospecha de sepsis temprana, así como en desenlace como mortalidad y días de estancia hospitalaria (p > 0.05).
Tabla 2 Comparativa por diagnóstico de PCA a las 24 h
| Variable | Diagnóstico de PCA a las 24 h | Valor de p | |
|---|---|---|---|
| No (25) | Sí (14) | ||
| Edad gestacional (semanas) | |||
| Mediana [Q1, Q3] | 30 [28, 33.1] | 30.85 [29, 31.9] | 0.77* |
| Media ± DE | 30.4 ± 2.69 | 30.6 ± 1.91 | |
| Peso (kg) | |||
| Mediana [Q1, Q3] | 1.21 [0.91, 1.46] | 1.07 [0.83, 1.25] | 0.23* |
| Media ± DE | 1.18 ± 0.31 | 1.06 ± 0.25 | |
| Sexo (hombre) | 15 (60) | 7 (50) | 0.54** |
| Admin. de esteroide prenatal | 13 (52) | 3 (21) | 0.06† |
| Admin. de surfactante | 15 (60) | 7 (50) | 0.54** |
| Sospecha de sepsis | 12 (48) | 7 (50) | 0.90** |
| Días de estancia hospitalaria | |||
| Mediana [Q1, Q3] | 29 [20, 48] | 32 [25, 51.5] | 0.80‡ |
| Media ± DE | 35.9 ± 22.8 | 44.2 ± 37.4 | |
| Mortalidad | 6 (24) | 4 (28) | 1† |
| IP preductal 24 h | |||
| Mediana [Q1, Q3] | 1.3 [0.97, 1.76] | 0.88 [0.70, 1.27] | 0.12‡ |
| Media ± DE | 1.4 ± 0.73 | 1.3 ± 1.06 | |
| IP posductal 24 h | |||
| Mediana [Q1, Q3] | 0.95 [0.68, 1.41] | 0.87 [0.52, 1.62] | 0.88‡ |
| Media ± DE | 1.08 ± 0.59 | 1.17 ± 0.86 | |
| DIP 24 h | |||
| Mediana [Q1, Q3] | 0.22 [0.06, 0.58] | 0.03 [0.27, 0.2] | 0.09‡ |
| Media ± DE | 0.31 ± 0.77 | 0.12 ± 0.92 | |
*t de Student.
**Chi cuadrada.
†Prueba exacta de Fisher.
‡U de Mann-Whitney.
PCA: persistencia de conducto arterioso; Q1, Q3: cuartil 1, cuartil 3 (rango intercuartílico); DE: desviación estándar; Admin.: administración; IP: índice de perfusión;
ΔIP: incremento del índice de perfusión.
Tabla 3 Comparativa por diagnóstico de PCA a las 72 h
| Variable | Diagnóstico de PCA a las 72 h | Valor de p | |
|---|---|---|---|
| No (n = 30) | Sí (n = 9) | ||
| Edad gestacional (semanas) | |||
| Mediana [Q1, Q3] | 30.1 [29, 32.85] | 31 [29, 31.5] | 0.78* |
| Media ± DE | 30.45 ± 2.45 | 30.7 ± 2.4 | |
| Peso (kg) | |||
| Mediana [Q1, Q3] | 1.07 [0.87, 1.33] | 1.3 [1.05, 1.45] | 0.25* |
| Media ± DE | 1.11 ± 0.3 | 1.23 ± 0.26 | |
| Sexo (hombre) | 16 (53) | 6 (66) | 0.47** |
| Admin. de esteroide prenatal | 15 (50) | 1 (11) | 0.056† |
| Admin. de surfactante | 18 (60) | 4 (44) | 0.46† |
| Sospecha de sepsis | 16 (53) | 3 (33) | 0.45† |
| Días de estancia hospitalaria | |||
| Mediana [Q1, Q3] | 37.5 [21.2, 48.7] | 25 [12, 29] | 0.33† |
| Media ± DE | 40.2 ± 28 | 34.5 ± 31.4 | |
| Mortalidad | 6 (20) | 4 (44) | 0.19† |
| IP preductal 72 h | |||
| Mediana [Q1, Q3] | 1.27 [0.99, 1.84] | 1.33 [0.82, 1.81] | 0.75* |
| Media ± DE | 1.46 ± 0.71 | 1.38 ± 0.63 | |
| IP posductal 72 h | |||
| Mediana [Q1, Q3] | 1.01 [0.69, 1.22] | 0.71 [0.53, 1.25] | 0.3‡ |
| Media ± DE | 1.1 ± 0.59 | 0.94 ± 0.56 | |
| DIP 72 h | |||
| Mediana [Q1, Q3] | 0.2 [0, 0.47] | 0.45 [-0.37, 0.76] | 0.47§ |
| Media ± DE | 0.35 ± 0.74 | 0.44 ± 0.52 | |
*t de Student.
**Chi cuadrada.
†Prueba exacta de Fisher.
‡U de Mann-Whitney.
PCA: persistencia de conducto arterioso; DE: desviación estándar; Q1, Q3: cuartil 1, cuartil 3 (rango intercuartílico); Admin.: administración; IP: índice de perfusión;
ΔIP: incremento del índice de perfusión.
Respondiendo al objetivo general, no se encontraron diferencias estadísticamente significativas en el ΔIP en pacientes sin y con PCA a las 24 h (0.22 [0.06 a 0.58] vs. 0.03 [0.27 a 0.2], p = 0.09) ni a las 72 h (0.2 [0 a 0.47] vs. 0.45 [0.37 a 0.76], p = 0.47).
Tampoco se encontraron diferencias en el IP pre y posductal aislado a las 24 y 72 h (Tablas 2 y 3).
Se realizaron asociaciones estadísticas entre los IP y las medidas ecocardiográficas, destacando una correlación positiva por rho de Spearman entre el DCA y el ΔIP (r: 0.78; IC 95%: 0.60-0.88; p = 0.01) en los 9 pacientes con PCA a las 72 h (Fig. 2). Para la veracidad de dicha asociación se realizó un power test con los 9 pacientes de dicha correlación, fijando el a en 0.05 y determinando una β de 0.7748061.
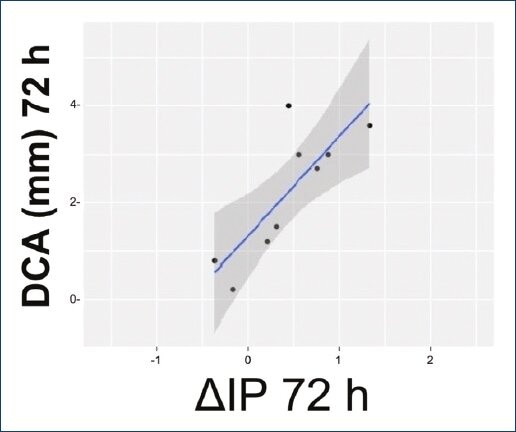
Figura 2 Gráfica de dispersión de datos con línea de regresión (r: 0.78; IC 95%: 0.60-0.88; p = 0.01).DCA: diámetro de conducto arterioso a las 72 h de vida; ΔIP: incremento del índice de perfusión a las 72 h de vida.
En la regresión lineal (DCA~ΔIP) se encontró una R2 = 0.66, error estándar residual = 0.82 y significancia estadística con p = 0.007. De este análisis de regresión, se obtuvo la siguiente fórmula para predecir el DCA con base en el ΔIP; DCA = 1.31 + (2.05 x ΔIP). Con base en esta fórmula, despejando el ΔIP y fijando el DCA necesario para repercusión hemodinámica, 1.5 mm, podríamos inferir que cuando el ΔIP sea ≥ 0.09, el conducto arterioso tendrá significancia hemodinámica.
Discusión
El presente estudio no demostró la utilidad del uso del IP y su incremento para el diagnóstico de PCAHs en neonatos pretérmino, al no lograr discriminar por este método la presencia o no del conducto arterioso, a diferencia de lo reportado en la literatura, incluso con resultados contradictorios, recordando que la hipótesis era que en presencia de PCAHs habría más robo de flujo sanguíneo hacia preductal, disminuyendo en el posductal y con ello el aumento del incremento, sin embargo en nuestros resultados a las 24 h hubo una tendencia hacia que el ΔIP fuera mayor en pacientes sin PCA. A las 72 h hubo una tendencia hacia el ΔIP mayor en los pacientes con PCA, sin embargo, no estadísticamente significativo (p = 0.47).
Después de la determinación del IP, se ha tratado de encontrar utilidad en patologías específicas para esta medición, predominantemente cardíacas y circulatorias, tales como cardiopatías congénitas estructurales y estados hiperdinámicos como sepsis severa12. Sin embargo, la alta variabilidad en los dispositivos que determinan este parámetro complica la reproducibilidad de dichos estudios. A diferencia de los resultados de nuestro estudio, Khositseth, et al. en 2013 con 30 pacientes y un punto de corte de ΔIP > 1.05 pudieron diagnosticar PCAHs con una sensibilidad del 66.7% y especificidad del 70%14. Por otro lado, Balla, et al., con solo 27 pacientes, fijaron el punto en 0.85, con una sensibilidad del 80%15. Estos resultados no pudieron ser replicados en nuestro estudio. En 2017, Gómez-Pomar publicó un artículo con 31 pacientes con monitorización continua, encontrando mayor utilidad en la variabilidad que en el valor crudo del ΔIP16. En nuestro estudio encontramos cierta similitud con los resultados de Alderliesten, et al., quienes en 342 neonatos reportaron un valor superior de IP posductal aislado en pacientes con PCAHS, atribuyéndolo a la circulación hiperdinámica que se traduce en aumento de la amplitud del pulso aunado a un componente con decreciente perfusión general10. Uno de los elementos reflexivos más predominantes es intentar entender en qué momento se debe definir el ΔIP, es decir: ¿se tendría que medir continuamente y registrar el cambio?, ¿tendría que ser a una hora definida?, ¿cuándo haya signos de repercusión hemodinámica ductal?
Durante la realización del subanálisis de los parámetros ecocardiográficos, se encontró una correlación positiva entre el DCA y el ΔIP en los 9 pacientes que persistían con conducto permeable a las 72 h de vida, es decir, el ΔIP es directamente proporcional al DCA, y por ende a su repercusión hemodinámica. Mediante un análisis de regresión lineal para predicción de valores se obtuvo una fórmula que nos permite estimar el diámetro del conducto a partir del ΔIP, esto podría resultar particularmente útil para la monitorización de este subgrupo de pacientes. Es decir, en un paciente diagnosticado por ecocardiograma con PCA a las 72 h de vida, la monitorización continua del IP pre y posductal permitirían estimar el diámetro en tiempo real mediante el ΔIP, y con esto, determinar la gravedad y repercusión hemodinámica de la PCAHs para su correcto tratamiento médico o quirúrgico.
Conclusiones
El IP es un parámetro de monitorización que podría ser útil en determinadas patologías, especialmente cardíacas y hemodinámicas, sin embargo, la alta variabilidad de su medición entre oxímetros limita su reproducibilidad. Resulta necesario unificar los valores obtenidos con los diferentes sistemas y marcas comerciales que miden el IP.
El ΔIP podría resultar una herramienta útil en la monitorización de pacientes diagnosticados con PCAHs mediante ecocardiograma a las 72 h de vida, y con ello estimar continua y dinámicamente el diámetro del conducto con su consecuente repercusión hemodinámica sobre el neonato. Se necesitan estudios posteriores para reproducir esta asociación y así utilizarlo de manera sistemática dentro de las salas de neonatología en este subgrupo de pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)


