Introducción
Desde que comenzó la estimulación cardíaca, la mayor preocupación era la sobrevida del paciente sin atender otros aspectos1,2. Treinta y cuatro años antes del primer implante de marcapasos intracavitario en humanos3, el fisió- logo Carl Wiggers describió en perros el deterioro de la función ventricular izquierda con la estimulación ventricular derecha4. En 1998, van Oosterhout et al.5 caracterizaron los cambios morfológicos producidos en el miocardio canino tras estimulación. Se postuló entonces la potencial relación de la asincronía y reducción de la «performance» miocárdica6.
En las últimas décadas del pasado siglo se describió, en humanos, algunos efectos nocivos de la estimulación en el ápex del ventrículo derecho (VD): hipertrofia ventricular asimétrica, dilatación ventricular, disposición anormal de fibras7, aumento de concentración miocárdica de catecolaminas8 y alteraciones de la perfusión9.
Con el fin de evitar los efectos nocivos de la estimulación en el ápex del VD, se han estudiado otros sitios alternativos para la estimulación como: tracto de salida de VD10; sin embargo, los resultados no han sido concordantes ni alentadores11,12.
La era de la resincronización cardíaca llevó a la introducción de la estimulación selectiva, en busca de reproducir la secuencia natural de despolarización13. En ese sentido, han sido evaluadas la estimulación del haz de His o para-His14-22 y la estimulación de las porciones media y alta del septo interventricular del VD23-36.
Ortega et al.37 demostraron, al estudiar el efecto electromecánico inmediato, que el sitio de estimulación que provocaba menor retardo en la pared libre del ventrículo izquierdo (VI), en pacientes sin trastorno de conducción intraventricular, era la región septal parahisiana, donde se lograba un complejo QRS de características similares al electrocardiograma (ECG) basal38.
Se ha planteado que el posicionamiento del electrodo ventricular derecho en las regiones media y alta del septo interventricular, con el auxilio de la anatomía radiológica y la evaluación del trazado electrocardiográfico es simple y de fácil reproducibilidad39,40, lo cual puede ser ejecutable en cualquier servicio que realice implantes de marcapasos cardíaco convencional39-44.
Conociendo los efectos deletéreos descritos en la función cardíaca con la estimulación en punta de VD y los cambios favorables expuestos en la literatura tras la estimulación en áreas cercanas al sistema de conducción, nos propusimos describir las diferencias electrocardiográficas y ecocardiográficas entre la estimulación en la región apical y la región septal del VD.
Métodos
Se realizó un estudio descriptivo longitudinal y prospectivo, en pacientes con fracción de eyección deprimida (≤ 35%) secundaria a estimulación en punta de VD en portadores de marcapasos DDD o VDD, tras 2 años de seguimiento; además, con complejo QRS angosto en el ECG previo a la estimulación apical. Se presume que la disfunción sistólica se debió a la estimulación en punta de VD, dado que no existieron otras causas identificadas de dicha disfunción. Esto último se descartó mediante interrogatorio y diversos estudios (ecocardiografía, coronariografía y estudio de perfusión miocárdica), para evitar sesgos en el estudio. A los pacientes seleccionados, se les implantó un electrodo en la región paraseptal alta, con el fin de estimular la región cercana al haz de His, lo que asumimos al comprobarse la presencia de complejos QRS angostos tras este sitio de estimulación se pretendía evaluar los efectos sobre la fracción de eyección de VI (FEVI).
Se seleccionó a 27 pacientes para el estudio en cuestión; la muestra quedó conformada por 24 tras criterios de inclusión y de salida, 22 varones y 2 mujeres, con rango de edad entre 40 y 65 años, promedio de 53 ± 5.1 años, de raza blanca y sin comorbilidades descritas en sus antecedentes personales, con FEVI previa al primoimplante del marcapasos de 59.2 ± 5.8% y un volumen latido de 115.78 ± 37.4 ml. Tres pacientes se excluyeron del estudio: 2, por umbrales altos (derivados a terapia de resincronización cardíaca) y uno que presentaba endocarditis infecciosa y que falleció en el posquirúrgico. De estos 24 pacientes, 9 habían recibido estimulación DDDR: 3 VDDR (con electrodo específico de estimulación VDD) y 12 VVIR, estos últimos por fibrilación auricular y bloqueo AV completo. Ninguno de los 24 pacientes era dependiente de la estimulación eléctrica, lo cual permitió desconectar el electrodo previo colocado en la punta del VD. En algunos casos se realizó la extracción total del electrodo de punta de VD.
Al derivarlos para la estimulación septal, se utilizó el marcapasos DDDR en los 12 pacientes que tenían previamente estimulación secuencial (DDDR y VDDR); se conectó el canal auricular de estimulación al electrodo ubicado en la aurícula derecha o al terminal de detección auricular de la modalidad VDDR, y el canal de estimulación ventricular, al electrodo de fijación activa que se colocó en región septal, todo con la finalidad de mantener la sincronía aurículo-ventricular. Los 12 pacientes restantes recibieron modalidad VVIR con un único electrodo en la región septal.
El sitio de estimulación, en la región septal, fue elegido mediante fluoroscopia (fig. 1). Se decidió el sitio del implante septal con un umbral ≤ 2 milivoltios (mV) y un registro electrocardiográfico con QRS más angosto (fig. 2) al previo (estimulación en punta de VD). Se programó frecuencia cardíaca de 80 latidos por minuto, con el objetivo de lograr un porcentaje de estimulación septal igual o superior al 90% en cada consulta de seguimiento, y así se consideró que los cambios en la geometría y la fracción de eyección ventricular fueron secundarios a la estimulación septal.
Criterios de inclusión
1. Pacientes que necesitaron implante de marcapasos permanente por ritmos lentos asociado a síntomas car- diovasculares.
2. Con disfunción sistólica secundaria a la estimulación en punta de VD que se hayan descartado otras causas de disfunción sistólica.
3. Que presentaban ECG con QRS estrecho (≤ 100 ms) en su conducción intrínseca.
4. Que presentaban, previo a la estimulación en punta de VD, una FEVI conservada ≥ 50%.
5. Que se diagnosticó ecocardiográficamente disfunción sistólica del VI (FEVI ≤ 35%), con clase funcional ii a iv de la NYHA (Clasificación funcional de la insuficiencia cardíaca), en el seguimiento de pacientes con estimulación en punta de VD.
6. Que el porcentaje de estimulación, tanto en punta de VD como en región septal, fuera ≥ 90%.
Criterios de exclusión
--- Personas que abandonaron el estudio.
--- Personas que fallecieron por otra causa no relacionada con la estimulación eléctrica.
--- Desplazamiento del electrodo o aumentos muy exagerados de los umbrales a nivel del septum interventricular, que obligaron a tomar otra conducta terapéutica en cuanto a los sitios de estimulación.
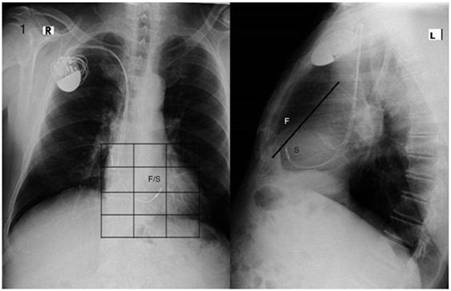
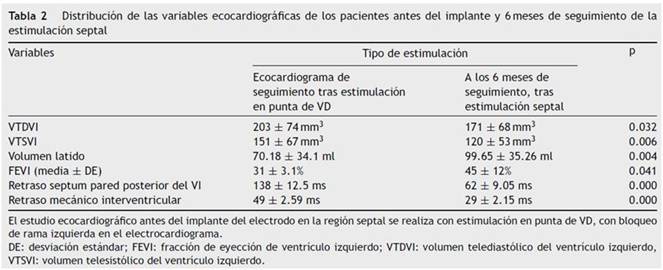
Figura 1 A la izquierda: vista posteroanterior, la punta del electrodo ventricular se encuentra en una cuadrícula que corresponde a cualquiera de las 2 regiones, septal (S) o pared libre (F) de ventrículo derecho. A la derecha: vista lateral, encontrándose la punta del electrodo por debajo de la línea recta; se corrobora que se encuentra en el área que corresponde a la región septal.
Figura 2 Electrocardiograma del paciente que se muestra en las radiografías de la figura 1. Obsérvese la estimulación DDD. Después de la espiga bipolar en la estimulación ventricular, se observa seudodelta de la captura precoz de la masa ventricular (mejor observada en DI, V5 y V6) y un QRS angosto, correspondiente a la estimulación septal capturando tempranamente el sistema de conducción.
Al culminar el implante, se programó un voltaje de estimulación en 7 V y frecuencia de 80 latidos por minuto, con el fin de asegurar la estimulación el mayor tiempo posible. El seguimiento fue realizado de manera semanal durante 2 meses y mensual hasta los primeros 6 meses del implante. En el posterior seguimiento, y al estabilizarse el umbral crónico, se programó una amplitud del doble de la hallada. Se les realizó ecocardiograma a los 3 y 6 meses, y se describieron los resultados de este último.
Se cuantificaron los siguientes parámetros:
1. ECG:
--- ECG: anchura máxima del QRS: duración máxima del complejo QRS, en las 12 derivaciones del ECG.
--- Anchura mínima del QRS: duración mínima del complejo QRS, en las 12 derivaciones del ECG.
--- Dispersión del QRS (dQRS): diferencia entre el mayor y el menor valor del QRS medido en el ECG de 12 derivaciones durante estimulación en punta de VD y septal. El QRS fue medido manualmente por 2 observadores, con velocidad de registro del ECG: 25 mm por segundo; amplitud: 10 mm por mV. Se consideró QRS desde el inicio de la onda q o R hasta el punto J en el inicio del segmento ST. Fueron medidos los ECG con ritmo de marcapasos durante estimulación en punta de VD y región septal.
2. Ecocardiograma:
--- FEVI.
--- Volumen latido: es la cantidad de sangre eyectada en una sístole cardíaca.
--- Volumen telesistólico del VI, volumen medido al final de la sístole del VI.
--- Volumen telediastólico del VI, volumen medido al final de la diástole del VI.
--- Retraso mecánico interventricular: diferencias entre los periodos eyectivos de ambos ventrículos; se mide desde el inicio del QRS hasta el inicio del espectro de flujo de tracto de salida del VI y el VD.
--- Retraso del septo de pared posterior: en modo M y eje largo paraesternal, perpendicular a los segmentos basales, se mide desde el pico de la contracción sistólica del septum hasta el de la pared posterior.
Análisis estadístico
Se utilizó una base de datos creada en el paquete estadístico SPSS v.17.0 para Windows. Se comprobó la distribución normal de la muestra y se obtuvo p > 0.05 para la prueba Shapiro-Wilk, lo que nos permitió realizar otras pruebas paramétricas. La propia muestra fue estudiada en 2 momentos: los datos tomados durante la estimulación en punta de VD y los obtenidos durante la estimulación en la región septal. Fueron comparados los resultados derivados de los 2 momentos del estudio.
Se realizaron la distribución de la frecuencia de las variables numéricas en estudio y las comparaciones de medias y regresión lineal para comprobar la existencia de asociación estadística: significativa (p ≤ 0.05), altamente significativa (p ≤ 0.001) y no significativo (p ≥ 0.05).
Ética
Se solicitó y se obtuvo la aprobación de los consejos científicos del Cardiocentro Ernesto Che Guevara y de la Universidad Médica de Villa Clara y, de igual manera, se hizo saber a cada paciente los objetivos del estudio; además, se les informó sobre la opción de la resincronización cardíaca. Se cumplió con los requisitos de estudios en humanos aprobados en el acuerdo de Helsinki.
Resultados
La duración máxima del QRS y su dispersión (tabla 1) mostró un QRS máximo de 178.12 ± 14.31 durante estimulación en punta de VD vs. 103.17 ± 3.43 con estimulación septal (p < 0.001). La dQRS durante la estimulación en punta de VD (45.07 ± 4.83 ms) vs. 33.15 ± 2.14 ms en la región septal (p < 0.001).
Las variables ecocardiográficas (tabla 2) mostraron diferencias significativas. Tras 2 años de estimulación en punta de VD, se constató una FEVI media de 31 ± 3.1% vs. 45 ± 12%, a los 6 meses postestimulación septal, p = 0.041.
El volumen latido hallado fue de 70.18 ± 34.11 ml durante estimulación en punta de VD con disfunción sistólica comprobada, luego ascendió a 99.65 ± 35.26 ml a los 6 meses de seguimiento, tras estimulación septal, p = 0.004. Los volúmenes telediastólicos en disfunción sistólica fueron 203 ± 74 mm3 y decrecieron a los 6 meses de estimulación septal hasta 171 ± 68 mm3, p = 0.032. Los volúmenes telesistólicos disminuyeron desde 151 ± 67 mm3 (estimulación en ápex) hasta 120 ± 53 mm3 (tras 6 meses de estimulación septal), p = 0.006. El retraso septum pared posterior del VI, 138 ± 12.5 ms vs. 62 ± 9.05 ms, p = 0.000, y el retraso mecánico interventricular 49 ± 2.59 ms vs. 29 ± 2.15 ms, p = 0.000.
Una correlación entre FEVI y dispersión del QRS (fig. 3) mostró r = 0.18 y p = 0.32, mientras los pacientes presentaban disfunción sistólica secundaria a la estimulación en punta de VD (bloqueo de rama izquierda por estimulación en punta de VD). A los 6 meses de seguimiento, postestimulación septal, demostró tener significación estadística con coeficiente negativo (r = ---0.51 y p = 0.020).
Discusión
El Protect-Pace study45 mencionó las dificultades técnicas al implantar el electrodo en la región septal; sin embargo, The SEPTAL Study46 hizo mención a la factibilidad a la hora del implante del electrodo de fijación activa en la región septal al usar las vistas radiológicas y la comprobación de un ECG más angosto, según criterios del electrofisiólogo durante el implante.
Ortega et al.47 refirieron que, a pesar de que el QRS de la estimulación septal parahisiana es más ancho, ello
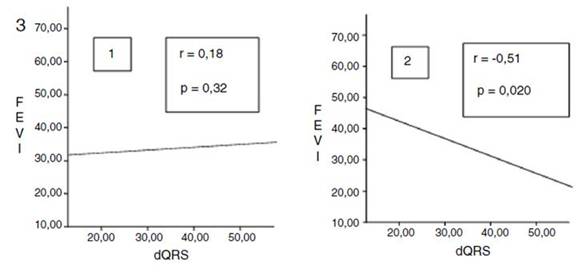
Figura 3 Correlación entre fracción de eyección del ventrículo izquierdo y la dispersión del QRS, durante la disfunción sistólica (1) y a los 6 meses de seguimiento postestimulación septal interventricular (2).
no implicaba cambios significativos en el tiempo de la despolarización de la pared libre posterobasal del VI, lo cual mejoraba la sincronía por una despolarización y contracción similares a la fisiológica.
Lange et al.48 evaluaron, en pacientes con buena fracción de eyección, 2 sitios diferentes de estimulación de VD. La disincronía evaluada mediante ecocardiografía a corto, medio y largo plazo no evidenció diferencias a favor de la estimulación medioseptal en la disincronía intraventricular (grupo A: 14.44 ± 19.76 ms vs. grupo B: 9 ± 36.45 ms; grupo A: 6.11 ± 62.11 ms vs. grupo B: 13 ± 38.31 ms; grupo A: 77 ± 53.51 ms vs. grupo B: 24.29 ± 80.90 ms, p = NS), como tampoco en la disincronía interventricular (grupo A: 46.44 ± 19.76 ms vs. grupo B: 42.20 ± 29.56 ms; grupo A: 45.33 ± 45.67 ms vs. grupo B: 29.80 ± 44.66 ms; grupo A: 46.38 ± 20 ms vs. grupo B: 21 ± 27.20 ms, p = NS) a las 48 h, 5 meses y 48 meses, respectivamente.
Victor et al.49 demostraron la presencia de un QRS más angosto y a los 3 meses de seguimiento una mejoría de la FEVI en los pacientes estimulados en septum interventricular, resultado este que se demostró en nuestro estudio. Alhous et al.50, también observaron incrementos en la FEVI y mejoría de la sincronía de pacientes estimulados en septum interventricular medio, comparados con los estimulados en ápex de VD. Otros autores51,52 describieron mejoría del rendimiento regional y global del VI con la estimulación septal.
Barja et al.53 plantearon que en los pacientes sin trastornos de la conducción existe el consenso de que la estimulación septal, al seguir los caminos naturales de la conducción aurículo-ventricular, la convierte en una estimulación absolutamente más fisiológica, mayormente en aquellos cuya función del VI tiene un deterioro moderado, ya que evitaría la disincronía por el bloqueo de rama izquierda, producido por la estimulación estándar. Y plantearon que tan importarte es tratar de sincronizar como de no desincronizar.
A pesar que el estudio Providing Regional Observations to Study Predictors of Events in the Coronary Tree (PROSPECT)54 puso en dudas los resultados de la ecocardiografía para evaluar la asincronía mecánica como respuesta a la terapia de resincronización, subestudios de este dan valor a ella55; es por eso que se decidió evaluar por ecocardiografía el retraso preeyectivo y septo-pared posterior del VI durante estimulación en punta de VD (BRIHH) y desde la región septal alta. Resultados que coinciden con los nuestros, donde apareció una mejoría de la FEVI y la reducción ≥ 15% del volumen telesistólico del VI, con disminución de la disincronía mecánica, tras estimulación septal.
La controversia en busca de un sitio de estimulación permanente quizás con QRS más angosto y menor disincronía, para evitar los efectos deletéreos de la estimulación en ápex de VD, al parecer no ha terminado, pues el estudio The Homburg Biventricular Pacing Evaluation (HOBIPACE)56 demostró que la estimulación biventricular fue superior a la estimulación univentricular en el VD al reducir diámetros telediastólicos del VI y mejorar la FEVI. El Protect-Pace study45, por su parte, demostró un decremento de la FEVI independientemente del sitio de estimulación (ápex o septum); en el propio estudio se mencionaron otros que sugieren la estimulación septal como alternativa para evitar efectos nocivos de la estimulación en ápex del VD. Cano et al.57 encontraron menos disincronía mecánica en el grupo de pacientes con estimulación septal al compararlos con la apical de VD y sugirieron en su estudio que la estimulación septal puede ser una alternativa para evitar los daños de la estimulación en ápex de VD. Yoshikawa et al.58, por estudio Doppler tisular, también describieron menor disincronía en pacientes con estimulación septal comparados con otro grupo con estimulación en ápex de VD.
Chávez González et al.59 propusieron considerar que a menor dispersión del QRS en pacientes resincronizados, existe menor disincronía mecánica. En el presente estudio, al disminuir la anchura del QRS con la estimulación en la región septal y presentar menor dispersión del QRS, se demostró una disminución de la disincronía mecánica y se obtuvo una mejoría en la FEVI tras 6 meses de seguimiento con estimulación septal. Chan et al.60 concluyeron que la mayor duración del QRS ocurrió al estimular el ápex de VD vs. región septal (152.2 ± 19.6 vs. 140.4 ±14.3 p = 0.032) y estos podían predecir cambios en los volúmenes de VI y en la FEVI.
Con los resultados encontrados en nuestro estudio, donde se demostró que a menor dispersión del QRS mejoraba la sincronía mecánica y así se incrementaba la FEVI, puede sugerirse la búsqueda de puntos de corte de la duración y dispersión del QRS que demuestren sincronía vs. disincronía mecánica, lo cual ayudaría a encontrar respuestas, si existe o no alguna utilidad para la dispersión del QRS en la práctica clínica61.
Los rayos X y el ECG (figs. 2 y 3) pertenecen a un paciente de 56 an˜os de edad, con los criterios de inclusión para el estudio con estimulación septal (léase el pie de la figura); este colectivo de autores ha considerado que la metodología radiológica de la ubicación de la punta del electrodo en la cuadrícula en vista posteroanterior y por detrás de la línea en lateral es correcta; sin embargo, puede reflexionarse que la ubicación en la cuadrícula depende de varios factores: eje anatómico ápico-basal del corazón, rotación del corazón sobre ese eje, fenotipo del paciente (longilíneo o brevilíneo) y la magnitud de la cardiomegalia. Sin embargo, cuando se corrobora al unísono la posición radiológica del electrodo con las características del ECG (fig. 3), es posible lograr una mejor aproximación al deseo de una estimulación septal que invada precozmente el sistema de conducción con las características deseadas. También hemos observado que en sitios radiológicos similares de estimulación, la anchura del QRS probablemente depende del grado de dilatación del VI, quizás relacionado con el grado de fibrosis intersticial, pues a mayor dilatación del VI más ancho son los QRS resultantes en la estimulación septal.
Hemos considerado, de los resultados de este estudio, que la estimulación septal en pacientes con disfunción sistólica secundaria a estimulación en ápex es una alternativa a la estimulación biventricular, ya que los resultados en esta pequeña muestra fueron alentadores.
Conclusiones
Se demostró un decremento de la FEVI, así como de la disincronía mecánica intra e interventricular en la muestra estudiada como efecto deletéreo de la estimulación en punta de VD. Se demostraron incrementos en la FEVI con disminución de los volúmenes telediastólicos y telesistólicos al realizar la estimulación septal. En el ECG de la estimulación septal, a menores valores de dispersión del QRS se observaron mayores incrementos de la FEVI. Por lo cual la estimulación septal puede constituir un sitio de elección al estimular pacientes con disfunción sistólica del VI secundaria a la estimulación convencional, probablemente por una mejoría en la sincronía electromecánica.











 nueva página del texto (beta)
nueva página del texto (beta)