Introducción
El síndrome de la cimitarra se caracteriza por la conexión anómala de las venas pulmonares derechas en la porción suprahepática de la vena cava inferior o a la aurícula derecha, por encima de la desembocadura de esta vena (fig. 1). El síndrome incluye dextroposición del corazón debido al grado de hipoplasia del pulmón derecho y de la rama derecha de la arteria pulmonar, anomalías sistémicas de la irrigación arterial del pulmón derecho (arterias colaterales aortopulmonares que pueden originar cortocircuito de izquierda a derecha), secuestro broncopulmonar del lóbulo inferior con displasia de los bronquios derechos superior o medio y otras alteraciones extracardíacas y cardíacas; entre estas últimas la más frecuente es la comunicación interauricular. El colector venoso que recoge la sangre de las venas pulmonares derechas tiene un trayecto curvo que se evidencia en la radiografía y que ha sido comparado por su forma con la cimitarra, nombre dado a una daga turca1 2 3 4 5 6 (fig. 2).

Figura 1 Esquema frontal de un corazón que muestra la conexión anómala de las venas del pulmón derecho a la porción suprahepática de la vena cava inferior. AD: aurícula derecha; AI: aurícula izquierda; VCI: vena cava inferior; VCS: vena cava superior; VD: ventrículo derecho; VI: ventrículo izquierdo.

Figura 2 Radiografía de tórax de un caso con síndrome de la cimitarra. Obsérvese en el hemotórax derecho el trayecto curvo del colector venoso (flechas).
Se han descrito variantes en este síndrome; por ejemplo, el ubicado a la izquierda, en el que las venas pulmonares izquierdas desembocan en un colector que drena en la vena cava inferior7, la presencia de 2 colectores curvos paralelos5, una rama del colector que se conecta con la aurícula izquierda2, la presencia de estenosis en el colector8 o la conexión del colector con una vena sacrocardinal pélvica en un paciente con ausencia de la porción hepática de la vena cava inferior6. También se ha descrito múltiple conexión anómala en un paciente: supracardíaca, cardíaca e infracardíaca9. La vena cimitarra curvilínea puede ser enmascarada por la dextroposición del corazón derecho; este signo radiológico no es específico del colector anómalo curvo, ya que puede representar a una vena varicosa conectada normalmente con la aurícula izquierda10.
La etiología de este síndrome no es clara, es una anomalía que involucra fundamentalmente al desarrollo pulmonar principalmente del pulmón derecho, aunque puede estar afectado el pulmón izquierdo8; el daño ocurre tempranamente durante el desarrollo de las venas pulmonares en la cuarta y quinta semanas del desarrollo prenatal11. Existe preponderancia del sexo femenino en una proporción de 1.4:16.
El síndrome de la cimitarra se clasifica en 3 grupos de acuerdo con la edad de los pacientes. El grupo I constituye la forma adulta sin hipertensión arterial pulmonar y con comunicación interauricular pequeña, que es el mejor tolerado12; el grupo II se caracteriza por su asociación con cardiopatías congénitas complejas, lo que modifica la historia natural y la sintomatología; el grupo III es el infantil, está caracterizado por hipertensión arterial pulmonar severa y presenta mal pronóstico; los síntomas más frecuentes son los respiratorios y la disnea progresiva13. Los estudios diagnósticos por imagen establecen las características de este síndrome.
La patogénesis es la parte de la embriopatología que estudia las alteraciones de los procesos del desarrollo embrionario que originan las malformaciones congénitas; son ejemplos de mecanismos patogenéticos la desviación anterior del septum infundibular, que origina la tetralogía de Fallot; la falta de crecimiento de las almohadillas endocardíacas auriculoventriculares, que origina la ausencia de la tabicación auriculoventricular; y la atresia del canal auriculoventricular derecho, que origina la ausencia de conexión auriculoventricular derecha14 15.
En este trabajo se presenta una teoría que explica la patogénesis de la conexión de las venas pulmonares presente en este síndrome. Esta hipótesis está basada en el conocimiento del desarrollo de las venas pulmonares1 11 16 17 18.
Material y método
Se describe morfológicamente un bloque visceral toracoabdominal que muestra el sustrato anatómico del síndrome de la cimitarra perteneciente a la colección patológica del Instituto Nacional de Cardiología Ignacio Chávez. El corazón fue estudiado con el sistema secuencial segmentario empleado en el diagnóstico de las cardiopatías congénitas19. Se determinó el situs auricular y abdominal, las conexiones auriculoventriculares y ventriculoarteriales, el retorno venoso pulmonar, los tabiques cardíacos y las anomalías agregadas. Se consignó el tamaño del pulmón derecho y la estructura lobar, bronquial y vascular. Se elaboró una correlación anatomoembriológica en la que se estableció la correspondencia entre la alteración anatómica y el desarrollo de la conexión venosa pulmonar, que sirvió de base para explicar hipotéticamente la patogénesis de las alteraciones presentes en este síndrome.
Resultados
El situs auricular cardíaco y abdominal fue solitus, las conexiones auriculoventriculares y ventriculoarteriales fueron concordantes, las venas pulmonares izquierdas desembocaron en la aurícula izquierda, y las del pulmón derecho drenaron en un colector curvo que desembocó en la vena cava inferior, por encima del diafragma (fig. 3). Estuvo presente una comunicación interauricular a nivel del orificio oval. Existió hipoplasia del pulmón derecho y displasia de los bronquios medio y superior derechos, así como secuestro pulmonar, que afectó al lóbulo pulmonar inferior derecho, que fue irrigado por una arteria originada de la aorta abdominal (colateral aortopulmonar). La aurícula derecha presentó un crecimiento moderado y el ventrículo derecho estuvo dilatado e hipertrofiado (fig. 3).

Figura 3 Fotografía de un bloque visceral post mórtem con síndrome de cimitarra. Obsérvese el colector curvo (asterisco) y la arteria que irriga el secuestro pulmonar (2 asteriscos). AD: aurícula derecha; H: hígado; PD: pulmón derecho; VCI: vena cava inferior; VCS: vena cava superior; VD: ventrículo derecho.
Discusión
La correlación anatomoembriológica establece la correspondencia entre el rasgo anatómico de la conexión venosa pulmonar doble que presenta este síndrome y la embriogénesis de las venas pulmonares. Esta correlación constituye la herramienta metodológica para formar la hipótesis patogenética que explica la formación del síndrome.
En el horizonte XII de Streeter del desarrollo embrionario humano (25-27 días)20 aparece el esbozo de los pulmones como una evaginación endodérmica de la porción más caudal del piso de la faringe primitiva; dicho esbozo se asocia con mesénquima esplácnico, del cual se originan los angioblastos que forman los vasos sanguíneos del plexo pulmonar. Al mismo tiempo, del techo de la aurícula izquierda surge una evaginación endotelial que constituye el primordio de la vena pulmonar común (VPC) (fig. 4). Cuando el embrión alcanza la edad del horizonte XIII de Streeter (27-29 días)21 se inicia la vasculogénesis pulmonar, que incluye una extensa red capilar situada entre ambos pulmones; los capilares de esta zona se fusionan entre sí y forman una pequeña cámara denominada seno de las venas pulmonares (SVP), que tiene origen extrapulmonar y extracardíaco; este seno establece conexiones con las venas sistémicas bilaterales en desarrollo: cardinal anterior y común derechas, que originan a la vena cava superior y cardinal posterior derecha que forma el cayado de la vena ácigos; cardinal anterior izquierda, de la que surgen las venas cavas superior izquierda y vertical; la vena vitelina derecha, que origina el segmento suprahepático de la vena cava inferior; las venas hepáticas, suprahepáticas y porta y los cuernos sinusales del corazón, el izquierdo, que origina el seno venoso coronario, y el derecho, que forma la porción sinusal de la aurícula derecha (fig. 4). En este horizonte la VPC crece hacia el SVP. En los horizontes de Streeter XIV (28-30 días) y XV (30-32 días)22 la VPC canalizada se conecta con el SVP. Se inicia la involución de los canales de la conexión venosa pulmonar primaria con los plexos cardinal y umbilicovitelino.
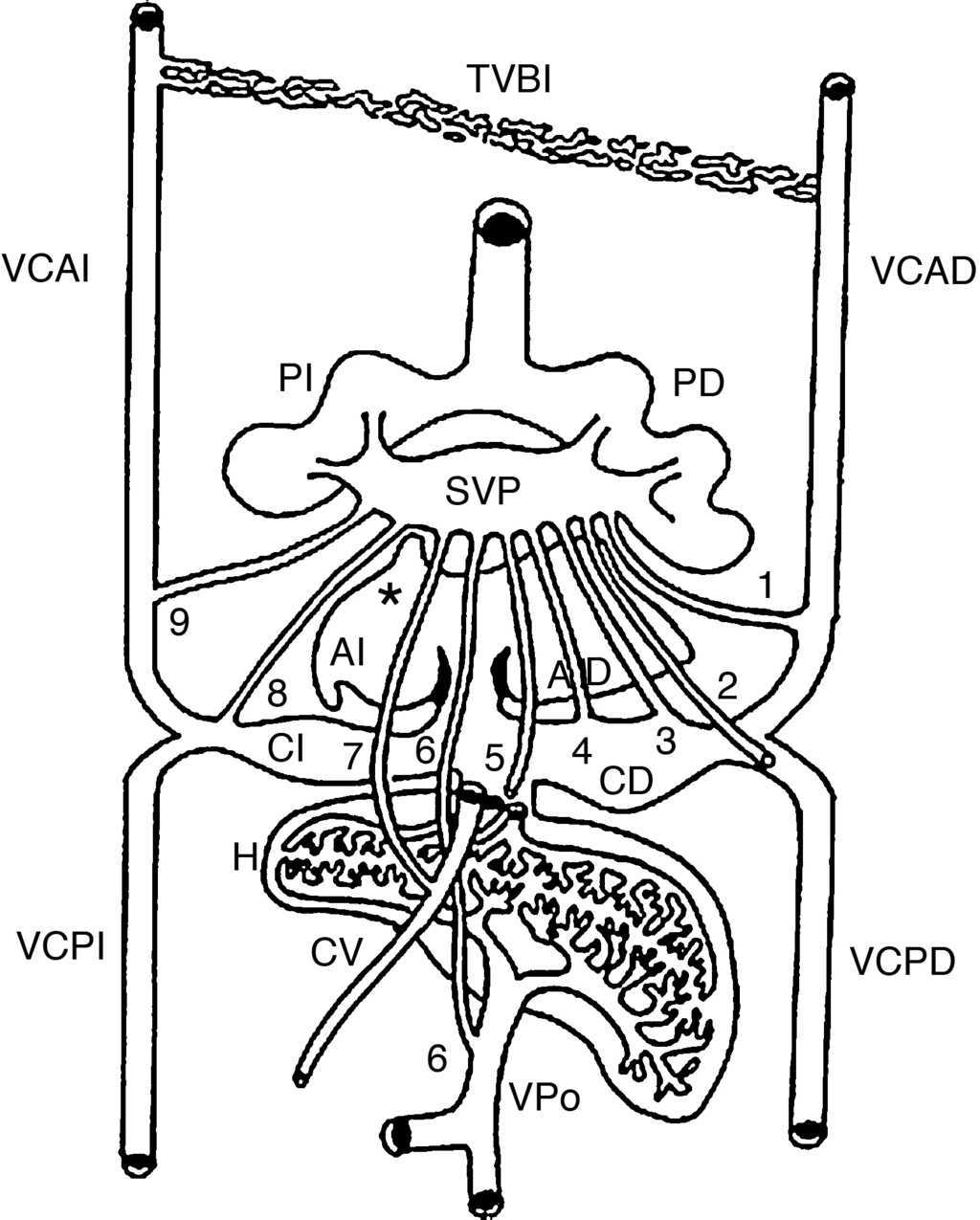
Figura 4 Vista posterior de un esquema que muestra las conexiones primarias entre el seno de las venas pulmonares y las venas sistémicas embrionarias. Los colectores primarios están representados del 1 al 9. Obsérvese el origen de la vena pulmonar primitiva (asterisco). AD: aurícula derecha; AI: aurícula izquierda; CD: cuerno derecho; CI: cuerno izquierdo; CV: conducto venoso; H: hígado; PD: pulmón derecho; PI: pulmón izquierdo; SVP: seno de las venas pulmonares; TVBI: tronco venoso braquiocefálico izquierdo; VCAD: vena cardinal anterior derecha; VCAI: vena cardinal anterior izquierda; VCPD: vena cardinal posterior derecha; VCPI: vena cardinal posterior izquierda; VPo: vena porta. 1: colector hacia la futura vena cava superior; 2: colector hacia el cayado de la vena ácigos; 3: colector hacia la vena cava superior; 4: colector hacia la porción sinusal de la aurícula derecha; 5: colector hacia la porción suprahepática de la vena cava inferior; 6: colector hacia la vena porta; 7: colector hacia el conducto venoso; 8: colector hacia el seno venoso coronario; 9: colector hacia la vena vertical.
Durante los horizontes de Streeter XVI al XVIII (32-37 días)22 el SVP pierde la mayor parte de sus conexiones con las venas sistémicas y se conecta con la aurícula izquierda a través de la VPC; se inicia la integración del SVP con la aurícula izquierda a nivel de su techo para constituir su porción sinusal, en la cual penetran separadamente las venas de ambos pulmones (fig. 5).
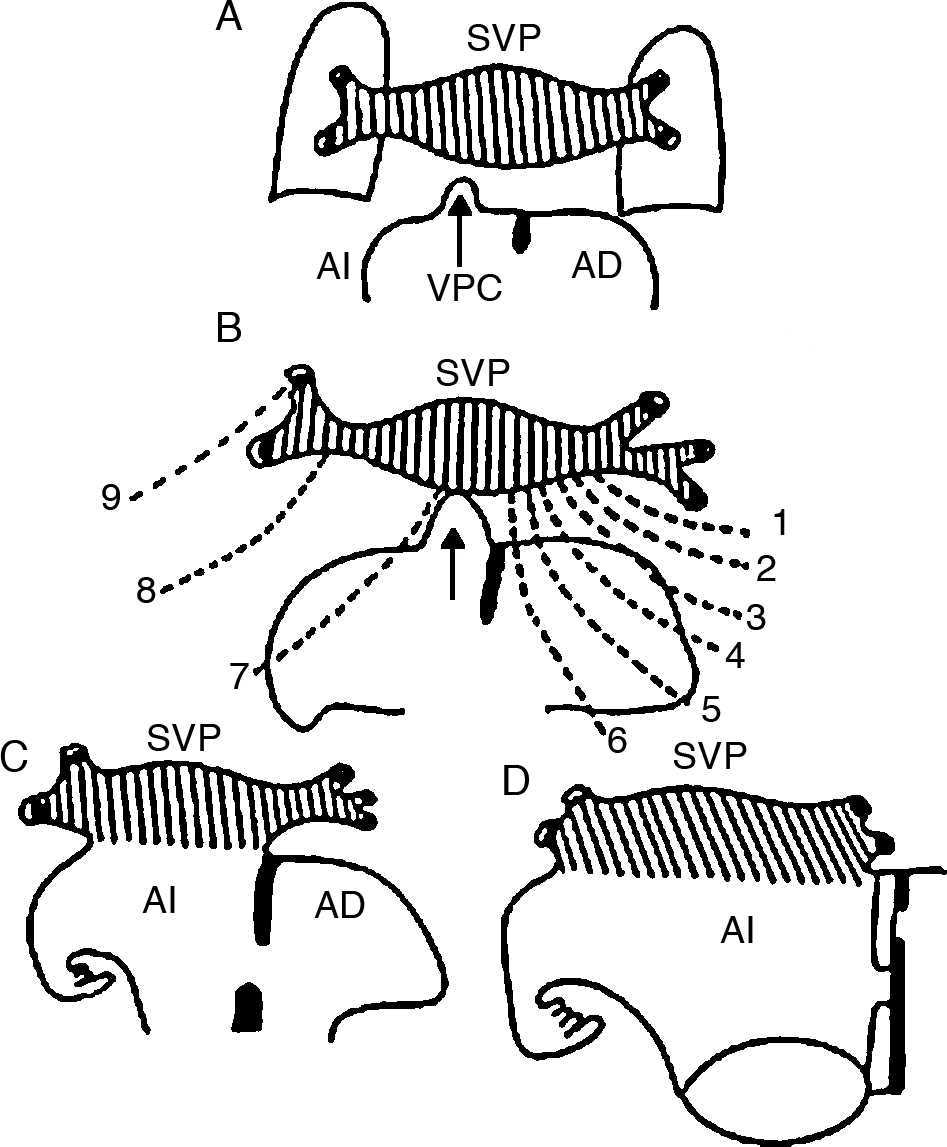
Figura 5 Esquemas que muestran la conexión venosa pulmonar secundaria con la aurícula izquierda a través de la vena pulmonar común. A) Acercamiento de la vena pulmonar común con el seno venoso pulmonar. B) Conexión de la vena pulmonar común (flecha) con el seno venoso pulmonar; obsérvese la atresia de los colectores primitivos de la conexión venosa pulmonar primaria (líneas discontinuas). C y D) Incorporación del seno venoso pulmonar al techo de la aurícula izquierda. AD: aurícula derecha; AI: aurícula izquierda; SVP: seno de las venas pulmonares; VPC: vena pulmonar común; 1: colector hacia la futura vena cava superior; 2: colector hacia el cayado de la vena ácigos; 3: colector hacia la vena cava superior; 4: colector hacia la porción sinusal de la aurícula derecha; 5: colector hacia la porción suprahepática de la vena cava inferior; 6: colector hacia la vena porta; 7: colector hacia el conducto venoso; 8: colector hacia el seno venoso coronario; 9: colector hacia la vena vertical.
La premisa para que se desarrolle cualquier tipo de conexión anómala de las venas pulmonares es la falta de crecimiento y desarrollo de la VPC, lo que impide el establecimiento de la conexión venosa secundaria. En el síndrome de la cimitarra ocurre la persistencia del colector que recibe las venas del pulmón derecho que desemboca en la porción suprahepática de la vena embrionaria vitelina derecha de la que deriva esa porción de la vena cava inferior, y además se desarrolla la VPC del techo de la aurícula izquierda que se conecta con la parte izquierda del SVP; de esta manera la sangre de este seno drena del lado derecho hacia el colector curvo y en su extremo izquierdo drena hacia la aurícula izquierda. La disminución del flujo sanguíneo en la parte central del SVP determina una reducción en su calibre, y esta estrechez progresiva produce una separación ulterior del mismo; la parte derecha se integra al colector curvo y la izquierda conecta las venas del pulmón izquierdo con la aurícula izquierda (fig. 6).
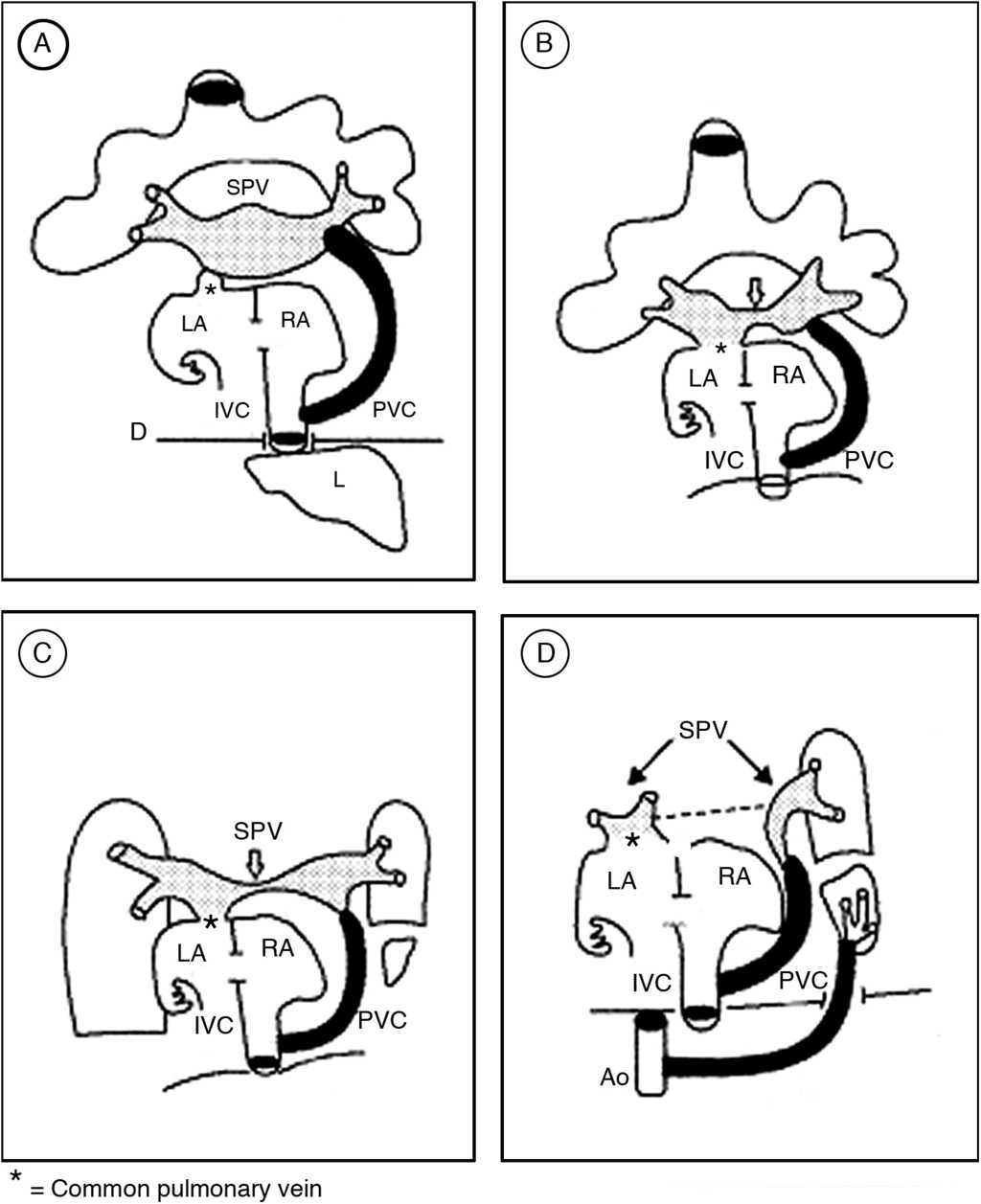
Figura 6 Esquemas que ilustran la hipótesis sobre la morfogénesis de la conexión venosa pulmonar del síndrome de la cimitarra. A) Muestra la persistencia del colector que une el seno de las venas pulmonares con la porción suprahepática de la vena cava inferior y el inicio de la conexión entre dicho seno y la aurícula izquierda. B y C) Muestran la separación del seno venoso pulmonar. D) El seno venoso pulmonar queda separado en 2 porciones, la izquierda se conecta a la aurícula izquierda y la derecha se continúa con el colector venoso pulmonar curvo. AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta; CVP: colector venoso pulmonar; D: diafragma;H: hígado; SVP: seno de las venas pulmonares; VCI: vena cava inferior.fbibl
En el desarrollo pulmonar operan 5 procesos morfogenéticos que conducen el desarrollo anatómico e histológico de este órgano. Estos procesos son: las interacciones inductoras epitelio-mesénquina, el crecimiento, la diferenciación celular, el movimiento y la apoptosis23 24 25 26 27. La primera es la responsable de la construcción y diferenciación del árbol bronquial y del establecimiento del epitelio respiratorio; cuando este proceso se altera origina la displasia y la hipoplasia del órgano, el secuestro pulmonar, las alteraciones vasculares intrapulmonares y la diferenciación del epitelio respiratorio es anormal28 29.
Conclusiones
La hipótesis patogenética presentada en este trabajo explica suficientemente las conexiones venosas pulmonares que caracterizan a este síndrome. Estas representan la persistencia del patrón vascular que opera durante el horizonte XIV de Streeter (28-30 días de desarrollo), cuando la VPC de la aurícula izquierda se conecta con el SVP y, a la vez, continúa permeable el canal primitivo de la conexión venosa pulmonar primaria que desemboca en la porción suprahepática de la vena cava inferior.











 nova página do texto(beta)
nova página do texto(beta)


