La energía criotérmica aplicada para el tratamiento invasivo de diferentes arritmias surgió a partir de los años 90 como energía alternativa a la radiofrecuencia (RF). Sin embargo, la crioterapia ha sido utilizada en el transcurso de la historia en diferentes aplicaciones clínicas y en diferentes áreas de la medicina como la oncología, dermatología, ginecología, entre otras. Inclusive, previo al inicio de su utilización para la ablación transcatéter, la crioterapia fue utilizada ampliamente en la cirugía de diversas arritmias cardiacas, dando las bases para su conceptualización de la técnica actual.
En la última década la electrofisiología cardiaca invasiva a través de la ablación por catéter se ha posicionado como el tratamiento de primera línea para la mayoría de las arritmias, siendo la RF la energía más utilizada por ser una fuente de energía segura y altamente efectiva. Sin embargo, las propiedades biofísicas únicas de la crioterapia, aunadas a novedosos avances tecnológicos, la han convertido en una alternativa que asegura un perfil de seguridad mayor con implicaciones clínicas diferentes a la RF.
La finalidad de la presente revisión es dar a conocer las aplicaciones clínicas de la crioterapia en la electrofisiología cardiaca partiendo de sus bases biofísicas.
Bases biofísicas de la crioterapia
Formación de la lesión
El éxito de la ablación por catéter depende, no solamente de la adecuada localización del tejido arritmogénico, sino también de la transmuralidad de las lesiones, por lo que el cabal entendimiento en la formación de la lesión según las diferentes fuentes de energía utilizadas es de vital importancia.
Los sistemas de RF utilizan corrientes sinusoidales de alta frecuencia (500-750 Hz) para generar lesiones a través de daño térmico. La corriente unipolar es entregada desde el catéter de RF hacia un parche dispersor en la piel del paciente, ocasionando el calentamiento de su punta, secundario a la resistencia en el paso de la corriente AC. Este calentamiento resistivo es el responsable de la destrucción celular y, con ello, de la formación de una lesión aguda caracterizada por un centro de necrosis coagulativa rodeado por áreas inflamatorias y hemorrágicas1,2 (Fig. 1).
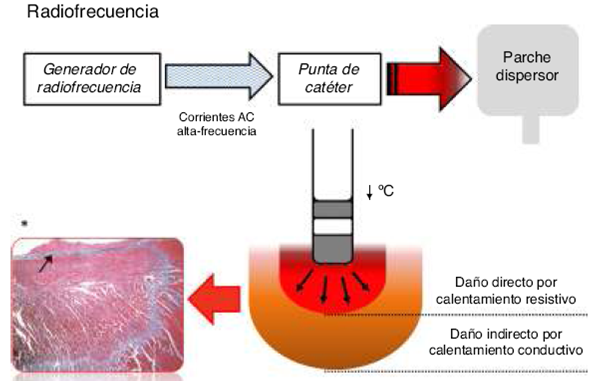
Figura 1 Representación esquemática de la formación de lesión por radiofrecuencia. (Ver texto). * Histología de lesión por radiofrecuencia con tricromo de Masson y amplificación 16 veces. Lesión poco circunscrita, con bordes irregulares. La flecha indica la formación de trombo endocárdico en el sitio de ablación.
Y mientras la RF genera daño tisular por calentamiento resistivo, la crioterapia lo hará por hipotermia, siendo su mecanismo fundamental la formación de hielo. El proceso congelante empieza en el espacio extracelular al descender la temperatura por debajo de −15 °C, lo que ocasiona enlentecimiento del metabolismo celular y pérdida en la capacidad para transportar iones. Si la temperatura continúa disminuyendo hasta los −40 °C, masas de hielo se formarán en el espacio intracelular comprimiendo y deformando al núcleo y a los componentes citoplasmáticos, siendo las mitocondrias las primeras en sufrir daño irreversible3,4. Si bien hay un daño celular mecánico, el daño celular principal es a través de procesos bioquímicos, ya que la formación de hielo extracelular lo convertirá en un espacio hipertónico, creando un gradiente osmótico con la subsecuente salida de agua e iones H+ del espacio intracelular para reestablecer el equilibrio. Esto genera la disminución del tamaño celular y el incremento en su concentración salina con reducción del pH intracelular y, como resultado, daño a las proteínas celulares, alteraciones en los sistemas enzimáticos y daño a los componentes lipoproteicos de la membrana plasmática5,6.
Al detener la crioterapia, la célula regresa pasivamente a su temperatura basal, entrando a la segunda fase de lesión conocida como "efecto descongelante", la cual está conformada por 2 mecanismos de lesión. El primero es secundario a la fusión de cristales de hielo en el espacio extra- e intercelular, lo cual incrementará el daño osmótico a través del "efecto solución", causando mayor disrupción en la arquitectura celular. Y el segundo mecanismo es dado por el restablecimiento de la microcirculación, lo que provoca edema en las células endoteliales y daño citoplasmático del tejido profundo y subepitelial de vénulas y capilares. Esto ocasiona estasis y obliteración vascular con necrosis isquémica subsecuente, fase caracterizada por inflamación y hemorragia5.
Finalmente, en la última fase se establecerán lesiones bien circunscritas con áreas densas de tejido fibrótico, contracción de bandas necróticas y una matriz tisular conservada, secundarios al daño microvascular y a la apoptosis (Fig. 2) 7,8.
Características de la lesión y tromboembolismo
En el caso de la RF, el tamaño de la lesión es determinado por el balance entre la conducción del calor desde la punta del catéter hasta el tejido circundante y su pérdida, secundaria al enfriamiento generado por el flujo sanguíneo. El diámetro de la lesión está influido por la cantidad de poder entregado, el diámetro de la punta del catéter y la integral tiempo/fuerza de contacto, generando daño tisular cuando la interfase catéter/tejido alcanza los 48 °C y entrando a una fase de meseta en los primeros 10-40 s, posterior a lo cual no habrá mayor expansión de lesión. Sin embargo, si la temperatura se acerca a los 100 °C, existe el riesgo de formación de coágulo de plasma y de proteínas desnaturalizadas en la punta del catéter, lo que impide la adecuada entrega de energía. Esto, aunado a la presencia de hemorragia intralesional y a la disrupción del endotelio propio de la lesión con RF, aumenta el riesgo de eventos tromboembólicos, que en la clínica se ha estimado en una incidencia entre el 0.6 y el 0.8%, siendo mayor en ablaciones realizadas en cavidades cardíacas sistémicas (1.8-2%) y en el caso de ablación de arritmias ventriculares (2.8%)1,2,9.
Por su parte, el tamaño de las lesiones en la criotermia estará relacionado con la temperatura mínima alcanzada, el tiempo de exposición, el área expuesta y los ciclos de congelamiento/descongelamiento y, si bien tiempos prolongados de exposición a menores temperaturas aseguran lesiones de mayor dimensión, la lesión alcanzará un estado de meseta a los 5 min, cuando, a pesar de la temperatura y el tiempo, la lesión no aumentará de tamaño6. Por lo tanto, 2 ciclos de congelamiento/descongelamiento causan lesiones de mayor dimensión que aplicaciones únicas de mayor duración10 y, mientras más rápido es el congelamiento y más lento el descongelamiento, más se incrementará su tamaño11. Distintivamente la crioterapia genera lesiones de bordes bien definidos con mínima lesión endotelial, menor activación plaquetaria y menor activación de la cascada de coagulación, por lo que la utilización de RF conlleva un riesgo 5 veces mayor para la formación de trombo en comparación con la crioablación12.
Supresión reversible
Posiblemente una de las grandes ventajas de la crioterapia es la supresión reversible, lo que significa que antes de producir daño tisular permanente existe un lapso de tiempo en el que se produce una inhibición tisular transitoria, a lo que biofísicamente equivale la formación de hielo en el espacio extracelular con temperaturas entre los −10 y −25 °C, cuando el metabolismo celular podrá regresar a la normalidad al detener la agresión térmica, o bien progresar al daño tisular definitivo, dependiendo del tiempo de exposición o de la disminución en la temperatura (≤−50 °C produce instantáneamente daño irreversible) 7,10,13. Por lo tanto, al realizar aplicaciones con temperaturas congelantes ligeras y por tiempos cortos, se puede alterar la función celular de manera transitoria y reversible, permitiendo valorar la eficacia o seguridad de sitios potenciales de ablación sin ocasionar daño permanente, lo que se conoce como cryomapping, particularmente útil en sustratos arritmogénicos cercanos a estructuras como el haz de His o el nervio frénico.
Crioadherencia
Previamente se comentó que una de las determinantes para generar lesiones transmurales por RF es la integral tiempo/fuerza de contacto, lo que significa que, durante la aplicación, la punta del catéter debe tener un contacto adecuado con el tejido diana de manera constante por tiempo suficiente, por lo que la estabilidad del catéter juega un papel protagónico en el éxito del procedimiento. Dicho inconveniente no existe en la crioterapia, ya que, cuando la temperatura del criocatéter disminuye por debajo de 0 °C, se formará de manera progresiva un recubrimiento de hielo en su punta que asegura su adhesión a la superficie endocárdica, a lo que se denomina crioadherencia. Al permanecer inamovible la punta del catéter durante la aplicación, es posible realizar maniobras de estimulación para comprobar la eficacia del sitio de ablación, sin riesgo de desplazamiento ni pérdida de la posición original, lo que también se puede considerar como cryomapping. Y, a diferencia de la RF, donde la punta del catéter, al permanecer relativamente libre durante la entrega de energía, ocasiona un efecto de cepillado en las estructuras circundantes al tejido diana, la crioterapia permite realizar lesiones precisas, disminuyendo el daño colateral potencial a estructuras críticas cercanas14-16.
Crioablación libre de dolor
Inicialmente, con la criocirugía se asumió que la criotermia era indolora por un bloqueo inmediato en la transmisión neural, secundaria probablemente a la contracción del axón en los nervios mielinizados5. Si bien no es posible decir si este daño axonal es suficiente para bloquear la transmisión nerviosa y, con esto, el dolor, la poca evidencia clínica así lo indica. Estudios clínicos se han dado a la tarea de comparar con escalas de dolor la RF con la crioterapia en la ablación de arritmias supraventriculares (flutter auricular típico, taquicardia por reentrada intranodal AV y FA) mostrando escalas mayores de incomodidad con la RF17-19. A pesar de que esta desventaja de la RF puede ser fácilmente contrarrestada con analgésicos y anestésicos, en ciertas localizaciones anatómicas particularmente sensibles, como la pared posterior de la aurícula izquierda, el seno coronario y el istmo cavo tricúspideo posterior, la crioablación puede ser particularmente útil.
Crioablación para manejo invasivo de fibrilación auricular
La ablación de las venas pulmonares (VP) con el fin de lograr su aislamiento eléctrico de la aurícula izquierda es la piedra angular del manejo invasivo para la fibrilación auricular (FA) en particular de la FA paroxística, ya que se sabe que focos ectópicos localizados en su interior son los desencadenantes de dicha arritmia, según se ha publicado en el trabajo original de Haissagüerre et al.20.
La técnica para la ablación de FA ha tenido una evolución vertiginosa en los últimos años, pasando por la ablación focal de focos ectópicos dentro de las VP hasta su aislamiento antral circunferencial, y en fechas recientes el desarrollo de novedosas fuentes de energía y tecnología que han permitido el aislamiento eléctrico de las VP por medio de aplicaciones únicas (one- shot) en lugar de punto-por-punto de la ablación con catéter de RF21. Parte de estas nuevas tecnologías es el aislamiento a través del criobalón22.
El sistema de criobalón consiste en un catéter deflectable de 10.5 Fr, que tiene distalmente un balón de poliuretano y poliéster el cual, inflado, puede tener un diámetro de 23/28 mm (Arctic Front Advance, Medtronic, Inc). Los nuevos modelos contienen un canal interno por el cual se avanza un catéter decapolar circular (Achieve, Medtronic), que es de utilidad tanto para canular como para registrar la actividad eléctrica de las VP preablación y durante el momento del aislamiento eléctrico (Fig. 3). Todo esto se monta a través de una camisa deflectable de 15 Fr con diámetro interno de 12 Fr (FlexCath, Medtronic).
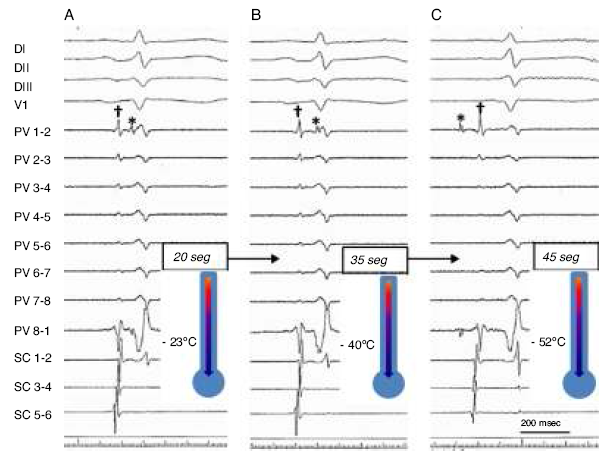
Figura 3 Registro simultáneo del ECG de superficie; EGM de vena pulmonar inferior izquierda; y seno coronario durante crioablación con balón. A) Muestra la crioablación a 20 s con una temperatura registrada de −23 °C, en los EGM de venas pulmonares es evidente una separación de AI a PVP de 62 ms. B) Aumento en el retardo AI-PVP de 92 ms a 35 s de crioablación alcanzando los −40 °C. C) Evidencia de bloqueo de salida con disociación de PVP a 45 s con temperatura de −52 °C.AI: aurícula izquierda; EGM: electrogramas; PVP: potencial de vena pulmonar.
El catéter contiene también una luz por donde se inyecta un criorrefrigerante al interior del balón. Y el lumen central que, además de contener al catéter circular, puede ser de utilidad para medir presiones distales al balón así como para la inyección de material de contraste, el cual se utiliza para la confirmación de localización y oclusión de la vena pulmonar en la que se trabaja.
La ablación se realiza una vez inflado el criobalón y comprobada la oclusión de la vena al liberar el criorrefrigerante presurizado (N2O: óxido nitroso) a la parte distal del balón interno cambiando de fase líquida a fase gaseosa. Previamente el balón se caracterizaba por 4 jets de N2O sin lograr una congelación homogénea. Actualmente la nueva generación en criobalón utiliza un balón con 8 jets, el cual libera el criorrefrigerante en todo el ecuador y hemisferios del balón.
El N2O es nuevamente presurizado para maximizar el congelamiento con caída de la temperatura hasta −80 °C por medio del efecto Joule-Thompson (mayor enfriamiento cuando un gas no ideal es altamente comprimido dentro de una región de baja presión).
La utilización del criobalón para el aislamiento de VP ha ido ganando terreno, ya que ha logrado simplificar el procedimiento sin sacrificar su eficacia. En un estudio de revisión de expedientes donde se comparó RF con criotermia se reportó una reducción significativa en el tiempo total de procedimiento y el tiempo total de fluoroscopia en el grupo de crioablación, sin cambios significativos en su eficacia, esto definido por la tasa de aislamiento de VP durante el procedimiento y los días de estancia hospitalaria23. A pesar de haber demostrado la simplificación del procedimiento con la utilización de criobalón, estos resultados están sujetos a una curva de aprendizaje, ya que la tecnología del criobalón combina una serie de elementos totalmente diferentes a la ablación con RF24. Dicha curva de aprendizaje para la optimización de los resultados se ha estimado en 20 procedimientos. Se alcanza paulatinamente la tasa más alta de eficacia y seguridad en centros con más de 50 procedimientos25.
A diferencia de la ablación con RF, en el aislamiento de VP por medio de criobalón, únicamente es necesaria una punción transeptal, y el procedimiento no exige la utilización de un sistema 3D de mapeo electroanatómico.
STOP-AF es el primer estudio clínico prospectivo, multicéntrico, aleatorizado que compara el aislamiento de VP por medio de criobalón con medicamentos antiarrítmicos para el manejo de la FA paroxística, donde se reportó una tasa de éxito a 12 meses de 69.9% en el grupo de crioablación en comparación con el 7.3% en el grupo de antiarrítmicos, con un 79% de cross over hacia el grupo de crioablación26. Es importante entender que el estudio STOP- AF se realizó con la tecnología criobalón de primera generación, lo cual resulta prometedor, ya que los cambios tecnológicos con el criobalón de segunda generación, aunados a la incorporación del catéter circular de mapeo, han demostrado una mayor tasa de efectividad a largo plazo, siendo de 78% para el criobalón de segunda generación en comparación con el 58% para la primera generación27.
Si bien la criotecnología se muestra amigable con tasas bajas de complicaciones, uno de los retos principales es el riesgo de lesión al nervio frénico con parálisis diafragmática posterior al aislamiento de las venas pulmonares derechas: la casuística de dicha complicación tiende a ser variable dependiendo del centro, el tipo de balón y la técnica utilizada. En estudios recientes con criobalón de segunda generación, se reportó una incidencia muy variable de parálisis de nervio frénico entre 3.5-19.5%28,29. A pesar de que la lesión al nervio frénico es una complicación relativamente frecuente, su relevancia clínica es discutible ya que cerca del 90% de los pacientes presentan una recuperación completa dentro del primer año de seguimiento, y únicamente el 3.5% presenta síntomas atribuibles a la parálisis diafragmática26. Múltiples técnicas se han utilizado para prever y evitar dicha complicación, todas basadas en la estimulación del nervio frénico a través de un catéter colocado de manera intravenosa en la vena cava superior, sitio donde el trayecto del nervio se encuentra en íntima relación. Las técnicas para la medición de la contracción diafragmática varían desde la apreciación subjetiva de la amplitud de contracción a través de su palpación en el abdomen o la visualización de la elevación del hemidiafragma por fluoroscopia, hasta la medición electromiográfica del nervio frénico a través del potencial de acción motor compuesto, con lo cual se puede anticipar el daño al nervio frénico antes de su apreciación subjetiva en la contracción diafragmática, con lo que se evita o limita el daño al detener la criotermia de manera oportuna30-32.
Desde el inicio del manejo invasivo para la FA se ha establecido a la RF como la fuente de energía idónea para su realización, por lo que, ya establecida la eficacia de la criotermia en el aislamiento de VP, la pregunta se basa en qué fuente de energía ofrece mayor seguridad y eficacia a largo plazo y, secundariamente, qué método asegura procedimientos más cortos con menor exposición a la radiación. Hasta el momento, hay pocos estudios prospectivos que hayan comparado la crioablación con balón de segunda generación y la RF para el aislamiento de VP, sin reportar diferencias significativas en la tasa de efectividad a 12 meses entre ambas fuentes de energía33-35. Sin embargo, dichos estudios han incluido un limitado número de pacientes de un único centro (Tabla 1). Fire and Ice y FreezeAF trial son 2 estudios clínicos prospectivos, multicéntricos, aleatorizados en desarrollo que comparan el aislamiento de venas pulmonares con criobalón con RF36,37. El resultado de estos estudios nos ayudará a seleccionar el tipo de técnica según su eficacia y perfil individual.
Tabla 1 Estudios clínicos prospectivos de ablación de FA comparando radiofrecuencia y crioablación
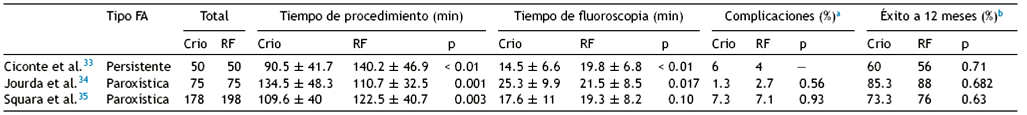
Los 3 estudios fueron realizados por medio de criobalón de segunda generación, y los grupos correspondientes a radiofrecuencia utilizaron catéter irrigado con tecnología contact-force.Crio: crioablación; FA: fibrilación auricular; RF: radiofrecuencia.
a Ciconte et al. del 6% de complicaciones reportadas en el grupo de crioablación, el 4% correspondió a parálisis diafragmática transitoria, que se resolvió para el final del procedimiento. Lo mismo sucedió en el 5.6% de las complicaciones reportadas por Squara et al.
b En el estudio presentado por Squara et al. el éxito de seguimiento corresponde a 18 meses. En el caso de los estudios de Ciconte et al. y Jourda et al. se definió por su seguimiento a 12 meses.
Crioablación en taquicardia por reentrada intranodal auriculoventricular
Desde la concepción de la ablación para la eliminación de la vía lenta en la taquicardia por reentrada intranodal AV (TREIN), la RF ha sido la fuente de energía más difundida y más utilizada en todo el mundo, con porcentajes de eficacia superiores al 95% y tasas bajas de recurrencia, entre el 3 y el 7%. Sin embargo, por las propiedades biofísicas de la RF en la formación de la lesión y la cercanía anatómica de la vía lenta al haz de His, el bloqueo AV de alto grado es la complicación más temida, llegando a requerir marcapasos definitivo entre el 0.8 y el 2% de los casos38,39. Es especialmente lamentable por corresponder a una población característicamente joven con corazón sano.
En cambio, la criotermia, por sus propiedades biofísicas, genera lesiones bien circunscritas sin daño a estructuras adyacentes al evitar el desplazamiento del catéter por crioadherencia, y, además, es capaz de demostrar la pérdida de función de la vía lenta por supresión reversible y de corroborar la eficacia y la seguridad de la aplicación sin concurrir en daño permanente, por lo que la posibilidad de daño al sistema eléctrico de conducción con la necesidad de estimulación cardiaca es particularmente baja40.
Si bien el perfil de seguridad de la crioablación en TREIN está bien establecido, han existido dudas respecto a su éxito a largo plazo. Durante la última década, 4 estudios prospectivos aleatorizados han comparado la RF con la criotermia en la ablación de la vía lenta por TREIN (Tabla 2) 19,41-44. Dichos estudios demostraron un porcentaje de éxito inmediato similar con ambas técnicas, con una disminución en el éxito a largo plazo (6-12 meses) con la crioablación (siendo estadísticamente significativa en los estudios publicados por Deisenhofer19 y Rodriguez-Entem44 ), y sin diferencias estadísticamente significativas en la incidencia de bloqueo AV completo, sin embargo es importante aclarar que este desenlace no se presentó en ningún paciente aleatorizado a crioablación. Recientemente 2 metaanálisis publicados por Santangeli et al. y Hanninen et al. compararon la ablación por RF y la crioablación para TREIN en 2,340 y 5,617 pacientes respectivamente, donde se encontraron tasas de éxito inmediato comparables para las 2 técnicas, con una tasa mayor de recurrencia para la crioablación de 9% comparada con 3.5% para RF, y demostrando nuevamente el perfil de seguridad como punto fuerte de la crioablación con 0% de bloqueo AV completo comparado con 0.75-0.87% con la ablación por RF45,46.
Tabla 2 Estudios clínicos de ablación de taquicardia por reentrada intranodal comparando radiofrecuencia y crioablación
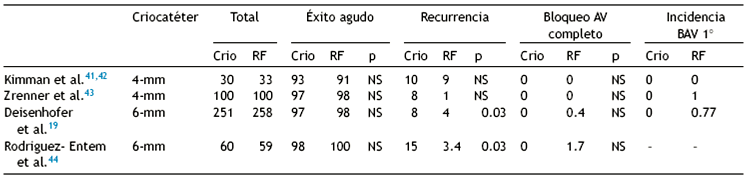
BAV 1°: bloqueo AV primer grado: Crio: crioablación; NS: no significativo: RF: radiofrecuencia.
Cuando se habla de crioablación en la TREIN, es importante entender que es un procedimiento diferente a la ablación con RF. Una diferencia que resulta esencial conocer es la manera de comprobar el sitio efectivo, ya que con RF la presencia de ritmo nodal acelerado es interpretado como un signo positivo respecto a la eficacia de dicha aplicación, mientras que en la crioablación se encuentra raramente47. Por el contrario, sus propiedades biofísicas permiten realizar maniobras de estimulación programadas durante la aplicación para comprobar la presencia de doble fisiología nodal o la no inductividad de la taquicardia40. De igual manera, el punto final de la ablación por RF parece no aplicar a la crioablación, ya que la presencia de doble fisiología nodal con eco único bajo infusión de isoproterenol es aceptable con RF. En el caso de la crioablación, la evidencia actual ha resultado controversial, existen artículos que han reportado sus resultados tanto a favor como en contra de la presencia de doble fisiología nodal con eco único como factor predictor de recurrencia48-51 y es evidente que falta información referente a la abolición completa de la vía lenta como punto final en la criotermia. Sin embargo, es probable que la tasa mayor de recurrencia sea secundaria a la necesidad de un mapeo más preciso por la característica focal de la criolesión.
Crioablación en localizaciones de alto riesgo
Por las propiedades biofísicas y el perfil de seguridad de la crioterapia, sus indicaciones clínicas se han diversificado más allá de la ablación de TREIN y del aislamiento de venas pulmonares. A pesar de que la RF es una fuente de energía altamente segura y eficaz, cuando el sustrato arrítmico se origina en la proximidad de ciertas estructuras, estas pueden resultar dañadas, siendo particularmente frecuente en localizaciones septales, primordialmente parahisianos, donde el riesgo de daño al nodo AV con bloqueo AV de alto grado es particularmente preocupante52, Yildirim et al. publicaron su experiencia en 25 pacientes llevados a crioablación de vías accesorias parahisianas. Reportaron un 92% de éxito inmediato con 4.3% de recurrencias, sin documentarse bloqueo AV completo53. Datos que fueron ratificados por Karadeniz et al. para la crioablación de 43 pacientes con vías accesorias septales, sin reportarse complicaciones y con una tasa de recurrencia del 12.5%54, ligeramente superior a lo reportado para la crioablación de TREIN.
La parálisis diafragmática secundaria a lesión del nervio frénico es una complicación potencial durante la ablación de focos ectópicos perisinusales dada su relación anatómica55. Cuando, al estimular a altos voltajes el sitio potencial de aplicación, se logra captura diafragmática, la criotermia ha demostrado ser una alternativa segura para evitar daño al nervio frénico56.
Debido a la disminución en la formación de trombo y la disminución del daño a estructuras adyacentes, la criotermia tiene un valor clínico agregado en caso de ser necesaria la ablación a través del seno coronario. Experimentos en animales han demostrado lesiones transmurales en el 72% de las criolesiones, sin documentarse trombosis ni espasmo del seno coronario, ni daño a las arterias adyacentes57. Clínicamente, Stavrakis et al. publicaron la experiencia de 240 pacientes llevados a ablación epicárdica de vías accesorias posteroseptales a través del sistema venoso coronario, reportando la presencia angiográfica de lesión a las arterias coronarias en 59 y 16%, cuando el sitio de ablación con RF se encontraba <2 mm y de 3- 5 mm de la arteria coronaria, respectivamente, mientras que no se observó ninguna lesión coronaria en los 26 pacientes llevados a ablación por criotermia, independientemente de la cercanía de la arteria coronaria al sitio de aplicación. La tase de éxito con un solo procedimiento fue de 90% para RF y 77% para crioablación58, cifra que pudiera corresponder al porcentaje de lesiones transmurales descritas en ensayo con animales.
Finalmente, se han reportado casos de taquicardia auricular dentro de la orejuela derecha e izquierda, donde, por el riesgo de perforación y formación de trombo con RF, se optó por la crioablación, consiguiendo realizar una ablación de foco ectópico de manera exitosa59,60.
Costo-efectividad de la crioablación
El crecimiento logarítmico de la electrofisiología cardiaca invasiva a nivel global ha generado el desarrollo de nuevas tecnologías más efectivas y más seguras para el tratamiento definitivo de las arritmias y, a la par de estas nuevas tecnologías, se han incrementado los costos operativos de cada procedimiento, por lo que el conocimiento del costo beneficio de cada una de las nuevas herramientas con las que contamos es fundamental para tener una práctica clínica sustentable. Winkle et al. publicaron los costos en población Medicare tratados mediante ablación de FA según el material utilizado con la siguiente tecnología: radiofrecuencia con sistema electroanatómico 3D con catéter irrigado sin tecnología contact-force entre los 6,636-12,603 $ dólares; radiofrecuencia con sistema electroanatómico 3D con navegación magnética (Stereotaxis) entre los 12,261-15,464 $ dólares y crioablación con criobalón de primera generación entre los 12,847-15,320 $ dólares61.
Si bien es esperable un aumento en los costos de material con crioablación en comparación con la RF, lo realmente importante es saber si el costo por procedimiento supone un beneficio a largo plazo, para lo cual se ha ajustado el costo total a los años/calidad de vida en comparación con el tratamiento antiarrítmico, demostrándose que el manejo invasivo por crioablación en un periodo de 5 años tiene índices mayores de calidad de vida con el mismo costo en comparación con el manejo médico, y similar a lo previamente estimado con RF62. Esta similitud entre RF y crioablación es parcialmente explicada por una reducción del 13% en el tiempo de ocupación del laboratorio de electrofisiología, lo cual infiere mayor productividad en el mismo tiempo. Sin embargo, este beneficio estará sujeto al tiempo que toma alcanzar el punto máximo de la curva de aprendizaje, algo que temporalmente resulta en menor productividad y mayores costos, siendo más evidente en un centro con amplia experiencia en ablación por RF23,63.
Conclusiones
La crioterapia introducida recientemente en la electrofisiología cardiaca intervencionista es una alternativa a la ablación con radiofrecuencia, en la que sus propiedades biofísicas particulares ofrecen un mayor margen de seguridad para el tratamiento de ciertas arritmias y en ciertas localizaciones.
El aislamiento de venas pulmonares por medio de criobalón es una técnica no solo segura y simplificada, sino también efectiva a largo plazo cuando la comparamos con medicamentos antiarrítmicos, e igualmente efectiva que la radiofrecuencia con la evidencia clínica actual. Próximamente contaremos con la evidencia clínica al compara el criobalón de segunda generación con la radiofrecuencia, lo que nos dará las pautas para elegir la fuente de energía en el tratamiento de la FA paroxística.
La ablación de taquicardia por reentrada intranodal AV es una de las indicaciones más sólidas actualmente para la crioterapia, en la que la probabilidad de daño al nodo AV es prácticamente nula y, si bien el éxito a largo plazo es menor que con radiofrecuencia, el éxito sigue siendo >90%, resultando una excelente opción como abordaje de primera línea.
La crioterapia debe ser vista como una herramienta más dentro del arsenal de la electrofisiología cardiaca intervencionista, y el conocimiento de sus propiedades biofísicas individuales nos permitirá optimizar los resultados, extender sus aplicaciones clínicas y sopesar las limitaciones.
Financiación
No se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.











 nueva página del texto (beta)
nueva página del texto (beta)



