Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.82 n.4 Ciudad de México Oct./Dec. 2012
https://doi.org/10.1016/j.acmx.2012.09.003
Investigación clínica
La electrofisiología del Wolff-Parkinson-White en el paciente asintomático con actividad o riesgo profesional alto
The electrophysiology of Wolff-Parkinson-White in the asymptomatic patient with activity or with high professional risk
Enrique Velázquez-Rodrígueza, b, c, Alex Pacheco-Bouthilliera, b, c, Horacio Rodríguez-Piñaa, b, c y Luz María Deras-Mejíaa, b
a Curso de Posgrado de Alta Especialidad en Electrofisiología Cardiaca, México D.F., México.
b Servicio de Electrofisiología, Hospital de Cardiología del Centro Médico Nacional Siglo XXI, I.M.S.S., México D.F., México.
c Facultad de Medicina, Universidad Nacional Autónoma de México, México D.F., México.
Autor para correspondencia:
Enrique Velázquez-Rodríguez
Servicio de Electrofisiología.
Hospital de Cardiología CMN SXXI, I.M.S.S.
Cuauhtémoc 330, Colonia Doctores, C.P. 06760, México D.F., México.
Correo electrónico: enve@prodigy.net.mx
Recibido el 4 de octubre de 2011
Aceptado el 19 de septiembre de 2012
Resumen
Objetivo: Describir las características electrofisiológicas en individuos con Wolff-Parkinson-White asintomático con actividad deportiva o alta responsabilidad profesional.
Métodos: Se evaluaron 19 individuos, edad media 33 ± 13 años (grupo A). Las características electrofisiológicas fueron comparadas con un grupo control similar con WPW sintomático (grupo B).
Resultados: En estado basal el periodo refractario anterógrado y la conducción anterógrada 1:1 sobre el fascículo accesorio fueron más largos en el grupo A (300 ± 48 ms vs 262 ± 32 ms, p < 0.05) y (355 ± 108 ms vs 307 ± 86 ms, p < 0.05), respectivamente. Ningún individuo del grupo A tuvo un periodo refractario anterógrado < 250 ms; y 58% no tuvieron conducción retrógrada sobre el fascículo accesorio vs 4% del grupo B (p< 0.001). La inducción de taquicardia fue significativamente menor (5.2%) en el grupo A vs grupo B (95%) (p < 0.001). Se indujo fibrilación auricular (FA) sólo en uno del grupo A vs en 32% grupo B (p< 0.001).
Conclusión: Se confirman las características electrofisiológicas benignas en individuos asintomáticos comparados con sintomáticos. La deficiente conducción anterógrada junto con ausencia de conducción retrógrada explica la baja frecuencia de taquiarritmias y no apoyaría la investigación rutinaria en toda la población asintomática, pero debido a las posibles consecuencias, se mantiene la indicación sistemática con fines de ablación preventiva en el subgrupo de individuos asintomáticos con actividad deportiva o alta responsabilidad profesional.
Palabras clave: Wolff-Parkinson-White asintomático; Muerte súbita cardiaca; Vía accesoria; Periodo refractario anterógrado; Taquicardia reciprocante auriculoventricular; Fibrilación auricular preexcitada; México.
Abstract
Objective: Describe the electrophysiological characteristics in subjects with asymptomatic Wolff-Parkinson-White with sports activities or high professional responsibility.
Methods: Nineteen subjects, mean age 33 ± 13 years (group A). The electrophysiological characteristics were compared with a matched group with symptomatic WPW (group B).
Results: At baseline the anterograde refractory period and the anterograde conduction 1:1 over the accessory pathway were longer in group A (300 ± 48 ms vs 262 ± 32 ms, p <0.05 and 355 ± 108 ms vs 307 ± 86 ms, p <0.05), respectively. None of group A had a anterograde refractory period < 250 ms and 58% showed absence of retrograde conduction over the accessory pathway vs 4% of group B (p < 0.001). Induction of tachycardia was significantly less in group A (5%) than in group B (92%) (p < 0.001). Atrial fibrillation was induced in only one of group A vs 32% of group B (p< 0.001).
Conclusion: We confirm the benign electrophysiological characteristics in asymptomatic compared to symptomatic subjects. Poor anterograde conduction along with absence of retrograde conduction explains the low frequency of tachyarrhythmias and would not support the routine investigation of all asymptomatic subjects. But, due to possible consequences, remains the systematic indication for preventive ablation in the subgroup of asymptomatic subjects with sporting activities or high professional responsibility.
Keywords: Asymptomatic Wolff-Parkinson-White; Sudden cardiac death; Accessory pathway; Anterograde refractory period; Atrioventricular reciprocating tachycardia; Antidromic atrial fibrillation; Mexico.
Introducción
La taquicardia reciprocante auriculoventricular (TRAV) y en menor frecuencia la fibrilación auricular (FA) están asociadas con el síndrome de Wolff-Parkinson-White (WPW) en el 50% a 80% de los casos1. De éstas, la FA con frecuencia ventricular rápida puede degenerar en fibrilación ventricular (FV), y la muerte súbita (MS) puede ser la primera manifestación del síndrome2-4, aunque esta manifestación es probable que sea un evento raro de acuerdo a estudios previos sobre historia natural del síndrome5-8.
El riesgo de los pacientes con síndrome de WPW de desarrollar MS no se conoce con certeza. Con base a estudios de población, el riesgo en pacientes sintomáticos se estima en aproximadamente 0.02% a 0.25% por anoo3%a4%depor vida9-11.
Por otro lado, se ha reportado un patrón electrocardiográfico de WPW en 1.5 por 1000 personas (intervalos de edad 16a50anos)12 o una incidencia de 0.004 por 1000 personas por año (intervalos desde la infancia a los 77 años)10, que son descubiertos incidentalmente. Estudios previos sugieren que en los sujetos asintomáticos con el patrón electrocardiográfico de WPW la MS es todavía más rara, pero hay reportes que señalan que del 12% al 27% de éstos, estuvieron asintomáticos antes del episodio de FV3,13,14.
El estudio electrofisiológico (EEF) es el método más confiable para establecer el pronóstico en el paciente con síndrome de WPW, se han identificado claramente las propiedades electrofisiológicas de los pacientes sintomáticos que sobrevivieron a un episodio de MS3,4,13-15. Pero, por otro lado, la incidencia de arritmias consideradas de riesgo se dice que es similar en individuos sintomáticos y asintomáticos16,17, sin embargo, el significado de las arritmias inducidas por estimulación en el EEF y el riesgo de MS en individuos asintomáticos con el patrón electrocardiográfico de WPW, sigue siendo motivo de controversia y el EEF sólo se ha sugerido sistemáticamente en población que practica alguna actividad deportiva, atletas competitivos, profesiones con alto nivel físico (policías, bomberos, soldados) y en personas con alta responsabilidad profesional (pilotos, choferes, etc.)14,18-21. El objetivo del informe es describir las características electrofisiológicas encontradas en un grupo de individuos con WPW asintomático con una actividad deportiva o alta responsabilidad profesional, referidos para tratamiento, y compararlos con un grupo control similar de pacientes con WPW sintomático en el Hospital de Cardiología del Centro Médico Nacional Siglo XXI del Instituto Mexicano del Seguro Social.
Métodos Pacientes
Entre diciembre de 2004 y diciembre de 2010, se estudiaron a 19 individuos asintomáticos consecutivos con patrón electrocardiográfico clásico de WPW (grupo A), edad media de 33 ± 13 años (intervalos 14 a 65 años), de los cuales 16 (84%) fueron sexo masculino. El patrón electrocardiográfico fue descubierto de manera fortuita durante una evaluación médica en 14 individuos con alta responsabilidad profesional, referidos por la Secretaría de Comunicaciones y Transportes (12 conductores de transporte público de pasajeros, un piloto aviador agrícola y un aspirante a piloto aviador privado), 5 para evaluación de aptitud deportiva (3 con actividad deportiva habitual en gimnasio, uno de alto rendimiento en baloncesto y uno en competencia en fisicoculturismo). Otro piloto aviador privado rehusó el estudio y no fue incluido.
Estos individuos fueron considerados asintomáticos porque nunca tuvieron historia de palpitaciones sostenidas ni arritmias documentadas. Las características electrofisiológicas fueron comparadas con un grupo control similar de WPW sintomático (grupo B). En todos se realizó una historia clínica y examen médico completo, radiografía de tórax, electrocardiograma en reposo, prueba de esfuerzo y monitoreo Holter-24 horas. La ausencia de cardiopatía estructural fue confirmada por ecocardiografía.
Protocolo del estudio electrofisiológico
El EEF fue realizado en ayunas y sin sedación; todos los pacientes dieron su consentimiento informado escrito. La estimulación programada se realizó con un estimulador cardiaco digital con pulsos rectangulares de 2 ms de duración al doble del umbral diastólico (EP3i, EP MedSystem). Se realizó estimulación auricular y ventricular a frecuencia creciente. La estimulación programada con extraestímulos (S2, S3 o S4) se realizó después de un tren de 8 latidos a 3 diferentes ciclos básicos (S1S1 600, 500 y 400 ms) hasta alcanzar la refractariedad auricular o ventricular. Cuando la FA no ocurrió con el protocolo previo, se intentó inducirla con estimulación tipo ráfaga iniciando con un ciclo de 300ms (200lpm) durante 20 segundos, hasta un ciclo mínimo de 150 ms (400 lpm). En los casos en los cuales no se indujo con los métodos de estimulación previa o en taquiarritmias no sostenidas, la inducción de FA fue evaluada con orciprenalina en 8 de los 19 pacientes asintomáticos (concentración 5 a10 μg/mL en infusión intravenosa continua, hasta alcanzar al menos un incremento del 20% de la frecuencia cardiaca de base).
Definiciones
Conducción anterógrada 1:1 (CaVAc 1:1). El ciclo de estimulación auricular con bloqueo de conducción al ventrículo por el fascículo accesorio (desaparición de la onda delta).
Conducción retrógrada 1:1 (CrVAc 1:1). El ciclo de estimulación ventricular con bloqueo de conducción a la aurícula por el fascículo accesorio.
El periodo refractario efectivo anterógrado (PREa-VAc) del fascículo accesorio fue definido como el intervalo de acoplamiento A1-A2 más largo que perdió la conducción al ventrículo por el fascículo accesorio (desaparición de la onda delta).
El periodo refractario efectivo retrógrado (PREr-VAc) del fascículo accesorio fue definido como el intervalo de acoplamiento V1-V2 más largo que perdió la conducción a la aurícula sobre el fascículo accesorio.
Se consideró taquicardia reciprocante o FA sostenidas cuando tuvieron una duración de ≥ 30 segundos y no sostenidas cuando terminaron espontáneamente dentro de ≤ 30 segundos. Se definió taquiarrítmia potencialmente grave a la TRAV antidrómicayalaFAcon un intervalo RR preexcitado<250ms basal o<200ms bajo orciprenalina. FA primaria a la arritmia inicial; FA secundaria a degeneración de TRAV en FA. El sitio del fascículo accesorio fue determinado por la polaridad del QRS en el electrocardiograma de superficie (ECG-12), de acuerdo a un algoritmo ampliamente utilizado22.
Análisis estadístico
Los datos se expresan con media ± DE. Para el análisis estadístico se utilizó la prueba t de Student o la prueba ji cuadrada. Un valor de p ≤ 0.05 fue considerado significativo.
Resultados
Características clínicas (tabla 1)
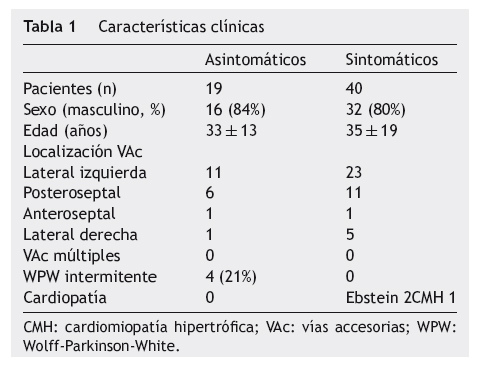
No hubo diferencias con respecto a la edad (33 ± 13 años vs 35 ± 19, p = NS) o sexo (hombres 84% vs 79%, p = NS) entre el grupo A y B. De los individuos asintomáticos 11 (58%) tuvieron localización en la pared libre lateral izquierda, en 7 (37%) la localización fue paraseptal (6 posteroseptal y uno anteroseptal derecha) y uno en la pared libre lateral derecha. No hubo diferencias en la localización del fascículo accesorio entre los grupos. La presencia de WPW intermitente o con bloqueo anterógrado súbito de la preexcitación fue más frecuente en el grupo A, 4 de 19 (21%) vs en ningún caso del grupo B, p < 0.001. No se documentaron casos de fascículos accesorios múltiples en ningún grupo y no hubo cardiopatía estructural en el grupo A. En el grupo B hubo 2 pacientes con anomalía de Ebstein y uno con cardiomiopatía hipertrófica no obstructiva.
Conducción anterógrada (tabla 2)
En estado de base hubo una diferencia significativa en el (PREa-VAc) y en el ciclo conducción anterógrada (CaVAc 1:1) en el grupo A comparado con el grupo B (PREa-VAc = 300 ±48 ms vs 262 ± 32 ms, p <0.05) y (CaVAc 1:1 = 355± 108ms vs 307±86ms, p<0.05), respectivamente (fig. 1). Ninguno del grupo A tuvo un PREa-VAc < 250 ms vs el 20% de los pacientes del grupo B, p < 0.001. Con orciprenalina se obtuvo un acortamiento significativo del PREa-VAc (298 ± 30 ms a 249 ± 26 ms, p<0.05). En 3 de los 8 pacientes (37.5%), el PREa-VAc fue< 250ms.
Inducción de taquiarritmias (tablas 3 y 4)

En condiciones de base en el grupo A se logró inducir FA no sostenida (12 segundos) y no preexcitada después de estimulación tipo ráfaga S1S1 a 220 ms en un solo caso (5.2%), con preexcitación de localización posteroseptal derecha. El protocolo de estimulación indujo FA en 13 de 40 (32.5%) pacientes del grupo B (p < 0.001), con técnica de extraestímulos o ráfaga (entre 180 y 270ms). En estos pacientes la FA fue sostenida y preexcitada en 12 (92.3%), no sostenida y preexcitada en uno (7.6%). En estos casos, en el 63% la FA terminó espontáneamente dentro de los 15 minutos de iniciada y en 5 de los 13 (38.4%) se interrumpió con cardioversión eléctrica por repercusión hemodinámica. El intervalo RR más corto entre latidos preexcitados durante FA en el grupo B fue 243 ± 50 ms. Hubo una tendencia sin significado estadístico de inducción de FA en la localización posteroseptal.
Con infusión de orciprenalina la estimulación programada indujo FA en 2 individuos del grupo A (10.5%), en uno de manera reproducible (3 veces) FA primaria sostenida no preexcitada (en el paciente en que previamente se indujo FA no sostenida en estado basal) y sin repercusión hemodinámica, pero que requirió cardioversión eléctrica por persistencia de más de 20 minutos. En el otro caso se obtuvo FA secundaria, inicialmente TRAV ortodrómica con conducción aberrante con paso espontáneo a FA con preexcitación intermitente (intervalo RR más corto entre latidos preexcitados de 310 ms) y terminación espontánea subsecuente (preexcitación de localización anteroseptal). El protocolo de estimulación en condiciones de base indujo TRAV ortodrómica variedad no sostenía sólo en un caso del grupo A 5.26% vs en 12.5% del grupo B (p <0.05). En ningún caso del grupo A se indujo TRAV sostenida, en contraste se indujo TRAV ortodrómica sostenida en el 82.5% del grupo B (p<0.001). Con orciprenalina se indujo TRAV ortodrómica en 3 de 19 (15.8%) asintomáticos, ésta fue sostenida y sin repercusión hemodinámica en el mismo caso en quien previamente fue no sostenida, y en los otros 2 la TRAV fue no sostenida (16 y 22 segundos de duración).
Conducción retrógrada
Once de 19 (58%) del grupo A no tuvieron conducción retrógrada sobre el fascículo accesorio, de los cuales 7 por disociación retrógrada completa y en 4 la conducción ventrículo-auricular fue de tipo decremental, mientras que sólo estuvo ausente en el 4% de los pacientes del grupo B (p < 0.001). La ausencia de conducción retrógrada se mantuvo a pesar de orciprenalina en 8 de 11 casos (72.7%) en que se utilizó. En el resto del grupo A con conducción retrógrada intacta sobre el fascículo accesorio, el periodo refractario efectivo (PREr-VAc) fue más largo comparado con el grupo B (320± 38ms vs 270± 33 ms, p<0.05). En los 8 pacientes con conducción retrógrada intacta sobre el fascículo accesorio la orciprenalina acortó tanto el PREr-VAc como la CrVAc 1:1 sobre el fascículo accesorio, pero sólo fue lo suficientemente crítica para inducir TRAV ortodrómica no sostenida en un caso.
Discusión
En pacientes con WPW, la FA puede ser una arritmia grave si el fascículo accesorio tiene un periodo refractario anterógrado muy corto, en estas circunstancias se ha documentado la ocurrencia de FV. Varios estudios han demostrado que en cerca de la mitad de los casos, la MS debida a FA que degenera en FV puede ser la primera manifestación del WPW. De acuerdo a estudios publicados, la incidencia de taquiarritmias consideradas de riesgo es similar en individuos asintomáticos y sintomáticos y abarca aproximadamente al 10% de la población con WPW.
En la práctica actual, la intención de la estratificación del riesgo en el individuo con WPW asintomático es identificar quiénes están en riesgo de taquiarritmias potencialmente letales. La estratificación del riesgo ha utilizado pruebas no invasivas que generalmente se consideran limitadas, por lo tanto, el EEF se considera el método más confiable para evaluar el riesgo15,23-28. Sin embargo, el significado clínico exacto de las taquiarrítmias inducidas en la evaluación electrofisiológica con el riesgo de MS en el individuo asintomático sigue siendo polémico7,16,29. Un estudio reciente de Pappone et al.30 confirma diversos predictores de eventos arrítmicos en el WPW asintomático e incluye a individuos jóvenes, un PREa-VAc significativamente corto y fascículos accesorios múltiples, e incluso la sola inducción de taquiarrítmias mostró buena sensibilidad, especificidad y valor predictivo positivo más alto que el PREa-VAc, concluyendo que en el WPW asintomático un EEF negativo identifica un grupo de pacientes de muy bajo riesgo de presentar taquiarritmias espontáneas y que la inducción de FA preexcitada con intervalo RR<250ms particularmente en presencia de vías múltiples, ayuda a seleccionar al individuo asintomático en riesgo definitivo de MS, en quien es obligado indicar la ablación con catéter.
Este perfil electrofisiológico es congruente con los resultados de nuestro informe para el PREa-VAc y CaVAc 1:1, pero en esta serie limitada, una diferencia clara fue que no hubo casos con vías múltiples y la baja inducibilidad de TRAV o FA, tanto en situación de base o con reto farmacológico con orciprenalina si se compara con la muy alta incidencia de inducibilidad en los informes del grupo de Pappone30,31, aunque acorde si se compara con informes sobre historia natural del WPW asintomático7,9-11,32.
Pero, como puntualiza Todd et al.33 ¿son estos hallazgos argumentos convincentes para el EEF de rutina en todos los casos con WPW asintomático? No necesariamente, ya que el principal argumento para el EEF de un individuo asintomático es identificar aquellos con riesgo subsecuente de MS, más que identificar aquellos que pueden hacerse sintomáticos en un momento de su evolución por aparición de cualquier otra taquiarrítmia. Pero debe aclararse que considerar a la MS como objetivo final de la estratificación por EEF no es posible debido a la muy baja incidencia de esta complicación, y si uno considera otros objetivos secundarios como la aparición del primer evento arrítmico, aunque es un objetivo clínico más susceptible de ser medible, quizás no tenga la suficiente justificación para permitir el EEF en todos34.
En cuanto al EEF no hay un solo elemento con alta sensibilidad y especificidad, por ejemplo, en FA un intervalo RR preexcitado<250ms es un marcador específico pero poco sensible de riesgo de FV, ya que se encuentra presente hasta en la tercera parte de los individuos asintomáticos durante la inducción de FA. La inducción de TRAV se considera que también es un marcador específico de eventos arrítmicos futuros, ya que la secuencia de eventos generalmente aceptada es el inicio de TRAV que degenera en FA secundaria y ésta en FV, pero también es un criterio poco sensible. La posibilidad de que un individuo asintomático desarrolle TRAV en el seguimiento es mucho más alta si conserva intacta la conducción retrógrada y si se induce TRAV sostenida en el EEF33,35,36. La frecuencia de inducción de TRAV sostenida en nuestro grupo asintomático fue muy baja y en más de la mitad de los casos (58%) no hubo conducción retrógrada por la vía accesoria o fue muy limitada aún después del uso de orciprenalina, lo que explica porque están libres de episodios de taquicardia.
En el reporte más reciente y probablemente el más cercano a la historia natural del WPW asintomático se confirma el pronóstico generalmente bueno, y apoya la utilidad del EEF para identificar a individuos asintomáticos con alto riesgo, ya que los parámetros electrofisiológicos predictivos de arritmias graves son los mismos para el WPW sintomático como asintomático, notablemente en población preadolescente y adolescente, sugiriendo que en éstos la ablación con catéter debería realizarse en el contexto del EEF, y se deja como indicación más libre a pacientes de bajo riesgo, que representan la gran mayoría de los pacientes37.
Otro punto de vista a considerar es el de Femenia et al.38 quienes cuestionan si se debe esperar a que un individuo asintomático debute con un episodio de MS, sugiriendo que de manera individualizada y en base a una tasa elevada de éxitos, seguridad y bajas complicaciones, la ablación con catéter debería ser considerada como la alternativa más simple en la prevención de MS en el WPW asintomático.
Muchos de los casos de MS en individuos con WPW han tenido asociación con el ejercicio. En el contexto del deportista, el WPW representó aproximadamente el 1% en un registro a largo plazo de muerte súbita en atletas39. Sin embargo, no se sabe si éstos eran por definición individuos asintomáticos. La intención de reducir el riesgo llevó a la Asociación Americana del Corazón a establecer recomendaciones para decidir elegir o descalificar atletas, dando la recomendación de estratificación de riesgo con EEF sólo en atletas asintomáticos que participan en deportes de moderado a alto nivel competitivo. Esto está en contraste con una posición un poco más agresiva de la Sociedad Europea de Cardiología, que establece que todos los atletas con WPW deben someterse a la evaluación de riesgos completa que incluye un EEF40 (clase IIA, evidencia B/C)41. Mientras que la ablación se ha recomendado en los deportistas asintomáticos con WPW, para aquellos que rechazan la ablación o que tienen una localización parahisiana, los deportes competitivos se pueden permitir si ninguno de los criterios electrofisiológicos críticos de riesgo antes mencionados están presentes (clase IIA, evidencia C)41.
Obeyesekere et al.42 en su comentario editorial resalta que el tratamiento deberá apoyarse también en la preferencia del paciente bien informado para el balance de un riesgo muy bajo de la ablación inmediata, pero también un riesgo muy bajo a largo plazo sin ablación.
¿Cambiarán las indicaciones de las guías actuales para proponer una estrategia de ablación profiláctica en WPW asintomático? Es difícil hacer una fuerte recomendación, las últimas guías hacen una indicación en adultos clase IIA, nivel de evidencia B43. En nuestro país no existe una legislación sanitaria para la práctica deportiva, por lo que la evaluación cardiovascular antes o después de la participación es a discreción, aunque en general todos los casos con preexcitación ventricular son referidos y en base a las recomendaciones internacionales son aceptados para estratificación y/o tratamiento antes de otorgar un certificado de elegibilidad deportiva.
Del mismo modo, aún cuando los individuos con WPW asintomático referidos por actividad profesional de alto riesgo en nuestra pequeña serie confirman un perfil electrofisiológico benigno, la Secretaría de Comunicaciones y Transporte solicita en base a las guías médico/científicas de seguridad personal y pública20,44, que se realice el procedimiento ablativo. Tomando en cuenta un riesgo aunque muy bajo, pero inaceptable de taquiarritmias potencialmente graves en este subgrupo de pacientes, en nuestro Centro se acepta esta conducta terapéutica, más aún cuando el procedimiento está al alcance de la institución, se cuenta con amplia experiencia y ofrece un éxito alto, por lo que el EEF con fines de ablación con catéter se mantiene como una indicación sistemática.
Limitaciones del estudio
En ausencia de disponibilidad en nuestro medio de isoproterenol se utilizó el agonista (β2-adrenérgico orciprenalina (metaproterenol), aunque ambos fármacos tienen acciones esencialmente similares y el objetivo fue un incremento de al menos el 20% de la frecuencia cardiaca de base. La mayoría de los pacientes fueron mayores de 30 años de edad, por tanto, los resultados no pueden ser aplicados a población pediátrica en quienes las propiedades electrofisiológicas cambian con el tiempo. La presencia de arritmias asintomáticas no podría ser excluida, aunque no fueron observadas durante el monitoreo Holter-24 horas. No se hicieron esfuerzos para protocolos de estimulación más agresivos (mínimo 150 ms), si se compara con otros estudios que utilizan ciclos mínimos de 50 o 40 ms (estimulación auricular entre 1200 y 1500 impulsos por minuto), que evidentemente le resta especificidad. Aunque los resultados son similares con estudios previos, se resalta que ésta fue una serie limitada de pacientes.
Conclusión
En esta muestra de individuos con WPW asintomático tuvimos la oportunidad de confirmar que las propiedades electrofisiológicas son benignas por tener un periodo refractario efectivo anterógrado del fascículo accesorio largo, y en más de la mitad de los casos ausencia o deficiente conducción retrógrada por el fascículo accesorio aún después de estimulación β2-adrenérgica, lo que explicaría la ausencia clínica de taquiarritmias. Aunque estos resultados no estarían a favor de una investigación agresiva en todo paciente asintomático, debido a las posibles consecuencias en los deportistas y aquellos con alta responsabilidad profesional, se mantiene la indicación del EEF sistemático con fines de ablación preventiva.
Financiamiento
No se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Gallagher JJ, Pritchett ELC, Sealy WC, et al. The preexcitation syndrome. Prog Cardiovasc Dis. 1978;20:285-327. [ Links ]
2. Dreyfus LS, Haiat R, Watanabe Y. Ventricular fibrillation: A possible mechanism of sudden death in patients with Wolff-Parkinson-White syndrome. Circulation. 1971;43:520-7. [ Links ]
3. Klein GJ, Bashore TM, Sellers TD, et al. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. N Engl J Med. 1979;301:1080-5. [ Links ]
4. Montoya PT. On behalf of the European Registry on Sudden Death in the Wolff-Parkinson-White Syndrome: Ventricular fibrillation in the Wolff-Parkinson-White syndrome (abstract). Circulation. 1988;78 suppl II. II-22. [ Links ]
5. Averill KH, Fosmoe RJ, Lamb LE. Electrocardiographic findings in 67,375 asymptomatic subjects. Am J Cardiol. 1960;6:108-29. [ Links ]
6. Smith RF. The Wolff-Parkinson-White syndrome as an aviation risk. Circulation. 1964;29:672-9. [ Links ]
7. Berkman NL, Lamb LE. The Wolff-Parkinson-White electrocardiogram: A follow up study of five to twenty-eight years. N Engl J Med. 1968;278:492-4. [ Links ]
8. Guize L, Soria R, Chaouat JC, et al. Prevalence et evolution du syndrome de Wolff-Parkinson-White dans use population de 138 048 sujets. Ann Med Interne. 1985;136:474-8. [ Links ]
9. Flensted-Jensen E. Wolff-Parkinson-White syndrome. A long-term follow-up of 47 cases. Acta Med Scand. 1969;186:65-74. [ Links ]
10. Munger TM, Packer DL, Hammill SC, et al. A population study of the natural history of Wolff-Parkinson-White syndrome in Olmsted County. Minnesota, 1953-1989. Circulation. 1993;87:866-73. [ Links ]
11. Fitzsimmons PJ, McWhirter PD, Peterson DW, et al. The natural history of Wolff-Parkinson-White syndrome in 228 military aviators: a long-term follow-up of 22 years. Am Heart J. 2001;142:530-6. [ Links ]
12. Hiss RG, Lamb LE. Electrocardiographic findings in 122,043 individuals. Circulation. 1962;25:947-61. [ Links ]
13. Montoya PT, Brugada P, Smeets J, et al. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. Eur Heart J. 1991;12:144-50. [ Links ]
14. Timmermans C, Smeets JL, Rodriguez LM, et al. Aborted sudden death in the Wolff-Parkinson-White syndrome. Am J Cardiol. 1995;76:492-4. [ Links ]
15. Sharma AD, Yee R, Guiraudon G, et al. Sensitivity and specificity of invasive and noninvasive testing for risk of sudden death in Wolff-Parkinson-White syndrome. J Am Coll Cardiol. 1987;10:373-81. [ Links ]
16. Brembilla-Perrot B, Ghawi R. Electrophysiological characteristics of asymptomatic Wolff-Parkinson-White syndrome. Eur Heart J. 1993;14:511-5. [ Links ]
17. Milstein S, Sharma AD, Klein GI. Electrophysiologic profile of asymptomatic Wolff-Parkinson-White pattern. Am J Cardiol. 1986;57:1097-100. [ Links ]
18. Wiedermann CJ, Becker AE, Hopperwieser T, etal. Sudden death in young competitive athlete with Wolff-Parkinson-White syndrome. Eur Heart J. 1987;8:651 -5. [ Links ]
19. Maron BJ. Sudden death in young athletes. N Engl J Med. 2003;349:1064-75. [ Links ]
20. Borchardt CJ. You're the flight surgeon: WPW ECG pattern. Aviat Space Environ Med. 2004;75:1094-5. [ Links ]
21. Saxena A, Chang CJ, Wang S. Wolff-Parkinson-White syndrome in athletes. Curr Sports Med Rep. 2006;5:254-7. [ Links ]
22. Iturralde TP, Araya GV, de Micheli A, et al. A new Electrocardiographic algorithm for localizing accessory pathways using only the polarity of the QRS complex. Arch Inst Cardiol Méx. 1995;65:19-29. [ Links ]
23. LevyS, Broustet JP, Clementy J, etal. Syndrome de Wolff Parkinson White. Correlation entre l'exploration electrophysiologique et l'effet de l'epreuve d'effort sur l'aspect electrocardiographique de preexcitation. Arch Mal Coeur. 1979;72:634-40. [ Links ]
24. Strasberg B, Ashley WW, Wyndham CRC, et al. Treadmill exercise testing in the Wolff Parkinson White syndrome. Am J Cardiol. 1980;45:742-8. [ Links ]
25. Daubert C, Ollitraut J, Descaves C, et al. Failure of the exercise test to predict the anterograde refractory period of the accessory pathway in Wolff Parkinson White syndrome. Am J Cardiol. 1986;57:782-6. [ Links ]
26. Wellens HJJ, Bar FW, Dassen WR, et al. Effects of drugs in the Wolff Parkinson White syndrome. Importance of initial length of effective refractory period in the accessory pathway. Am J Cardiol. 1980;46:665-9. [ Links ]
27. Critelli G, Gallagher JJ, Perticone F, et al. Evaluation of non invasive tests for identifying patients with preexcitation syndrome at risk of rapid ventricular response. Am Heart J. 1984;108:905-9. [ Links ]
28. Brembilla-Perrot B. Electrophysiological evaluation of Wolff-Parkinson-White Syndrome. Indian Pacing Electrophysiol J. 2002;2:143-52. [ Links ]
29. Brembilla-Perrot B, Holban I, Houriez P, et al. Influence of age on the potential risk of sudden death in asymptomatic Wolff-Parkinson-White syndrome. PACE. 2001;24:1514-8. [ Links ]
30. Pappone C, Santinelli V, Rosanio S, et al. Usefulness of invasive electrophysiologic testing to stratify the risk of arrhythmic events in asymptomatic patients with Wolff-Parkinson-White pattern. Results from a large prospective long-term follow-up study. J Am Coll Cardiol. 2003;41:239-44. [ Links ]
31. Pappone C, Santinelli V, Manguso M, et al. A Randomized study of prophylactic catheter ablation in asymptomatic patients with the Wolff -Parkinson -White syndrome. N Engl J Med. 2003;349:1803-11. [ Links ]
32. Wellens HJJ, Pappone C, Santinelli V. When to perform catheter ablation in asymptomatic patients with a Wolff-Parkinson-White electrocardiogram. Circulation. 2005;112:2201-16. [ Links ]
33. Todd DM, Klein GJ, Krahn AD, et al. Asymptomatic Wolff Parkinson-White Syndrome: Is it time to revisit guidelines? J Am Coll Cardiol. 2003;41:245-8. [ Links ]
34. Klein GJ, Gula LJ, Krahn Hl, et al. WPW pattern in the asymptomatic individual: Has anything changed? Circ Arrhythm Electrophysiol. 2009;2:97-9. [ Links ]
35. Beckman KJ, Gallastegui JL, Bauman JL, et al. The predictive value of electrophysiologic studies in untreated patients with Wolff- Parkinson-White syndrome. J Am Coll Cardiol. 1990;15:640-7. [ Links ]
36. Leitch JW, Klein GJ, Yee R, et al. Prognostic value of electrophysiology testing in asymptomatic patients with Wolff-Parkinson-White pattern. Circulation. 1990;82:1718-23. [ Links ]
37. Pappone C, Vicedomini G, Manguso F, et al. Risk of malignant arrhythmias in initially symptomatic patients with Wolff-Parkinson-White syndrome. Results of a prospective long-term electrophysiological follow-up study. Circulation. 2012;125:661-8. [ Links ]
38. Femenia JF, Bravo A, Peñafort F, et al. Síndrome de preexcitación: aproximación simple en la prevención de muerte súbita. Rev Fed Arg Cardiol. 2008;37:253-7. [ Links ]
39. Maron BJ, Doerer JJ, Haas TS, et al. Sudden deaths in young competitive athletes: analysis of 1866 deaths in the United States, 1980-2006. Circulation. 2009;119:1085-92. [ Links ]
40. Pelliccia A, Zipes DP, Maron BJ. Bethesda Conference #36 and the European Society of Cardiology Consensus Recommendations Revisited. A Comparison of U.S. and European Criteria for Eligibility and Disqualification of Competitive Athletes with Cardiovascular Abnormalities. J Am Coll Cardiol. 2008;52:1990-6. [ Links ]
41. Cohen MI, Triedman JK, Cannon BC, et al. PACES/HRS expert consensus statement on the management of the asymptomatic young patient with a Wolff-Parkinson-White (WPW, ventricular preexcitation) electrocardiographic pattern: developed in partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American College of Cardiology Foundation (ACCF), the American Heart Association (AHA), the American Academy of Pediatrics (AAP), and the Canadian Heart Rhythm Society (CHRS). Heart Rhythm. 2012;9:1006-24. [ Links ]
42. Obeyesekere M, Gula JL, Skanes CA, et al. Risk of sudden death in Wolff-Parkinson-White Syndrome. How high is the risk? Circulation. 2012;125:659-60. [ Links ]
43. Blomstrom-Lundqvist C, Scheinman MM, Aliot EM, et al. ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias- executive summary: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias). Circulation. 2003;108:1871-909. [ Links ]
44. Epstein AE, Miles WM, Benditt DG, et al. Personal and public safety issues related to arrhythmias that may affect consciousness: implications for regulation and physician recommendations: A medical/scientific statement from the American Heart Association and the North American Society of Pacing and Electrophysiology. Circulation. 1996;94:1147-66. [ Links ]














