Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.82 no.4 Ciudad de México oct./dic. 2012
https://doi.org/10.1016/j.acmx.2012.09.002
Investigación básica
Doble salida de ventrículo derecho. Enfoque embriológico
Double outlet right ventricle. Embryological approach
Luis Muñoz-Castellanosa y Magdalena Kurib
a Departamento de Embriología, Instituto Nacional de Cardiología Ignacio Chávez, México D.F., México.
b Departamento de Ciencias Morfológicas, Escuela Superior de Medicina, Instituto Politécnico Nacional, México D.F., México.
Autor para correspondencia:
Luis Muñoz-Castellanos
Departamento de Embriología.
Instituto Nacional de Cardiología Ignacio Chávez.
Juan Badiano 1, Colonia Sección 16, C.P. 14080, México D.F., México.
Correo electrónico: munoz-embriologia@hotmail.com
Recibido el 21 de junio de 2012
Aceptado el 27 de septiembre de 2012
Resumen
Objetivo: Se presenta una explicación patogenética sobre la morfogénesis de la doble salida de ventrículo derecho que explica su origen.
Método: Se describieron 35 corazones con doble salida de ventrículo derecho, 15 con grandes arterias ligeramente cruzadas, 10 con arterias lado a lado y 10 con aorta anterior y pulmonar posterior. Se comparó el plano de separación de las vías de salida y de las grandes arterias en los 3 tipos de esta cardiopatía, con el plano de la tabicación troncoconal normal del corazón embrionario. Se determinó el plano cefálico del tabique troncoconal y se comparó con la posición de su borde inferior, con lo cual se calculó el grado de torsión troncoconal en cada grupo de esta cardiopatía; esto permitió inferir el tipo de giro de ese tabique en las 3 formas anatómicas mencionadas.
Resultados: En las grandes arterias ligeramente cruzadas el giro troncoconal fue de 135°,en las arterias lado a lado fue de 90°, en la aorta anterior derecha fue de 0° y en la aorta anterior izquierda fue de -90°.
Conclusión: Embriológicamente esta cardiopatía se origina por persistencia de la continuidad entre el ventrículo derecho y el troncocono, que origina las vías de salida y las grandes arterias. Sus variantes anatómicas se originan por una detorsión progresiva del tabique troncoconal continuada con una torsión de -90°.
Palabras clave: Cardiopatía congénita; Doble salida de ventrículo derecho; Embriología cardíaca; México.
Abstract
Objective: It is proposed a pathogenetic explanation that explains the morphogenesis of the anatomic variants of double outlet right ventricle.
Method: An anatomic embryological correlation was made in which the plane separating the outlets and great arteries in the types of this cardiopathy was compared with the normal truncoconal septum in the embryonic heart. Thirty five hearts with double outlet right ventricle were described, fifteen with great arteries slightly crossed, ten with side by side great arteries and ten with anterior aorta and posterior pulmonary artery. The cephalic border of the truncoconal septum was compared with its inferior border in each group. With this procedure we calculated the type of torsion of the truncoconal septum.
Results: In the slightly crossed great arteries the truncoconal twist was of 135° in side by side great arteries the twist was of 90° and in anterior right aorta the truncoconal septum was straight with 0° of rotation, and with left anterior aorta the rotation was of -90°. Conclusion: Embryologically double outlet right ventricle is originated by the persisting continuity between the right ventricle with the truncus and conus which form the great arteries and their outlets. The anatomic variations are the consequence of progressive detortion of the truncoconal septum followed by a torsion of -90°.
Keywords: Congenital heart disease; Double outlet right ventricle; Cardiac embryology; Mexico.
Introducción
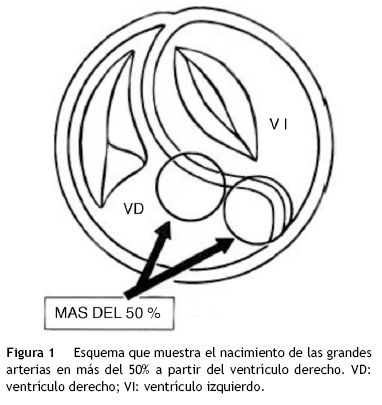
La doble salida de ventrículo derecho agrupa a un conjunto heterogéneo de cardiopatías congénitas que tienen en común el tipo de conexión ventriculoarterial, en el que más del 50% de las áreas valvulares de las grandes arterias nacen de ese ventrículo1 (fig. 1). En estos corazones es necesaria una comunicación interventricular que funciona como única salida de la sangre del ventrículo izquierdo hacia el ventrículo derecho, de donde surgen las grandes arterias; este defecto septal puede variar de posición según se ubique la trabécula septomarginal, si ésta se desarrolla debajo del infundíbulo posterior derecho el defecto septal es subinfundibular posterior, por el contrario si la trabécula se forma en posición anterior se ubica debajo del infundíbulo anterior, dicho defecto es subinfundibular anterior. Cuando el septum infundibular no se forma o es muy hipoplásico, la trabécula septomarginal se ubica debajo de las 2 salidas, constituyendo el defecto septal infundibular subarterial, finalmente la comunicación interventricular puede formarse en zonas alejadas a las vías de salida. Estas variantes de la comunicación interventricular y los tipos de relaciones espaciales de las vías de salida y de las grandes arterias han servido como parámetros para su sistematización2,3. Clásicamente se han considerado 3 grandes grupos con la aorta dextropuesta: grandes arterias ligeramente entrecruzadas, paralelas en el plano frontal (lado a lado) y con aorta anterior y arteria pulmonar posterior, este último grupo a su vez con 3 variantes anatómicas: aorta anterior derecha con arteria pulmonar posterior izquierda, aorta anterior con pulmonar posterior y aorta anterior izquierda con pulmonar posterior derecha (fig. 2). En estas cardiopatías las vías de salida presentan 2 variantes posicionales anterior-posterior y lado a lado4 (fig. 3). En el grupo de grandes arterias ligeramente cruzadas la salida anterior es izquierda y origina a la arteria pulmonar, y la salida posterior es derecha y origina a la aorta. En el grupo con aorta anterior esta arteria nace del infundíbulo anterior derecho, y la arteria pulmonar lo hace del infundíbulo posterior izquierdo. En la variante de grandes arterias paralelas en el plano frontal (lado a lado), la salida subaórtica está situada a la derecha y la salida subpulmonar a la izquierda, las grandes arterias tienen las mismas posiciones que sus vías de salida. Otro criterio empleado en la sistematización de este grupo de cardiopatías es la presencia o ausencia de obstrucción en una de las 2 vías de salida, ya sea subaórtica o subpulmonar5.

Es frecuente la presencia de 2 infundíbulos que se definen como vías de salida de paredes musculares con discontinuidad atrioventricular-sigmoidea, lo que en el pasado se consideró como criterio patognomónico de esta cardiopatía6 (fig. 4 A). Se han descrito muchos casos con un solo infundíbulo que puede ser subaórtico o subpulmonar7 (fig. 4 B). Para entender los mecanismos patogenéticos involucrados en el origen de este grupo heterogéneo de cardiopatías, es necesario conocer con precisión las características anatómicas y espaciales tanto de las vías de salida ventriculares como de las grandes arterias8,9.

Varios autores han propuesto que la doble salida del ventrículo derecho se origina por la persistencia de un patrón morfológico y hemodinámico característico del corazón embrionario durante los horizontes XIII y XIV de Streeter, en los que el esbozo del ventrículo derecho posee las 2 vías de salida10-12.
En el presente trabajo se propone una explicación patogenética de los diferentes tipos anatómicos de esta cardiopatía basada en las torsiones anormales del tabique troncoconal inferiores a los 180°, que afectan primariamente al segmento infundibular que origina las vías de salida y que repercute secundariamente en el tabique troncal que separa a las grandes arterias. Esta propuesta se basa en el análisis anatómico de las vías de salida y de la interrelación de las grandes arterias en cada uno de los grupos mencionados. También se propone una nueva nomenclatura de la comunicación interventricular basada en la anatomía de las vías de salida de este grupo de cardiopatías congénitas.
Método
Se describieron 30 corazones portadores de doble salida de ventrículo derecho de la colección patológica del Instituto Nacional de Cardiología Ignacio Chávez. Se emplearon los lineamientos del sistema secuencial segmentario utilizados en el diagnóstico morfológico de las cardiopatías congénitas1. Se empleó la clasificación basada en la relación espacial entre las grandes arterias y sus vías de salida2,3, la cual comprende 3 grupos: grandes arterias ligeramente cruzadas, grandes arterias lado a lado, y grandes arterias con aorta anterior y arteria pulmonar posterior (fig. 2).
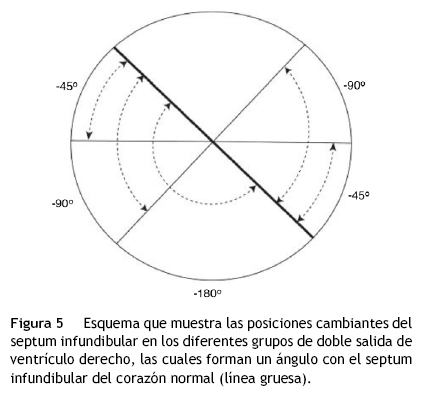
Se utilizó un método geométrico que consistió en determinar la orientación espacial del septum infundibular en cada uno de los 3 grupos mencionados; éste se proyectó hacia el plano del septum infundibular del corazón normal; el ángulo obtenido entre los 2 planos fue medido y su valor en grados se restó al valor de 180°, que representa la torsión normal del tabique troncoconal; de esta forma se calcularon los grados de rotación troncoconal en cada grupo de la doble salida de ventrículo derecho (fig. 5).
Resultados
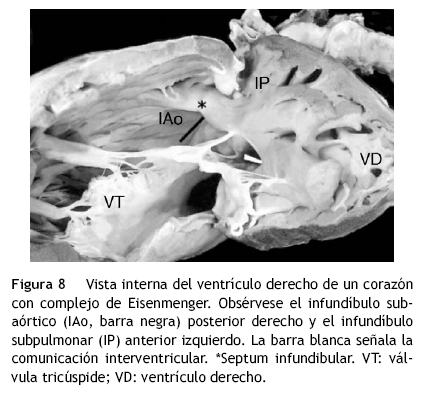
Las posiciones cambiantes del tabique infundibular que separa las vías de salida y los grados de rotación variables del tabique troncal que separa las grandes arterias, revelaron un espectro de grados de detorsión del tabique troncoconal que afecta primariamente al segmento infundibular, y que repercute en el segmento troncal. En el grupo con grandes arterias ligeramente cruzadas constituido por 15 corazones, el borde inferior del tabique troncoconal se ubicó de derecha a izquierda en sentido ventrodorsal, por lo que la torsión troncoconal fue de 135° y la detorsión fue de 45°, con las vías de salida subpulmonar anterior izquierda y subaórtica posterior derecha (figs. 6A y B, 7-9). La comunicación interventricular fue subinfundibular posterior ubicada debajo del infundíbulo subaórtico en 14 corazones, y en uno fue infundibular subarterial. En el grupo con grandes arterias lado a lado formado por 5 corazones, la ubicación del extremo inferior del tabique troncoconal fue anteroposterior con torsión troncoconal de 90° y detorsión también de 90° (figs. 6C, 10 y 11). La comunicación interventricular en este grupo fue subinfundibular anterior, debajo del infundíbulo subpulmonar.


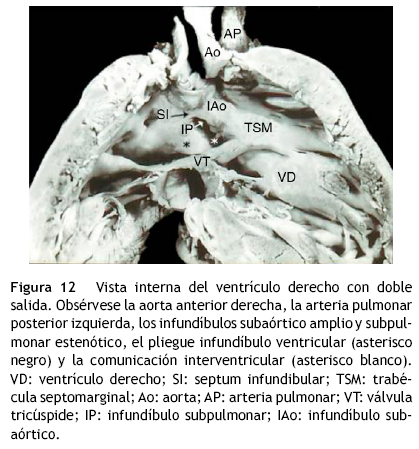
El tercer grupo estuvo formado por 10 corazones, 8 con aorta anterior derecha y pulmonar posterior izquierda, en los cuales la orientación del borde inferior del tabique troncoconal fue de derecha a izquierda en sentido ventrodorsal, que coincide con la orientación del borde cefálico del tabique troncal, el cual fue recto (0° de torsión) (figs.6D y 12), la comunicación interventricular en este subgrupo fue subinfundibular posterior debajo del infundíbulo subpulmonar; 2 corazones de este subgrupo presentaron estenosis pulmonar mixta valvular e infundibular. La variante con aorta anterior y pulmonar posterior representada por un corazón mostró el borde inferior el tabique troncoconal orientado frontalmente de derecha a izquierda, con una rotación negativa de 45° (fig. 6 E); la comunicación interventricular en este corazón fue subinfundibular posterior debajo de la arteria pulmonar. La variante con aorta anterior izquierda y pulmonar posterior derecha constituida por un corazón, mostró una rotación negativa de 90° en el tabique troncoconal (fig. 6 F). La comunicación interventricular fue subinfundibular anterior situada debajo de la aorta.
Discusión
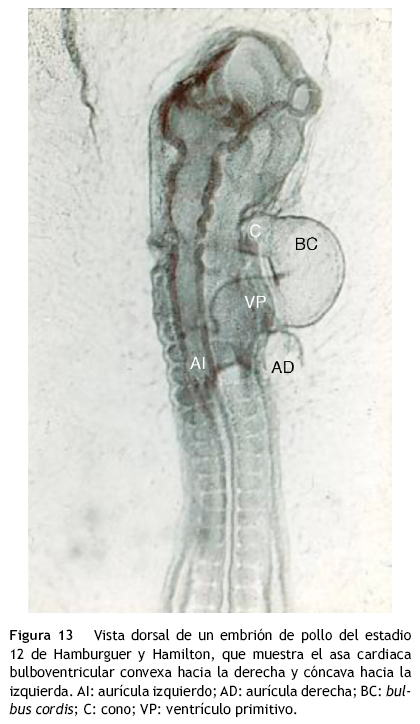
En etapas tempranas del desarrollo del corazón, el esbozo del ventrículo derecho (bulbus cordis) se continúa con el cono o infundíbulo primitivo que da origen a las vías de salida, y éste a su vez, con el tronco que da origen a la aorta ascendente y al tronco de la arteria pulmonar (horizontes de Streeter XI, XII, XIII y XIV)13,14 (figs. 13 y 14), esto constituye la premisa fundamental que explica el origen de la doble salida del ventrículo derecho. Normalmente, los canales aórtico y pulmonar se separan por el desarrollo de un tabique troncoconal helicoidal con un giro de 180°, lo que determina la relación entrecruzada de las grandes arterias que se observa en el corazón normal (horizontes de Streeter XIV, XV, XVI, XVII y XVIII)15. Durante la separación de los canales aórtico y pulmonar por el tabique troncoconal, éstos nacen del ventrículo derecho (fig. 15 A). El troncocono experimenta un desplazamiento de derecha a izquierda, proceso que acerca a la vía de salida subaórtica hacia la cavidad del ventrículo izquierdo (fig. 15 B) hasta que la aorta establece su conexión completa con dicho ventrículo (fig. 15 C); en este momento se oblitera la comunicación interventricular (horizonte XIX de Streeter)10. La explicación patogenética generalmente aceptada es la falta de desplazamiento troncoconal de derecha a izquierda, lo que determina que la salida aórtica no se conecte con el ventrículo izquierdo y permanezca dentro del ventrículo derecho junto con la salida subpulmonar8,13,15 (fig. 15 A). No se conocen las causas de fondo de la detención del deslizamiento troncoconal de derecha hacia la izquierda.

En este trabajo se proponen los mecanismos patogenéticos que originan las variantes anatómicas de la doble salida de ventrículo derecho basados en alteraciones de las posiciones del tabique infundibular, que provocan detorsiones progresivas en el tabique troncal. Cuando ocurre tabicación troncoconal normal, este tabique presenta un giro de 180° en los que la salida aórtica es posterior izquierda, y la pulmonar anterior derecha (fig. 16 A).
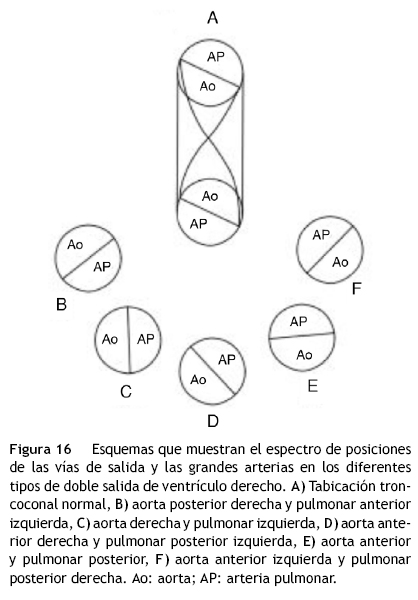
Cuando se comparan los 3 grupos anatómicos de esta cardiopatía, se observa como elemento constante la dextroposición aórtica y en cada variante la aorta cambia de ubicación; en el grupo de grandes arterias ligeramente cruzadas, la vía de salida subaórtica es posterior derecha (fig. 16 B); en el grupo de grandes arterias lado a lado, la aorta es paralela a la arteria pulmonar y está situada a la derecha de ella (fig. 16 C); en el tercer grupo, la aorta se sitúa a la derecha por delante de la arteria pulmonar (fig. 16 D), luego se ubica por delante de la arteria pulmonar (fig. 16 E) y finalmente, se coloca en posición anterior izquierda respecto a la arteria pulmonar (fig. 16 F).
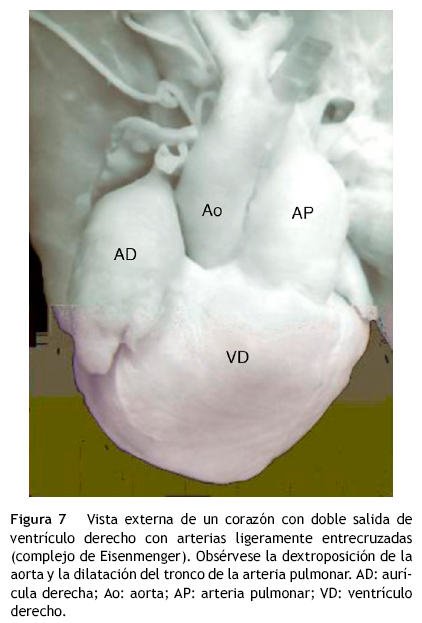
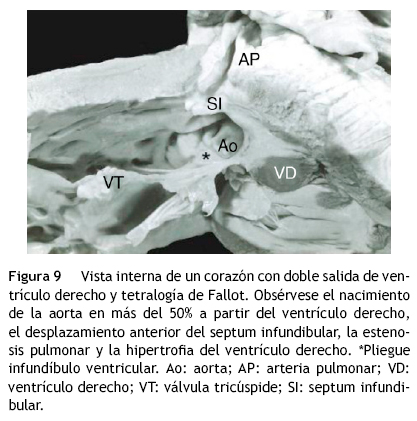
En el grupo de grandes arterias ligeramente cruzadas sin obstrucción de la vía pulmonar, se conforma la variante denominada complejo de Eisenmenger que cursa con hiperflujo pulmonar (figs. 7 y 8). Una variable que puede agregarse es la obstrucción de la vía pulmonar debido al desplazamiento anterior del septum infundibular, lo que produce la asociación de doble salida de ventrículo derecho con tetralogía de Fallot6,7 (figs.6 B y 9). Cuando las vías de salida y las grandes arterias están lado a lado, el infundíbulo subaórtico al experimentar hipertrofia puede quedar obstruido y presentar hiperflujo pulmonar. En el grupo con aorta anterior y pulmonar posterior, el septum infundibular puede desplazarse en sentido posterior produciendo obstrucción subpulmonar; cuando el tabique infundibular presenta desplazamiento anterior se produce obstrucción subaórtica.
En la nomenclatura tradicional el nombre de la comunicación interventricular está dado por la arteria que se ubica por encima de ella (subaórtica o subpulmonar). Se mencionó que las grandes arterias cambian de posición en los 3 grupos de la doble salida de ventrículo derecho, y un mismo defecto septal interventricular puede ser subaórtico cuando las grandes arterias están ligeramente cruzadas, o subpulmonar, cuando la aorta es anterior derecha y la arteria pulmonar posterior izquierda. De la misma manera la comunicación interventricular subinfundibular anterior puede ser subpulmonar cuando las grandes arterias están lado a lado (complejo de Taussig Bing), o subaórtica en el grupo con aorta anterior izquierda y pulmonar posterior derecha.
De la Cruz11 y Kramer16 sostuvieron que la doble salida del ventrículo derecho se originaba por la persistencia del espolón de Wolff (pliegue infundíbulo ventricular), que impedía el desplazamiento de derecha a izquierda del troncocono, lo cual evitaría la conexión de la aorta con el ventrículo izquierdo quedando las 2 grandes arterias contenidas en el ventrículo derecho16 (fig. 14 A). Este punto de vista actualmente se considera muy mecanicista, y ha sido invalidado por la existencia de corazones con doble salida del ventrículo derecho y ausencia del pliegue infundíbulo ventricular, en los que existe continuidad valvular mitroaórtica3.Nose sabe qué papel juegan las modificaciones del citoesqueleto de las células involucradas en la transferencia de la aorta hacia el tracto de salida del ventrículo izquierdo. Estas modificaciones sí están involucradas en otros tipos de movimientos morfogenéticos, como la torsión del tubo cardíaco que origina la formación del asa bulboventricular17,18. Por esta razón no podemos ofrecer una explicación de la detención del desplazamiento troncoconal.
Experimentalmente se ha producido en embriones de pollo doble salida de ventrículo derecho al colocar dispositivos en el troncocono que impiden su desplazamiento normal, por lo que las grandes arterias quedan retenidas dentro del ventrículo derecho19,20; también se ha reproducido esta cardiopatía cuando el desarrollo embrionario es afectado por hipotermia21.
Del análisis de las posiciones cambiantes del segmento inferior (infundibular) del tabique troncoconal, se infirió que en cada uno de los 3 grupos anatómicos con doble salida de ventrículo derecho ocurre un cambio de posición progresivo del segmento infundibular del tabique troncoconal, que secundariamente modifica la torsión troncal de dicho tabique. Así, cuando las grandes arterias están ligeramente cruzadas la torsión del tabique troncoconal es de 135° en vez de 180° como ocurre en el corazón normal, experimentando una detorsión (falta de rotación) de 45°, lo que explica la orientación del tabique infundibular de derecha a izquierda en sentido ventrodorsal y que la salida subaórtica sea posterior derecha en vez de posterior izquierda.
La hipótesis patogenética que explica las variantes anatómicas respecto a las posiciones de las grandes arterias y de sus vías de salida, es la que se presenta en este trabajo como rotaciones del tabique troncoconal inferiores a los 180°. Esta hipótesis explica suficientemente la existencia de un espectro de corazones patológicos postulada por Lev, que se inicia con la comunicación interventricular y cabalgamiento aórtico con o sin estenosis pulmonar, que gradualmente conduce a la doble salida de ventrículo derecho,avanza hacia el corazón con la malformación de Taussig-Bing y que finalmente lleva a la transposición completa de las grandes arterias. La posición cambiante de la aorta dextropuesta es consecuencia de las rotaciones incompletas del tabique troncoconal; en el grupo de doble salida de ventrículo derecho con aorta anterior y pulmonar posterior quedó bloqueada la transferencia del infundíbulo subpulmonar hacia el tracto de salida del ventrículo izquierdo, lo que impidió el establecimiento de la discordancia ventriculoarterial (transposición completa de las grandes arterias), que completa el espectro patológico propuesto por Lev22.
El rasgo anatómico básico que unifica a este grupo heterogéneo de cardiopatías tiene su fundamento en el corazón embrionario de los horizontes de Streeter XI al XIV, en los que el bulbus cordis (esbozo de la porción trabeculada del ventrículo derecho) se continúa cefálicamente con el cono o infundíbulo y éste a su vez con el tronco, segmentos que originan respectivamente las vías de salida y los troncos de las grandes arterias13,14 (figs. 14 y 15 A). Esta morfología persiste debido a que no ocurre el desplazamiento del troncocono de derecha a izquierda, por lo que las vías de salida y las grandes arterias nacen del ventrículo derecho (fig. 16).
Conclusiones
La doble salida de ventrículo derecho se origina por 2 mecanismos embrionarios, el primero se basa en la persistencia de la continuidad que existe entre el esbozo del ventrículo derecho (bulbus cordis) y el segmento infundíbulo-troncal que origina las vías de salida y las grandes arterias; el segundo es la detorsión progresiva del tabique troncoconal, que determina las variantes anatómicas de este grupo heterogéneo de cardiopatías congénitas.
En este trabajo se propone que la designación de la comunicación interventricular se base en la anatomía de las vías de salida, y no en la posición variable de las grandes arterias.
Financiamiento
No se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Tynan MJ, Becker AE, Macartney FJ, et al. Nomenclature and classification of congenital heart disease. Br Heart J. 1979;41:544-53. [ Links ]
2. Hagler DJ. Double-outlet right ventricle and double-outlet Left ventricle. En: Allen HD, Driscoll DJ, Shaddy RE, et al., editors. Moss and Adams' Heart Disease in Infants, Children and adolescents including the fetus and young adults, II, 7th ed. Philadelphia: Wolters Kluwer; 2008. p. 1100-27. [ Links ]
3. Becker AE, Anderson RH. Pathology of congenital heart disease. London: Butterworths; 1981. p. 297-304. [ Links ]
4. De la Cruz MV, Cayre R, Arista O, et al. The infundibular interrelationships and the ventriculoarterial connection in double outlet right ventricle. Clinical and surgical implications. Int J Cardiol. 1992;35:153-64. [ Links ]
5. Taussig HB, Bing RJ. Complete transposition of the aorta and a levoposition of the pulmonary artery; Clinical, physiological and pathological findings. Am Heart J. 1949;37:551-9. [ Links ]
6. Edwards WD. Double-outlet right ventricle and tetralogy of Fallot. J Thorac Cardiovasc Surg. 1981;82:418-22. [ Links ]
7. Van Praagh R, Pérez Trevino C, Reynolds JL, et al. Double outlet right ventricle (s, d, l) with subaortic ventricular septal defect and pulmonary stenosis. Report of six cases. Am J Cardiol. 1975;35:42-53. [ Links ]
8. Manner J, Seidl W, Steding G. Embryological observations on the morphogenesis of double outlet right ventricle with subaortic ventricular septal defect and normal arrangement of the great arteries. Thorac Cardiovasc Surg. 1995;43:307-12. [ Links ]
9. Van Praagh S, Davidoff A, Chin A, et al. Double-outlet right ventricle: anatomic types and developmental implications base on a study of 101 cases. Coeur. 1982;12:389-439. [ Links ]
10. Goor DA, Edwards JE. The spectrum of transposition of the great arteries with special referent to developmental anatomy of the conus. Circulation. 1973;48:406-15. [ Links ]
11. De la Cruz MV, Pío da Rocha J. An ontogenetic theory for the explanation of congenital malformations involving the truncus and conus. Am Heart J. 1955;51:782-805. [ Links ]
12. De Vries PA, Saunders CM. Development of the ventricles and spiral outflow tract in the human heart contribution to development of the human heart from group IX to age Group XV. Contrib Embryol. 1962;37:89-112. [ Links ]
13. Streeter GL. Developmental horizons in human embryos: description of age group XI, 13-20 somites and age group XII, 21-29 somites. Contrib Embryol. 1942;30:211-45. [ Links ]
14. Streeter GL. Developmental horizons in human embryos: description of age group XIII, embryos about 4 or 5 millimeters long and age group XIV, period of indentation of the lens vesicle. Contrib Embryol. 1945;31:27-63. [ Links ]
15. Streeter GL. Developmental horizons in human embryos: description of age group XV, XVI, XVII and XVIIIl, being the third issue of a Survey of the Carnegie Collection. Contrib Embryol. 1949;33:153-203. [ Links ]
16. Kramer TC. The partitioning of the truncus and conus and the formation membranous portion of the interventricular septum in the human heart. Am J Anat. 1942;71: 343 -52. [ Links ]
17. Zaffran S, Frasch M. Early signals in cardiac development. Circ Rest. 2002;91:457-69. [ Links ]
18. Wang DZ. Requirement of a novel gene, Xin, in cardiac morphogenesis. Development. 1999;126:1281-94. [ Links ]
19. Gesner IH, van Mierop LHS. Experimental production of cardiac defect: the spectrum of dextroposition of the aorta. Am J Cardiol. 1970;25:272-5. [ Links ]
20. Domenech Mateu JM, Reig Vilallonga J. Defectos de tabicación interventricular y doble salida de ventrículo derecho producidos experimentalmente en embrión de pollo. Análisis causal. Rev Esp Cardiol. 1980;33:147-56. [ Links ]
21. Muñoz Castellanos L, Kuri Nivon M, Chévez A. Espectro de conexión biventricular de la aorta y doble cámara de salida de ventrículo derecho producidos experimentalmente en el corazón de pollo por hipotermia (34.5° C). Arch Inst Cardiol Mex. 1982;52:91 -102. [ Links ]
22. Lev M, Bharati S, Meng L, et al. Aconcept of double-outlet right ventricle. J Thorac Cardiovasc Surg. 1972;64:271-9. [ Links ]














