Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.82 no.3 Ciudad de México jul./sep. 2012
Artículo de revisión
Estado actual de la terapia de resincronización cardiaca
Current status of cardiac resynchronization therapy
Ignacio García-Bolaoa,*, Naiara Calvoa, Juan José Gavirab, Leire Moreno-Galdósa, Hugo Arguedas-Jiméneza, Juan Pablo Canepaa y Manuel García-De-Yébenesa
a Unidad de Electrofisiología y Arritmias, Departamento de Cardiología y Cirugía Cardiaca, Clínica Universidad de Navarra, Pamplona, España.
b Unidad de Insuficiencia Cardiaca, Departamento de Cardiología y Cirugía Cardiaca, Clínica Universidad de Navarra, Pamplona, España.
* Autor para correspondencia:
Unidad de Electrofisiología y Arritmias,
Departamento de Cardiología y Cirugía Cardiaca,
Clínica Universidad de Navarra, C/ Pío XII, s/n. C.P. 31008, Pamplona, España.
Tel.: +34 948 2554000; Fax: +34 948 296500.
Correo electrónico: igarciab@unav.es (I. García-Bolao).
Recibido el 17 de enero de 2012.
Aceptado el 2 de abril de 2012.
Resumen
Se revisa el estado actual de la terapia de resincronización cardiaca en sus diferentes aspectos: mecanismos de acción, indicaciones actuales y técnica de implante.
Palabras clave: Terapia de resincronización cardiaca; Electrofisiología; Desfibrilador; Marcapasos; España.
Abstract
The present document reviews various aspects of the current status of cardiac resynchronization therapy: mechanisms of action, current indications and implantation technique.
Keywords: Cardiac resynchronization therapy; Electrophysiology; Defibrillators; Pacemakers; Spain.
Introducción
Alrededor del 30% de los pacientes con insuficiencia cardiaca avanzada sufren trastornos de la conducción eléctrica. Dichas alteraciones de conducción auriculoventriculares o intraventriculares provocan la descoordinación de los patrones normales de contractilidad de las cámaras cardiacas, que tienen efectos deletéreos sobre el rendimiento mecánico de la sístole ventricular izquierda y contribuyen a empeorar la insuficiencia cardiaca1.
La terapia de resincronización tiene como objetivo corregir los trastornos mecánicos producidos por las alteraciones eléctricas (trastornos de conducción auriculoventricular e intraventricular), mediante la estimulación eléctrica auriculobiventricular, que desde el punto de vista técnico consiste en la implantación de un dispositivo de estimulación cardiaca (marcapasos o desfibrilador), que es capaz de estimular la aurícula, el ventrículo derecho y la pared lateral del ventrículo izquierdo.
Los retrasos de conducción auriculoventricular provocan una desincronización entre la contracción auricular y ventricular, mientras que los trastornos de conducción intraventricular, fundamentalmente el bloqueo de rama izquierda, condicionan una alteración en la sincronización de la sístole de ambos ventrículos (desincronía interventricular) y en la sincronización de la sístole de las diferentes porciones del ventrículo izquierdo (desincronía intraventricular)1-3.
Fisiopatología y efectos mecánicos de la desincronía
En presencia de un retraso de la conducción auriculoventricular (bloqueo auriculoventricular de primer grado) y/o de un retraso en la conducción intraventricular (típicamente, un bloqueo de la rama izquierda del haz de His), la activación ventricular izquierda está retrasada, pero no lo está la auricular. Por este motivo, tanto el llenado pasivo temprano como la sístole auricular pueden ocurrir simultáneamente, resultando en una disminución del flujo transmitral diastólico y en una menor precarga ventricular izquierda. Con frecuencia este fenómeno se pone de manifiesto con la fusión de las ondas E (llenado ventricular pasivo), y A (contribución de la sístole auricular al llenado ventricular), en la señal Doppler del flujo de llenado mitral3.
La corrección de este fenómeno mediante la terapia de resincronización se consigue con la modificación de los intervalos auriculoventriculares, aunque la disminución de los tiempos sistólicos que se consigue mediante la preexcitación ventricular izquierda contribuye a aumentar el tiempo de llenado diastólico. Mediante ecocardiografía-Doppler, este hecho se pone de manifiesto por la separación de las ondas E y A, tras la resincronización y una prolongación del tiempo de flujo transmitral.
Cuando existe un trastorno de conducción intraventricular, típicamente un bloqueo de rama izquierda, la activación de la pared libre ventricular izquierda y su contracción están retrasadas, mientras que la activación y contracción del septo no lo están. Esa descoordinación provoca la llamada discinesia septal o movimiento paradójico septal, en el cual el septo se aleja de la pared libre durante la sístole3. Este fenómeno contribuye a empeorar el funcionamiento dinámico de la válvula mitral, y reduce la contribución de la contracción septal al volumen sistólico ventricular izquierdo. A pesar de que existen métodos ecográficos muy sofisticados para cuantificar este fenómeno, en muchos casos la apreciación de este es obvia, simplemente mediante un corte ecocardiográfico modo M en el plano paraesternal eje corto, observándose un retraso entre la máxima excursión del septo y de la pared posterior (fig. 1). Los trastornos de conducción también pueden afectar a la sincronización de la sístole de ambos ventrículos (desincronía interventricular). Mediante ecocardiografía puede apreciarse este fenómeno como la diferencia entre el retraso electromecánico del ventrículo derecho (tiempo en ms desde el inicio del QRS al inicio del flujo pulmonar), y el izquierdo (tiempo en ms desde el inicio del QRS al comienzo del flujo aórtico).
La colocación de un electrodo de estimulación en el epicardio de la pared lateral del ventrículo izquierdo a través del sistema venoso coronario, consigue la preexcitación eléctrica de esa región, que en la mayor parte de los pacientes con bloqueo de rama izquierda es la zona de activación mecánica más retrasada. De esta manera, se adelanta la contracción mecánica en esa región, minimizando los fenómenos de desincronía inter e intraventricular.
Efectos hemodinámicos agudos de la terapia de resincronización cardiaca
El beneficio hemodinámico agudo observado tras la terapia de resincronización está relacionado fundamentalmente con su capacidad para incrementar los tiempos de llenado del ventrículo izquierdo y disminuir la discinesia septo-lateral (la desincronía intraventricular), asimismo para reducir la insuficiencia mitral.
Los efectos sobre el electrocardiograma incluyen la normalización del intervalo auriculoventricular y, con frecuencia, la disminución de la duración del complejo QRS.
Desde el punto de vista electrocardiográfico, los pacientes sometidos a terapia de resincronización cardiaca pueden presentar diversos patrones. En general, tiende a observarse una desviación del eje hacia la derecha, con complejos QRS negativos en derivaciones I y aVL, morfología de bloqueo de rama derecha (fuerzas iniciales en V1 positivas), y duración del complejo QRS relativamente estrechos para tratarse de pacientes sometidos a estimulación eléctrica4 (fig. 2).
Como hemos visto, los primeros estudios clínicos sobre terapia de resincronización fueron disenñados inicialmente para desentrañnar el mecanismo de acción de esta técnica, demostraron que en este subgrupo de pacientes, la estimulación eléctrica del ventrículo izquierdo corregía la desincronía intraventricular y mejoraba los parámetros hemodinámicos agudos, incrementando la eficacia de la sístole y optimizando la función diastólica, sin aumentar la frecuencia cardiaca ni el consumo miocárdico de oxígeno.
En los pacientes con disfunción ventricular izquierda, insuficiencia cardiaca avanzada y signos de desincronía, comúnmente detectados por una prolongación en la duración del complejo QRS, se observa una serie de efectos hemodinámicos agudos beneficiosos tras la resincronización (tabla 1). Además, uno de los efectos más consistentes de la terapia de resincronización cardiaca es la disminución de la insuficiencia mitral funcional, muy frecuente en pacientes con dilatación y disfunción ventricular izquierda y trastornos de la conducción intraventricular. La disminución de la insuficiencia mitral, tanto en su componente presistólico como sistólico, asociada a la resincronización contribuye a su beneficio clínico. Es importante recalcar que estos efectos beneficiosos observados en estudios hemodinámicos agudos, se acompanñan de una disminución en la frecuencia cardiaca y en el consumo miocárdico de oxígeno, lo cual es importante desde el punto de vista pronóstico.

Efectos crónicos y beneficio clínico de la terapia de resincronización cardiaca
A medio plazo, estos efectos hemodinámicos de la resincronización se traducen en una mejora de la función y geometría ventricular izquierda compatible con un remodelado cardiaco inverso, un potente predictor pronóstico en insuficiencia cardiaca. En este sentido, diversos estudios han puesto de manifiesto que la terapia de resincronización disminuye los diámetros y volúmenes telesistólicos y telediastólicos y mejora la fracción de eyección del ventrículo izquierdo, cuando se compara con el mejor tratamiento farmacológico disponible para insuficiencia cardiaca. Este efecto es muy precoz y puede apreciarse ya desde los primeros meses del inicio del tratamiento, es mantenido e independiente del tratamiento médico. Su magnitud es similar a la obtenida con otros tratamientos para la insuficiencia cardiaca que mejoran el remodelado, como los betabloqueantes, y parece estar favorecido en parte por una restauración del metabolismo del colágeno cardiaco5-7.
Los primeros ensayos clínicos, demostraron a finales de la década de los años 90, que desde el punto de vista clínico, la terapia de resincronización ofrecía una mejoría de la capacidad funcional evaluada con diferentes parámetros (clase NYHA, consumo de oxígeno, test de caminar seis minutos), disminuía el número de hospitalizaciones y además, mejoraba la calidad de vida cuando se comparaba al tratamiento farmacológico habitual8,9.
Efecto sobre la mortalidad
Más recientemente, dos grandes ensayos multicéntricos, los estudios COMPANION y CARE-HF10,11 demostraron el efecto beneficioso de la terapia de resincronización sobre la mortalidad total a largo plazo en este subgrupo concreto de pacientes con insuficiencia cardiaca (pacientes con disfunción ventricular izquierda, insuficiencia cardiaca avanzada en grados NHYA III ó IV y signos de desincronía, comúnmente detectados por una prolongación en la duración del complejo QRS).
En concreto, el estudio aleatorizado CARE-HF10 demostró en 813 pacientes que la terapia de resincronización con marcapasos mejoraba tanto el combinado de mortalidad y hospitalización por insuficiencia cardiaca (end-point primario del estudio), como la mortalidad por cualquier causa (objetivo secundario), comparado con el brazo control de tratamiento farmacológico óptimo. De manera similar, el estudio COMPANION11 que comparaba el efecto de la resincronización en dos brazos experimentales (con desfibrilador y con marcapasos) con un brazo control de tratamiento convencional farmacológico, demostró que la resincronización disminuía la tasa de eventos del objetivo primario, que era la supervivencia libre de insuficiencia cardiaca, tanto sin desfibrilador (HR 0.81; p = 0.014) como con desfibrilador (HR 0.80; p = 0.01). El número de hospitalizaciones por insuficiencia cardiaca disminuyó significativamente entre un 34% y un 40% en ambos grupos sometidos a resincronización. Por su parte, el marcapasos redujo la mortalidad por cualquier causa (objetivo secundario del estudio) en un 24%, al borde de la significación estadística (p = 0.059), mientras que el desfibrilador la redujo en un 36% (p = 0.003).
Los hallazgos de ambos estudios promovieron que ya a mediados de los años 2000, la terapia de resincronización recibiera de las principales sociedades científicas internacionales una indicación clase I para el tratamiento de pacientes con insuficiencia cardiaca grado III-IV, disfunción ventricular izquierda (FE < 0.35) y complejos QRS anchos (> 130 mseg)12.
La terapia de resincronización en fases más precoces de la insuficiencia cardiaca
En los últimos años han aparecido varios ensayos clínicos acerca del valor de la TRC en fases más precoces de la insuficiencia cardiaca, en concreto en pacientes con grado funcionalIyNdelaNHYA13-15.
En concreto, el estudio REVERSE13 demostró que la terapia de resincronización era eficaz en promover el remodelado inverso del ventrículo incluso en pacientes en grado funcional II, y con grados de disfunción ventricular izquierda más moderados (FE < 0.40).
Quizá más significativos fueron los resultados del estudio MADIT-CRT14. Dicho estudio incluyó a 1 820 pacientes con disfunción ventricular izquierda severa con FE < 0.30 y QRS > 130 mseg, que fueron aleatorizados en una razón 3:2 a recibir bien un desfibrilador-resincronizador, bien un desfibrilador convencional. La etiología debía ser miocardiopatía de origen idiopático si los pacientes se encontraban en grado II de la NYHA o bien I o II, si era miocardiopatía de origen isquémico. El objetivo primario fue la supervivencia libre de insuficiencia cardiaca, es decir, se alcanzaba el end-point primario tanto si el paciente fallecía por cualquier causa o si presentaba eventos relacionados con la insuficiencia cardiaca. Entre los objetivos secundarios se encontraba la mortalidad por cualquier causa. Tras un seguimiento medio de 2.4 años, los pacientes del grupo de intervención (desfibrilador-resincronizador) tuvieron menos eventos primarios que los pacientes del grupo control (desfibrilador solo) (17.2% vs 25.3%, diferencia que fue estadísticamente significativa; HR 0.66; IC 95% 0.52 a 0.84; p = 0.001), con similares ventajas independientemente del origen de la miocardiopatía y del grado funcional basal. Esta superioridad se alcanzó por una importante reducción (41%) de los eventos de insuficiencia cardiaca, puesto que la mortalidad total no fue diferente entre los dos grupos. El análisis de sub-grupos confirmó (al igual que en el estudio REVERSE), que los pacientes con complejos QRS superiores a 150 mseg y los de sexo femenino eran los que más beneficio obtenían de la resincronización. Los cambios fueron acompañados de un significativo remodelado inverso del ventrículo izquierdo, en términos de una mejoría de los volúmenes telesistólico y telediastólico y de la fracción de eyección. De hecho, la mejoría clínica se restringió al subgrupo de pacientes en los que se observaba un remodelado izquierdo significativo16.
Por último, el estudio RAFT15 aleatorizó a casi 1800 pacientes durante una media de 40 meses a recibir un desfibrilador-resincronizador o un desfibrilador convencional. Los pacientes debían tener disfunción ventricular izquierda de cualquier origen (FE < 0.30), un complejo QRS intrínseco mayor de 120 mseg (o >130 mseg si era estimulado) y grado funcional del la NYHA II o III, si bien en la población finalmente incluida, alrededor del 80% de los pacientes en ambos grupos se encontraban en grado funcional II. De manera similar al MADIT-CRT, el objetivo primario del estudio fue la supervivencia libre de insuficiencia cardiaca, que se alcanzó en el 33.2% en el grupo de resincronización frente al 40.3% del grupo convencional (HR 0.75; IC 95% 0.64 a 0.87; p < 0.001). Sin embargo a diferencia del MADIT-CRT, el análisis de la mortalidad por cualquier causa demostró una reducción de la mortalidad total en el grupo tratado con resincronizador respecto al grupo control.
Selección de candidatos para terapia de resincronización cardiaca
Desde el añno 2002, las guías de práctica clínica tanto europeas como americanas aceptan la terapia de resincronización cardiaca como un tratamiento probadamente eficaz para el tratamiento de pacientes con insuficiencia cardiaca refractaria en grado funcional III o IV de la NHYA de cualquier etiología, disfunción sistólica ventricular izquierda con fracción de eyección inferior a 0.35, y signos de desincronía comúnmente detectados como una prolongación de la anchura del complejo QRS17,18 (tabla 2).
La publicación de los estudios COMPANION, CARE-HF, MADIT-CRT y REVERSE, han modificado al alza la indicación de la terapia de resincronización, que ahora es clase I (condición para la que existe un acuerdo general en la comunidad científica, de que una determinada terapia es beneficiosa o efectiva), con un nivel de evidencia A (datos obtenidos sobre la base de múltiples ensayos clínicos aleatorizados o bien sobre la base de meta-análisis) o B (evidencias obtenidas a partir de un único ensayos clínico aleatorizado o basadas en ensayos no aleatorizados), para pacientes con disfunción ventricular izquierda, clases funcionales superiores A II y complejos QRS anchos. En la tabla 3 se resumen las principales indicaciones de la terapia de resincronización según las últimas guías internacionales publicadas hasta la fecha, en concreto las de la Sociedad Europea de Cardiología19.

Por todo ello, podemos decir que a día de hoy, la terapia de resincronización se considera un estándar de tratamiento de la insuficiencia cardiaca en este subgrupo de pacientes.
Por otra parte, los efectos deletéreos a largo plazo de la estimulación crónica ventricular derecha sobre la función ventricular izquierda han sido ampliamente demostrados en estudios previos20,21. Estos hallazgos han contribuido a la búsqueda de nuevas alternativas en la técnica de estimulación cardiaca, como es la colocación de los electrodos de ventrículo derecho en zonas diferentes al ápex, como es el septo, tracto de salida o en la zona de His. Sin embargo, los resultados son contradictorios y hasta la fecha no existen datos concluyentes para recomendar de rutina, sitios de estimulación cardiaca diferentes del abordaje convencional en el ápex del ventrículo derecho22.
Asimismo, existen estudios recientes23,24 que han analizado el papel de la terapia de resincronización cardiaca en pacientes con función ventricular izquierda conservada e indicación de estimulación cardiaca permanente, pero la ausencia de un beneficio claro en este grupo de pacientes hace que la terapia de resincronización cardiaca no se recomiende como una primera opción.
El procedimiento del implante de dispositivos de resincronización
El implante de dispositivos de resincronización cardiaca difiere sensiblemente de dispositivos convencionales de estimulación cardiaca y desfibrilación, tanto por la complejidad del procedimiento como por la necesidad de recursos materiales específicos. Sin embargo, a lo largo de la última década las técnicas de implante percutáneo del electrodo ventricular izquierdo han evolucionado profundamente, simplificándose en gran medida. Aunque continúa siendo un procedimiento exigente, que consume tiempo y recursos y está sujeto a potenciales complicaciones, el abordaje endocavitario proporciona un porcentaje de éxito del implante cercano al 95% cuando se ha superado la curva de aprendizaje25-27.
Hoy en día, el abordaje de elección es el endocavitario. El implante se realiza mediante la colocación percutánea de la sonda ventricular izquierda a través del sistema venoso coronario. La vía epicárdica, mediante minitoracotomía o toracoscopía se reserva casi exclusivamente para casos en los que el abordaje endocavitario fracasa, o bien cuando el paciente ha de someterse a un procedimiento quirúrgico concomitante.
Los implantes se llevan a cabo bajo anestesia local y ligera sedación consciente. El primer paso para la colocación del electrodo ventricular izquierdo es la canulación del seno coronario con un catéter guía, cuya función del catéter guía es la de cateterizar el seno coronario y proporcionar la vía de entrada para introducir el resto del material (electrodo, guías, entre otros). Existen diversos sistemas en el mercado, y cada uno de ellos dispone de diferentes curvas que pueden adaptarse a la anatomía específica de cada paciente28. Las maniobras típicas para conseguir el acceso a seno coronario parten de la clásica secuencia cross-torque-back-forth: cross (atravesar la válvula tricúspide), torque (aplicar rotación antihoraria), y back (retirar lentamente hasta aurícula, manteniendo la rotación antihoraria). Con estas tres primeras maniobras, se redirige la punta del catéter guía hacia una dirección posterior e inferior. En este punto, puede resultar útil localizar el ostium inyectando una pequeña cantidad de contraste radioopaco (5-10 cc), a través del catéter guía cuando éste se mantiene en la posición anteriormente citada y con rotación antihoraria.
Una vez que confirmamos la localización del ostium del seno coronario, y dado que los catéteres guía adolecen de cierta flexibilidad, es preferible avanzar el catéter guía cualquier elemento atraumático (guíade0.035'', electrocatéter de electrofisiología, etcétera), hasta el tercio medio del seno coronario. Esto constituiría la cuarta de las maniobras: forth (avanzar el catéter guía hacia el interior del seno coronario).
Para facilitar el acceso al seno coronario, hoy en día se dispone múltiples configuraciones de catéteres guía en cuanto a curvas y longitudes, que facilitan la canulación y el acceso estable al cuerpo del seno coronario. Las curvas más útiles son las tipo multipropósito, o bien las más amplias tipo extended-hook.
Una vez canulado el seno coronario, la angiografía nos permite conocer la anatomía venosa de cada paciente, dadas las grandes diferencias interindividuales que existen. La angiografía suele realizarse a través de un catéter tipo Berman con balón oclusor, hasta conseguir una aceptable opacificación de las ramas venosas (fig. 3).
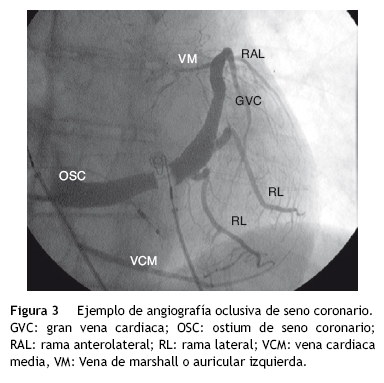
Con la experiencia del implantador, la realización de la clásica venografía oclusiva retrógrada puede sustituirse por una venografía directa selectiva con catéter selector, que ahorra tiempo (no hay que introducir catéter balón y prepara el sistema para el siguiente paso del procedimiento, el implante de la sonda) y es muy segura (en nuestra experiencia no hemos tenido complicaciones relacionadas con esta parte del procedimiento). En nuestro centro se realiza de primera elección, y solamente cuando la visualización es muy pobre (aproximadamente el 20% de los casos), se reconvierte a angiografía oclusiva convencional con catéter balón.
La anatomía venosa coronaria presenta una amplia variabilidad interindividual. Como ya se ha comentado previamente, el seno coronario desemboca en la porción posteroinferior de la aurícula derecha. Su trayecto discurre ''rodeando'' la válvula mitral, desde su aspecto más posterior, siguiendo la zona lateral y acabando en la zona anterior, siguiendo la habitual nomenclatura anatómica de vías accesorias. En proyección oblicua anterior izquierda, el trayecto del seno coronario tendría una apariencia circular (rodeando el anillo mitral), con las posiciones posteriores hacia las seis, laterales hacia las tres y anteriores hacia las 12, marcadas en un hipotético reloj.
A lo largo de todo su recorrido, el seno coronario recibe ramas venosas en un número variable (fig. 3). Desde la posiciones más posteriores a las más anteriores, nos encontraríamos con la desembocadura de las siguientes ramas venosas: 1) vena cardiaca media: la más posterior, que desemboca cerca del ostium del seno coronario y discurre por el septo interventricular posterior; 2) ramas posteriores; 3) ramas posterolaterales o laterales (también denominadas marginales), en número variable y que en ocasiones son paralelas a las arterias marginales; 4) ramas anterolaterales, recogen el drenaje venoso de la zona anterolateral, en ocasiones asociadas a las arterias diagonales; y 5) gran vena cardiaca. En realidad es la última porción (más anterior) del seno coronario, que discurre por el septo interventricular anterior, en vecindad con la arteria descendente anterior (fig. 3).
La zona en la que se ha demostrado mayor beneficio hemodinámico en estudios agudos es la región lateral (situada entre las dos y las cuatro en el anillo mitral en proyección oblicua anterior izquierda), por lo que se considera la región de interés en resincronización (fig. 4)29.

Una vez que se identifica la zona a estimular, se procede a implantar la sonda-electrodo ventricular izquierda. Los electrodos más versátiles y útiles son aquellos que se dirigen mediante guías coaxiales de 0.014'' (tecnología over-the-wire).
El avance de los electrodos over-the-wire a través del catéter guía y de la rama venosa, se facilita mediante las clásicas maniobras pull and back: tras avanzar la guía de 0.014'' hasta la porción más distal posible de la rama venosa, se avanza sobre ella el electrodo realizando simultáneamente una ligera tracción de la guía en sentido inverso o incluso retirándola de manera franca. El avance del electrodo (pull) sobre la guía que simultáneamente se retira (back), facilita considerablemente el movimiento de avance del electrodo. Cuando el electrodo ha avanzado, se vuelve a introducir la guía de 0.014'' a continuación, para volver a realizar la citada maniobra. El empleo de guías que proporcionan diferente grado de soporte, permite adaptarnos a diferentes anatomías y situaciones peculiares.
Incluso algunos fabricantes poseen catéteres guía que permiten acceder directamente a la rama objetivo (cateterización selectiva de la rama con el catéter guía), lo que evidentemente proporciona un grado máximo de apoyo para introducir el electrodo, que en algunos casos puede resultar muy útil30-32.
Nuevamente conviene recordar que la proyección radiológica oblicua anterior izquierda, proporciona la mejor información acerca de la posición anterior o lateral del electrodo, mientras que la oblicua anterior derecha es muy útil para comprobar su localización basal o apical. Durante el procedimiento del implante, se suele trabajar en posición anteroposterior por la mayor comodidad que ofrece al implantador, pero cuando el electrodo se encuentra en su posición final debe comprobarse la localización definitiva realizando proyecciones oblicuas.
Tras la obtención de una localización adecuada se procede a la retirada del catéter guía. Ésta es una maniobra delicada debido a la sutileza de los sistemas de fijación que necesariamente han de emplearse en el interior del sistema venoso coronario, por lo que debe realizarse muy cuidadosamente y suele requerir la participación de dos operarios. El éxito de esta maniobra radica en mantener fija (no empujar hacia dentro) la mano que sostiene la cuchilla (es decir, la mano que sostiene el electrodo).
En experiencia de los autores es muy recomendable que los operadores que deseen iniciarse en esta técnica, reciban entrenamiento específico para ayudar a superar la curva de aprendizaje con rapidez y seguridad.
Conclusiones
La terapia de resincronización debe considerarse un tratamiento estándar para pacientes con insuficiencia cardiaca, disfunción ventricular izquierda y signos de desincronía, comúnmente detectados por una prolongación del complejo QRS. La técnica de implante es asumible por los muchos equipos de electrofisiología y estimulación cardiaca, tras un correcto entrenamiento.
Financiamiento
No se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Referencias
1. Abraham WT. Cardiac resynchronization therapy. Prog Cardiovasc Dis 2006;48:232-8. [ Links ]
2. Biriani G, Biffi M, Martignani C, et al. Cardiac resynchronization by pacing: an electrical treatment of heart failure. Int J Cardiol 2004;94:151-61. [ Links ]
3. Leclercq C, Kass DA. Retiming the failing heart: principles and current clinical status of cardiac resynchronization. J Am Coll Cardiol 2002;39:194-201. [ Links ]
4. Bax JJ, Abraham T, Barold SS, et al. Cardiac resynchronization therapy. Issues before device implantation. J Am Coll Cardiol 2005;46:2135-67. [ Links ]
5. Duncan A, Wait D, Gibson D, et al. MUSTIC (Multisite Stimulationin Cardiomyopathies) Trial. Left ventricular remodelling and haemodynamic effects of multisite biventricular pacing in patients with left ventricular systolic dysfunction and activation disturbances in sinus rhythm: sub-study of the MUSTIC (Multisite Stimulationin Cardiomyopathies) trial. Eur Heart J 2003;24:430-41. [ Links ]
6. García-Bolao I, López B, Macías A, et al. Impact of collagen type I turnover on the long-term response to cardiac resynchronization therapy. Eur Heart J 2008;29:898-906. [ Links ]
7. García-Bolao I, Macías A, López B, et al. A biomarker of myocardial fibrosis predicts long-term response to cardiac resynchronization therapy. J Am Coll Cardiol 2006;47:2335 -7. [ Links ]
8. Cazeau S, Leclercq C, Lavergne T, et al. Effects of multisite biventricular pacing in patients with heart failure and intraventricular conduction delay. N Engl J Med 2001;344:873-80. [ Links ]
9. Abraham WT, Fisher WG, Smith AL, et al. Cardiac resynchronization in chronic heart failure. N Engl J Med 2002;346:1845-53. [ Links ]
10. Cleland JG, Daubert JC, Erdmann E, et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005;52:1539-49. [ Links ]
11. Bristow MR, Saxon LA, Boehmer J, et al. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004;350:2140-50. [ Links ]
12. Zipes DP, Camm AJ, Borggrefe M, et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death-executive summary: A report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (writing committee to develop guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death) Developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Eur Heart J 2006;27:2099-140. [ Links ]
13. Linde C, Abraham WT, Gold MR, et al. Randomized trial of cardiac resynchronization in mildly symptomatic heart failure patients and in asymptomatic patients with left ventricular dysfunction and previous heart failure symptoms. J Am Coll Cardiol 2008;52:1834-43. [ Links ]
14. Moss AJ, Hall WJ, Cannom DS, et al. Cardiac-resynchronization therapy for the prevention of heart-failure events. N Engl J Med 2009;361:1329-38. [ Links ]
15. Tang AS, Wells GA, Talajic M, et al. Resynchronization-Defibrillation for Ambulatory Heart Failure Trial Investigators Cardiac-resynchronization therapy for mild-to-moderate heart failure. N Engl J Med 2010;363:2385-95. [ Links ]
16. Solomon SD, Foster E, Bourgoun M, et al. Effect of cardiac resynchronization therapy on reverse remodeling and relation to outcome: multicenter automatic defibrillator implantation trial: cardiac resynchronization therapy. Circulation 2010;122:985-92. [ Links ]
17. Strickberger SA, Conti J, Daoud EG, et al. Patient selection for cardiac resynchronization therapy. Circulation 2005;111:2146-50. [ Links ]
18. Bank AJ, Kelly AS, Burns KV, et al. Cardiac resynchronization therapy: role of patient selection. Curr Cardiol Rep 2006;5:336-42. [ Links ]
19. Dickstein K, Vardas PE, Auricchio A, et al. Focused Update of ESC Guidelines on device therapy in heart failure: an update of the 2008 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure and the 2007 ESC guidelines for cardiac and resynchronization therapy. Developed with the special contribution of the Heart Failure Association and the European Heart Rhythm Association. Eur Heart J 2010;31:2677-87. [ Links ]
20. Nahlawi M, Waligora M, Spies SM, et al. Left ventricular function during and after right ventricular pacing. J Am Coll Cardiol 2004;44:1883-8. [ Links ]
21. Zhang XH, Chen H, Siu CW, et al. New-onset heart failure after permanent right ventricular apical pacing in patients with acquired high-grade atrioventricular block and normal left ventricular function. J Cardiovasc Electrophysiol 2008;19:136-41. [ Links ]
22. Albouaini K, Alkarmi A, Mudawi T, et al. Selective site right ventricular pacing. Heart 2009;95:2030-9. [ Links ]
23. Stockburger M, Gómez-Doblas JJ, Lamas G, et al. Preventing ventricular dysfunction in pacemaker patients without advanced heart failure: results from a multicentre international randomized trial (PREVENT-HF). Eur J Heart Fail 2011;13:633-41. [ Links ]
24. Chan JY, Fang F, Zhang Q, et al. Biventricular pacing is superior to right ventricular pacing in bradycardia patients with preserved systolic function: 2-year results of the PACE trial. Eur Heart J 2011;32:2533-40. [ Links ]
25. Gras D, Böcker D, Lunati M, et al. Implantation of cardiac resynchronization therapy systems in the CARE-HF trial: procedural success rate and safety. Europace 2007;9: 516-22. [ Links ]
26. Macías A, García-Bolao I, Díaz-Infante E, et al. Cardiac resynchronization therapy: predictive factors of unsuccessful left ventricular lead implant. Eur Heart J 2007;28:450-6. [ Links ]
27. Díaz-Infante E, Hernández-Madrid A, Brugada-Terradellas J, et al. Consenso sobre la terapia de resincronización cardiaca. Rev Esp Cardiol 2005;suppl 5:3B-11B. [ Links ]
28. Alonso C, Leclercq C, d'Allonnes FR, et al. Six year experience of transvenous left ventricular lead implantation for permanent biventricular pacing in patients with advanced heart failure: technical aspects. Heart 2001;86:405 -10. [ Links ]
29. Macías A, Gavira JJ, Castaño S, et al. Left ventricular pacing site in cardiac resynchronization therapy: clinical follow-up and predictors of failed lateral implant. Eur J Heart Fail 2008;10:421 -7. [ Links ]
30. Daoud EG, Kalbfleisch SJ, Hummel JD, et al. Implantation techniques and chronic lead parameters of biventricular pacing dual-chamber defibrillators. J Cardiovasc Electrophysiol 2002;13:964-70. [ Links ]
31. Meade TH, Lopez JA. Balloon occlusion technique to cannulate angulated and tortuous coronary sinus branches in cardiac resynchronization therapy. Pacing Clin Electrophysiol 2005;28:1243-4. [ Links ]
32. Zanon F, Baracca E, Pastore G, et al. Implantation of left ventricular leads using a telescopic catheter system. Pacing Clin Electrophysiol 2006;29:1266-72. [ Links ]














