Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.82 no.1 Ciudad de México ene./mar. 2012
Artículos de revisión
Tratamiento de tromboembolia pulmonar aguda
Management of acute pulmonary thromboembolism
Tomás Pulido,1 Luis Felipe Reyes-Fuentes,1 Miguel Beltrán-Gámez,2 Armando Rodríguez,1 Carolina Rosado,1 Karina del Valle-Zamora,1 Paulina Ramírez-Neria,1 Paola de la-Garza,1 Jorge Téllez,1 Julio Sandoval.1
1 Departamento de Cardioneumología, Instituto Nacional de Cardiología Ignacio Chávez. México D.F. , México.
2 ISSSTECALI (MBG), Tijuana, Baja California.
Correspondencia:
Dr. Tomás Pulido Zamudio.
Departamento de Cardioneumología.
Instituto Nacional de Cardiología Ignacio Chávez.
Juan Badiano No. 1 - 4° Piso, Colonia Sección XVI.
México D. F. 14080, México.
Tel. 55 5573 2911, ext. 1355.
Correo electrónico: pultom@cardiologia.org.mx
Recibido el 4 de agosto de 2010;
Aceptado el 1 de noviembre de 2011.
Resumen
La tromboembolia pulmonar (TEP) es considerada como una urgencia cardiovascular, representa una de las principales causas de morbilidad y mortalidad en pacientes hospitalizados. El diagnóstico debe realizarse lo más tempranamente posible, y su tratamiento instaurarse de manera inmediata. El manejo de la embolia pulmonar aguda, incluye medidas de soporte, apoyo hemodinámico, utilización de anticoagulantes y en el caso del paciente inestable, trombólisis o embolectomía. En el presente artículo, se revisan las generalidades en el tratamiento de los pacientes con TEP.
Palabras clave: Tromboembolia pulmonar; Revisión; Tratamiento intervencionista; Tratamiento médico; México.
Abstract
Acute pulmonary embolism (APE) is considered a cardiovascular emergency and is one of the most important causes of morbidity and mortality in hospitalized patients. Pulmonary embolism diagnosis has to be made early in the course of the disease and its management installed immediately. Pulmonary embolism management includes hemodynamic support, anticoagulation, thrombolysis and embolectomy. We present an overview of the treatment of APE.
Key words: Pulmonary embolism; Review; Interventional therapy; medical treatment; Mexico.
Introducción
La tromboembolia pulmonar (TEP) esta considerada como una urgencia cardiovascular, y constituye una de las principales causas de morbi-mortalidad, en pacientes hospitalizados.1,2 En Estados Unidos la incidencia se ha calculado en 600 000 casos por año, con una mortalidad entre 50 000 y 100 000 casos.3 Se han publicado dos registros recientemente, que nos han dado más información al respecto. En el registro MAPPET, la mortalidad fue de 31%4 y en el registro de cooperación internacional de embolia pulmonar (ICOPER, por sus siglas en Inglés),5 la mortalidad a tres años fue de 17%. México participó en este registro con 189 pacientes y en un seguimiento a tres meses, la mortalidad fue de 23%.2 Nuestro grupo evaluó de forma retrospectiva, las autopsias realizadas en nuestra institución en un período de diez años, encontrando que la TEP masiva fue la tercera causa de muerte.6 Muchas de estas muertes ocurren en las primeras horas del evento embólico, por lo que el tratamiento debe de instalarse de manera rápida y adecuada. El tratamiento inicial dependerá de la magnitud de la embolia, es decir, si el paciente se encuentra hemodinámicamente estable o si existe inestabilidad hemodinámica y/o disfunción ventricular derecha (TEP masiva). Así, en una embolia pulmonar no complicada con el paciente estable se deberán de dar medidas de soporte y manejo con anticoagulantes, mientras que en el paciente inestable hemodinámicamente, el tratamiento deberá realizarse con trombólisis o embolectomía.
Soporte respiratorio
En los casos en que exista hipoxemia, aunque no se haya confirmado la TEP, ésta se deberá corregir con oxígeno suplementario. Si además de hipoxemia existen datos de insufciencia respiratoria, se debe considerar la intubación orotraqueal y el inicio de asistencia mecánica ventilatoria. Es importante tomar en cuenta, los cambios hemodinámicos que acompañan al inicio de la ventilación mecánica, como es la disminución del retorno venoso.7
Soporte hemodinámico
El manejo hemodinámico deberá instituirse de forma rápida en aquellos pacientes, que se presentan con hipotensión (definida como una presión sistólica ≤ 90 mmHg, o con un descenso ≥ 40 mmHg con respecto a la TA basal). En pacientes con falla ventricular derecha (FVD), la hipotensión persistente produce una disminución del gradiente de perfusión coronaria lo que provoca un desequilibrio entre el aporte y la demanda de oxígeno, provocando la aparición de isquemia. Se deberá iniciar con la administración intravenosa de cristaloides (solución salina isotónica), con el objeto de mejorar el retorno venoso y por ende el gasto cardiaco.7,8 Sin embargo, su administración debe de realizarse con cuidado, sobretodo en pacientes que tienen falla ventricular derecha severa con un ventrículo derecho muy dilatado, ya que se corre el riesgo de producir una sobrecarga de volumen y con esto agravar la dilatación.9,10 Además, la administración de líquidos intravenosos, puede también aumentar la tensión de la pared del VD, disminuyendo la relación entre el aporte y el consumo de oxígeno, empeorando la isquemia.9,10 Si a pesar de la administración inicial de líquidos parenterales, el paciente sigue hipotenso, se deberá iniciar apoyo con medicamentos vasopresores e inotrópicos.
Aunque se pueden utilizar la norepinefrina, la dopamina y la epinefrina. En nuestra experiencia, preferimos la utilización de norepinefrina, ya que ésta es la que menos produce taquicardia. Aunque no hay estudios específicos en TEP, se ha demostrado que la norepinefirina mejora la función del VD por su efecto inotrópico, además de mejorar la perfusión coronaria del mismo, al aumentar la presión arterial sistémica.7,11 La indicación para el uso de este medicamento, es la hipotensión refractaria a la administración inicial de volumen. La utilización de inotrópicos se limita a la presencia de un índice cardiaco disminuido. En este caso, el medicamento de elección es la dobutamina.12 En un estudio pequeño de pacientes con TEP, admitidos a la terapia intensiva, la administración de dobutamina incrementó el gasto cardiaco, mejoró el transporte de oxígeno y la oxigenación tisular, manteniendo una PaO2 constante.13 Uno de los efectos secundarios de la dobutamina es la vasodilatación, por lo cual su administración puede asociarse a hipotensión y taquicardia. Sin embargo, en un estudio de diez pacientes con TEP, la dobutamina incrementó el gasto cardiaco en 35% con respecto al basal, sin modificaciones en frecuencia cardiaca o presión arterial.12 Los efectos deletéreos de la dobutamina, pueden minimizarse combinándola con no-repinefrina.
Anticoagulantes
Los anticoagulantes siguen siendo la piedra angular en el tratamiento de la TEP aguda, desde que se publicara el trabajo clásico de Barrit y Jordan, a principios de los años sesenta, en donde se demostró la disminución de la mortalidad, en pacientes tratados con heparina no fraccionada (HNF) comparados con pacientes sin tratamiento.14 Los objetivos del manejo con anticoagulantes, son prevenir la muerte y los eventos recurrentes con un riesgo aceptable de complicaciones hemorrágicas.15 Los medicamentos que con mayor frecuencia se utilizan son los inhibidores directos de la trombina (HNF, heparina de bajo peso molecular HBPM y fondaparinux) y los antagonistas de la vitamina K (anticoagulantes orales). El tratamiento con anticoagulantes parenterales debe iniciarse de manera inmediata, cuando exista la sospecha deTEP aguda, si es que no existen contraindicaciones para su utilización.
Tanto la HNF como la HBPM, reducen fenómenos de retrombosis, al inhibir la trombina circulante, pero no actúan sobre la trombina ligada al trombo. Impiden la agregación plaquetaria y de la fibrina ligada al trombo, con lo que evitan su crecimiento y permiten que la fibrinolisis endógena actúe in vivo.16,17 Si se utiliza HNF, la dosis inicial será de 80 mg/kg de peso en bolo, seguidos de una infusión de 18 mg/kg/h, para mantener un tiempo parcial de tromboplastina activado (TPTa) entre 1.5 y 2.5 veces el control, de acuerdo a las Guías sobre el Diagnóstico y Tratamiento de la Tromboembolia Pulmonar Aguda de la Sociedad Europea de Cardiología.15 El TPTa debe medirse antes de iniciar la heparina, de cuatro a seis horas posterior al inicio y tres horas después, de cada ajuste de dosis.15 Se sugiere no incrementar la infusión por arriba de 1 667 unidades por hora, considerando que esto equivaldría a niveles de heparina, de al menos 0.35 IU/mL, aunque el TPTa no se encuentre en rango terapéutico.15
Las HBPM se une a la antitrombina III, con lo que cataliza la inactivación del factor Xa de la coagulación. Por esta razón, tienen relativamente más actividad anti-Xa, que anti-trombina y por ello, menos efecto en el TPTa. Las HBPM deben de administrarse cuidadosamente, en pacientes con nefropatía y depuración calculada de creatinina menor de 30 mL/min, su dosis debe ser ajustada de acuerdo a los niveles de anti-Xa. La dosis de enoxaparina es de 1 mg/kg de peso, cada doce horas por vía subcutánea, o 1.5 mg/kg de peso cada 24 horas. La dosis de tinzaparina es de 175 U/kg cada 24 hrs.18 Diversos estudios han comparado la seguridad y efectividad de la HNF con la HBPM,19-22 y al menos, un meta-análisis demostró que ambas son igual de efectivas y seguras.23 Debido al riesgo de trombocitopenia inducida por heparina (mucho más frecuente con HNF, aunque puede presentarse también con HBPM), se recomienda monitorizar la cuenta plaquetaria frecuentemente.15
El fondaparinux es un inhibidor selectivo del factor Xa, que se administra por vía subcutánea, las dosis aprobadas para TEP aguda son 5 mg cada 24 hrs (en pacientes menores de 50 kg), 7.5 mg cada 24 horas (en pacientes entre 50 y 100 Kg), y 10 mg cada 24 horas (en pacientes mayores de 100 kg).15 Un estudio abierto controlado, que comparó fondaparinux con HBPM, no encontró diferencia entre tasa de recurrencia de evento embólico o sangrado.24 No se ha reportado trombocitopenia con este medicamento, por lo que no es necesario monitorizar el nivel de plaquetas. El fondaparinux se encuentra contraindicado en pacientes con insufciencia renal severa.15
El tratamiento con anticoagulantes parenterales o subcutáneos, debe ser seguido por la administración de antagonistas de vitamina K. Éstos producen su efecto, al interferir con la interconversión cíclica de la vitamina K con su epóxido, lo cual limita la carboxilación de los factores de coagulación dependientes de ésta (II, VII, IX, X) y de las proteínas C y S.25 Por lo anterior, los anticoagulantes orales pueden tener un efecto protrombótico y nunca deben utilizarse como terapia inicial. En nuestro medio, los anticoagulantes orales más utilizados son la warfarina y el acenocumarol. El monitoreo se hace con el tiempo de protrombina (TP), el cual debe reportarse ajustado al índice normalizado internacional (INR, por sus siglas en inglés). Los antagonistas de la vitamina K, deben iniciarse los más pronto posible, de preferencia al mismo tiempo que los anticoagulantes parenterales. Éstos últimos deberán suspenderse, cuando se haya alcanzado un INR entre 2.0 y 3.0, por dos días consecutivos. El tratamiento con antagonistas de vitamina K en TEP aguda, deberá mantenerse por lo menos de tres a seis meses y deberá individualizarse, de acuerdo a los factores de riesgo que tenga el paciente (ver más adelante).15,25
Trombólisis
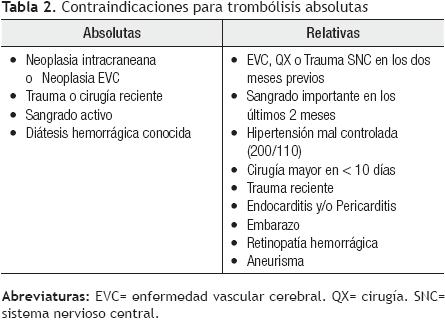
La terapia fibrinolítica tiene como objetivo acelerar la lisis del trombo, en pacientes con TEP aguda, siendo una terapia efectiva en pacientes seleccionados. Diversos estudios controlados, han mostrado una mejoría en parámetros hemodinámicos y en la función ventricular derecha,26-32 aunque sólo un estudio ha demostrado su superioridad al evaluar la supervivencia, en pacientes con TEP masiva e inestabilidad hemodinámica tratados con trombólisis, al compararse con pacientes tratados con anticoagulación convencional.33 Los fibrinolíticos aprobados para tratamiento de la TEP masiva, son la estreptoquinasa, uroquinasa (que no se encuentra disponible en nuestro país) y alteplasa, las dosis aprobadas se muestran en la Tabla 1. El tenecteplase es un fibrinolítico de reciente aprobación, para síndromes coronarios agudos y enfermedad vascular cerebral isquémica, que poco a poco ha ganado aceptación en el manejo de TEP aguda masiva, con un perfil de seguridad muy similar a los trombolíticos ya existentes.34,35 Actualmente, se está llevando a cabo un estudio multicéntrico internacional, para evaluar la eficacia y seguridad del tenecteplase en pacientes con TEP aguda. La indicación para la utilización de la terapia fibrinolítica, es el paciente con alto riesgo para TEP, que se presenta con choque cardiogénico y/o hipotensión arterial persistente.15 Aunque no se recomienda la utilización de trombolíticos en pacientes con estabilidad hemodinámica, se puede considerar su uso, si el paciente tiene evidencia de disfunción ventricular derecha y no existe riesgo de hemorragia.15 En ausencia de inestabilidad hemodinámica o disfunción ventricular derecha, la terapia trombolítica no está indicada. Las complicaciones hemorrágicas mayores se presentan en 13% de los casos y la hemorragia intracraneal en 1.9%15, y hay mayor riesgo de presentarlas cuando existen comorbilidades. Las contraindicaciones absolutas y relativas se presentan en el la Tabla 2.

Embolectomía
La embolectomía se refiere a la fragmentación o extracción mecánica del trombo, y puede ser percutánea o quirúrgica. Este método está indicado, en aquellos pacientes con TEP e inestabilidad hemodinámica, en los que existe contraindicación para la utilización de fibrinolíticos, o cuando la trombólisis no ha sido exitosa.
La embolectomía percutánea consiste en la introducción de un catéter, a través de un acceso venoso hasta alcanzar la arteria pulmonar, con el fin de fragmentar o aspirar el trombo. Los fundamentos para la realización de este procedimiento son los siguientes: 1. El alivio de la poscarga es la intervención más importante en el manejo de la disfunción ventricular derecha causada por TEP masiva; 2. la obstrucción central produce un mayor incremento de la impedancia, al vaciamiento del ventrículo derecho y 3. la eliminación de la obstrucción central (aspiración) o su desplazamiento hacia la periferia (fragmentación), disminuye considerablemente la impedancia del VD.7
Aunque la embolectomía no quirúrgica fue planteada desde hace algún tiempo por el D r. Greenfield, en los últimos años ha tomado auge gracias al desarrollo de catéteres y equipos diseñados, especialmente para esta indicación.36,37 La fragmentación del trombo con catéteres para angioplastía o ''cola de cochino'', se han empleado con éxito en series pequeñas, por otro lado dentro de los dispositivos específicos para DVD se encuentran el Angiojet Xpeedior® (Possis), y el Aspirex® (Straub Medical).38,39 La fragmentación consiste en llevar un catéter ''cola de cochino'', hasta la arteria pulmonar que se encuentra obstruida, para posteriormente realizar movimientos de introducción y extracción, con el fin de fragmentar el trombo central y producir microembolias distales.39 La aspiración del trombo se lleva a cabo con un dispositivo especial (por ejemplo, catéter Aspirex®). Recientemente, Eid-Lidt y colaboradores40 publicaron su experiencia en 18 pacientes con TEP masiva e inestabilidad hemodinámica, que fueron tratados con fragmentación y aspiración, teniendo un porcentaje de éxito de 89%, definida como mejoría en la saturación de oxígeno y presión arterial sistémica. Dentro de las complicaciones de la embolectomía percutánea, se han reportado la perforación o disección de estructuras cardiovasculares, el taponamiento cardiaco, hemorragia pulmonar, arritmias cardiacas, pérdida sanguínea.7
La embolectomía quirúrgica consiste en la extracción directa del trombo, a través de una esternotomía media, con el apoyo de circulación extracorpórea. Además de la inestabilidad hemodinámica y contraindicación para fibrinolisis farmacológica, otras indicaciones para la embolectomía quirúrgica son la presencia de trombo en cavidades derechas o atrapado en un foramen oval.41 Leacche y colaboradores publicaron los resultados de 47 pacientes sometidos a embolectomía quirúrgica,42 donde tres pacientes murieron en el transoperatorio, siendo la supervivencia a un año de 86%. Las indicaciones para embolectomía quirúrgica fueron: contraindicación para terapia fibrinolítica en 45% de los pacientes, falla del tratamiento médico en 10% y disfunción ventricular derecha en 32%.42 Este método implica el contar con un equipo quirúrgico multidisciplinario, disponible las 24 horas del día. La elección de embolectomía percutánea o quirúrgica dependerá de los recursos y experiencia, con que cuente el centro.
Interrupción de vena cava inferior
Los filtros de vena cava inferior proveen una protección, al interrumpir el paso de trombos provenientes del sistema venoso profundo de miembros inferiores, hacia la circulación pulmonar. Las indicaciones para este procedimiento son: falla en el tratamiento anticoagulante para prevenir la recurrencia, contraindicación para el uso de anticoagulantes o complicaciones por su uso.7,15 Otra indicación sería posterior a la realización de embolectomía, ya que la situación de gravedad en la que se encuentran los pacientes, hace que una nueva embolia por pequeña que sea, ponga en riesgo la vida.7 Existen los filtros de vena cava inferior temporales, que pueden utilizarse en pacientes de riesgo alto o intermedio, que serán sometidos a algún procedimiento quirúrgico. En estudios recientes, no se ha encontrado diferencia en cuanto al beneficio de utilizar filtros temporales o permanentes.43
Nuevos anticoagulantes
Recientemente se han desarrollado nuevos fármacos para la profilaxis o tratamiento de la enfermedad tromboembólica venosa, que actúan sobre el factor Xa (idraparinux, rivaroxaban o apixaban) o la trombina (dabigatran).44
El idraparinux tiene una estructura similar al fondaparinux pero con una vida media más prolongada, por lo que la administración es semanal. En estudios clínicos, demostró la misma efectividad para prevenir enfermedad tromboembólica venosa en pacientes con fibrilación auricular, y recurrencia en pacientes con trombosis venosa profunda, sin embargo se encontró mayor riesgo de sangrado por lo que su desarrollo se ha detenido. Actualmente, se está desarrollando un protocolo clínico fase III de su versión biotinilada (idrabiotaparinux).45,46 El rivaroxaban es un potente inhibidor del factor Xa, que se administra de forma oral y que ha sido aprobado en la Unión Europea y México, para proflaxis de enfermedad tromboembólica venosa en pacientes sometidos a cirugía de rodilla o cadera. Actualmente, se están llevando a cabo estudios clínicos fase III para tratamiento de trombosis venosa profunda.44 El dabigatran es un inhibidor directo de la trombina de administración oral, aprobado también por la Unión Europea, Canadá y México, entre otros países, con las mismas indicaciones que el rivaroxaban y que actualmente se está estudiando para su uso en el tratamiento de trombosis venosa profunda y tromboembolia pulmonar.44 Debido a que la mayoría de estos fármacos, tienen una dosis fija y no hay necesidad de monitorizar su efecto con exámenes de sangre, pueden ser más convenientes que la warfarina. No obstante, su utilización más allá de la proflaxis de enfermedad tromboembólica venosa, es decir, en el tratamiento de la enfermedad de manera aguda, aún está por definirse.44
Recomendaciones para el tratamiento de la TEP aguda
Recientemente, la Sociedad Europea de Cardiología ha publicado sus recomendaciones para el diagnóstico y tratamiento de la TEP aguda15, éstas se pueden resumir de la siguiente forma:
En pacientes con embolia pulmonar de alto riesgo:
• Iniciar anticoagulación con HNF a la brevedad posible.
• Si existe hipotensión, ésta debe ser corregida para prevenir la progresión de falla cardiaca derecha.
• Se recomienda el uso de medicamentos vasopresores, en pacientes con hipotensión.
• Se puede utilizar dobutamina o dopamina en pacientes con TEP, bajo gasto cardiaco y normotensión.
• No se recomienda el manejo agresivo con soluciones parenterales.
• Se debe administrar oxígeno en pacientes con baja saturación.
• En pacientes con TEP de alto riesgo y con choque cardiogénico o hipotensión persistente, se recomienda el uso de fibrinolíticos.
• La embolectomía quirúrgica se deberá utilizar en pacientes con alto riesgo de TEP y en donde la fibrinolisis está absolutamente contraindicada.
• La embolectomía percutánea se recomienda en pacientes con alto riesgo de TEP, como alternativa a la embolectomía quirúrgica, cuando la fibrinolisis está absolutamente contraindicada.
En pacientes con TEP sin riesgo elevado:15
• Se deberá iniciar anticoagulación de manera inmediata, incluso mientras se lleva a cabo el proceso diagnóstico.
• Se recomienda la utilización de HBPM o fondaparinux, como manejo inicial en pacientes con TEP sin riesgo elevado.
• En pacientes con riesgo elevado para sangrado y en aquellos con insufciencia renal, se recomienda como inicio, la utilización de HNF manteniendo un TPTa 1.5 a 2.0, veces el control.
• El manejo inicial con HNF, HBPM o fondaparinux se debe de mantener, por lo menos cinco días y reemplazarse con antagonistas de vitamina K, sólo después de alcanzar un INR óptimo (2.0), en dos días consecutivos.
• No se recomienda el uso de fibrinolíticos en pacientes con bajo riesgo para TEP, pero puede considerarse en aquellos pacientes con disfunción ventricular derecha, en ausencia de hipotensión.
• No se recomienda la utilización de fibrinolíticos, en pacientes con riesgo bajo para TEP.
Duración de la anticoagulación
Independientemente de la presencia de factores de riesgo o no, después de un primer evento de TEP la anticoagulación se debe mantener por lo menos tres meses.15 De acuerdo a la Sociedad Europea de Cardiología,15 pacientes con un factor de riesgo transitorio y un primer evento de TEP (por ejemplo, cirugía ortopédica), deberán mantenerse anticoagulados por tres meses, lo que contrasta con las recomendaciones del American College of Chest Physicians, que recomienda mantener la anticoagulación oral por lo menos seis meses.47 Es práctica de nuestro grupo, anticoagular a estos pacientes por lo menos seis meses y evaluar de forma continua, la presencia o aparición de nuevos factores de riesgo. En pacientes con cáncer y un primer evento de TEP, se recomienda por ambas sociedades, anticoagular a los pacientes con HBPM de tres a seis meses. Después de este periodo, la terapia con HBPM o antagonistas de vitamina K se mantendrá, por el tiempo en que el cáncer se considere activo y de manera individualizada.15,47 Aquellos pacientes con un factor de riesgo hereditario, como presencia de anticoagulante lúpico, mutación del factor V Leiden, deficiencia de proteína C o S o mutación del gen de la protrombina, la anticoagulación se deberá mantener de forma indefinida, evaluando cada caso de manera individual.15,47
Referencias
1. Wood KE. Major pulmonary embolism. Chest 2002;121:877-905. [ Links ]
2. Guías y Recomendaciones del Capítulo de Circulación Pulmonar de la Sociedad Mexicana de Cardiología. Diagnóstico, estratificación y tratamiento de la tromboembolia pulmonar aguda. Arch Cardiol Mex 2004;74:S547-S585. [ Links ]
3. Dalen JE, Alpert JS. Natural history of pulmonary embolism. Prog Cardiovasc Dis 1975;17:259-270. [ Links ]
4. Kasper W, Konstantinides S, Geibel A, et al. Management strategies and determinants of outcome in acute major pulmonary embolism: results of a multicenter registry. J Am Coll Cardiol 1997;30:1165–1171. [ Links ]
5. Goldhaber SZ, Visani L, De Rosa M. For the ICOPER study group. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999;353:1386–1389. [ Links ]
6. Pulido T, Aranda A, Zeballos MA, et al. Pulmonary embolism as a cause of death in patients with heart disease. An autopsy study. Chest 2006;29:1282-1287. [ Links ]
7. Sandoval J, Eid-Lidt G, González H, et al. Embolectomía no quirúrgica en tromboembolia pulmonar masiva. Una alternativa en casos seleccionados. En: Martínez Sanchez C, Martínez Reding JO, González Pacheco H (Editores). Urgencias Cardiovasculares. Tópicos selectos. Primera edición. México. Intersistemas. 2008. 207-217. [ Links ]
8. Mercat A, Diehl JL, Meyer G, et al. Hemodynamic effects of fluid loading in acute massive pulmonary embolism. Crit Care Med 1999;27:540-544. [ Links ]
9. Kucher N, Goldhaber SZ. Managemenet of massive pulmonary embolism. Circulation 2005;112:e28-32. [ Links ]
10. Ghignone M, Girling L, Prewitt RM. Volume expansion cersus norepinephrine in treatment of a low cardiac output complicating in acute increase in right ventricular afterload in dogs. Anesthesiology 1984;60:132-135. [ Links ]
11. Prewitt RM. Hemodynamic management in pulmonary embolism and acute hypoxemic respiratory failure. Crit Care Med 1990; 18:S61-S69. [ Links ]
12. Jardin F, Genevray B, Brun-Ney D, et al. Dobutamine: a hemodynamic evaluation in pulmonary embolism shock. Crit Care Med 1985;13:1009-1012. [ Links ]
13. Manier G, Castaing Y. influence of cardiac output on oxygen exchange in acute pulmonary embolism. Am Rev Respir Dis 1992;145:130-136. [ Links ]
14. Barrit DW, Jordan SC. Anticoagulant drugs in the treatment of pulmonary embolism: a controlled trial. Lancet 1960;315:1309-1312 [ Links ]
15. The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2008;29:2276-2315 [ Links ]
16. Witz J, Hudoba M, Massel D. Clot-bound thrombin is protected from inhibition by heparin-antithrombin III but susceptible to inactivation by antithrombin III-independent inhibitors. J Clin Invest 1990;86:385-391. [ Links ]
17. Jerjes-Sánchez C, Ramírez-Rivera A, Gutiérrez-Fajardo P, et al. Un enfoque diferente del estado actual de la trombólisis en la tromboembolia pulmonar. Arch Inst Cardiol Mex 1998;68:166-180. [ Links ]
18. Levine MN, Hirsh J, Gent M, et al. A randomized trial comparing activated thromboplastin time with heparin assay in patients with acute venous thromboembolism requiring large daily doses of heparin. Arch Intern Med 1994;154:49-56. [ Links ]
19. Hull RD, Raskob GE, Pineo G F, et al. Subcutaneous low-molecular-weight heparin compared with continuous intravenous heparin in the treatment of proximal-vein thrombosis. N Eng J Med 1992;326:975-982 [ Links ]
20. Pérez de Llano LA, Baloira VA, Veres RA, et al. Estudio prospectivo, multicéntrico para comparar enoxaparina con heparina no fraccionada en el tratamiento de embolia pulmonar submasiva. Arch Bronconeumol 2003;39:341-345 [ Links ]
21. Thery C, Simonneau G, Meyer G, et al. Randomized trial of subcutaneous low-molecular-weight heparin CY 216 (Fraxiparine) compared with intravenous unfractioned heparin in the curative treatment of submassive pulmonary embolism. A dose-ranging study. Circulation 1992;85:1380-1389. [ Links ]
22. Simonneau G, Sors H, Charbonnier B, et al. A comparison of low-molecular-weight heparin with unfractioned heparin for acute pulmonary embolism. The THEESE Study Group. Tinzaparine ou Heparine Standard: evaluations dans l’Embolie Pulmonaire. N Eng J Med 1997;74:1432-1435. [ Links ]
23. Quinlan DJ, McQuillan A, Elkeboom JW. Low-molecular-weight heparin compared with intravenous unfractioned heparin for treatment of pulmonary embolism: a meta-analysis of randomized, controlled trials. Ann Intern Med 2004;140:175-183. [ Links ]
24. Buller HR, Davidson BL, Decousus H, et al. Subcutaneous fondaparinux versos intravenous unfractioned heparin in the initial treatment of pulmonary embolism. N Eng J Med 2003;349:1695-1702. [ Links ]
25. Ansell J, Hirsh J, Hylek E, et al. Pharmacology and management of vitamin K antagonists: American College of Chest Physicians Evidence-Based Clinical Parctice Guidelines (8th Edition). Chest 2008;133:160-198. [ Links ]
26. Goldhaber SZ, Haire WD, Feldstein ML, et al. Alteplase versus heparin in acute pulmonary embolism: randomised trial assesing right ventricular function and pulmonary perfusion. Lancet 1993;341:507-511. [ Links ]
27. The urokinase pulmonary embolism trial. A national cooperative study. Circulation 1973;47:1-108. [ Links ]
28. Dalla-Volta S, Palla A, Santolicandro A, et al. PAIMS 2: alteplase combined with heparin versus heparin in the treatment of acute pulmonary embolism. Plasminogen activator italian multicenter study 2. J Am Coll Cardiol 1992;20:520-526. [ Links ]
29. Tissue plasminogen activator for the treatment of acute pulmonary embolism. A collaborative study by the PIOPED investigators. Chest 1990;97:528-533. [ Links ]
30. Levine M, Hirsh J, Veitz J, et al. A randomised trial of single bolus dosage regiment of recombinant tissue plasminogen activator in patients with acute pulmonary embolism. Chest 1990;98:1473-1479. [ Links ]
31. Marini C, Di Ricco G, Rossi G, Rindi M, Palla R, Giutini C. Fibrinolytic effects of urokinase and heparin in acute pulmonary embolism: a randomized clinical trial. Respiration 1988;54:162-173. [ Links ]
32. Ly B, Arnessen H, Eie H, Hol R. A controlled clinical trial on strep-tokinase and heparin in the treatment of major pulmonary embolism. Acta Med Scand 1978;203:162-173. [ Links ]
33. Jerjes-Sánchez C, Ramírez-Rivera A, de Lourdes GM, et al. Streptokinase and heparin versus heparin alone in massive pulmonary embolism: a randomized controlled trial. J Thromb Thrombolysis 1995;2:227-229 [ Links ]
34. Bhuvaneswaran JS, Premchand RK, Iyengar SS, Rajeev Khare, et al. Tenecteplase in the treatment of acute pulmonary thromboembolism J Thromb Thrombolysis 2011;3:445-448. [ Links ]
35. Smadja D, Chausson N, Joux J, et al. A New Therapeutic Strategy for Acute Ischemic Stroke: Sequential Combined Intravenous tPA-Tenecteplase for Proximal Middle Cerebral Artery Occlusion Based on First Results in 13 Consecutive Patients. Stroke 2011;42:1644-1647. [ Links ]
36. Greenfeld LJ, Kimmel GO, McCurdy WC III. Transvenous removal of pulmonary emboli by vacuum-cup catheter technique. J Surg Res 1969;9:337-352. [ Links ]
37. Greenfeld LJ, Proctor MC, Williams DM, et al. Long-term experience with transvenous catheter pulmonary embolectomy. J Vasc Surd 1993;18:450-458. [ Links ]
38. Kucher N, Goldhaber SZ. Management of massive pulmonary embolism. Circulation 2005;29:1282. [ Links ]
39. Kucher N, Windecker S, Banz Y, et al. Percutaneous catheter thrombectomy device for acute pulmonary embolism. Radiology 2005;236:852-858. [ Links ]
40. Eid-Lidt G, Gaspar J, Sandoval J, et al. Combined clot fragmentation and aspiration in patients with acute pulmonary embolism. Chest 2008;134:54-60. [ Links ]
41. Bloomfeld P, Boon NA, DeBono D P. Indications for pulmonary embolectomy. Lancet 1988;2:329. [ Links ]
42. Leacche M, Unic D, Goldhaber SZ, et al. Modern surgical of pulmonary embolism: results in 47 consecutive patients after rapid diagnosis and aggressive surgical approach. J Thorac Cardiovasc Surg 2005;129:1018-1023. [ Links ]
43. Hiromatsu S, et al. Non-permanent inferior vena cava filters for prophylaxis and treatment of lower limb venous thromboembolism. Vasc Endovascular Surg 2010;44:668-673. [ Links ]
44. Gross PL, Weitz JI. New anticoagulants for treatment of venous thromboembolism. Arterioscler Thromb Vasc Biol 2008;28:380-386. [ Links ]
45. Walenga JM, Jeske W P, Fareed J. Short- and long-acting synthetic pentasaccharides as antithrombotic agents. Expert Opin Investig Drugs 2005;14:847-858. [ Links ]
46. Spyropoulos AC. Investigational treatments of venous thromboembolism. Expert Opin Investig Drugs 2007;16:431-440. [ Links ]
47. Hirsh J, Guyatt G, Abers GW, et al. Antithormbotic and thrombolytic therapy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008;133:S110-S112. [ Links ]














