Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.81 no.2 Ciudad de México abr./jun. 2011
Comunicaciones breves
Cierre percutáneo del conducto arterioso permeable utilizando el Amplatzer vascular Plug II
Percutaneous closure of patent ductus arteriosus using the Amplatzer vascular Plug II
Rafael Parra–Bravo,1 Luisa Beirana–Palencia,1 Antonio Corona–Rodríguez,2 Laura Alarcón–Elguera,2 Norma Tejeda–Hernández,3 Perla Aguilar–Segura,3 César Lazo–Cárdenas,1 Abril Arellano–Llamas4
1 Servicio de Cardiología y Hemodinamia Pediátrica.
2 Médico Pediatra en Adiestramiento de Cardiología Pediátrica.
3 Médico Residente de Cardiología Pediátrica.
4 Médico Residente de Pediatría Médica.
Hospital de Pediatría. Centro Médico Nacional Siglo XXI, IMSS. México, D. F.
Correspondencia:
José Rafael Parra Bravo. Av. Cuauhtémoc No. 330
Col. Doctores 06720. México, DF.
Teléfono: 5627.6900 ext. 22270.
Fax: 5593.6300.
Correo electrónico: rafaelparrabravo@yahoo.com.mx, rafaelparrabravo@gmail.com
Recibido el 7 de septiembre de 2010;
Aceptado 13 de diciembre de 2010.
Resumen
Amplatzer vascular Plug II (AVP II) es un dispositivo oclusor autoexpandible, indicado para oclusiones arteriales o venosas en la vasculatura periférica.
Objetivo: Describir nuestra experiencia clínica inicial con el AVP II, en el cierre percutáneo del conducto arterioso permeable pequeño.
Métodos: Analizamos retrospectivamente, siete pacientes sometidos a oclusión percutánea del conducto arterioso. El AVP II se eligió con un diámetro mayor a 50% del diámetro mínimo del conducto arterioso.
Resultados: Los pacientes evidenciaron un conducto arterioso con un diámetro mínimo de 1.5 ± 1.4 (intervalo: 0.8 a 4.7mm). Se logró un implante exitoso y con adecuada oclusión angiográfica en seis pacientes. Un paciente fue enviado a cirugía. Sólo observamos una complicación mayor. El ecocardiograma transtorácico a las 24 horas, confirmó la oclusión completa en estos pacientes. El seguimiento fue de 10.6 ± 9.1 meses.
Conclusiones: El AVP II, en este grupo de pacientes mostró ser seguro y efectivo para el cierre percutáneo del conducto arterioso.
Palabras clave: Amplatzer vascular Plug; Cierre transcatéter; Conducto arterioso permeable; México.
Abstract
The Amplatzer vascular Plug II (AVP II) is a self–expanding occluder device, indicated for arterial and venous occlusion in the peripheral circulation.
Objective: To describe our initial clinical experience with the AVP II, in the percutaneous closure of small patent ductus arteriosus.
Method: We retrospectively analyzed seven patients who underwent percutaneous closure of patent ductus arteriosus. The AVP II was chosen with a diameter greater than 50% of the minimum diameter of the ductus arteriosus.
Results:Patients showed a ductus arteriosus with a diameter of 1.5 ± 1.4 (range: 0.8 – 4.7mm). Successful implant was achieved with adequate angiographic occlusion in 6 patients. One patient was sent to surgery. We only found a major complication. Transthoracic echocardiography at 24 hours, confirmed the complete occlusion in this patients. The follow–up was 10.6 ± 9.1 months.
Conclusion: The AVP II in this group of patients was shown to be safe and effective for percutaneous closure of patent ductus arteriosus.
Keywords Amplatzer vascular Plug; Transcatheter closure; Patent ductus arteriosus; Mexico.
Introducción
El cierre transcatéter del conducto arterioso persistente (CAP) es un procedimiento bien establecido. Habitualmente los CAPs pequeños (≤ 2mm), son ocluidos con coils de Gianturco o coils de liberación controlada, con las siguientes ventajas: requieren de sistemas de liberación pequeños, facilidad de implante, alta frecuencia de oclusión, baja frecuencia de complicaciones y bajo costo.1–3Para conductos de un tamaño moderado a grande, el oclusor de Amplatzer (Amplatzer Duct Occluder) es el dispositivo más popular, con excelentes tasas de oclusión4–7y buenos resultados a corto, mediano y largo plazo.8–10El Amplatzer vascular Plug II ([AVP II]; AGA Medical Corporation, Golden Valley, MN, USA), es un nuevo dispositivo de oclusión, que aunque originalmente diseñado para embolizar malformaciones vasculares arteriovenosas periféricas (Figura 1),11,12 se ha utilizado en otras afecciones.13 En este reporte, describimos nuestra experiencia clínica inicial con el AVP II, en el cierre percutáneo del conducto arterioso.

Método
Muestra: Analizamos retrospectivamente los expedientes clínicos de siete pacientes (tres niños y cuatro niñas), sometidos a cierre transcatéter del CAP con el dispositivo AVP II (Tabla 1). La mediana de edad de los pacientes fue de 21 meses (intervalo de seis a 51 meses), peso de 4.8 a 16.0 kilos (mediana: 11.7 Kg) y talla de 59 a 100 cm (mediana: 77 cm). Uno de los pacientes evidenció un peso menor de 5 Kg y tres pacientes eran portadores de Síndrome de Down. La detección de soplo cardiaco fue el motivo de la valoración cardiológica inicial en todos ellos. Los pacientes se encontraban asintomáticos, excepto dos con manifestaciones leves de falla cardiaca, que requirieron de manejo médico con digital y diurético. En dos pacientes se detectaron pulsos amplios. De los pacientes, dos evidenciaron lesiones cardiacas asociadas; uno con comunicación interventricular pequeña y comunicación interauricular, y otro con comunicación interauricular pequeña. Por radiología, sólo dos casos evidenciaron cardiomeglia leve. El índice cardiotorácico varió de 0.44 a 0.62 (mediana: 0.46). Por ecocardiografía se observó dilatación de cavidades izquierdas en tres casos, con una relación AI/AO de 0.96 – 1.3 (mediana: 1.1). El diámetro mínimo y máximo del CAP por ecocardiografía fue de 1.0 a 4.9 mm (mediana: 2.0) y de 1.7 a 8.5 mm (mediana: 3.0), respectivamente. Hemodinámicamente, la presión sistólica pulmonar osciló entre 25 a 45 mmHg (mediana: 36.5 mmHg), habiéndose considerado hipertensión pulmonar en únicamente dos casos. La relación presión sistólica pulmonar/presión sistólica sistémica (PSP/PSS) varió de 0.23 a 0.84 (mediana: 0.52) y la relación gasto pulmonar/gasto sistémico (QP/QS) mostró una mediana de 1.1 /1.0 (rango: 1.0 a 1.3). Por angiografía, el tipo de CAP más frecuente fue el cónico (cinco casos, 71.4%) y tubular en los dos restantes. Los diámetro mínimo, máximo y longitud del CAP medido por angiografía fue de 0.8 a 4.7 mm (mediana; 1.0 mm), 2.0 a 8.5 mm (mediana; 3.3 mm) y 2.9 a 12.5 mm (mediana; 7.0 mm), respectivamente. Cuatro pacientes (57%) con un diámetro mínimo angiográfico del CAP ≤ 1 mm. El acceso del CAP fue anterógrado en cuatro casos y retrógrado en los restantes. El catéter guía Judkins derecho requerido fue 5 F en seis pacientes (86%) y 6 F en el restante. El tamaño del AVP II utilizado fue de 3 mm en cuatro pacientes (57.1%), 4 mm en dos pacientes (28.6%) y 8 mm en un paciente (14.3%).
Dispositivo: El AVP II, es un dispositivo cilíndrico auto–expandible y confeccionado con una malla de alambres de Nitinol.11–13 Adiferencia de otros oclusores de la familia Amplatzer, no contiene material trombogénico en su interior. El dispositivo tiene marcas de platino en ambos extremos. El tamaño del AVP II, varía de 3 a 22 mm de diámetro y de 6 mm a 18 mm de longitud (Figura 1). El sistema liberador, consiste de un cable de Nitinol de 135 cm de longitud, al que se atornilla el dispositivo precargado. El dispositivo, puede ser liberado a través de catéteres guía de 5–9 Fr. El AVP II seleccionado, debe ser un 30% a 50% mayor al diámetro del vaso a tratar. Una vez implantado el dispositivo, es posible recapturarlo y extraerlo mientras permanece atornillado. Dado que el AVP II es una malla flexible de alambre de Nitinol, se ajusta a la forma del vaso y evita la migración posterior a su implante; aunque debe considerase como uno de sus riesgos principales. El protocolo de implante del AVP II ha sido ampliamente detallado.14,15
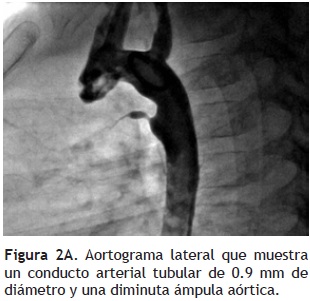
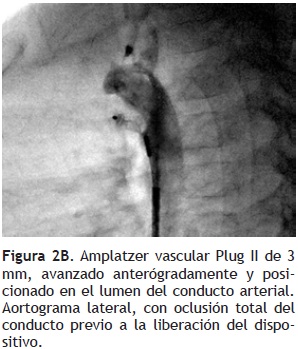
Protocolo: Obtuvimos el consentimiento informado de los padres o tutores. Todas las intervenciones se realizaron bajo anestesia general, canalizando la vena y arteria femoral, y administrando 100 U/kg de heparina. Posterior al registro de las presiones pulmonares y sistémicas, se realizó un aortograma en proyecciones lateral y oblicua anterior derecha 40°, para definir el tamaño y la morfología del CAP de acuerdo a Krichenko (Figura 2A).16 Con un catéter multipropósito 4 Fr y ayuda de guía hidrofílica, se canalizó el conducto de modo anterógrado en cuatro casos y retrógrado en los tres restantes. Sobre una guía de intercambio Amplatzer de calibre 0.035", se avanzó anterógradamente o retrógradamente un catéter guía Judkins derecho (JR–4), posicionándolo en la porción central del CAP. Se seleccionó un dispositivo mayor al 50% del diámetro mínimo del conducto. El dispositivo se introdujo atornillado a través del catéter guía JR y se llevó hasta la parte central del conducto arterioso; en este sitio, se retiró el catéter guía JR, y se implantó el dispositivo, evitando su protrusión hacía la luz de la aorta o de la rama pulmonar izquierda (Figura 2B). Posterior al implante y destornillamiento del AVP, se realizó una angiografía en aorta descendente, para verificar la presencia de fuga residual (Figura 2C). Implantamos un AVP en cada paciente (Tabla 1).

Resultados
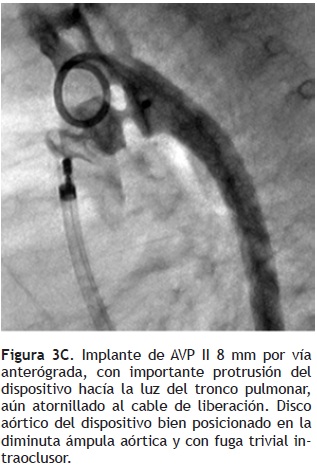
Un implante exitoso del AVP se logró en seis pacientes (85.7%), confirmándose la oclusión angiográfica del CAP, en todos ellos. En uno de nuestros casos (paciente cinco), se optó por no liberar el AVP II, debido que al implantarlo tanto por vía anterógrada como retrógrada, no fue posible obtener la forma del dispositivo dentro de la luz del conducto arterioso, con protrusión del mismo hacía la luz del tronco pulmonar y de la aorta (Figura 3). La paciente, fue enviada finalmente a cirugía. Los tiempos de fluoroscopia y del procedimiento fueron de 5 a 12 minutos (media: 8.5 ± 2.4 minutos) y 40 a 65 minutos (media: 52 ± 9.7 minutos), respectivamente. Como complicación mayor, registramos un evento de sangrado mayor al 10% del volumen circulante, que requirió de hemotransfusión (paciente cinco). La mortalidad fue nula con el procedimiento. Todos los pacientes fueron dados de alta a las 24 horas. En el seguimiento clínico, radiológico y ecocardiográfico a 24 horas, seis meses y un año, de los seis pacientes, observamos una posición adecuada del dispositivo, sin evidencia de fuga residual o datos de obstrucción en la rama pulmonar izquierda (gradiente máximo ecocardiográfico; media de 4.6 ± 1.7 mmHg) o de la aorta descendente (gradiente máximo ecocardiográfico; media de 4.5 ± 0.8 mmHg). El seguimiento total fue de uno a 24 meses (media: 10.6 ± 9.1).


Discusión
Actualmente, el cierre transcatéter del conducto arterioso permeable es un procedimiento bien establecido. Habitualmente, los CAPs pequeños (≤ 2mm), son ocluidos con coils de Gianturco o coils de liberación controlada.1–3 Para conductos de un tamaño moderado a grande, el oclusor de Amplatzer (ADO) ha demostrado su eficacia.7–9 Sin embargo, hay dos grupos de pacientes con CAP, donde la oclusión transcatéter es técnicamente difícil; neonatos con CAP grandes, y lactantes con CAP tubular. Estos factores, están asociados con un resultado más desfavorable.5–7,9,10
Aunque el Amplatzer Duct Occluder (ADO), es empleado con éxito en el cierre de virtualmente todos los tipos morfológicos de CAP,4–6se le considera menos útil en estructuras tubulares, ya que su diseño y configuración son específicos para CAPs tipo cónico.8,9 La selección del dispositivo ideal para el CAP tubular grande, es aún limitado.9 El ADO ofrece muchas ventajas compradas con otros oclusores; sin embargo, en niños pequeños, la embolización del oclusor a la aorta descendente, y la obstrucción de la luz aórtica o de la rama pulmonar izquierda, han sido reportadas.7–9,17 Thanopoulos y colaboradores,18 al comparar las ventajas del nuevo ADO II, refieren que su propiedad más importante, son los discos de muy bajo perfil, que pueden adaptarse a los diferentes ángulos de inserción del CAP dentro de la aorta y la arteria pulmonar izquierda, minimizando el riesgo de obstrucción relacionada con el dispositivo.
El AVP II es un dispositivo oclusor relativamente nuevo,11–13 que posee las características de los dispositivos de la familia Amplatzer, excepto que tiene una malla de alambre más densa y no contiene material trombogénico en su interior. Está indicado para embolizaciones arteriales y venosas en la vasculatura periférica. Su sistema de liberación es a través de catéteres guía de pequeño calibre, que lo hace particularmente ventajoso para su abordaje arterial o venoso en pacientes pediátricos, sin haber descripción de las ventajas o desventajas, de cada una de las vías de abordaje. El AVP II presenta las siguientes ventajas: permite una oclusión más precisa, su posición puede verificarse antes de liberarlo, el riesgo de migración es menor, se libera fácilmente por vía anterógrada y retrógrada, y puede obtenerse una oclusión completa con un sólo dispositivo. Su principal desventaja, es el riesgo de embolización.
Nuestros casos, describen la novedosa utilidad del AVP II en el cierre del conducto arterioso permeable.13–15 En un niño Down de 21 meses, angiográficamente se demostró una comunicación interventricular de 2 mm, una comunicación interauricular de 6 mm y un CAP tubular de 0.9 mm en su diámetro mínimo. A pesar de que el componente principal del cortocircuito de izquierda a derecha, ocurrió a nivel auricular, consideramos que el CAP mostraba moderada significancia hemodinámica, por el importante flujo angiográfico a nivel del conducto. Se decidió ocluir el CAP por la vía anterógrada con un AVP. Si bien en dos de nuestros casos, se intentó ocluir el conducto en forma inicial, con un coil de liberación controlada por la vía retrógrada, dicho procedimiento no fue efectivo, debido a la imposibilidad para poder avanzar el catéter multipropósito hasta el tronco pulmonar. Para evitar complicaciones potenciales, elegimos utilizar el AVP II, para ocluir un CAP pequeño y tubular.
En seis pacientes logramos implantar dispositivos con un diámetro mayor al 50% del calibre mínimo del conducto. Una ventaja potencial del AVP, es la de poderse implantar tanto por la vía anterógrada, como por la retrógrada. En una paciente (caso cinco), con un CAP tubular corto de 4.7 mm de diámetro mínimo, se intentó ocluir inicialmente con un AVP de 10 mm por vía retrógrada y posteriormente con un AVP de 8 mm por vía anterógrada, sin lograr su posicionamiento adecuado, debido a una protrusión significativa del dispositivo hacía la luz de la aorta descendente y de la rama pulmonar izquierda (Figuras 3 A, B y C). Se decidió finalmente no ocluir el CAP y enviarla a cirugía. Se menciona que el AVP no posee un disco de retención aórtico, como el ADO, por lo que puede ser fácilmente centrado dentro del CAP sin protruir hacía la luz de la aorta, y expandirse a su diámetro nominal en forma adecuada, ejerciendo una fuerza radial que lo fija dentro de la luz del conducto.11–13,15 Esta última característica, lo hace particularmente útil en conductos de forma tubular.
El uso del AVP para el cierre percutáneo del CAP de forma tubular, ha sido reportado en últimas fechas. Holzer y colaboradores,11 implantaron exitosamente un AVP de 6 mm, dentro de un CAP tipo C de 6 mm de diámetro en su porción media y 4.2 mm en su extremo pulmonar. Los autores establecen que el AVP puede ser aceptable en CAP tubular, aún en niños pequeños. Hoyer,15 informó la oclusión exitosa de un CAP tubular grande en un niño pequeño. A pesar de estos resultados, se reporta el stenting inadvertido del conducto arterioso, utilizando un AVP, con presencia de un importante cortocircuito de alta velocidad a través del dispositivo.19 Los autores comentan que la presencia de un cortocircuito residual de alta velocidad a través del dispositivo, no permite la formación de un trombo intradispositivo adecuado y subsecuente endotelización, y concluyen que el AVP no debe ser implantado en el CAP tubular.
La endotelización de un AVP, es probable que nunca ocurra en un canal de baja resistencia, y con alta velocidad de flujo. Cheatham,20 publicó un caso de flujo residual de alta velocidad intradispositivo, que requirió del retiro quirúrgico del AVP. Glatz,14 describió dos casos de oclusión exitosa del CAP, utilizando un AVP rellenado con coils de embolización, para disminuir el riesgo de flujo residual a través del dispositivo. La falta del parche de poliéster interno en el AVP, no permite un mecanismo de flujo lento dentro del dispositivo y puede no ser completamente oclusivo en el CAP de alto flujo.19,20
Conclusión
Aproximadamente la mitad de nuestros pacientes evidenciaron un diámetro mínimo del CAP igual o menor de 1 mm, y al igual que otros grupos, consideramos que la embolización percutánea del CAP pequeño con el AVP II es un procedimiento seguro y efectivo, y evita un acto quirúrgico. Su uso reduce la duración del procedimiento y aumenta la seguridad de este. Sin embargo, dado el escaso número de comunicaciones sobre este tipo de casos,11–15,20 se necesita de una mayor experiencia, antes de definir la indicación del AVP II como oclusor del CAP pequeño (< 2 mm).
Referencias
1. Lloyd TR, Fedderly R, Mendelshon AM, et al. Transcather occlusion of patent ductus arteriosus with Gianturco coils. Circulation 1993;88:1412–1420. [ Links ]
2. Bermúdez–Cañete R, Santoro G, Bialkowsky J, et al. Patent ductus arteriosus occlusion using detachable coils. Am J Cardiol 1998;82:1547–1549. [ Links ]
3. Patel HT, Cao QL, Rhodes J, et al. Long–term outcome of transcatheter coil closure of small to large patent ductus arteriosus. Catheter Cardiovasc Interv 1999;47:457–461. [ Links ]
4. Masura J, Gavora P, Podnar T. Catheter closure of moderate of moderate– to large–sized patent ductus arteriosus using the new Amplatzer Duct Occluder: immediate and short term results. J Am Coll Cardiol 1998;31:878–882. [ Links ]
5. Bilkis AA, Alwi M, Hasri S, et al. The Amplatzer duct occluder: experience en 209 patient. J Am Coll Cardiol 2001;37:258–261. [ Links ]
6. Masura J, Tittel P, Gavora P, et al. Long–term outcome of transcatheter patent ductus arteriosus closure using Amplatzer duct occluders. Am Heart J 2006;151:755.e7–755.e10. [ Links ]
7. Al–Ata J, Arfi AM, Hussain A, et al. The efficacy and safety of the Amplatzer ductal occluder in young children and infants. Cardiol Young 2005:15:279–285. [ Links ]
8. Fischer G, Stich J, Grabitz R, et al. Transcatheter closure of persistent ductus arteriosus in infants using the Amplatzer duct occluder. Heart 2001;86:444–447. [ Links ]
9. Butera G, De Rosa G, Chessa M, et al. Transcatheter closure of persistent ductus arteriosus with the Amplatzer duct occluder in very young symptomatic children. Heart 2004;90:1467–1470. [ Links ]
10. Roberts P, Adwani S, Archer N, et al. Catheter closure of the arterial duct in preterm infants. Arch Dis Child Fetal Neo 2007;92:F248–F250. [ Links ]
11. Holzer R, Coa Q, Shandu S, et al. The Amplatzer vascular plug: an addition to our interventional armamentarium. Pediatric Cardiology Today 2004;2:6–8. [ Links ]
12. Hill SL, Hijazi ZM, Hellenbrand WE, et al. Evaluation of the Amplatzer vascular plug for embolization of peripheral vascular malformations associated with congenital disease. Catheter Cardiovasc Interv 2006;67:113–119. [ Links ]
13. Tuite DJ, Kessel DO, Nicholson AA, et al. Initial clinical experience using the Amplatzer vascular Plug. Cardiovasc Intervent Radiol 2007; 30:650–654. [ Links ]
14. Glatz AC, Petit ChJ, Guillespie M. Novel use of a modified Amplatzer vascular Plug to occlude a patent ductus arteriosus in two patients. Catheter Cardiovasc Interv2008;72:82–86. [ Links ]
15. Hoyer MH. Novel use of the Amplatzer vascular plug for closure of a patent ductus arteriosus. Catheter Cardiovasc Interv 2005;65:577–580. [ Links ]
16. Krichenko A, Benson LN, Burrows P, et al. Angiographic classification of the isolated, persistently patent ductus arteriosus and implications for percutaneous catheter occlusion. Am J Cardiol 1989;63:877–880. [ Links ]
17. Duke C, Chan KC. Aortic obstruction caused by device occlusion of patent arterial duct. Heart 1999;82:109–111. [ Links ]
18. Thanopoulos B, Eleftherakis N, Tzannos K, et al. Transcatheter closure of the patent ductus arteriosus using the new Amplatzer duct occluder: Initial clinical applications in children. Am Heart J 2008;156:917.e1–917.e6 [ Links ]
19. Javois AJ, Husayni TS, Thoele D, et al. Inadvertent stenting of patent ductus arteriosus with Amplatzer vascular Plug. Catheter Cardiovasc Interv 2006;67:485–489. [ Links ]
20. Cheatham JP. Not so fast with that novel use: does AVP = PDA? Catheter Cardiovasc Interv 2005;65:581 –583. [ Links ]














