Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.80 no.4 Ciudad de México oct./dic. 2010
Comunicaciones breves
Importancia del binomio corazón–cerebro en el manejo integral de las cardiopatías congénitas
Importance of the heart–brain binomial in the management of congenital heart disease
Luis A. Pando–Orellana,1 Alfonso Buendía–Hernández,1 Juan Calderón–Colmenero,1 José Antonio Razo–Pinete,1 Emilia J. Patiño,1 Jorge Luis Cervantes–Salazar,2 Aloha Meave–González,3 David Bialostozky,4 Iván Corral–Mejorado,5 Pedro José Curi–Curi2
1 Departamento de Cardiología Pediátrica, Instituto Nacional de Cardiología Ignacio Chávez.
2 Departamento de Cirugía de Congénitos en Cardiología Pediátrica, Instituto Nacional de Cardiología Ignacio Chávez.
3 Departamento de Resonancia Magnética, Instituto Nacional de Cardiología Ignacio Chávez.
4 Departamento de Medicina Nuclear, Instituto Nacional de Cardiología Ignacio Chávez.
5 Departamento de Patología, Instituto Nacional de Cardiología Ignacio Chávez.
Correspondencia:
Luis A. Pando Orellana,
Instituto Nacional de Cardiología Ignacio Chávez,
Centro para la Atención en Lesiones Cerebrales S. C.
Artemio del Valle Arizpe núm. 16–101, Col. Del Valle. México, D. F.
Teléfono: 55 23 26 84. Correo electrónico: drpando@hotmail.com
Recibido el 11 de noviembre de 2009.
Aceptado el 18 de marzo de 2010.
Resumen
Se presenta el caso de un lactante de dos meses con una cardiopatía congénita compleja del tipo coartación aórtica con comunicación interventricular asociada a un trastorno de migración celular cerebral. El manejo consistió en la corrección de la cardiopatía congénita en dos tiempos quirúrgicos sin haber profundizado en la evaluación neurológica preoperatoria. El paciente desarrolló múltiples complicaciones perioperatorias que incluyeron paro cardiaco en dos ocasiones, reconexiones consecutivas a circulación extracorpórea, tamponamiento cardiaco, quilotórax y choque séptico. Concomitante a las complicaciones postoperatorias, se realizó una evaluación neurológica secundaria bajo un protocolo de abordaje neurológico que consistió en electroencefalografía, resonancia nuclear magnética y tomografía por emisión de positrón (SPECT). De esta forma se detectó paquigiria con microgiria y se sospechó trastorno de migración celular cerebral. La evolución final fue hacia el deceso por falla multisistémica y la autopsia confirmó la patología neural, así como el pobre pronóstico para la función y la vida. De haberse considerado en el preoperatorio un estudio integral que incluyera el binomio corazón–cerebro, el planteamiento terapéutico podría haberse modificado.
Palabras clave: Cardiopatía congénita compleja; Trastorno de migración celular cerebral; Binomio corazón–cerebro; México.
Abstract
A case of a two month infant with complex congenital heart disease (aortic coarctation with ventricular septal defect) associated to a cellular brain migration failure is presented. The management strategy consisted on the correction of congenital heart disease by means of a two–stage surgery without a further preoperative evaluation of the neurological status. The patient developed several perioperative complications such as two episodes of cardiac arrest, reconnection to cardiopulmonary bypass, cardiac tamponade, chilothorax and septic shock. A neurological protocol consisting in electroencephalography, brain magnetic resonance and Single Photon Emission Computed Tomography (SPECT) was practiced during the postoperative period, which detected microgyria with paquigyria and a cellular brain migration failure was suspected. The final outcome was death due to multisystemic failure and the autopsy confirmed the neurological disease, as well as poor life function prognosis. Should the heart–brain binomial had been considered in an integral preoperative evaluation, the therapeutical approach could have been modified.
Key words: Complex congenital heart disease; Cellular brain migration failure; Heart–brain binomial; Mexico.
Introducción
Dentro del vasto y complejo mundo de las cardiopatías congénitas, y la interacción de subespecialidades en este contexto, es evidente que tanto las ciencias básicas, como las imagenológicas y otras especialidades médicas y quirúrgicas deben intervenir, no sólo en lo que al corazón se refiere.1 Las cardiopatías congénitas se asocian con malformaciones en otros sistemas. Dentro de ellos destacan las malformaciones del Sistema Nervioso Central estructurales y funcionales, como lo estableció Mckusick de la Universidad de Johns Hopkins en Baltimore durante la segunda mitad del siglo pasado en la que documentó más de 10 000 condiciones clínicas multisistémicas.2 Los defectos o alteraciones de la migración neuronal son las malformaciones más frecuentes del sistema nervioso. La migración embrional es una etapa que se da con el cierre del tubo neural y la formación de las vesículas telencefálicas (necesarias para la formación de hemisferios y cuerpo calloso).3 Dicha migración acontece entre la doceava y vigésima semana de gestación, y son oleadas sucesivas que de manera ordenada, de la línea media hacia la superficie, van a situarse desde el epéndimo ventricular hasta la corteza, guiadas por el sistema glial, que en esta etapa actúa a manera de radar cuya función es guiar a las neuronas migratorias en su viaje, mediante mediadores químicos específicos hasta alcanzar su lugar definitivo en la neocorteza.4
Así, nuestro objetivo fue el vincular en términos morfológicos y funcionales dos alteraciones en la organogénesis que con mucha frecuencia se asocian y que es necesario evaluar conjuntamente: corazón y cerebro; tanto de origen genético como secundarias a procedimientos terapéuticos. Con este fin, se presenta un caso que por sus características y evolución nos dio pauta para replantear la necesidad de una mayor integración de disciplinas en el ámbito de las cardiopatías congénitas.5,6
Informe del caso
Se trata de un lactante menor de tres meses de edad, originario del Estado de México, sin antecedentes perinatales de importancia. Presentó un cuadro clínico que inició desde su nacimiento y se caracterizó por episodios de diaforesis y cianosis relacionados al llanto.
Fue atendido en un hospital pediátrico, donde le detectaron un soplo cardiaco, motivo por el cual fue trasladado a los tres días de vida, a nuestra institución para continuar su estudio y tratamiento.
Al momento de su ingreso estaba taquicárdico (196 latidos por minuto), taquipnéico (59 respiraciones por minuto) y con saturación de oxígeno de 76% al aire ambiente. Al examen físico destacaba la presencia de un soplo sistólico paraesternal izquierdo alto, grado II/IV, con segundo ruido reforzado y ausencia de pulsos en miembros pélvicos. El electrocardiograma mostró signos de crecimiento biventricular de predominio derecho; y en la radiografía de tórax se evidenció una cardiomegalia moderada con índice cardio–torácico de 0.68, botón pulmonar prominente, y signos de hiperflujo pulmonar. Se le realizó una ecocardiografía que mostró una coartación aórtica con hipoplasia del arco aórtico asociada a un foramen oval primum permeable y comunicación interventricular perimembranosa. Con el objeto de aclarar la anatomía aórtica, se solicitó una tomografía computarizada (TC) que evidenció una coartación yuxtaductal de 3 mm de diámetro, de tipo tubular, asociada a un a hipoplasia del arco aórtico, además de los defectos septales interatrial e interventricular ya descritos.
Se presentó el caso en sesión médico–quirúrgica, en donde se discutió la corrección quirúrgica en un tiempo, versus el abordaje conservador en dos etapas operatorias, y se optó por la segunda postura; decidiendo realizar una coartectomía extendida en una primera instancia asociado a un bandaje paliativo de la arteria pulmonar.6 La cirugía inicial se llevó a cabo al mes de vida del paciente a través de una toracotomía póstero–lateral izquierda; se realizó una coartectomía extendida con anastomosis término–terminal y un cerclaje de arteria pulmonar con una banda de politetrafluoroetileno de 24 mm de longitud.
La evolución postoperatoria fue tórpida desde el punto de vista hemodinámico, con tendencia a la hipotensión y desaturación intermitentes que precipitaron un episodio de asistolia y paro cardiaco6 de dos minutos de duración a las 48 horas del postquirúrgico. Después de revertirlo se estableció un fallo importante de la función ventricular izquierda con alteraciones del ritmo. Posteriormente se agregaron datos de respuesta inflamatoria sistémica secundaria a una sepsis por Acinetobacter barmanii y Strentophomona maltophilia aislados en secreción bronquial, por lo que recibió tratamiento antimicrobiano de amplio espectro.
Si bien la hemodinámica mejoró parcialmente y el cuadro séptico parecía haberse controlado, a los 21 días de posoperado, presentó un aumento significativo del débito por el drenaje pleural izquierdo que alcanzaba valores de 300 mL/día, con características macroscópicas y por laboratorio de quilotórax. Por este motivo se inició manejo médico que incluyó nutrición parenteral baja en lípidos por 15 días y administración de somatostatina, sin lograr un adecuado control del débito pleural. Ante esta refractariedad al tratamiento convencional, se decidió realizar una ligadura del conducto torácico por la misma vía de abordaje quirúrgico inicial.
La evolución postoperatoria continuó siendo estacionaria, sin remisión completa del cuadro séptico ni mejoría hemodinámica, con necesidad de apoyo mecánico ventilatorio, por lo que se decidió completar la corrección quirúrgica de su patología intracardiaca.7,8 Es así que a los dos meses de vida, se le llevó nuevamente a cirugía, y a través de un abordaje por esternotomía media, se realizó el cierre quirúrgico de la comunicación interventricular con parche de pericardio bovino, cierre del foramen oval permeable por sutura primaria, y retiro del bandaje de arteria pulmonar. Si bien el paciente pudo salir de la circulación extracorpórea al primer intento, después del cierre esternal presentó deterioro hemodinámico y llegó hasta la actividad eléctrica sin pulso.7–11 Esto obligó a la reapertura esternal para dar masaje cardiaco directo; después de seis minutos de asistencia, el paciente salió del paro cardiaco en forma satisfactoria; pero para no precipitar otro deterioro hemodinámico, se decidió manejarlo con protocolo de esternón abierto. Después de seis días, las condiciones hemodinámicas se estabilizaron, y permitieron realizar el cierre esternal diferido.
La evolución a partir de entonces fue tórpida, por sepsis persistente por Stentophomona maltophilia refractaria a tratamiento antimicrobiano. Se mantuvo hospitalizado por el lapso de un mes sin mejoría del estado hemodinámico ni ventilatorio. Requirió ventilación mecánica asistida sin lograr extubación por datos clínicos y radiográficos de broncodisplasia pulmonar.1,7,8
Con el objeto de determinar daño a nivel del sistema nervioso central, fue sometido a un protocolo de valoración neurológica que incluyó una serie de estudios: electroencefalograma, resonancia magnética y tomografía por emisión de positrón. El electroencefalograma reveló disfunción eléctrica generalizada, de tipo bajo voltaje generalizado, alternando con punta/onda agudas, de mediando voltaje, difusas. La resonancia magnética mostró una atrofia cortical importante por la presencia de un quiste subaracnoideo gigante capaz de ejercer efecto de masa (Figura 1).12,13 La tomografía por emisión de positrón corroboró el importante daño funcional.

Después de tres meses de hospitalización, desarrolló deterioro hemodinámico progresivo por tendencia a la hipotensión y bradicardia, llegando al choque cardiogénico, insuficiencia renal secundaria, y falla orgánica múltiple. Finalmente, en las últimas 24 horas desarrolló edema generalizado, acidosis mixta y trastornos del ritmo cardiaco que lo llevaron a paro cardiorespiratorio, y motivaron maniobras avanzadas de reanimación durante 25 minutos sin respuesta, por lo que se declaró la defunción.
Con el debido consentimiento de los familiares del paciente, se solicitó estudio post–mortem (necropsia total), en la cual se evidenció:
1. Menor con facies característica
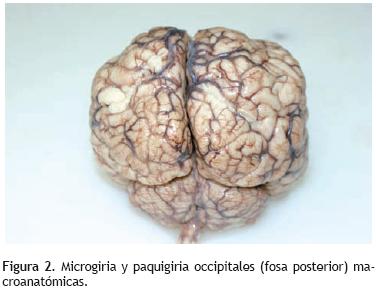
2. Paquigiria y microgiria macroscópicas (Figura 2).
a. Atrofia cerebral macroscópica (Figura 3).
b. Asimetría olivar.
3. Trastorno migratorio (Figuras 4 y 5).
4. Quiste subaracnoideo con efecto de masa



Discusión
En el binomio corazón–cerebro se plantea un paradigma: dentro de la ya compleja tarea de reparar corazones a nivel anatómico y funcional, se añade el problema del daño que resulta en el sistema nervioso central. Es necesario considerar este binomio por razones éticas y de criterio clínico integral, bajo condiciones económicas precarias, tanto de los pacientes cuyas condiciones de pobreza son bien conocidas, como debido a las limitaciones presupuestales institucionales.3,4
En el caso que nos ocupa: los trastornos migratorios, en sus variantes de paquigiria y microgiria, consecuencia de la deficiencia en la formación de la totalidad de las capas de la corteza, tanto cerebrales como cerebelosas, nos ofrecen un panorama de mal pronóstico, aunado a las condiciones de insultos repetidos al sistema nervioso, por los procedimientos ya descritos.3,10,14,15
Antes del nacimiento, pudiera considerarse un mecanismo común en el desarrollo cardiovascular y del sistema nervioso como se han descrito en varios síndromes (Miller–Dieker, alteración del fragmento distal del cromosoma 17, síndrome de Down y Síndrome de Goldberg–Shoprintzen, entre otros). Las cardiopatías congénitas pueden afectar la hemodinamia cerebral, fenómeno que puede ocurrir en diferentes momentos del desarrollo del cerebro. En la deleción del cromosoma 22q11, la gran variedad de anomalías es muy amplia. Una polimicrogiria puede ser causada también por isquemias focales prenatales secundarias a enfermedad cardiaca. La resonancia per se puede pasar por alto afecciones metabólicas y de microestructura cerebral, distintas de las del recién nacido a término con lesión por hipoxia–isquemia.16–20
Todas estas consideraciones son relevantes en el preoperatorio. Las lesiones que derivan de hipoxia secundaria a los procedimientos tienen una historia natural diferente de aquellos cambios en la corteza cerebral que derivan de los cambios de estructura original y que acontecen en el siguiente orden: capa uno (o marginal); seguida de la capa siete (transitoria) posteriormente de la dos a la seis, en orden inverso a la numeración. Las neuronas tienen su destino marcado genéticamente, pero hay múltiples factores que pueden colaborar al fallo, a la migración interrumpida, desviada o a la que no acontece o no se detiene.1,3 Es esta integridad la que permite establecer pronósticos para la toma de decisiones de inclusión y exclusión de pacientes en función de costo/beneficio en su mejor interés, de la sociedad y de los recursos a nuestro alcance, a fin de optimizar las acciones médico–quirúrgicas.
No pueden tomarse decisiones en un entorno de malformaciones sin visión integral y multidisciplinaria. Hay factores sistémicos que determinan buenas o tórpidas evoluciones, si ignoramos áreas como las de Sistema Nervioso, criterios genéticos, neurológicos o neuropsiquiátricos, considerando que esta última disciplina se ocupa y trabaja con seis capas de corteza y conexiones, embriológicos, de anatomía patológica y gabinetes (como la resonancia magnética, tomografía computarizada CT/PET, tractografía, medicina nuclear, mapa cerebral y hasta tomografía por emisión de un solo fotón).21 De particular interés en casos de esta naturaleza, resultan la espectroscopia por RM, que junto con la patología clínica de marcadores como glutamato, enolasa neural, acetil aspartato, mio–inositol, creatina y colina,22 y la proteína S100B (si no ha habido procedimientos hipotémicos),23 que por caros que resulten, pueden dirigir las acciones a una mayor eficiencia, tanto a nivel clínico como quirúrgico y con mejores resultados para el paciente en términos de vida, calidad de la misma e inversión de recursos que a la postre, resultan más económicos en toda la extensión del término.
Referencias
1. Jacinto S, Gieron–Korthals M, Ferreira J. Predicting outcome in hypoxicischemic brain injury. Ped Clin North Am 2001;3: 671686. [ Links ]
2. Sarta E. La migración neuroblástica: aspectos embriológicos y mecanismos. Neurology 1998;27;156: 242–246. [ Links ]
3. Flores L. Cuadro clínico de los trastornos de la migración neuroblástica. Rev Neurológica 1999; 28;10:990–996. [ Links ]
4. Muñoz A. Control hormonal de los genes implicados en la migración neuronal durante el desarrollo del cerebro. VIII Reunión interdisciplinaria sobre poblaciones de alto riesgo de deficiencias. Recuperado de www.Paidos.rediris.es [ Links ]
5. Kochanek P, Clark R, Ruppel R, et al. Cerebral resuscitation after traumatic brain injury and cardiopulmonary arrest in infants and children in the new millennium. Ped Clin North Am 2001;3:687–710. [ Links ]
6. Lowry O, Passanneau J, Hasselberger F, et al. Effect of ischemia on known substrates and cofactors of the glycolytic pathway in brain. J Biol Chem 1964;239:18–30. [ Links ]
7. Schell R, Kern F, Greeley W, et al. Cerebral blood flow and metabolism during cardiopulmonary bypass. Anesth Analg 1993;76:849–865. [ Links ]
8. Taggart D, Browne S, Halligan P, et al. Is cardiopulmonary bypass still the cause of cognitive dysfunction after cardiac operations? J Thorac Cardiovasc Surg 1999;118:414–421. [ Links ]
9. Watanabe T, Miura M, Orita H, et al. Brain tissue pH, oxygen tension and carbon dioxide tension in profoundly hypothermic cardiopulmonary bypass. J Thorac Cardiovasc Surg 1990; 100:274–280. [ Links ]
10. Brierly J. The influence of brain swelling, age and hypotension, upon the pattern of cerebral damage in hypoxia. Proc of the Fifth International Congress of Neuropathology Zurich: 1965. [ Links ]
11. Aguilar–Rebolledo F. Encefalopatía hipóxico isquémica su manejo y secuelas. 1° Congreso Mundial, 5° Reunión Internacional: Avances en la Restauración del sistema nervioso. México, 2002. [ Links ]
12. Padilla M. Desarrollo, vascularización, neurología y citoarquitectura del cerebro humano. Rev Neurol Clin 2000;1:1–19. [ Links ]
13. Macaya A. Cell death in neonatal hypoxia–ischemia. Rev Neurol 2000; 31: 784–789. [ Links ]
14. Duchovny M, Jayasar P, Levin B. Aberrant neural circuits in malformations of cortical development and focal epilepsy. Rev Neurology 2000; 55: 423–428. [ Links ]
15. Campos J. Manifestaciones epilépticas en las alteraciones de la migración neuronal. Rev Neurología 1999;1:514–519. [ Links ]
16. Schaer M, Glaser B, Bach MC, et al. Congenital heart disease affects local gyrification in 22q11.2 deletion syndrome. Dev Med Child Neurol 2009;51:746–753. [ Links ]
17. Vaquerizo JM, Gómez MH, Rincón RP, et al. Síndrome de Miller–Dieker: aportación con estudio ecográfico cerebral. Rev Neurol 2000;30:48–50. [ Links ]
18. Arriola GP, Verdu AP, Castro DP. Polimicrogiria cerebral y síndrome de deleción 22q11. Rev Neurol 2009;48:188–190. [ Links ]
19. Barkovich AJ, Rolewy H, Bollen A. Correlation of prenatal events with the development of polymicrogiria. AJNR Am J Neuroradiol 1995;16:822–827. [ Links ]
20. Miller SP, McQuillen PS, Hamrick S, et.al. Abnormal brain development in newborns with congenital heart disease. N Engl J Med 2007;357:1928–1938. [ Links ]
21. Van Heertum R, Tikofsky RS. Trivirum Publishing Company 1989. EUA. [ Links ]
22. Brandao L, Cortes R. Espectroscopia de prótons do encéfalo. Revinter Brasil. 2002. [ Links ]
23. Jönsson H, Johnsson P, Backström M, et al. Controversial significance of early S100B levels after cardiac surgery. BMC Neurology 2004;4:4–24. [ Links ]














