Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.80 no.3 Ciudad de México jul./sep. 2010
Investigación clínica
Interpretación de la relación presión–flujo en la hipertensión arterial pulmonar idiopática
Pressure–flow relationships interpretation in idiopathic pulmonary arterial hypertension
Eulo Lupi–Herrera,1 Luis Efren Santos–Martínez,2 Tomás Pulido,2 Julio Sandoval.2
1 Sub–Dirección de Investigación Clínica. Instituto Nacional de Cardiología Ignacio Chávez.
2 Departamento de Cardiopulmonar. Instituto Nacional de Cardiología Ignacio Chávez.
Correspondencia:
Eulo Lupi–Herrera.
Sub–Dirección de Investigación Clínica.
Instituto Nacional de Cardiología
Ignacio Chávez. Juan Badiano N° 1,
Tlalpan, Col Sección XVI,
México D.F., 14080.
Teléfono y fax: +52 555 5732479.
Correo electrónico: eulo.lupi@ cardiología.org.mx
Recibido el 25 de julio de 2008.
Aceptado el 26 de noviembre de 2009.
Resumen
Objetivo: Conocer más de la relación presión arterial pulmonar media/índice cardiaco y sus perfiles en enfermos con hipertensión arterial pulmonar idiopática.
Métodos: La presión arterial pulmonar media/índice cardiaco y la presión extrapolada al eje de cero flujo se obtuvo en 40 enfermos respirando aire ambiente, oxígeno 99.5% e hidralazina. Se obtuvieron dos grupos de acuerdo a criterios de "respuesta vasodilatadora aguda", respondedores (n = 20) y no respondedores (n = 20). Se analizó este criterio versus el propuesto por la Task Force de la Sociedad Europea de Cardiología en la población respondedora.
Resultados: La presión arterial pulmonar media/Índice cardiaco se ubicó de forma anormal en el diagrama de presión–flujo de la cohorte total, (p < 0.01). Sin alteraciones en el intercambio gaseoso o mecánica pulmonar. Para los enfermos respondedores versus no respondedores, la pendiente fue anormal 2.2 (95%IC:1.1–3.3) vs. 5.89 (95%IC:4.69–7.11) mm Hg/L min/m2 e incremento de la presión extrapolada al eje de cero flujo (38.2 ± 7.5 a 66.3 ± 7.5 mm Hg, p < 0.01). Sin diferencias con oxígeno al 99.5%. Con vasodilatador, la presión arterial pulmonar media disminuyó (52.1 ± 9.5 a 40 ± 5.5 mm Hg, p < 0.01) vs. no se modificó (96.2 ± 8.5 vs. 90 ± 7.5 mmHg, p = 0.3), pendiente 1.15 (95%IC:0.68–1.62) vs. 1.28 (95%IC:0.78–1.78) mmHg/Lmin/m2, la presión extrapolada al eje de cero flujo no cambió vs. incrementó (69.4 ± 7.8 a 85.1 ± 8.5 mm Hg, p < 0.01), en relación al control. En no respondedores con vasodilatador, la presión arterial pulmonar media/índice cardiaco (90 ± 7.5 mmHg, pendiente:1.28; 95%IC: 0.78 – 1.78 mm Hg/L min/m2) fue diferente al comparar respondedores con menor o mayor de 40 mm Hg de presión arterial pulmonar media. Presiones 34 ± 3 vs. 45 ± 4 mm Hg y pendientes 1.14 (95%IC: 0.67 –1.61 vs. 2.22 (95%IC: 1.35 – 3.09 mm Hg/L min/m2), respectivamente p < 0.01.
Conclusiones: Las anormalidades de la relación presión arterial pulmonar media/Índice cardiaco reflejan el incremento de las resistencias vasculares pulmonares reales a nivel arteriolar pulmonar en enfermos con hipertensión arterial pulmonar idiopática. Ambos criterios de respuesta vasodilatadora aguda son de utilidad para identificar respondedores y no, en esta población de enfermos.
Palabras clave: Hipertensión arterial pulmonar idiopática; Relación presión–flujo; Prueba de reto vasodilatador agudo; Inhalación de oxígeno; México.
Abstract
Objectives: We analyze exercise–derived mean pulmonary artery pressure/cardiac index relationship to expand the concepts regarding its nature and to better identify "responders" in idiopathic pulmonary arterial hypertension patients.
Methods: Mean pulmonary artery pressure/cardiac index relationship and extrapolated pressure to zero flow were obtained in 40 patients' breathing room air, oxygen 99.5% and hydralazine. The hemodynamic characteristics were analyzed for the cohort and separate for responders (n = 20) and non responders (n = 20) according to the acute response to vasodilator. We tested this previous criteria versus the Task Force on diagnosis and treatment prescribed by the European Society of Cardiology.
Results: The mean pulmonary arterial pressure/cardiac index was located abnormally in the pressure–flow diagram of the total cohort (p < 0.01). No alterations in gas exchange or lung mechanics. For patients responders versus non–responders, the slope was abnormal 2.2 (95% CI:1.1–3.3) vs. 5.89 (95% CI: 4.69 – 7.11), mm Hg/L min/m2 and increased extrapolated pressure to zero flow (38.2 ± 7.5 to 66.3 ± 7.5 mm Hg, p <0.01). Without difference with oxygen 99.5%. With vasodilator effect, mean pulmonary arterial pressure decreased (52.1 ± 9.5 to 40 ± 5.5 mm Hg, p <0.01) versus it did not change (96.2 ± 8.5 versus 90 ± 7.5 mm Hg, p=0.3), slope 1.15 (95% CI: 0.68 – 1.62) vs. 1.28 (95% CI: 0.78–1.78) mmHg/L min/m2, the extrapolated pressure to zero flow did not change (69.4 ± 7.8 to 85.1 ± 8.5 mm Hg), p <0.01, compared to control. In non–responders with vasodilator, mean pulmonary arterial pressure/cardiac index (90 ± 7.5 mmHg, slope: 1.28, 95% CI :0.78 – 1.78 mm Hg/L min/m2) was different between responders < or > 40 mmHg mean pulmonary arterial pressure. Pressures were 34 ± 3 vs. 45 ± 4 mm Hg and slopes 1.14 (95% CI: 0.67 – 1.61) vs. 2.22(95% CI: 1.35 – 3.09) mm Hg/L min/m2, p <0.01, respectively..
Conclusions: Abnormalities of the mean pulmonary arterial pressure/cardiac index relationship exercise–derived seems to reflect "mainly arteriolar" increased lineal pulmonary vascular resistance in idiopathic pulmonary arterial hypertension patients. Both acute vasodilator response criteria are useful to identify responders and not responders in this patient population.
Key words: Idiopathic pulmonary arterial hypertension; Pressure–flow relationships; Acute vasodilating trial; Breathing oxygen; Mexico.
Introducción
Las anormalidades patológicas que distinguen a la Hipertensión Arterial Pulmonar Idiopática (HAP–I) están caracterizadas por el grado y la distribución de la arteriopatía, donde la Presión arterial pulmonar media (PAPm) tiene un significado pronóstico al parecer poco trascendente.1–3 Con la asociación de la PAPm, del gasto cardiaco (GC) y de la resistencia vascular pulmonar (RVP) calculada, en el pasado, se logró establecer el valor clínico y de predicción que tiene el ser o no respondedor a los fármacos vasodilatadores en la HAP–I.4–8 Sin embargo, no es del todo apropiado valerse solo de la cifra de la PAPm o en combinación con el GC para derivar la RVP calculada y poder identificar con ésta a los sujetos con respuesta a fármacos vasodilatadores de entre los enfermos con HAP–I.9–12 Por lo que existen controversias de opinión de la PAPm y de la RVP calculada para utilizarlas como guías para orientar la terapéutica a seguir.
Con estas limitaciones, en la actualidad una respuesta "vasodilatadora positiva" en el reto farmacológico agudo se ha definido: Cuando ocurre una reducción de la PAPm de 10 mm Hg o más, siempre y cuando se alcance un valor absoluto de 40 mm Hg o menos, con o sin modificaciones del GC.8
Este criterio se ha fundamentado de experiencia monocéntrica e información retrospectiva, y de las características hemodinámicas documentadas en enfermos con HAP–I que se han beneficiado con el tratamiento a largo plazo del uso de medicamentos antagonistas de los canales lentos del calcio.13 Criterio que solo se llegó a cumplir a largo plazo en el 6 al 15% de los enfermos con HAP–I.8,13
Los criterios utilizados en el pasado por varios investigadores para considerar una respuesta "vasodilatadora aguda positiva", eran: 1. Disminución de la PAPm ≥ 20% de la cifra control y; 2. Incremento del GC ≥ 20% del basal; y dieron como resultado que 26% a 35% de la población adulta fueran categorizados como respondedores y en niños 41% a 42%.2–5,14–17 Estos criterios, se basaron en cambios porcentuales de la PAPm y del GC (sin existir un punto de corte fisiopatológico tan estricto para la PAPm), resultaron mas flexibles en sus componentes para poder identificar a los sujetos respondedores que los criterios propuestos por Sitbon y colaboradores13 que son los actualmente aceptados por la Task Force on Diagnosis and Treatment de la Sociedad Europea de Cardiología.8
La divergencia de estas cifras pueden arrojar consecuencias clínicas de estratificación erróneas, no solo en los tratamientos (terapias de bajo costo versus de elevada cuantía, simples versus complejos) sino también en las expectativas pronósticas para dicha población. Para conocer la naturaleza de la RVP "lineal", una aproximación mejor a la determinación de la misma se ha fundamentado en la construcción de la relación que resulta de registrar la PAPm y de determinar el índice cardiaco (PAPm/ IC). Esta relación es derivada y obtenida de "observaciones de puntos múltiples" durante la maniobra de efectuar el cambio del estado de reposo al de ejercicio. 18–28 Técnica hemodinámica que de manera muy eventual se ha llevado a cabo en cohortes muy pequeñas con HAP–I;29,30 de aplicarse permitiría analizar con mayor puntualidad la validez de los criterios hasta ahora propuestos para identificar una respuesta positiva aguda a los vasodilatadores.
Con los antecedentes previamente acotados, los objetivos de esta investigación (de naturaleza retrospectiva), fueron: 1. Extender la limitada información e interpretación clínica que existe acerca de la PAPm/IC en enfermos con HAP–I; 2. Si con la obtención de la PAPm/IC es posible identificar de una manera mas puntual a la población de respondedores o nó a la administración de vasodilatadores; y, 3. Si separando a los enfermos con base en los criterios propuestos, el análisis de la PAPm/IC permitirá avalarlos para su uso en la práctica clínica.
Métodos
Los enfermos estudiados pertenecen a la cohorte de sujetos con HAP del departamento de Cardiopulmonar del Instituto Nacional de Cardiología Ignacio Chávez. Diseño de cohorte retrospectiva. Este estudio fue aprobado por la Comisión de Ética Institucional.
Población estudiada: La serie de enfermos analizados (n = 40) fueron seleccionados de un grupo de 138 enfermos que tuvieron el diagnóstico de HAP–I. Todos fueron residentes permanentes de la Ciudad de México (altitud = 2240 metros sobre el nivel medio del mar).
El diagnóstico de HAP–I se basó en los hallazgos clínicos, en los criterios hemodinámicos hoy aceptados y siempre después de haber excluido otras causas que pudieron generar HAP.1,2,8,14
Criterios de inclusión:
1. Pertenecer a los grupos I–II de la clasificación de la NYHA / WHO.
2. Habérseles practicado cateterismo cardiaco derecho en reposo y en ejercicio respirando aire ambiente e inhalando oxígeno al 99.5%; y
4. Que tuvieran reto farmacológico agudo durante el mismo cateterismo.
Estudios de la función pulmonar: La metodología utilizada para las pruebas de función pulmonar, para el análisis de los gases espirados y los de la sangre, así como para los valores normales de la función pulmonar a nuestra altitud han sido objeto y detallados en varias publicaciones previas.31–36
Determinaciones hemodinámicas: La técnica para realizar el cateterismo cardiaco derecho en reposo y durante el ejercicio, han sido publicadas previamente. 2,14 Se registraron las siguientes variables: La PAPm, la Presión capilar pulmonar media (PCPm), enclavada; y la Presión arterial sistémica media (PASm). El GC se determinó por el método de termodilución por triplicado y la cifra comunicada fue el promedio de las mismas.
Reto con oxígeno: La mezcla de O2 al 99.5% se inspiró de una bolsa reservorio rodeada de presión atmosférica y a través de una válvula de alta velocidad y de baja resistencia para el flujo aéreo (unidireccional inspiratoria–espiratoria), durante 15 minutos antes de las determinaciones gasométricas y de las hemodinámicas en reposo y en el ejercicio.
Reto vasodilatador agudo: Previo al inicio del reto vasodilatador, las variables observadas regresaron a valores basales. En todos ellos se usó hidralazina que se infundió en la arteria pulmonar a razón de 0.33 mg/kg de peso corporal durante tres minutos.14
Con base en la respuesta hemodinámica a la administración del vasodilatador, separamos a los enfermos en dos grupos: respondedores (n = 20) y no respondedores (n = 20). El criterio para una respuesta "vasodilatadora positiva aguda", incluyó: 1. Disminución de la PAPm ≥ 20% de la cifra control, y 2. Incremento del GC ≥ 20% del basal.2,14
Protocolo de estudio: Se menciona brevemente la maniobra para el estudio. Antes de realizar el procedimiento hemodinámico a todos los enfermos se les familiarizó con la técnica del ejercicio. Después de haber alcanzado el estado de equilibrio (definido como: frecuencia cardiaca FC, GC, PAPm y PASm constantes por 10 minutos), se registraron los parámetros hemodinámicos, se colectaron los gases espirados y las muestras de la sangre. Las presiones consignadas fueron el resultado del promedio obtenido por lo menos durante "tres ciclos respiratorios" (mediciones de reposo).
El periodo de colección para las muestras del ejercicio se inició en el momento en el que el enfermo mediante una señal preestablecida sintió disnea o fatiga. El periodo de colección nunca fue menor a un minuto (máximo de tres). Es de enfatizarse que el ejercicio en su nivel alcanzado fue tan selecto que siempre el grado de disnea o el de fatiga no fue más allá de poder ser catalogado de moderado (mediciones de ejercicio).
Después de 15 minutos de encontrarse el enfermo en estado de equilibrio entre cada una de las partes del protocolo, las determinaciones se efectuaron en las situaciones siguientes: 1. Pedaleando en la posición de decúbito supino, por lo menos durante cinco minutos (carga aproximada de trabajo de 35 a 40W), respirando aire ambiente; 2. Inhalando O2 al 99.5% y; 3. Respirando aire ambiente en reposo y en ejercicio durante la acción del medicamento vasodilatador.
Análisis de los datos: Se analizaron las características clínicas y de la función pulmonar para toda la población y de manera separada para la cohorte de acuerdo al criterio de ser respondedor o no. Los resultados hemodinámicos consignados de cada una de las maniobras de reposo–ejercicio representan el promedio de "tres registros" con menos de 10% de variación en cada una de ellas.
De manera separada se analizó la PAPm/IC obtenida para ambas poblaciones considerada como respondedora o no:
1. En condición de control (mediciones de reposo a las alcanzadas en el ejercicio) vs. la documentada para los normales.
2. La PAPm/IC respirando aire ambiente versus inhalando O2 al 99.5%.
3. La PAPm/IC control vs. bajo la influencia del vasodilatador.
4. Se analizó la PAPm/IC aplicando el criterio de "respuesta positiva aguda" usada en este estudio versus el sugerido por la Task Force on Diagnosis and Treatment de la Sociedad Europea de Cardiología.8
El diagrama de la PAPm/IC: La coordenada generada del estado de reposo al de ejercicio de la PAPm/IC (consecuencia de puntos múltiples de ésta) fue valorada por análisis de regresión lineal.38 La pendiente obtenida se consideró como se ha promulgado a ser igual a la "RVP verdadera".10 La PAPm/IC–95%IC se analizó para cada cohorte (n = 20 respectivamente). Por lo tanto, cada representación gráfica presentada de la relación PAPm/IC corresponde "por lo menos" el haber documentado 50 a 60 veces para cada cohorte los parámetros señalados; ya que el GC se determinó en cada sujeto por triplicado y las presiones vasculares asentadas de forma individual son el promedio de las registradas por lo menos en tres ciclos respiratorios en cada una de las etapas del protocolo analizado. En consecuencia, el documentar de esta manera cada uno de los parámetros, nos dio un número suficiente de mediciones para hacer representativa nuestra unidad muestral para cada situación de las etapas del protocolo en la que se analizó la PAPm/IC y en particular, 95%IC.
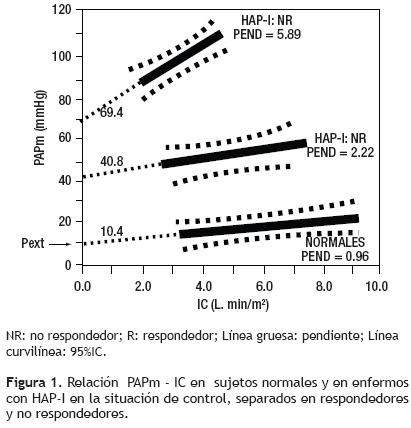
Los siguientes pasos se siguieron para construir y para graficar la relación presión–flujo, así como para ubicar la presión extrapolada al eje de cero flujo (Pext [b0]) en el eje de presión a cero flujo en cada cohorte: 1. El promedio de la PAPm ± 1desviación estándar (DE) obtenido de la maniobra reposo–ejercicio se ubicó en el diagrama de presión–flujo. 2. La pendiente (PEND) fue trazada. 3. La presión extrapolada al eje de cero flujo (Pext) se sitúo en el eje de presión a cero flujo (b0) 4. El IC ± 1DE se sobremarcó en la pendiente (línea sólida) y; 5. Los 95% IC se delinearon para cada PAPm/IC obtenida (punteado curvilíneo fino).
Su interpretación: Los resultados de los multipuntos de la PAPm/IC obtenidos para cada cohorte en la condición de control, se compararon con la de los sujetos sanos. Si la PAPm/IC–95%IC se situó fuera de la encontrada para la descrita en los normales, se consideró que existía incremento de la RVP lineal. Para considerarla diferente entre las cohortes estudiadas o entre una misma población bajo las condiciones diferentes de estudio, la PAPm/IC–95%IC debería estar ubicada estadísticamente de manera distinta de la considerada como la de control. El valor de la pendiente–95%IC se consideró desigual si ésta era estadísticamente diferente con la comparada. La Pext se consideró anormal para cifras de > 11 mm Hg10,12,18,22,28 y no similares si Pext ± 1DE era diferente en relación a la evaluada.
Se consideraron fenómenos de vasomoción para cada cohorte si existió: Para la PAPm/IC–95%IC una disminución o un incremento (de vasodilatación o de vasoconstricción, respectivamente) estadísticamente significativo como resultado del reto aplicado (oxígeno, vasodilatador) en relación con la obtenida para la situación de control (por ejemplo: sí entre la PAPm/IC–95%IC construida respirando aire ambiente y la obtenida respirando O2 no existía sobreposición).
Estadística: Los datos se presentan como valores medios ± 1DE, o con mediana (mínimo – máximo) de acuerdo a su distribución muestral. Para la comparación de variables independientes y dependientes con distribución normal se empleó la prueba t de Student para muestras independientes o dependientes (pareadas). La prueba U de Mann–Witney para muestras independientes y distribución anormal. La prueba Ji cuadrada o la exacta de Fisher se utilizó para establecer la asociación de variables discontinuas. ANOVA de una vía fue empleada para comparar las condiciones controles con aquellas documentadas en los retos respectivos. La prueba de Bonferroni se aplicó para las comparaciones múltiples. Valores de p < 0.05 fueron considerados con significación estadística. Se utilizó el programa estadístico SPSS–13.
Resultados
Características clínicas: No se observaron diferencias en cuanto a la edad, distribución por género, peso y área de superficie corporal entre ambas cohortes. La duración estimada de los síntomas fue más corta para los respondedores al compararse con el grupo no respondedor. De acuerdo a la clasificación funcional de la NYHA/WHO, hubo más enfermos en clase funcional II que en la I (Tabla 1).

Pruebas de función pulmonar e intercambio gaseoso en reposo y en ejercicio: En todos los enfermos se documentaron pruebas de función pulmonar normales con la excepción de ligera disminución del volumen espiratorio forzado entre el 25 y 75% de la capacidad vital (VEF25–75%). Todos tuvieron en el reposo hipoxemia ligera (PaO2 < 67 ± 2.5 mm Hg) la que permaneció sin cambio durante el ejercicio y no se asoció con disminución de la Saturación de oxígeno venosa mezclada (SvO2) Tabla 2.
Datos hemodinámicos y del intercambio gaseoso en reposo y ejercicio
1. Respirando aire ambiente: Los valores de PAPm documentados en el reposo para los enfermos respondedores (n = 20) vs. los no respondedores (n = 20) fueron diferentes (p = 0.001). Durante el ejercicio en ambas cohortes se triplicó el VO2 sin haber diferencias entre ambos picos máximos (p = 0.2).
La PAPm se incrementó 18.7 ± 9 y 13.6 ± 12 mm Hg durante el ejercicio para los enfermos respondedores y para aquellos no respondedores, respectivamente, p = 0.01.
El IC se incrementó significativamente con el ejercicio para la población respondedora (± 64%, p < 0.01) sin existir modificaciones significativas para la cohorte no respondedora (± 18%, p = 0.32). La PCPm se acrecentó para ambos grupos sin existir diferencias entre ellas y siendo el nivel de presión máximo alcanzado < 15 mm Hg en ambas cohortes (Tabla 2).
2. Inhalando oxígeno al 99.5%: Para ambas cohortes después de estar 15 minutos inspirando la mezcla de oxígeno en reposo, no se observaron cambios significativos de la PAPm, IC y de la PAPd–PCPm. Disminución de la FC basal de reposo al ser comparadas con los valores documentados respirando aire ambiente (Tablas 2 y 3). Situaciones hemodinámicas que se asociaron al incremento significativo de la PaO2 y la saturación de oxígeno venosa mezclada (SaO2) cuando se compararon con las observadas respirando aire ambiente.
Para el grupo de respondedores durante el ejercicio se incrementaron significativamente la PAPm, el IC, PCPm, la PAPd–PCPm y la FC. Para el grupo no respondedor acontecieron los mismos cambios, con la excepción que el IC no se modificó (± 12%, p = 0.4). Los niveles pico alcanzados para la PAPm y para el IC no fueron diferentes respirando aire ambiente y oxígeno al 99.5% (p = 0.23, p = 0.14, respectivamente), (Tablas 2 y 3).
3. Bajo la acción del vasodilatador no selectivo: Para los respondedores bajo la influencia del medicamento en el reposo se observó decremento significativo de la PAPm (–26%, p < 0.001) e incremento del IC (± 59%, p < 0.001), FC (± 42%, p < 0.001) y del Consumo de oxígeno (VO2) (± 25%, p < 0.001) con respecto a los documentados en la misma condición sin la acción de éste fármaco. Para la cohorte no respondedora no hubo modificación significativa de la PAPm, IC, FC y del VO2 con los documentados en el reposo sin la acción del vasodilatador.
Para el grupo respondedor durante el ejercicio y bajo la acción del medicamento la PAPm (± 44%, p < 0.007) y el IC (± 46%, p < 0.001) se acrecentaron. Para la población no respondedora se documentó incremento de la PAPm (± 14%, p = 0.05) y del IC (± 14%, p = 0.05). Para ambas cohortes, hubo incremento significativo de la FC y del VO2 Sin modificaciones de la PCPm y del intercambio gaseoso con el ejercicio (Tabla 4).
Resultados del análisis de la PAPm/IC
1. Respirando aire ambiente: Los valores documentados para la PAPm/IC en la población normal referidos se anotan en la Tabla 5. Para ambas poblaciones de enfermos respondedores y no respondedores la PAPm fue anormal comparada con la de los sujetos normales, y con diferencias para el IC para los no respondedores. El valor de la pendiente estuvo incrementado en todos los enfermos comparada con la de los sujetos normales. Hubo diferencia entre la pendiente documentada entre respondedores y no respondedores (Figura 1). La ubicación en el diagrama de presión–flujo de la PAPm/IC para ambas poblaciones fue diferente de la normal (p < 0.001) y guardando diferencias entre estas dos cohortes, ya que no existió sobreposición de las PAPm/ IC 95%IC, lo que indica disimilitud en las RVP lineales. Las Pext fueron anormales e incrementadas en las dos poblaciones, pero el aumento fue diferente (Tabla 5, Figura 1).
2. Inhalando O2 al 99.5%: Al comparar las PAPm de los grupos control vs. las observadas respirando O2 no se documentaron cambios significativos de la misma para la población respondedora ni para la no respondedora. Tampoco hubo diferencias para los IC, ni para las pendientes. En relación a la ubicación en el diagrama de presión–flujo para la PAPm/IC y para Pext no hubo cambios (Tabla 5, Figura 2).
3. Efectos del vasodilatador no selectivo: Para la cohorte respondedora los valores de la PAPm, IC, de las pendientes y la ubicación de la PAPm/IC fueron diferentes con respecto al control, más no de la Pext bajo el efecto del vasodilatador. Para la población no respondedora, se observó en relación al estado de control sin cambios significativos en la PAPm y en el IC, más sí de la pendiente y en Pext lo que no se vio asociado con un descenso significativo en la ubicación de la PAPm/IC 95% IC en el diagrama de presión–flujo durante el reto con el vasodilatador (Tabla 4, Figura 3). El análisis de la PAPm/IC 95% IC en enfermos no respondedores, al compararlas sin la influencia y bajo la acción del vasodilatador, demuestra ausencia de vasomoción pulmonar. Nótese que existe cruce de ambas relaciones presión–flujo aunque con cambio en la PEND. Para el grupo respondedor bajo la influencia de la hidralazina hubo disminución significativa de la PAPm/IC 95% IC (no sobreposición entre la condición control y bajo la acción del vasodilatador) lo que estuvo asociado a un descenso en el valor absoluto de la PEND. Observaciones hemodinámicas que permiten asegurar que existió disminución de la RVP lineal o verdadera (vasodilatación) (Figura 3).
4. Análisis de la relación presión–flujo versus los criterios para ser respondedor usando el punto de corte en < o > a 40 mm Hg de PAPm.8,13 Al comparar los enfermos respondedores con más o menos 40 mm Hg de PAPm se encontraron solo diferencias para las cifras de PAPm y para la inclinación de la pendiente, siendo ésta menos empinada para aquellos con PAPm < 40 mm Hg (Tabla 6). Sin embargo, ambas cohortes guardaron diferencias significativas al ser comparados con el grupo no respondedor (Figura 4).
Discusión
De acuerdo con los criterios de "normalidad" emitidos para la PAPm/IC,10 podemos consignar que para los enfermos con HAP–I que tengan en el reposo PAPm de ≥ 20 y que se acreciente a ≥ 30 mm Hg en el ejercicio, la ubicación de la relación presión–flujo será anormal. Sin embargo, es relevante señalar que esto se expresará tanto en el valor de la PEND y de Pext, a diferencia de lo que se ha documentado en otras patologías que afectan de manera primordial el parénquima pulmonar, el árbol bronquial10,12 y no de manera preferente las estructuras arteriolares de este órgano. La importancia de esta observación hemodinámica radica, en que en sujetos con enfisema pulmonar y con estenosis mitral moderada estando la PAPm incrementada las "pendientes" pueden tener valores absolutos normales.10,12
La hipótesis hemodinámica: Se ha señalado que en la HAP (estando la presión de la aurícula izquierda o la PCPm normal), la elevación de la PAPm puede ser el resultado del incremento de la presión crítica de cierre (Pext) o de un aumento en la RVP verdadera (ejemplificada por aumento absoluto en el valor de la PEND) o de ambas.10 Dependiendo de cual de los dos mecanismos "predomine", habrá una respuesta diferente de la PAPm frente a los incrementos del GC. Si la PAPm está elevada como consecuencia del incremento de la PCC, el flujo pulmonar se podrá incrementar el doble sin producir cambios mayores en la PAPm en relación a la cifra de control. En cambio, si la HAP es producto solo del aumento de la RVP real (es decir, de la pendiente), los incrementos del flujo pulmonar se traducirán en elevaciones significativas de la PAPm en relación con la documentada en la situación basal.10 En los enfermos con HAP–I estudiados, respondedores o no se obtuvieron pendientes y valores de Pext anormales. A mayor PCC la pendiente fue más anormal (caso de los no respondedores), lo contrario aconteció para los respondedores. Al confrontar la hipótesis hemodinámica en el escenario de la HAP–I, estando elevada la PCC frente a incrementos del GC, la PAPm no debió haberse incrementado o hacerlo de manera poco significativa. Sin embargo, la PAPm sí se acrecentó e inclusive fue mayor para aquellos enfermos con la Pext mas elevada. Sí la hipótesis propuesta ha resultado viable para otras entidades pulmonares que cursan con hipertensión pulmonar,10 para ésta patología analizada en particular no lo parece, concepto que se fundamenta en nuestras observaciones hemodinámicas colectadas para la PAPm/IC y para Pext.
Se ha señalado que cuando existe HAP asociada a una pérdida extensa del lecho arterio–arteriolar del pulmón se podría predecir que la RVP "verdadera", es decir la PEND, se deberá encontrar acrecentada.10 Comentario que en su naturaleza anatómico–funcional sí parece sostenerse al analizar nuestros resultados para los enfermos con HAP–I, donde las alteraciones de la función pulmonar se pueden considerar ausentes o tal vez ser mínimas.34 Estas observaciones nos llevan a hacer consideraciones acerca de la interpretación clínica–hemodinámica que le debemos de dar en la actualidad a la PAPm/IC en ésta entidad y que a continuación trataremos de analizar.
La interpretación de la PAPmlIC: De acuerdo con las observaciones hechas acerca del análisis del intercambio gaseoso en reposo y en ejercicio, con fundamento en las pruebas de función pulmonar y los conocidos de la histopatología, los resultados anormales de la PAPm/IC no pueden atribuirse a aspectos de naturaleza funcional (hipoxia alveolar, mecánica pulmonar); mas sí a la influencia de las anormalidades asentadas en la periferia de los vasos arteriales o arteriolares en la HAP–I.39–44 En vista de que la población estudiada radica en una altitud moderada (2240 metros sobre el nivel del mar) podría existir siempre la interrogante del papel de la hipoxia alveolar en la génesis de la vasoconstricción pulmonar. Sin embargo, para toda la población de enfermos con HAP–I al analizar el comportamiento de la PAPm/IC (en su ubicación o en su PEND) y de Pext (en sus valores documentados) no se demostraron diferencias significativas entre la situación control y los obtenidos bajo la inhalación de O2 al 99.5%; lo que excluye razonablemente el papel de la hipoxia alveolar en la génesis de la hipertensión pulmonar a nuestra altitud en la población con HAP–I, como ya ha sido publicado en el pasado.2,14 Tampoco pueden ser atribuidas a fuerzas externas a los vasos, al proceso de remodelación no vascular, así como al efecto del ejercicio en donde se induce vasoconstricción mediada por la disminución de la SvO2, mas no es factible excluir las que pueden ser producto de la activación del sistema nervioso simpático.39–42 Además, de acuerdo con los estudios hemodinámicos (donde en cierta parte de la población se ha demostrado vasoreactividad) y en los histológicos publicados los grados de daño en las arteriolas musculares pequeñas han demostrado que estas sí son primordialmente la causa de la HAP en la HAP–I.43,44 Por lo tanto, no parece difícil mencionar que en éste escenario de la HAP–I al analizar la PAPm/IC (en su ubicación o en la PEND) es que estamos de manera preferente refiriéndonos a la RVP "real o verdadera".
Al confrontar nuestros valores absolutos documentados para la pendiente con los comunicados por otros investigadores no resultan concordantes.29,30 Castelain y colaboradores,29 en siete enfermos con HAP–I cuya PAPm era de 56.3 ± 5.1 mm Hg han encontrado en la condición basal pendientes de 18.2 mm Hg L min/m2. Valores muy parecidos también han sido documentados en esta patología por Kafi y colaboradores,30 en 11 enfermos estando la PAPm en 52 ± 3 mm Hg, siendo el valor de la PEND de 15 mm Hg L min/m2. Para los valores absolutos de las pendientes comunicadas se pueden desprender los siguientes comentarios. En primer lugar, los valores de las pendientes fueron entre 11 y 13 veces más de las cifras que se han documentado en sujetos normales por otros investigadores.10,45 Aspecto que llama poderosamente la atención, ya que estando la circulación pulmonar funcionando a niveles "casi o sistémicos" se esperaría que las resistencias se equipararan, lo que daría un incremento de cinco o seis veces más de lo normal. Nótese que para ambas experiencias comunicadas la PAPm estaba entre 30 mm Hg a 40 mm Hg por debajo de la presión arterial sistémica media. En la investigación actual para los no respondedores teniendo PAPm de 96 ± 8.5 mm Hg las cifras de la PEND fueron de 5.89 (95% IC: 4.69–7.11 L min/m2) y para los respondedores estando la PAPm en 52.1 ± 9.5 mm Hg de 2.22 (95% IC: 1.22–3.2 L min/m2). Si bien la discrepancia de estos valores pudiera deberse a la forma metodológica estadística de analizar los datos, lo que puede llevar ha obtener esos valores absolutos tan diferentes.38 Sin embargo, pensamos que las cifras absolutas obtenidas por nosotros para las pendientes, es del todo fisiopatológico congruente con lo conocido en cuanto al incremento de cinco o seis veces más de las RVP en el caso de los no respondedores y que es lo que se esperaría cuando las cifras de PAPm y la presión arterial sistémica media se equiparan o están en estrecha relación en cuanto a sus niveles.1,2,4,14
Interpretación y limitaciones de los valores de Pext: De acuerdo con los conceptos actuales, se asume que Pext (P0) equivaldría a la presión crítica de cierre promedio de los vasos pulmonares9,10,12,23–28 y cuyo efecto sólo se ejercería a la salida del sistema circulatorio pulmonar como presión relevante cuando ésta fuera superior a la PCPm o a la de la aurícula izquierda.10,12,23,25 En los enfermos estudiados pudo ser éste el caso para toda la población (donde la PCPm siempre fue menor que la Pext). Sin embargo, debemos señalar con toda claridad que la interpretación puntual para Pext luce muy compleja a partir de la PAPm/ IC por las razones siguientes. 1. Es una presión derivada y por ende extrapolada . 2. Dependerá en parte, del nivel en el que se sitúa el promedio de la PAPm, y 3. En especial del valor absoluto de la PEND (en lo mayor o en lo menor de su inclinación). Los valores de Pext sólo se podrían analizar en toda su puntualidad de haberse llegado a "construir la porción curvilínea de la relación de presión–flujo a bajos rangos de la misma", aspecto metodológico que no se aplicó en la población estudiada.10,12 Hechas estas aclaraciones de las limitaciones que tiene Pext, los valores encontrados para la misma solo pueden tal vez sugerir: que para la patología analizada en donde Pext fue anormal insinúa que posiblemente exista incremento en el promedio de la Presión crítica de cierre (PCC). Más con énfasis señalamos, que no necesariamente corresponde a la "PCC promedio absoluta real".
Consideraciones acerca de los criterios hemodinámicos para identificar en el reto agudo "respondedores": Con base en la información derivada del análisis de la PAPm/IC, utilizando el criterio propuesto en éste estudio es factible identificar la población respondedora que existe entre los enfermos con HAP–I. Más también lo es de aplicarse el juicio promulgado por la Task Force de la Sociedad Europea de Cardiología.8 Se demostró que para aquellos que tienen la PAPm < 40 mm Hg bajo la influencia del vasodilatador no selectivo se caracterizan por estar ubicados en el diagrama de presión– flujo por debajo de aquellos cuya PAPm finalmente es de > 40 mm Hg y que el valor absoluto de la PEND y el de Pext es menor. Sin embargo, de haberse aplicado el criterio de la Task Force de la Sociedad Europea de Cardiología8 sólo 8/20 se hubieran considerado como respondedores, siendo en realidad 20 enfermos con esta característica hemodinámica, lo que pudiera tener aplicaciones tanto para la terapéutica como al parecer para el pronóstico. El análisis estadístico comparativo de las PAPm/IC de los no vs. los sí respondedores avalan la opinión antes asentada. Sin embargo, por el número tan reducido de enfermos analizados no es factible señalar cuál es el mejor.
Limitaciones del estudio: En primer término es un análisis retrospectivo y que de acuerdo a la metodología empleada para el análisis de la relación presión–flujo, queda claro que solo se pudo abordar en su estudio la porción linear de las RVP en los rangos clínicos de estos parámetros y por ende el segmento curvilíneo no se exploró con los métodos conocidos a flujos bajos.12,46–50 También, que los resultados solo se pueden aplicar a enfermos con la patología analizada en las clases I–II de la NYHA/WHO. Por las características naturales del protocolo aplicado debemos de aceptar que si bien se incrementa el flujo pulmonar, también se afectan y se inducen los fenómenos de vasoconstricción pulmonar con el ejercicio lo que puede tal vez dar origen a pendientes espurias en algunos enfermos.51–53 Sin embargo, si estos factores se toman siempre en la consideración debida al obtener la PAPm/ IC, ésta nos permitirá conocer mejor el significado de la RVP lineal y por consiguiente su interpretación en el espectro clínico de los enfermos con HAP–I.
Por otro lado, estamos perfectamente concientes que hoy día no es la hidralazina el fármaco ideal para efectuar ensayos vasodilatadores agudos (que en ese marco del tiempo histórico en el que se estudiaron a estos enfermos fue la aplicada, dado que la adenosina es el medicamento que se ha empleado de rutina en las últimas dos décadas en el departamento de Cardiopulmonary15,16 La hidralazina fue utilizada por sus características farmacodinámicas en ese entonces, que lo hicieron apropiado para este tipo de ensayo del análisis de la relación presión–flujo, ya que incrementa el GC sin causar trastorno ventilatorio–perfusorio, lo que es compensado mediante un incremento de la SvO2 y sin habérsele demostrado efectos adversos mayores circulatorios en experiencias de otros y de nosotros.5,14,37 En la actualidad, la adenosina, el óxido nítrico y los bloqueadores de la endotelina son los medicamentos vasodilatadores de elección para analizar los retos agudos en la HAP–I. Más la información hemodinámica obtenida de esta población no es despreciable y que sí resulta de valía para poder entender e interpretar mejor la naturaleza PAPm/IC en la HAP–I.
Conclusiones
Las anormalidades de la PAPm/IC reflejan "casi exclusivamente" un incremento en las RVP reales asentadas en las pequeñas arterias musculares y/o en las arteriolas de sujetos con HAP–I. La hidralazina fue útil para diferenciar el comportamiento hemodinámico, entender mejor el significado y el análisis de la PAPm/IC–95%IC de los enfermos respondedores y de los no respondedores con ésta enfermedad. Un criterio menos rígido (sin incluir de manera tácita el punto de corte de 40 mm Hg para la PAPm) también permitió seleccionar a los enfermos en respondedores y no respondedores.
Referencias
1. D'Alonzo GE, Barst RJ, Ayres SM, et al. Survival in patients with primary pulmonary hypertension: Results from a national prospective registry. Ann Intern Med 1991;115:343–349. [ Links ]
2. Sandoval J, Bauerle O, Palomar A, et al. Survival in primary pulmonary hypertension: validation of a prognostic equation. Circulation1994;89:1733–1744. [ Links ]
3. Rich S, Levy PS. Characteristics of surviving and no surviving patients with primary pulmonary hypertension. Am J Med 1984;76:573–578. [ Links ]
4. Rich S, Kaufmann E, Levy PS. The effect of high doses of calcium–channel blockers on survival in primary pulmonary hypertension. N Eng J Med 1992;327:76–81. [ Links ]
5. Weir EK, Rubin LJ, Ayres SM, et al. The acute administration of vasodilators in Primary Pulmonary Hypertension. Experience from the National Institutes of Health Registry on primary pulmonary hypertension. Am Rev Respir Dis 1989;140:1623–1630. [ Links ]
6. Rich S, Martínez J, Lam W, et al. Reassessment of the effects of vasodilator drugs in primary pulmonary hypertension: Guidelines for determining a pulmonary vasodilator response. Am Heart J 1983;105:119–127. [ Links ]
7. Galie N , Ussia G, Passarelli P, et al. Role of pharmacologic tests in the treatment of primary pulmonary hypertension. Am J Cardiol 1995;75:55A–62A. [ Links ]
8. Guidelines on diagnosis and treatment of pulmonary arterial hypertension. The Task Force on diagnosis and treatment of pulmonary arterial hypertension of the European Society of Cardiology. Eur Heart J 2004;25:2243–2278. [ Links ]
9. Versprille A. Pulmonary vascular resistance. A meaningless variable. Intensive Care Med 1984;10:51–53 . [ Links ]
10. McGregor M, Sniderman A. On pulmonary vascular resistance: the need for a more precise definition. Am J Cardiol 1985;55:217 – 221. [ Links ]
11. Naeije R. Pulmonary vascular resistance. A meaningless variable? Intensive Care Med 2003;29:526 –529. [ Links ]
12. Lupi HE, Sandoval ZJ, Gaspar HJ, et al: La resistencia vascular pulmonar "calculada". Un parámetro incierto para la valoración de la circulación pulmonar. Los métodos actuales para determinarla. Arch Cardiol Méx 2008;78:95–113. [ Links ]
13. Sitbon O, Humbert M, Jáis X, et al: Long–term response to calcium channel blockers in Idiopathic Pulmonary Arterial Hypertension. Circulation 2005;111:3105–3111. [ Links ]
14. Lupi HE, Sandoval JZ, Seoane M, et al. The role of hydralazine therapy for pulmonary artery hypertension of unknown cause. Circulation 1982;65:645–650. [ Links ]
15. Schrader BJ, Inbar S, Kaufmann L, et al. Comparison of the effects of adenosine and nifedipine in pulmonary hypertension. J Am Coll Cardiol 1992;19:1060–1064. [ Links ]
16. Sandoval J, Pulido T, Suarez J, et al. Adenosine as a predictor of the hemodynamic response to nifedipine in Primary Pulmonary Hypertension. Am J Respir Crit Care Med 1997;155:A443. [ Links ]
17. Yung D, Widlitz AC, Rosenzweig EB, et al. Outcomes in children with idiopathic pulmonary arterial hypertension. Circulation 2004;110:660–665. [ Links ]
18. Harris P, Segel N, Bishop JM. The relationship between pressure and flow in the pulmonary circulation in normal subjects and in patients with chronic bronchitis and mitral stenosis. Cardiovasc Res 1968;2:73–83. [ Links ]
19. Charms BL, Brofman BL, Eldeer JC, et al. Unilateral pulmonary artery occlusion in man II. Studies in patients with chronic pulmonary disease. J Thorac Surg 1958;35:316–331. [ Links ]
20. Charms BL, Brofman BL, Kohn PM. Pulmonary resistance in acquired heart disease. Circulation 1959;20:850– 855. [ Links ]
21. Janicki JS, Weber KT, Likoff MJ, et al. The pressure–flow response of the pulmonary circulation in patients with heart failure and pulmonary vascular disease. Circulation 1985;72:1270–1278. [ Links ]
22. Lupi HE, Furuya MYME, Sandoval J, et al. La conductancia vascular y la presión crítica de cierre en el lóbulo canino aislado in situ. Su historia natural. Arch Inst Cardiol Méx 1988;58:395–407. [ Links ]
23. Permutt S, Bromberger–Barnea B, Bane HN. Alveolar pressure, pulmonary venous pressure and vascular waterfall. Med Thorac 1962;19:239–260. [ Links ]
24. Permutt S, Howell JBL, Proctor DF, et al. Effect of lung inflation on static pressure–volume characteristics of pulmonary blood vessels. J Appl Physiol 1961;16:64–70. [ Links ]
25. Permutt S, Riley RL. Hemodynamics of collapsible vessels with tone: the vascular waterfall. J Appl Physiol 1963;18:924–932. [ Links ]
26. Graham R, Skoog C, Oppenheimer L, et al. Critical closure in the canine pulmonary vasculature. Circ Res 1982;50:566–572. [ Links ]
27. López–Muñiz R, Stephens NL, Bromberger– Barnes B, et al. Critical closure of pulmonary vessels analyzed in terms of Starling resistor model. J Appl Physiol 1968;24:625–635. [ Links ]
28. Lupi HE, Furuya MYME, Sandoval J, et al. Effect of hydralazine on vascular mechanics in a canine lobar preparation of pulmonary embolism. Lung 1992;170:291–309. [ Links ]
29. Castelain V, Chemla D, Humbert M, et al. Pulmonary artery pressure – flow relations after prostacyclin in primary pulmonary hypertension . Am J Respir Crit Care Med 2002;165:338–340 . [ Links ]
30. Kafi SA , Mélot C , Vachiéry JL, et al. Partitioning of pulmonary vascular resistance in primary pulmonary hypertension . J Am Coll Cardiol 1998;31:1372–1376. [ Links ]
31. Lupi HE, Seoane M, Verdejo J, et al. Hemodynamic Effect of Hydralazine in Interstitial Lung Disease Patients with Cor Pulmonale. Chest 1985;86:564–573. [ Links ]
32. Lupi HE, Sandoval J, Bialostozky D, et al. Extrinsic Allergic Alveolitis Caused by Pigeon Breeding at a High Altitude (2,240 meters). Hemodynamic Behavior of the Pulmonary Circulation. Am Rev Respir Dis 1981;124:602–607. [ Links ]
33. Lupi HE, Sandoval J, Seoane M, et al. Behavior of the Pulmonary Circulation in Chronic Obstructive Pulmonary Disease. Pathogenesis of Pulmonary Arterial Hypertension at an altitude of 2,240 meters. Am Rev Respir Dis 1982;126:509–514. [ Links ]
34. Fernández–Bonetti P, Lupi HE, Martínez–Guerra ML, et al. Peripheral airways obstruction in idiopathic pulmonary artery hypertension (Primary). Chest 1983;83:732–738. [ Links ]
35. Comroe JH, Forster RE, DuBois AB, et al. The lung. 2nd ed. Chicago: Year Book Medical Publishers, Inc., 1962:329,335,339. [ Links ]
36. Baldwin E, Cournand A, Richards DW: Pulmonary insufficiency I. Physiologic classification, clinical methods of analysis, standard values in normal subjects. Medicine 1948;27:243–278. [ Links ]
37. Lang IM. Management of acute and chronic RV dysfunction. Eur H J 2007; 9:H61– H67. [ Links ]
38. Campbell RC. Associated normal variables. En Statistics for Biologist. Cambridge University Pres; London, Great Britain. 1967. pp. 195–214. [ Links ]
39. Reeves JT, Dempsey JA, Grover RF: Pulmonary circulation during exercise. En: Weir EK, Reeves JT, eds. Pulmonary vascular physiology and Pathophysiology. Chapter 4. New York: Marcel Dekker; 1989.pp.107–133. [ Links ]
40. Fishman AP. Pulmonary Circulation. En: Handbook of Physiology. The Respiratory System. Circulation and Nonrespiratory Functions. Section 3, Vol.1 Bethesda (AMD); American Physiological Society,1985.pp 93–166. [ Links ]
41. Sandoval J, Long GR, Skoog C, et al. Independent influence of blood flow rate and mixed venous PO2 on shunt fraction. J Appl Physiol 1983; 55:1128–1133. [ Links ]
42. Sandoval J, Lopez R, Beltrán U, et al. Effect of hydralazine on intrapulmonary shunt. Crit Care Med 1986;14:689–692. [ Links ]
43. Pietra GG: The pathology of pulmonary hypertension. En Robin LJ, Rich S,Eds. Primary Pulmonary Hypertension. New York: Marcel Dekker,1997:19–61. [ Links ]
44. Palevsky HI, Schloo B, Pietra GG, et al. A potential new role for open lung biopsies in the evaluation of unexplained pulmonary hypertension. Am Rev Respir Dis 1985;131:A401. [ Links ]
45. Reeves JT, Dempsey JA, Grover RF: Pulmonary circulation during exercise. En: Weir EK, Reeves JT, Eds. Pulmonary vascular physiology and Pathophysiology. Chapter 4. New York: Marcel Dekker; 1989. pp.107–133. [ Links ]
46. Hakim TS, Michel RP, Chang HK. Partitioning of pulmonary vascular resistance in dogs by arterial and venous occlusion. J Appl Physiol: Respirat Environ Exercise Physiol 1982 52:710–715. [ Links ]
47. Zidulka A, Hakim TS. Wedge pressure in large vs. small pulmonary arteries to detect pulmonary venoconstriction. J Appl Physiol 1985; 59: 1329–1332. [ Links ]
48. Teboul JL, Andrivet P, Ansquer M, et al. Bedside evaluation of the resistance of large and medium pulmonary veins in various lung diseases. J Appl Physiol 1992;72:998–1003. [ Links ]
49. Fesler P , Pagnamenta A, Vachiéry JL, et al. Single arterial occlusion to locate resistance in patients with pulmonary hypertension. Eur Respir J 2003;21:31–36. [ Links ]
50. Lupi HE, Furuya MYME, Quesada A, et al. Efecto de la presión del segmento venoso sobre la presión crítica de cierre en el lóbulo canino aislado in situ. Arch Inst Cardiol Méx 1990;60:121–127. [ Links ]
51. Huez S, Naeije R. Exercise stress tests for detection and evaluation of pulmonary hypertension. Eur Heart J 2007;9:H17–H21. [ Links ]
52. Brimioulle S, Maggiorini M, Stephanazzi J, et al. Effects of low flow on pulmonary vascular flow–pressure curves and pulmonary vascular impedance. Cardiovasc Res 1999;42:183–192. [ Links ]
53. Lupi HE, Furuya MYME, Ramírez JC, et al. Efecto de la dopamina en la mecánica vascular pulmonar. Su estudio en un modelo canino de lóbulo aislado y embolizado con gelfoam. Arch Inst Cardiol Méx 1990;60:341–345. [ Links ]