Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.79 supl.2 Ciudad de México dic. 2009
PARTE I
Bases de las arritmias
Bloqueos miocárdicos periféricos no complicados y complicados
Uncomplicated and complicated myocardial peripheral blocks
Alfredo de Micheli, Gustavo A. Medrano, Pedro Iturralde–Torres
Instituto Nacional de Cardiología Ignacio Chávez. México.
Correspondencia:
Dr. Alfredo de Micheli.
Instituto Nacional de Cardiología Ignacio Chávez.
Calle Juan Badiano No.1 Tlalpan, 14080, México, D. F.
Teléfono: 5573 2911. Ext. 1317.
Recibido el 27 de febrero de 2009;
aceptado el 29 de febrero de 2009
*Homenaje a la memoria del ilustre maestro Demetrio Sodi Pallares
Resumen
Necrosis septal + bloqueos periféricos izquierdos. En presencia de una necrosis septal extensa, la manifestación de las fuerzas electromotrices iniciales de la activación ventricular puede reducirse en las derivaciones precordiales. Si coexiste un bloqueo bifascicular izquierdo (BSAI + BSPI), las fuerzas electromotrices iniciales de la activación ventricular se hacen más evidentes y los signos eléctricos de la zona inactivable septal resultan enmascarados. Cuando coexiste un bloqueo trifascicular, la manifestación de las primeras fuerzas electromotrices ventriculares vuelve a disminuir y los signos eléctricos de la necrosis septal otra vez resultan evidentes. Se inscriben, por tanto, pequeñas ondas Q en las derivaciones V1 a V4.
Necrosis anterior extensa + bloqueos periféricos izquierdos. Dicha necrosis se manifiesta por la presencia de complejos ventriculares QS de V2 a V6. Un bloqueo bifascicular izquierdo coexistente reduce la manifestación eléctrica del miocardio inactivable: los complejos QS permanecen sólo en V3 y V4. Por su lado, la coexistencia de un bloqueo trifascicular da origen a complejos QS desde V2 hasta V5.
Necrosis posteroinferior + bloqueos periféricos izquierdos. Las fuerzas electromotrices de la activación ventricular se desvían hacia arriba a causa de la necrosis posteroinferior y se registran complejos QS o QR en las derivaciones bajas aVF, II y III. Por efecto de un bloqueo bifascicular izquierdo asociado, las principales fuerzas electromotrices de la activación ventricular se desplazan hacia abajo, hacia atrás y a la izquierda debido a la duración prolongada de los frentes de activación posteroinferiores. Los complejos ventriculares se tornan positivos y anchos en todas las derivaciones, lo que refleja las variaciones de potencial en porciones inferiores del ventrículo izquierdo: aVF, II, III, a veces V5 y V6. Por consiguiente, los signos eléctricos de necrosis se reducen o se suprimen.
Los bloqueos ventriculares periféricos derechos no logran ocultar los signos electrocardiográficos de miocardio inactivable univentricular y biventricular.
Palabras clave: Bloqueos ventriculares periféricos izquierdos no complicados; Bloqueos ventriculares periféricos izquierdos complicados; Bloqueos ventriculares periféricos derechos no complicados; Bloqueos ventriculares periféricos derechos complicados.
Abstract
Septal necrosis + peripheral left blocks. Because of an extensive septal necrosis, the manifestation of the initial ventricular activation forces decreases in the precordial leads. With left bifascicular block (LASB + LPSB), the first ventricular activation forces become more evident and the electrical signs of septal necrosis can be concealed. In the presence of a trifascicular block, the manifestation of the first ventricular electromotive forces diminishes again and the electrical signs of septal necrosis become evident once more. Small Q waves are present in leads V1 to V4.
Extensive anterior necrosis + left peripheral blocks. This necrosis is manifested by QS complexes from V2 to V6. An associated left bifascicular block reduces the electrical manifestation of dead tissue: QS complexes persist only in V3 and V4. In turn, a coexisting trifascicular block causes the presence of QS complexes from V2 to V5.
Posteroinferior necrosis + left peripheral blocks. Electromotive forces of the ventricular activation shift upward, due to a posteroinferior necrosis, and QS or QR complexes are recorded in leads aVF, II and III. An associated left bifascicular block displaces the main electromotive forces downward, posteriorly and to the left, due to a delay of the posteroinferior activation fronts. The ventricular complexes become positive and wider in all leads, reflecting the potential variations of the inferior portions of the left ventricle: aVF, II, III, sometimes V5 and V6. Consequently, the electrical signs of necrosis are reduced or abolished
Right ventricular peripheral blocks do not conceal the electrocardiographic signs of univentricular and biventricular dead myocardium.
Key words: Uncomplicated left ventricular peripheral blocks; Complicated left ventricular peripheral blocks.
Introducción
Bloqueos periféricos o distales
Los bloqueos periféricos o distales son los que se presentan en el territorio de distribución de las últimas subdivisiones de los sistemas de conducción intraventricular o en el mismo miocardio ventricular. Causan, por tanto, un retardo circunscrito o regional del proceso de activación de los ventrículos.1 En el aspecto cronológico, este hecho se expresa por un retardo de la manifestación de algunos de los vectores resultantes de la activación del ventrículo homolateral. Bajo el aspecto morfológico, dichos bloqueos pueden reconocerse por empastamiento del vértice de la onda R, que se asocia a prolongación del tiempo de inicio de la deflexión intrinsecoide (TIDI) sólo en las derivaciones que exploran la región afectada.2 En realidad se trata de una lentificación circunscrita del proceso de activación ventricular debido con frecuencia, pero no siempre, a un bloqueo fascicular. En ciertos casos, el bloqueo distal depende de algún daño miocárdico local. Con criterio topográfico, los bloqueos periféricos pueden clasificarse en relación con el territorio de distribución de las últimas subdivisiones de los dos sistemas de conducción intraventricular. Es obvio que este diagnóstico está supeditado a la exploración eléctrica de regiones altas y bajas de los ventrículos.
Para establecer el diagnóstico de bloqueo periférico o distal, antes que nada debe demostrarse la existencia del bloqueo, esto es, de una lentificación del proceso de activación ventricular porque en ausencia de ésta no es posible reconocerlo. Luego hay que determinar la localización regional de tal retardo. De hecho, se sabe que la lentificación de la despolarización de las fibras miocárdicas produce empastamiento de la onda R y prolongación del TI DI sólo en las derivaciones que exploran la zona afectada.3 A su vez, existen empastamientos de las ondas S en las derivaciones que "miran" hacia regiones opuestas.
Sistema de conducción intraventricular izquierdo
El sistema de conducción intraventricular izquierdo se ha visualizado en el corazón de perro (Figura 1) mediante tinción con una solución de lugol (es decir, yodo–yodurada) porque el tejido específico que lo constituye es muy rico en glucógeno, que tiene gran afinidad para con el yodo. Comprende el tronco principal de la rama izquierda, que es corto (2 o 3 mm), y pronto da origen a sus subdivisiones, que son las que siguen: la anterior, que se distribuye en la masa septal izquierda mediosuperior, y la posterior, que se localiza en la masa septal izquierda posterior y da origen a ramificaciones en la pared posterior del ventrículo izquierdo. Del tronco principal y de las dos subdivisiones mencionadas se desprende una maraña de filetes que tienen el valor funcional de una subdivisión media situada en la masa septal izquierda media. Cada una de las subdivisiones mencionadas de la rama izquierda da origen a la red de Purkinje correspondiente, localizada en regiones endocárdicas y subendocárdicas.1 A través de los filetes que integran la subdivisión media izquierda, llegan los impulsos de activación a la superficie septal izquierda media, en donde se inicia el proceso de activación ventricular.

Bloqueos periféricos izquierdos no complicados
Bloqueo de la subdivisión anterior izquierda (BSAI)
Predomina la manifestación del vector basal izquierdo (3i), dirigido hacia la izquierda y arriba (Figura 2), por el predominio de las fuerzas electromotrices de las regiones basales del ventrículo izquierdo.4 Por el contrario, la orientación del vector 2i no se modifica en forma sensible, aunque su manifestación tiende a anticiparse porque ahora dicho vector corresponde sólo a fuerzas electromotrices laterales bajas del ventrículo homolateral. La activación tardía y lenta de las regiones anteroseptales y laterales altas de la pared libre del ventrículo izquierdo explica la prolongación del TIDI y el empastamiento de la onda R en aVL y DI, así como la orientación de ÂQRSF hacia la izquierda y arriba. Así se explica la morfología de los complejos ventriculares qRS de V3 a V6.

Bloqueo de la subdivisión posterior izquierda (BSPI)
Predomina la manifestación del vector 3i,5 de magnitud considerable, que se dirige hacia la izquierda, abajo y atrás (Figura 3). Así se explican la prolongación del TIDI y los empastamientos de la onda R en aVF, V6, D–II, D–III y también la verticalización de ÂQRSF. A su vez, el vector 2i, de magnitud reducida, se desvía hacia delante, lo que explica la presencia frecuente de ondas R relativamente altas en V2 y V3.

Bloqueo bifascicular izquierdo (BBFI)
A causa de un bloqueo bifascicular izquierdo (BSAI + BSPI), existe un retardo extenso pero desigual de la activación del ventrículo homolateral.6 Persiste la manifestación del primer vector septal izquierdo con su orientación normal (Figura 4). El vector 2i, que representa las fuerzas electromotrices de las porciones anteroinferiores de la pared libre del ventrículo izquierdo, se orienta hacia la izquierda, adelante y abajo y se manifiesta alrededor de los 0.036 seg en los seres humanos.
La representación vectorial de las fuerzas electromotrices del ventrículo izquierdo, retardadas en grado desigual, se realiza por el vector 3i. Éste se dirige hacia la izquierda y atrás, para manifestarse en alrededor de 0.06 seg en seres humanos y oculta por tanto la manifestación del vector 3d. Persiste la manifestación del primer vector septal. El TIDI está prolongado en diferente grado en las derivaciones izquierdas altas y bajas. Por la ausencia del fenómeno del "salto de onda", no obstante el retardo de la activación septal izquierda, se registran morfologías QS en la cavidad ventricular izquierda y rS en la derecha.
Bloqueo trifascicular (BRDHH + BSAI + BSPI)
El bloqueo trifascicular7 corresponde a la asociación de un bloqueo de la rama derecha del haz de His con un bloqueo bifascicular izquierdo (Figura 5). Constituye en realidad un bloqueo bilateral que tiende a restablecer la sincronía de la activación de ambos ventrículos. Da origen a morfologías de un bloqueo de rama derecha del haz de His (BRDHH) de grado intermedio en las derivaciones que detectan las variaciones de potencial del corazón derecho: aVR, V3R, V1, V2. Persiste la manifestación del primer vector de la activación septal. Se observan empastamientos de la onda R y retardo desigual del TIDI en las derivaciones que exploran el ventrículo izquierdo. El intervalo P–R puede ser normal. Debido a la ausencia de "salto de onda"6 de derecha a izquierda, la morfología de los complejos intraventriculares izquierdos permanece de tipo QS, mientras que los intraventriculares derechos son polifásicos, como se observó en condiciones experimentales.
Bloqueos periféricos izquierdos e infartos
BSAI + zona inactivable septal
Cuando un BSAI se asocia a una zona inactivable anteroseptal, al volver lenta la activación de regiones anterolaterales basales del ventrículo izquierdo incrementa la manifestación de fuerzas electromotrices anteriores y la desviación del primer vector septal izquierdo (li) hacia abajo y adelante. Por eso, en derivaciones precordiales derechas y transicionales, los complejos ventriculares QS se vuelven de tipo rS, a veces con disminución del voltaje de la pequeña onda r inicial de V1 a V3.
Se presentan como ejemplo los electrocardiogramas obtenidos en una enferma con infarto miocárdico anteroseptal agudo, observada en la institución donde se desempeñan los autores.8 El primer trazo (Figura 6a) muestra los signos electrocardiográficos de un infarto anteroseptal en fase aguda: QS en V2 y qrs en V3, con signos de lesión e isquemia subepicárdicas. Pero poco después, un BSAI transitorio provocó desviación del primer vector septal izquierdo, que no había desaparecido por completo, hacia abajo y adelante. Esto explica la aparición, en la Figura 6b, de una pequeña onda R inicial de V1 a V3, lo que hace desaparecer los signos de miocardio inactivable. El BSAI se reconoce por el empastamiento del vértice de la onda R y la prolongación del TIDI en aVL: 0.08 seg. Más tarde, al desaparecer el BSAI, se restablecieron las morfologías QS de V1 a V3 (Figura 6c). En este caso, los trazos seriados demuestran con claridad la capacidad del BSAI para ocultar o reducir la manifestación electrocardiográfica de una zona inactivable anteroseptal.



Además, un BSAI, al desviar el primer vector septal izquierdo hacia abajo, puede ocultar asimismo la manifestación electrocardiográfica de una zona inactivable de la cara diafragmática homolateral y producir complejos rS en vez de QS en las derivaciones bajas aVF, D–II y D–III.
BSPI + zona inactivable posteroinferior
Es bastante frecuente la asociación de un BSPI con una zona inactivable transmural posteroinferior.9–11 Ésta, por sí sola, debería permitir a los electrodos que la exploran, por ejemplo aVF, registrar el complejo intraventricular izquierdo QS. Pero, en presencia de un BSPI, la duración aumentada de los frentes de onda, que avanzan en las regiones inferiores del ventrículo izquierdo afectadas por el bloqueo, determina que el importante vector izquierdo tardío (3i) se dirija hacia abajo y dé origen a una onda R terminal, además de reducir la duración de la onda Q anormal del complejo ventricular en las derivaciones bajas. Esto puede observarse en la tira superior de la Figura 7, en donde el BSPI se reconoce por el empastamiento del vértice de R y la prolongación más o menos acentuada del TIDI en aVF. En el trazo registrado unas horas después (tira inferior de dicha Figura 7), los signos de BSPI desaparecieron y las morfologías se tornaron de tipo QS en D–III y aVF. Además, la pequeña onda R inicial se redujo de V1 a V3, (no comprendidas en esta figura), en donde el complejo ventricular es de tipo QS. Estos hechos sugieren la coexistencia de una zona inactivable anteroposterior transmural apical (en casquete).
BBIFI + zona inactivable septal
Cuando un bloqueo bifascicular izquierdo (BBIFI) se asocia con tejido inactivable septal, el proceso de activación miocárdica se retarda tanto en las porciones posteriores como en las anterosuperiores del tabique interventricular. Hay, por ende, una mayor manifestación de las fuerzas electromotrices que se originan en las regiones respetadas de los dos tercios anteroinferiores del tabique interventricular, las que se dirigen hacia la derecha y abajo. A éstas se suman otras fuerzas generadas en la zona trabecular del ventrículo derecho, la que se activa alrededor de 20 mseg después del comienzo de la despolarización ventricular. Esto hace que los complejos ventriculares se vuelvan de tipo rS en las derivaciones precordiales derechas y en V3. La pequeña onda R mencionada disminuye de voltaje en V2 y V3 y se registran morfologías qRs en V4, en tanto que los complejos ventriculares son de tipo qRs o qR debido a los dos bloqueos parciales izquierdos. Sin embargo, ahora la activación ventricular está prolongada. El vector resultante de la misma apunta otra vez hacia abajo, a la izquierda y atrás, lo que origina ondas R empastadas con TIDI prolongado en las tres derivaciones estándar y en V6. En este caso, el electrocardiograma es semejante al de un BRIHH de grado intermedio.
Un ejemplo de BBIFI con signos de probable zona inactivable posteroinferior se presenta en la Figura 8. Este ECG se registró en un varón de 63 años y sugiere la presencia de un bloqueo bifascicular izquierdo: la onda R aparece empastada tanto en aVL como en aVF, pero el TIDI está más prolongado en aVF (100 mseg) que en aVL (55 mseg). Persiste, además, la manifestación del primer vector septal izquierdo tanto en V1 como en V6. Por su lado, la pequeña onda Q de 40 mseg en aVF hace pensar en una probable zona miocárdica inactivable en la cara diafragmática del ventrículo izquierdo. Cabe hacer énfasis en que la morfología del complejo intraventricular izquierdo es de tipo QS (ICVI), lo que demuestra la ausencia del fenómeno de "salto de onda" intraseptal y aboga a favor de un bloqueo izquierdo periférico.

Bloqueo trifascicular + zona inactivable septoparietal
En presencia de una "necrosis" anteroseptal asociada a bloqueo trifascicular, en las derivaciones precordiales pueden predominar los complejos ventriculares positivos en V1 por el BRDHH, mientras que persisten los signos de "necrosis" de V2 a V4. Sin embargo, un bloqueo trifascicular puede enmascarar la manifestación de miocardio inactivable septoparietal. Por ejemplo, un ECG previo al de la Figura 9 mostraba un bloqueo bilateral: BRDHH + BSPI y, en aVF, una pequeña onda Q empastada, de 0.045 seg, era sospechosa de la existencia de miocardio inactivable en regiones septoparietales bajas. Pero el trazo de la Figura 9, tomado más tarde a la misma persona, exhibe un bloqueo trifascicular: BRDHH + BBIFI y no proporciona ningún signo de miocardio inactivable, puesto que no registra dicha pequeña onda Q empastada en aVF.12

Sistema de conducción intraventricular derecho
El tronco principal de la rama derecha del haz de His tiene un trayecto largo, en herradura, con sus porciones iniciales bastante superficiales. Sus porciones intermedias se tornan profundas en el espesor de la masa septal derecha: la parte mimética. Las terminales son de nuevo superficiales y en el límite entre el tercio medio y el tercio inferior de la superficie septal derecha –cerca de la base del músculo papilar anterior– dan origen a tres subdivisiones (Figura 10). Éstas se han encontrado tanto en el corazón del perro13,14 como del ser humano.15,16

La subdivisión anterior se distribuye en la región del cono de la arteria pulmonar y se sitúa en el ángulo diedro formado por la masa septal derecha anterosuperior y la pared anterior del ventrículo derecho. La subdivisión media, que se desprende del tronco principal de la rama en ángulo recto, se ramifica en la masa septal derecha anteroinferior. La subdivisión posterior se localiza en la masa septal derecha posteroinferior con filetes que se distribuyen en las regiones posteriores y laterales medias e inferiores de la pared libre del ventrículo derecho. Cada subdivisión da origen a la red de Purkinje correspondiente.
Bloqueos periféricos derechos no complicados
Bloqueo de la subdivisión anterior derecha (BSAD)
Cuando se lesiona la subdivisión anterior de la rama derecha, la que se sitúa en la región del infundíbulo de la arteria pulmonar, las derivaciones unipolares epicárdicas correspondientes señalan la existencia de un retardo regional del proceso de activación ventricular derecha circunscrito a las estructuras de la cámara de salida del ventrículo: porciones anterosuperiores de la masa septal derecha y paraseptales anteriores derechas altas. En tales zonas, el tiempo de inicio de la deflexión intrinsecoide (TIDI) del complejo ventricular puede prolongarse en unos 10 mseg, en promedio. En presencia de un BSAD, el vector resultante de la despolarización de las regiones basales del ventrículo derecho (3d) se dirige esencialmente hacia arriba y a la derecha o a la izquierda de –90°, de acuerdo con la posición y la rotación cardiacas (Figura 11). El diagnóstico electrocardiográfico de BSAD debe apoyarse en el aspecto del electrocardiograma: cuadro de tipo SI SII SIII, y ÂQRSF por arriba del eje transversal comprendido entre 

De hecho, las derivaciones del ECG convencional, que por lo regular no permiten explorar la región del cono de la arteria pulmonar, no revelan en el aspecto cronológico la existencia de un retardo regional del proceso de la activación ventricular derecha.
Bloqueo de la subdivisión posterior derecha (BSPD)
Los registros ECG obtenidos en animales de laboratorio marcan una pauta para el diagnóstico de BSPD en los electrocardiogramas clínicos. Las morfologías captadas en porciones bajas de la cavidad ventricular derecha permiten reconocer la existencia o no del fenómeno de "salto de onda"17 a través de la barrera intraseptal. De este modo hacen posible la diferenciación entre un BRDHH de grado intermedio y un BSPD. El ECG de superficie sugiere un BSPD cuando los signos de retardo y la lentitud de la despolarización del miocardio ventricular derecho (empastamiento de la onda R y prolongación del TIDI) se evidencian sólo en las derivaciones que exploran las regiones posteriores y laterales medioinferiores de la pared ventricular derecha libre. En este caso, el vector resultante de la activación ventricular homolateral se orienta hacia la derecha, abajo y atrás de su punto de origen (Figura 12). Hay empastamiento positivo del complejo ventricular en V3R y V1, también en aVF y en la derivación abdominal alta derecha MD, si la posición cardiaca es horizontal. Se observan asimismo empastamientos de la onda S en V5 y V6. Más aún, debe existir una diferencia significativa entre el tiempo de activación (TIDI) de las regiones afectadas y el de la masa septal derecha anteroinferior (TIDI en V3 y/o V4). En ausencia de hipertrofia ventricular derecha, tal diferencia debería ser de 30 mseg o más. Ésta se considera aún más significativa cuando el tiempo de manifestación del vector 2s es normal: entre 20 y 25 mseg (corazones sanos o con una simple dilatación del ventrículo derecho).18 De manera habitual, las derivaciones torácicas derechas V5R V4R y V3R exploran las porciones posterolaterales de la pared libre ventricular derecha, mientras que V3 y V4 quedan enfrente del tabique interventricular (posición cardiaca intermedia). Pero, en corazones horizontales, son las derivaciones bajas (en esencia aVF) las que exploran las regiones posterolaterales bajas de la pared libre del ventrículo derecho. El vector resultante de la activación ventricular (Figura 12), se manifiesta unos 60 mseg después del comienzo de ésta y se orienta alrededor de +125° en el plano frontal.

Bloqueos periféricos derechos complicados
BSAD + zona inactivable anteroseptal
El BSAD19 se reconoce por la presencia de ondas R empastadas en aVR con TIDI de 90 mseg o más, así como por las asas SF y SH de la curva vectocardiográfica ventricular horarias, empastadas y situadas arriba, a la derecha y atrás del punto de origen. Los signos de miocardio inactivable corresponden a los complejos ventriculares QS o QR en las derivaciones que exploran la zona afectada. Por ejemplo, los trazados reproducidos en la Figura 13 se obtuvieron en un varón de 65 años. El ECG muestra signos de miocardio inactivable localizado en la mitad inferior del tabique interventricular. Existe, además, isquemia subepicárdica anterolateral extensa. Coexiste un BSAD, que se manifiesta por la onda R empastada en aVR, con TIDI de 90 mseg. Este diagnóstico se apoya en las características de las asas SF y SH de la curva vectocardiográfica ventricular, horarias y empastadas con inscripción del vértice de SF a –120° y a los 85 mseg, y del vértice de SH a –114° y a los 75 mseg. La presencia de un empastamiento de la onda R en aVL, con TIDI de 70 mseg, así como la onda S en dicha derivación, podrían deberse a la posición cardiaca horizontal con dextrorrotación.

BSPD + zona inactivable posteroinferior
El BSPD se asocia con cierta frecuencia a infartos posteroinferiores o de la cara diafragmática. En estos casos, tanto la onda Q como la onda R están empastadas, con prolongación del TIDI en las derivaciones bajas como aVF. Debe tenerse presente que el BSPD se relaciona en especial con infartos posteroinferiores biventriculares.19 Tampoco en estos casos logra ocultar la manifestación electrocardiográfica de la existencia de miocardio inactivable. Los signos pertinentes se hallan en las derivaciones bajas
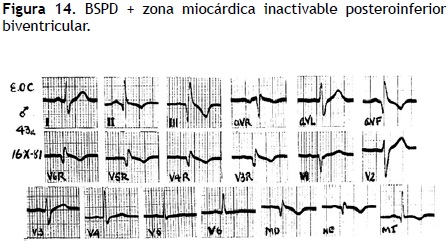
aVF, D–II y D–III, así como en las derivaciones abdominales altas MD y ME. Por ejemplo, el ECG de la Figura 14, que se tomó en un varón de 43 años, proporciona signos de una zona miocárdica inactivable posteroinferior biventricular (QR con onda Q de 40 mseg en aVF), anteroseptal (pequeña onda R de tipo embrionario en V1) y de la pared libre ventricular derecha (QR empastadas de V6R a V4R). El trazo exhibe aún signos del BSPD: R empastada y TIDI de 80 mseg de V6R a V4R, MD y ME . Por lo tanto, este bloqueo periférico derecho no oculta la manifestación electrocardiográfica de la amplia zona de miocardio inactivable.
Comentario
Bloqueos periféricos izquierdos
Tanto en presencia de un bloqueo de la subdivisión anterior izquierda como de la subdivisión posterior, la desviación de ÂQRSF se debe al reajuste de las fuerzas de la activación ventricular. La orientación de ÂQRSF es pues una consecuencia de los efectos del bloqueo, pero de ninguna manera puede considerarse como un signo patognomónico de dicho trastorno de la conducción ventricular. Así como en la identificación de la posición eléctrica del corazón, también en el diagnóstico del bloqueo periférico izquierdo el comportamiento del eje eléctrico de QRS sólo constituye un dato accesorio.
En presencia de un BSAI, el ÂQRSF se desvía hacia arriba por la duración aumentada de las fuerzas electromotrices basales del ventrículo izquierdo. El grado de desviación de ÂQRSF depende asimismo de la posición cardiaca. Resulta más acentuado en un corazón horizontal que en uno vertical. Por otra parte, el ÂQRSF puede estar desviado hacia arriba en ausencia de bloqueo de la subdivisión anterior izquierda. Este hecho se debe, a veces, a una "necrosis" de regiones ventriculares bajas o se observa en ciertas cardiopatías congénitas caracterizadas por la situación anómala del sistema específico de conducción auriculoventricular o por una importante hipertrofia basal de ambos ventrículos (canalis atrioventricularis communis). Por el contrario, el ÂQRSF puede situarse menos arriba de lo esperado en el bloqueo de la subdivisión anterior izquierda cuando éste coexiste con un bloqueo de la subdivisión posterior izquierda (bloqueo bifascicular) o con zonas inactivables laterales altas del ventrículo izquierdo.
En el caso de un bloqueo de la subdivisión posterior izquierda (BSPI), el ÂQRSF se desvía hacia abajo por efecto de la mayor duración de las fuerzas electromotrices originadas en las regiones posteroinferiores de la pared libre del ventrículo izquierdo.20 Dicha desviación es menor, o no se produce, si coexisten otros factores que tienden a orientar el ÂQRSF hacia arriba, por ejemplo un bloqueo de la subdivisión anterior izquierda asociado con un bloqueo de la rama derecha (bloqueo bilateral). En tales casos, la posición del eje eléctrico de QRS depende de la importancia del retardo del impulso de activación en cada uno de los diferentes segmentos del sistema hisiano.
Bloqueos periféricos derechos
En una publicación anterior21 se presentó la distribución en el plano frontal del vector resultante de la activación ventricular, que se manifiesta a los 60 mseg después del comienzo de la misma. Once sujetos con comunicación interauricular y BSAD presentaban dicho vector dirigido a alrededor de –135°, ángulo medio de –151°. A su vez, diecisiete sujetos con comunicación interauricular y BSPD mostraron la orientación del vector mencionado a alrededor de +125°, con ángulo medio de +140°. De hecho, las fuerzas electromotrices basales del ventrículo derecho dan origen al vector 3d que, en los seres humanos, se manifiesta de manera habitual a los 40 mseg, en promedio, en los niños18 y a los 65 mseg, en promedio, en los adultos,22 con dirección derecha y superior. Debido a un BSAD, se retarda la manifestación de estas fuerzas electromotrices,23 que ahora no coinciden –y por tanto no interfieren–con las del miocardio dañado en las regiones septales o parietales ventriculares.
Consideraciones análogas pueden formularse en lo que toca a los efectos del BSPD, que se origina en regiones posteriores y laterales medioinferiores de la pared ventricular derecha libre. En estos casos, el vector resultante del proceso de activación que se desarrolla de manera habitual en las regiones mencionadas en 20 a 35 mseg24 se manifiesta retardado en grado más o menos importante. Por eso no puede interferir en la manifestación de fuerzas electromotrices que se originan más temprano en otras regiones del miocardio ventricular.24,25 En otras palabras, los trastornos periféricos de la activación ventricular derecha se limitan a prolongar activaciones regionales tardías, lo que ya no les permite interferir en la manifestación de las fuerzas electromotrices alteradas o suprimidas más temprano. En consecuencia, los signos de alteraciones o supresión de estas últimas pueden seguir manifestándose en los trazos electrocardiográficos correspondientes. Además, el vector resultante de la activación ventricular en el BSPD (vector 3d) se orienta hacia la derecha y abajo, fuera del área comprendida por el ángulo sólido de los electrodos exploradores externos.
Conclusiones
En conclusión, los bloqueos periféricos o distales izquierdos, que pueden ocultar la coexistencia de miocardio inactivable septal o septoparietal, se reconocen con facilidad a la luz del enfoque diagnóstico electrofisiológico propuesto a su tiempo por la Escuela Mexicana de electrovectocardiografía.26 El diagnóstico correcto de un trastorno de la conducción ventricular izquierda de tipo periférico, junto con datos clínicos pertinentes, deben hacer pensar en la posible coexistencia de miocardio inactivable.27
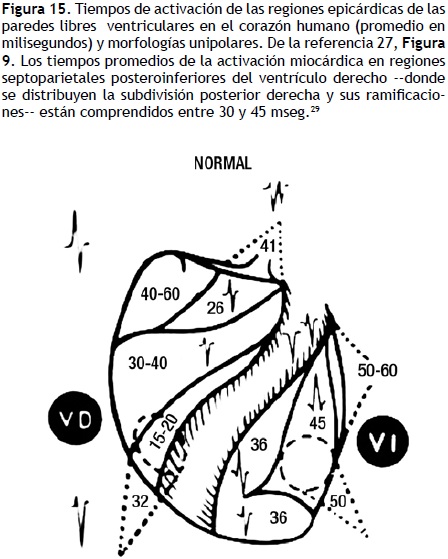
Por su lado, los bloqueos periféricos o distales derechos, –estudiados en forma experimental por Uhley y Rivkin en 196128 y por el grupo de los autores en 197514–en general no logran ocultar los signos eléctricos de "necrosis" miocárdica. Estos bloqueos acentúan las fuerzas electromotrices más tardías de la activación ventricular derecha (Figura 15). No pueden interferir, por tanto, con el comportamiento de las fuerzas electromotrices ventriculares afectadas por el daño miocárdico. Esto acontece tanto en presencia del BSAD, que incrementa por lo menos en 10 mseg la duración de las fuerzas electromotrices basales del ventrículo derecho, que de manera habitual se desarrollan entre 64 y 72 mseg, como en presencia del BSPD. Tal bloqueo prolonga en unos 12 mseg, en promedio, las fuerzas electromotrices originadas en regiones septales posteriores y posterolaterales medias e inferiores de la pared ventricular derecha libre, las que se activan normalmente en 40 a 48 mseg.
Bibliografía
1. De Micheli A. Los bloqueos parciales de la rama izquierda del haz de His. Arch Inst Cardiol Mex 1971;41 (6):625–8. [ Links ]
2. De Micheli A, Medrano GA. Los trastornos de la conducción intraventricular. Arch Inst Cardiol Mex 1987;57(3):247–58. [ Links ]
3. De Micheli A, Medrano GA. Enfoque electrofisiológico del diagnóstico de bloqueos ventriculares izquierdos no complicados y complicados. Arch Inst Cardiol Mex 1996;66(1):70–82. [ Links ]
4. Medrano GA, de Micheli A, Cisneros F, Sodi Pallares D. The anterior subdivision block of the left bundle branch of His. I. The ventricular activation process. J Electrocardiol 1970;3:7–12. [ Links ]
5. Medrano GA, Brenes C, de Micheli A, Sodi Pallares D. Block of the posterior subdivision of the left bundle branch of His. J Electrocardiol 1970;3:309–315. [ Links ]
6. Medrano GA, de Micheli A, Brenes C, Sodi Pallares D. Experimental bases for diagnosis of left bifascicular and trifascicular block. G Ital Cardiol 1975;5(1):8–18. [ Links ]
7. Medrano GA, de Micheli A. Bloqueos fasciculares, bifasciculares y trifasciculares. Rev Esp Cardiol 1973;26:419–28. [ Links ]
8. Horwitz S, Medrano GA, Salazar E. Left anterior fascicular block concealing anteroseptal infarction. Arch Inst Cardiol Mex 1976;46(1):35–41. [ Links ]
9. De Micheli A, Medrano GA. El diagnóstico de zona inactivable miocárdica con bloqueo intraventricular izquierdo. Arch Inst Cardiol Mex 1988;58(5):461–73. [ Links ]
10. De Micheli A, Medrano GA. "Necrosis" septales y parietales con bloqueos periféricos monofasciculares. Arch Cardiol Mex 2004;74 (4):306–14. [ Links ]
11. De Micheli A, Medrano GA. En torno a los bloqueos polifasciculares no complicados y complicados. Arch Cardiol Mex 2002;72(3):240–8. [ Links ]
12. Medrano GA, de Micheli A, Iturralde P. Peripheral heart blocks associated with myocardial infarcts: clinical diagnosis based on experimental findings. Curr Cardiol Rev 2008;4(2):140–7. [ Links ]
13. Uhley HN, Rivkin LM. Peripheral distribution of the canine A–V conduction system. Observations on gross morphology. Am J Cardiol 1960;5(5):688–91. [ Links ]
14. Medrano GA, de Micheli A. Contribución experimental al diagnóstico de los bloqueos fasciculares derechos. Arch Inst Cardiol Mex 1975;45(6):704–19. [ Links ]
15. Levy M. The conduction system. En: Gould S, editor: Pathology of the heart and blood vessels. Springfield Ill, Charles C. Thomas 1968:185. [ Links ]
16. Mahaim J. Les maladies organiques du faisceau de His–Tawara. Paris, Ed. Masson & Cie 1931. [ Links ]
17. Sodi Pallares D. New bases of electrocardiography. Saint Louis, Mo., The CV Mosby Co 1956:404. [ Links ]
18. Medrano GA, Attie F, Castro A, de Micheli A, Morún Simão C. Electrocardiograma en el niño normal. Arch Inst Cardiol Mex 1978;48(2):320–34. [ Links ]
19. De Micheli A, Medrano GA. Enfoque electrofisiológico del diagnóstico de bloqueos ventriculares derechos no complicados y complicados. Arch Inst Cardiol Mex 1996;66(3):269–81. [ Links ]
20. De Micheli A, Medrano GA. Enfoque electrofisiológico del diagnóstico de bloqueos ventriculares izquierdos no complicados y complicados. Arch Inst Cardiol Mex 1996;66(1):70–82. [ Links ]
21. De Micheli A, Medrano GA, Villarreal A. Cambios eléctricos en la sobrecarga experimental diastólica y mixta del ventrículo derecho. Memorias del XI Congreso Interamericano de Cardiología. San Juan de Puerto Rico, septiembre de 1980, No. 320, p. 108. [ Links ]
22. Sodi Pallares D, Bisteni A, Medrano GA. Electrocardiografía y vectocardiografía deductivas. T. I. México, La Prensa Médica Mexicana 1964:133. [ Links ]
23. De Micheli A, Medrano GA. Acerca de los bloqueos derechos distales. Rev Lat Cardiol 1980;1(4):47–56. [ Links ]
24. Barbato E, Pileggi F, Debes CA, Fujioka T, Magalhaes MS, Tranchesi J, et al. Study of the sequence of ventricular activation and the QRS complex of the normal human heart using direct epicardial leads. Am Heart J 1958;55(6):867–80. [ Links ]
25. Brusca A, Gandolfo S, Lovezzano G, Braguzzi E, Actis Dato A. Il processo di attivazione del cuore umano. I. L'ipertrofia del ventricolo destro. Mal Cardiovasc 1964;5(4):509–24. [ Links ]
26. De Micheli A, Medrano GA. Bloqueos periféricos. En: de Micheli A, Medrano GA, Iturralde P, editores: Diagnóstico electrovectocardiográfico en clínica. México, Méndez Editores, S. A., 1992:44–52. [ Links ]
27. De Micheli A, Medrano GA. Electrocardiograma y vectocardiograma en el infarto del miocardio. México, La Prensa Médica Mexicana 1971:34. [ Links ]
28. Uhley HN, Rivkin LM. Electrocardiographic patterns following interruption of main and peripheral branches of the canine right bundle of His. Am J Cardiol 1961;7(6):810–6. [ Links ]
29. Gallagher JJ, Sealy WL, Richet LE, Lan W, Wallace AG. Epicardial mapping in the WPW syndrome . Reviews of contemporary laboratory methods. En Arnold M. Weisen, ed. Am Heart Ass. INC, 1980. [ Links ]














