Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.79 no.4 Ciudad de México oct./dic. 2009
Investigación clínica: electrofisiología y arritmias
Predictores clínicos de tormenta arrítmica en pacientes con cardiomiopatía Chagásica con un desfibrilador automático implantable
Clinical predictors of ventricular arrhythmia storms in Chagas cardiomyopathy patients with implantable defibrillators
Jorge Flores–Ocampo, Santiago Nava, Manlio F Márquez, Jorge Gómez–Flores, Luis Colín, Atala López, Manuel Celaya, Ernesto Treviño, Jesús Antonio González–Hermosillo y Pedro Iturralde
Departamento de electrocardiología del Instituto Nacional de Cardiología Ignacio Chávez, México, D.F.
Correspondencia:
Santiago Nava.
Departamento de Electrocardiología.
Instituto Nacional de Cardiología Ignacio Chávez.
Juan Badiano Núm. 1. Col. Sección XVI.
Tlalpan 14800. México, D.F.
Teléfono: (0155) 55732911 Ext. 1218.
Correo electrónico: santiagonavat@hotmail.com.
Recibido el 15 de octubre de 2009.
Aceptado el 10 de noviembre de 2009.
Resumen
Objetivo. Definir los factores predictivos de la aparición de tormenta arrítmica (TA) en pacientes con Cardiopatía Chagasica Crónica (CCh) portadores de un desfibrilador automático implantable (DAI).
Material y métodos. Se estudiaron en forma retrospectiva a 21 pacientes consecutivos con CCh a los cuales se les implantó un DAI entre abril del 2005 y diciembre del 2008, con un seguimiento promedio de 867 días. Los pacientes fueron clasificados en dos grupos de acuerdo con la presencia de episodios de TA. Se compararon características básales, tratamiento médico y determinantes de función ventricular entre ambos grupos. Los valores de p menores de 0.05 se consideraron de significancia estadística.
Resultados. En los 21 pacientes con CCh hubo ocho mujeres (37%), la edad promedio fue de 61 años y la fracción de expulsión del ventrículo izquierdo (FEVI) promedio fue de 30%. Se observó por lo menos un episodio de TA en 9 casos (incidencia del 43%). El número total de episodios de TA fue de 13 y el número de arritmias ventriculares en cada episodio de TAfue de 15.6 (intervalo 3 a 61). Sólo en dos casos se identificó un factor desencadenante (proceso infeccioso pulmonar y descompensación de insuficiencia cardiaca crónica). Al analizar los posibles factores predictivos de TA se observó que un mayor porcentaje de sujetos con esta complicación tuvieron una FE < 35% (89% vs 50%; p = 0.01) y una clase funcional III o IV de la NYHA (66% vs 8.3%; p = 0.001). En contraste, un menor porcentaje de sujetos con TA se encontraban en tratamiento con bloqueador beta (55% vs 100%; p = 0.01).
Conclusiones. En sujetos con CCh, portadores de un DAI, las siguientes variables son predictivas del desarrollo de TA: FE < 35%, clase funcional III–IV de la NYHA y ausencia de tratamiento con bloqueador beta.
Palabras clave: Cardiopatía chagasica; Arritmias ventriculares malignas; Tormenta arrítmica; Desfibrilador automático implantable; México.
Abstract
Objectives. To define the predictive factors of electrical storm (ES) in patients with Chronic Chagas Heart Disease (CCh) with an implantable cardioverter defibrillator (ICD).
Material and methods. We retrospectively studied 21 consecutive patients with CCh in whom an ICD was implanted between April 2005 and December 2008, with a mean follow up of 867 days. Patients were classified into two groups according to the presence of electrical storm episodes. We compared baseline characteristics, medical treatment and determinants of ventricular function. P values less than 0.05 were considered statistically significant.
Results. Of the 21 patients with CCh there were eight women (37%), mean age 61 years and an EF of 30%. It was noted at least one episode of arrhythmic storm in 9 cases (incidence of 43%). The total number of episodes of arrhythmic storm was 13 and the number of ventricular arrhythmias in each episode of arrhythmic storm was 15.6 (range 3–61). A trigger was identified in only two cases (pulmonary infectious process and decompensation of chronic heart failure). After analyzing the possible predictors of arrhythmic storm was found that a greater percentage of subjects with this complication had an EF <35% (89% vs. 50%, p = 0.01) and NYHAfunctional class III (66% vs. 8.3%, p = 0.001). In contrast, a lower percentage of subjects with arrhythmic storm were under beta–blocker treatment (55% vs. 100%, p = 0.01).
Conclusions. In subjects with CCh with an ICD, the following variables are predictive of arrhythmic storm: EF <35%, NYHA functional class III–IV and absence of beta–blocker treatment.
Key words: Chagas disease; Malignant ventricular arrhythmias; Arrhythmic storm; Implantable;Cardioverter Defibrillator; Mexico.
Introducción
La enfermedad de Chagas es una enfermedad parasitaria endémica y un problema de salud pública en Latinoamérica, en donde hay 18 millones de personas crónicamente infectadas, 200 000 nuevos casos cada año y 120 millones de personas en riesgo.1 La principal y más grave afectación orgánica de la enfermedad es la cardiopatía chagásica crónica que se caracteriza por insuficiencia cardiaca (IC), fenómenos tromboembólicos, arritmias y muerte súbita (MS).2–4 La prevalencia de MS en pacientes con CCh varía del 29% en áreas no endémicas a 37% en áreas donde la enfermedad es endémica, con una incidencia de 5% anual. En poblaciones hospitalarias de pacientes con CCh en centros terciarios de referencia se han determinado prevalencias de 44% con una incidencia anual de 22%.5–7
El DAI se ha utilizado para la prevención primaria y secundaria de MS en esta población. No existen estudios clínicos aleatorios que evalúen la eficacia y la seguridad del tratamiento de los pacientes con CCh mediante la implantación de un DAI, por lo que la indicación actual para implantarlo proviene de la extrapolación de los resultados de estudios clínicos de pacientes con otras afecciones, como enfermedad arterial coronaria o miocardiopatía dilatada idiopática.8–16
Recientemente se cuestionó el beneficio del DAI en pacientes con CCh, señalando que el desfibrilador podría tener un impacto deletéreo en el pronóstico clínico del paciente. Se ha observado una alta frecuencia de terapias administradas y está demostrado que el número de éstas es un predictor poderoso e independiente de mortalidad en estos pacientes, lo que hace pensar que las frecuentes descargas promoverían y deteriorarían la función ventricular.17
La existencia de múltiples terapias administradas por el DAI en un corto tiempo (tres o más episodios de taquicardia ventricular (TV) o fibrilación ventricular (FV) en 24 horas) se define como TA, lo cual constituye una urgencia médica.18 Esta situación causa una profunda morbilidad psicológica y deteriora la calidad de vida de los pacientes afectados; además, existe evidencia de que incrementa la mortalidad general.18–22 Son muy pocos los estudios en los que se ha analizado el seguimiento y determinado la incidencia de TA en los pacientes con CCh y DAI. El objetivo de este estudio es determinar los factores predictivos de TA en esta población.
Metodología
Se implantaron desfibriladores automáticos a 21 pacientes consecutivos portadores de CCh de abril del 2005 a diciembre del 2008. Los pacientes se clasificaron en dos grupos de acuerdo con la presencia de episodios de TA. Todos los dispositivos eran de 3a o 4a generación, 12 unicamerales (57%) y la técnica de implantación fue endovenosa. Para ser incluidos en el estudio, los pacientes debían tener un resultado serológico positivo para enfermedad de Chagas y ausencia de otras afecciones que pudieran explicar la presencia de enfermedad miocárdica. La ocurrencia de episodios arrítmicos, el tipo de arritmia y el tipo de terapia eléctrica entregada se revisaron retrospectivamente. Los tipos de arritmias se catalogaron como TV o FV, según la frecuencia cardiaca, el inicio de la taquicardia y la estabilidad de los intervalos RR, y los tipos de terapias entregadas por los dispositivos se clasificaron como terapia anti–taquicardia (ATP) y cardiodesfibrilación. Los pacientes tuvieron un seguimiento durante al menos los seis meses siguientes a la implantación, con por lo menos dos valoraciones posteriores en donde se extrajo la información de los dispositivos para obtener los electrogramas almacenados para que los interpretara un médico especialista. La frecuencia de las visitas de seguimiento fue de uno, tres o seis meses, lo cual dependió de la condición médica del paciente. La media de seguimiento posterior a la implantación fue de 867 días (intervalo de 216 a 2 956 días). La presencia de TA se definió como más de dos episodios de arritmias ventriculares dentro de un lapso de 24 horas y separados por un periodo de ritmo sinusal (o ritmo basal distinto a la arritmia ventricular) mayor a una hora, definición que ha sido adoptada por las guías internacionales.17–19 Se compararon las características básales, el tratamiento médico y los determinantes de función ventricular en los pacientes con CCh con episodios de TA y sin ellos.
Análisis estadístico
Los datos fueron almacenados en una base de datos y analizados con el software estadístico SPSS en su versión 16 para Windows. El informe de la estadística descriptiva contenía medias y desviaciones estándar (o medianas e intervalos para distribuciones asimétricas) para las variables continuas, y frecuencias y porcentajes absolutos para variables categóricas. La comparación entre los grupos se efectuó con el test t de Student sin parejas de valores y la prueba X2 según fuera apropiado. Los valores de p menores de 0.05 fueron considerados de significancia estadística.
Resultados
El estudio se basó en el seguimiento retrospectivo de 21 pacientes consecutivos con diagnóstico de CCh, a los cuales se les implantó un DAI. Catorce eran pacientes del género masculino (62%), con una edad promedio de 61 ± 9 años y una FEVI del 30% ± 12. Siete pacientes (33.3%) tuvieron una FEVI > 35%, y únicamente un paciente una FEVI normal. Las comorbilidades más frecuentes fueron HAS, DM tipo 2, obesidad y tabaquismo, en orden de frecuencia. Ningún paciente tenía documentada enfermedad coronaria asociada y sólo un paciente padecía insuficiencia renal. El 95% de los pacientes recibía amiodarona como parte de su tratamiento médico; al 80% se le administraban bloqueadores beta e inhibidores de la enzima convertidora de angiotensina; el 85% de los individuos tomaba diuréticos y ningún paciente estaba tratado con estatinas. En 15 pacientes (71.4%) se colocó el DAI como medida de prevención secundaria de MS. En relación con los criterios de elegibilidad para la implantación del desfibrilador, el 100% de los pacientes en prevención primaria cumplía con el criterio de FEVI menor a 35%, 66% extrasístoles ventriculares frecuentes y 83% episodios documentados de taquicardia ventricular monomórfica no sostenida (TVMNS). Mientras que entre los pacientes con indicación secundaria para prevención de MS, 14 pacientes (93%) presentaron episodios de taquicardia ventricular sostenida (TVS) y dos pacientes (13.3%) se recuperaron de un episodio de MS (Tabla 1).
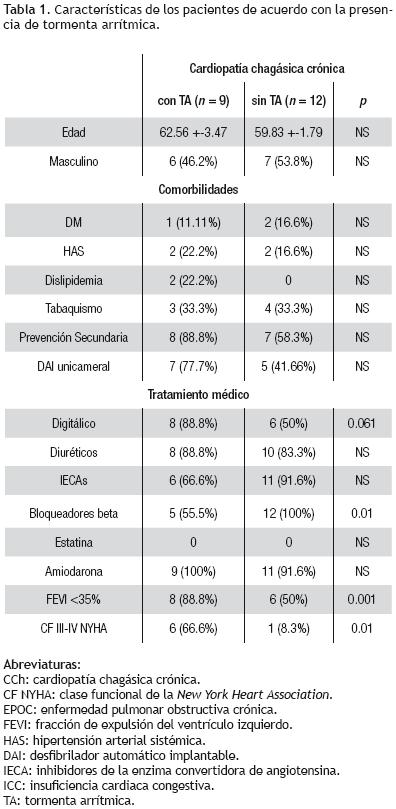
En 15 pacientes (71.4%) se documentaron terapias adecuadas del dispositivo en respuesta a trastornos arrítmicos ventriculares, y en seis pacientes no se documentaron terapias durante el tiempo de seguimiento. Se registró un total de 246 episodios de arritmias ventriculares, 16.4 episodios por paciente (intervalo de 1 a 61 episodios/paciente). Sólo 1.62% de las terapias fue catalogada como inadecuada (cuatro episodios en dos pacientes) que correspondió a taquicardias supraventriculares mal discriminadas. En relación con el tipo de terapia entregada se observó que dos pacientes (13.3%) recibieron únicamente terapias antitaquicardia (ATP), y 13 pacientes (86.6%) recibieron ATP y cardiodesfibrilación. La arritmia presentada en 20% de los casos fue taquicardia ventricular sostenida, mientras que en 80% de los pacientes se observaron episodios de TV y FV.
La prevalencia de TA fue de 42.9% (9 pacientes). Se observaron 13 episodios totales de TA, cuatro pacientes presentaron dos, y cinco individuos uno solo. Se registró un total de 203 arritmias ventriculares, que formó parte de los episodios de TA, los cuales representaron 82% del número total de arritmias ventriculares durante el seguimiento. El promedio de arritmias ventriculares por episodio de TA fue de 15.6 (intervalo 3 a 61). El número promedio de días posteriores a la implantadon que transcurrieron hasta el episodio de TA fue de 215 días (intervalo 2 a 1 115 días). En relación con el tipo de arritmias se observó que únicamente un paciente presentó episodios recurrentes de TV que fueron tratados con ATP de manera exitosa, mientras que el resto de los pacientes (ocho pacientes, 89%) manifestaron episodios de TV refractarios a ATP con degeneración posterior a FV, que requirieron múltiples descargas. Sólo en dos padentes (22.2%) se identificó un posible factor desencadenante, a saber, en un caso, un proceso infeccioso pulmonar, y en otro, una descompensación aguda de insuficiencia cardiaca (IC). Se requirió hospitalización en 92% de los casos, y el tratamiento administrado fue revisión del dispositivo, tratamiento antiarrítmico intravenoso, En ocho pacientes (89%) se realizó un estudio electrofisiológico con ablación.
La FEVI promedio de la totalidad de los pacientes fue de 30% ± 12%. Además, siete individuos (33%) tuvieron una FEVI mayor a 35%, y se documentó en este grupo terapias del DAI en 71% del mismo. De los enfermos en los que se documentaron episodios de TA, 89% tuvo una FEVI menor al 35% en comparación con solamente el 50% en el grupo sin TA (p = 0.001). En los pacientes con TA, el 67% estaba en una clase funcional III–IV de la NYHA, en comparación con 43% en el grupo sin TA (p = 0.01). Para finalizar, se observó que la totalidad de los pacientes sin TA recibía tratamiento con bloqueadores beta vs 55% de los pacientes con TA (p = 0.01).
La mortalidad general de la cohorte fue de 23% (cinco pacientes), 22% para los casos con TA (dos), y de 25% para aquéllos sin episodios de TA (tres, p = NS). Ninguna de las muertes se consideró de naturaleza arrítmica, tres estuvieron relacionadas con la progresión de la IC, una de naturaleza no cardiaca y una por complicaciones quirúrgicas.
Discusión
La MS cardiaca de origen arrítmico es la principal causa de mortalidad en pacientes con CCh, por lo que esta afección se ha vuelto una reciente indicación para la implantación de un DAI.5–8 Existen series que señalan que los pacientes con CCh evolucionan mal cuando se les implanta un DAI, en comparación con pacientes con otros tipos de cardiopatía.22 En concordancia con estos estudios, en esta serie se observó que un alto porcentaje de pacientes recibió terapias posterior al implante (71%), con una cantidad de terapias por paciente mucho mayor al dado a conocer en series de sujetos con cardiopatía no–chagásica (16 terapias/ pacientes).23 Además se observó que la mayor parte de las arritmias ventriculares se presentó como parte de los episodios de TA (82%). Conolly y colaboradores analizaron el subgrupo de pacientes con CCh del estudio Canadiense de DAI (CIDS),15 en el que se determinó que los pacientes con CCh y un desfibrilador implantado como medida de prevención secundaria presentaban una primera descarga temprana y tenían baja probabilidad de un seguimiento libre de descarga después de la implantación. Asimismo se observó que una importante proporción de pacientes con FEVI mayor de 35% presentaba descargas apropiadas. Todo esto contrasta con lo informado con respecto a pacientes portadores de Cl.15 El sustrato tan arritmógeno observado en los pacientes con CCh se explica por la extensa fibrosis y la cicatrización miocárdica, que provocan anisotropismo no uniforme de la conducción y que forman el sustrato para que se produzcan múltiples sitios de reentrada.24 También la disfunción autonómica, posiblemente mediada por mecanismos inmunitarios, tiene un papel central en la patogenia de la cardiopatía chagásica y en la génesis de las arritmias ventriculares.8
Muratore y colaboradores, en el recientemente publicado Registro Latinoamericano de DAI, que incluyó 89 pacientes con CCh, informan sobre 42% de terapias apropiadas y una prevalencia de TA de 15.7% durante un seguimiento promedio de 12 ± 7 meses. La explicación de la mayor frecuencia determinada en el presente estudio, tanto de terapias apropiadas como de TA, podría ser el mayor deterioro de la función ventricular de los pacientes de nuestra serie con una FE promedio de 30% ± 12% en comparación con 40% ±11% dada a conocer por este autor, así como al tiempo de seguimiento más prolongado (29 vs 12 meses).25
La incidencia general de TA en pacientes con un DAI implantado oscila entre 10% y 28%, y se asocia con un mayor riesgo de muerte cardiaca no súbita.17 Los factores predictivos de TA no se han definido en pacientes con CCh. En el presente estudio se observó que la prevalencia de TA es mucho mayor (42.9%), y requirieron hospitalización 92% de los pacientes. Al igual que lo publicado previamente, los desencadenantes de los episodios de TA no fueron evidentes, ya que sólo 22% de los pacientes tenía un posible factor identificado. Las principales variables que se identifican como predictivas de TA en las publicaciones especializadas son la función ventricular, la edad y la insuficiencia renal crónica.18,19 En la presente población se determinó que los factores asociados con TA en CCh son una FE menor al 35% (89% en aquéllos con TA vs 50% sin TA, p = 0.01), una clase funcional III–IV NYHA (67% vs 43%, p = 0.01) y la ausencia de tratamiento con bloqueadores beta (55%vs100%, p = 0.01).
De manera indirecta se observó que la mayoría de los episodios arrítmicos (80%) es compuesta, es decir, hay TV y FV, mientras que únicamente 20% corresponde a TV aislada. Al analizar estos grupos se pudo observar que de los episodios arrítmicos compuestos (TV/FV), la mayoría corresponde a episodios de TV en donde la estimulación contra la taquicardia no logra revertiría, por lo que se agotan las terapias y se pasa a la cardioversión, o bien, en donde la terapia antitaquicardia acelera la TV a la zona de FV y se aplica la desfibrilación. También se observó que a pesar del éxito inicial de la terapia hay recurrencia temprana de la taquicardia. Estos episodios de TV pueden ser relativamente lentos y, por lo general, son bien tolerados. Entonces surge la interrogante de cuál sería la programación ideal del DAI y si ésta podría contribuir a una mejor evolución del paciente con enfermedad de Chagas y DAI implantado.
La principal interrogante clínica por resolver en pacientes con CCh es si el DAI reduce la mortalidad total con un riesgo aceptable de efectos adversos y complicaciones en comparación con la mejor terapia médica disponible. Cardinalli–Neto demostró que el único predictor independiente de mortalidad en pacientes con CCh y DAI era el número de terapias que entrega el dispositivo,26,27 y sugirió que el DAI podría influir de manera adversa en el curso clínico de los pacientes con CCh porque favorece y exacerba la disfunción ventricular a causa de sus frecuentes descargas, ya que la principal causa de mortalidad en estos pacientes era la IC progresiva, mientras que en el momento del implante del DAI los pacientes se encontraban en clase funcional I NYHA.
La mortalidad general en el grupo de pacientes de este estudio fue de 23%, y en 60% del cual las causas fueron complicaciones relacionadas con insuficiencia cardiaca y el resto se debió a complicaciones no arrítmicas. No se determinaron diferencias significativas entre los grupos con TA (22%) y aquellos sin TA (25%). Debido al número reducido de pacientes de esta serie, no se puede asegurar entonces que la TA o el número de descargas se relacione con deterioro de la IC o mortalidad, sin embargo, Exner y colaboradores demostraron que en pacientes sin enfermedad de Chagas, los que padecían TA fallecían con mayor frecuencia por IC y no de muerte súbita arrítmica,27 aunque otros autores no han podido confirmar este hallazgo.18,19,25 A la fecha, la indicación del DAI se basa en la extrapolación de los resultados de estudios clínicos en pacientes con cardiopatía no–chagásica. No obstante, está demostrado que son diferentes las características y el comportamiento de los pacientes con CCh. Es de suma importancia contar entonces con estudios clínicos y aleatorios para la toma de decisiones en relación con la eficacia y seguridad del DAI en los pacientes con CCh.
Conclusiones
La prevalencia de los episodios de TA en pacientes con CCh es alta. Los factores determinantes del estado funcional del miocárdico como la FEVI y el estado clínico del paciente (clase NYHA), así como la ausencia de tratamiento con bloqueadores beta son los principales factores predictivos de la presencia de TA.
Bibliografía
1. Guzmán–Bracho C. Epidemiology of Chagas disease in Mexico: an update. Trends Parasitol 2001;17(8):372–376. [ Links ]
2. Ramos JL, Muratore C, Pachón–Mateos JC, Rodríguez A, González–Hermosillo A, Asenjo R et al. Prevención primaria y secundaria de muerte súbita en el ICD Registry Latin America. Arch Cardiol Mex 2008;78:400–406. [ Links ]
3. Punukollu G, Gowda RM, Khan IA. Early twentieth century descriptions of the Chagas heart disease. Int J Cardiol 2004;95(2–3): 347–349. [ Links ]
4. Marin–Neto JA, Cunha–Neto E, Maciel BC, Simóes MV. Pathogenesis of chronic Chagas heart disease. Circulation 2007;115(9):1109–1123. [ Links ]
5. Rassi A Jr, Rassi A, Rassi SG. Predictors of mortality in chronic Chagas disease: a systematic review of observational studies. Circulation 2007;115(9):1101 –1108. [ Links ]
6. Rassi A Jr, Rassi A, Little WC, Xavier SS, Rassi SG, Rassi AG, et al. Development and validation of a risk score for predicting death in Chagas' heart disease. N Engl J Med 2006;355(8):799–808. [ Links ]
7. Baroldi G, Oliveira SJ, Silver MD. Sudden and unexpected death in clinically 'silent' Chagas' disease. A hypothesis. Int J Cardiol 1997;58(3):263–268. [ Links ]
8. Bestetti RB, Cardinalli–Neto A. Sudden cardiac death in Chagas' heart disease in the contemporary era. Int J Cardiol 2008;131(1):9–17. [ Links ]
9. Iturralde TP. Estado actual del desfibrilador cardioverter implantable. Arch Cardiol Mex 2002;72 Supl.1 :s86–s90. [ Links ]
10. Mendoza C. Utilidad del desfibrilador automático implantable en la prevención de muerte súbita. Resultados de la medicina basada en evidencia. Arch Cardiol Mex 2007;Supl 2: 44–46. [ Links ]
11. DiMarco JP. Implantable cardioverter–defibrillators. N Engl J Med 2003;349(19):1836–1847. [ Links ]
12. McAnulty J, Halperin B, Larsen KG. Acomparison of antiarrhythmic–drug therapy with implantable defibrillators in patients resuscitated from near–fatal ventricular arrhythmias. The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. N Engl J Med 1997;337(22):1621–1623. [ Links ]
13. Kuck KH, Cappato R, Siebels J, Rüppel R. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation 2000;102(7):748–754. [ Links ]
14. Sheldon R, Connolly S, Krahn A, Roberts R, Gent M, Gardner M. Identification of patients most likely to benefit from implantable cardioverter–defibrillator therapy: the Canadian Implantable Defibrillator Study. Circulation 2000;101 (14):1660–1664. [ Links ]
15. Connolly SJ, Hallstrom AP, Cappato R, Schron EB, Kuck KH, Zipes DP, et al. Meta–analysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmics vs Implantable Defibrillator study. Cardiac Arrest Study Hamburg. Canadian Implantable Defibrillator Study. Eur Heart J 2000;21 (24):2071 –2078. [ Links ]
16. Kadish A, Dyer A, Daubert JP, Quigg R, Estes NA, Anderson KP, et al. Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med 2004;350(21 ):2151 –2158. [ Links ]
17. Exner DV, Pinski SL, Wyse DG, Renfroe EG, Follmann D, Gold M, et al. Electrical storm presages nonsudden death: the antiarrhythmics versus implantable defibrillators (AVID) trial. Circulation 2001;103(16):2066–2071. [ Links ]
18. Credner SC, Klingenheben T, Mauss O, Sticherling C, Hohnloser SH. Electrical storm in patients with transvenous implantable cardioverter–defibrillators: incidence, management and prognostic implications. J Am Coll Cardiol 1998;32(7):1909–1915. [ Links ]
19. Brigadeau F, Kouakam C, Klug D, Marquié C, Duhamel A, Mizon–Gérard F, et al. Clinical predictors and prognostic significance of electrical storm in patients with implantable cardioverter defibrillators. Eur Heart J 2006;27(6):700–707. [ Links ]
20. Hohnloser SH, Al–Khalidi HR, Pratt CM, Brum JM, Tatla DS, Tchou P, et al. Electrical storm in patients with an implantable defibrillator: incidence, features, and preventive therapy: insights from a randomized trial. Eur Heart J 2006;27(24):3027–3032. [ Links ]
21. Carbucicchio C, Santamaría M, Trevisi N, Maccabelli G, Giraldi F, Fassini G, et al. Catheter ablation for the treatment of electrical storm in patients with implantable cardioverter–defibrillators: short–and long–term outcomes in a prospective single–center study. Circulation 2008;117(4):462–469. [ Links ]
22. Muratore C, Rabinovich R, Iglesias R, González M, Darú V, Liprandi AS. Implantable cardioverter defibrillators in patients with Chagas' disease: are they different from patients with coronary disease? Pacing Clin Electrophysiol 1997;20:194–197. [ Links ]
23. Rabinovich R, Muratore C, Iglesias R, Gonzalez M, Darú V, Valentino M, et al. Time to first shock in implantable cardioverter defibrillator (ICD) patients with Chagas cardiomyopathy. Pacing Clin Electrophysiol 1999;22:202–205. [ Links ]
24. Micheli A, Aranda A, Iturralde P, Medrano A. En torno a las arritmias ventriculares en la miocardiopatía chagásica crónica. Arch Cardiol Mex 2006;76(3):320–323. [ Links ]
25. Muratore CA, Batista Sa LA, Chiale PA, Eloy R, Tentori MC, Escudero J et al. Implantable cardioverter defibrillators and Chagas' disease: results of the ICD Registry Latin America. Europace 2009;11:164–168. [ Links ]
26. Cardinalli–Neto A, Greco OT, Bestetti RB. Automatic implantable cardioverter–defibrillators in Chagas' heart disease patients with malignant ventricular arrhythmias. Pacing Clin Electrophysiol 2006;29:467–470. [ Links ]
27. Cardinalli–Neto A, Bestetti RB, Cordeiro JA, Rodrigues VC. Predictors of all–cause mortality for patients with chronic Chagas' heart disease receiving implantable cardioverter defibrillator therapy. J Cardiovasc Electrophysiol 2007;18(12):1236–1240. [ Links ]














