Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.79 n.3 Ciudad de México Jul./Sep. 2009
Investigación clínica: cirugía cardiovascular
Diagnóstico de infarto miocárdico perioperatorio dentro de las primeras 72 horas posteriores a la cirugía cardiaca
Diagnosis of perioperative myocardial infarction within the first seventy–two hours after cardiac surgery
Gustavo Díaz–Arrieta,1 José de Jesús Rincón–Salas,2 María Elena Reyes–Sánchez,3 Marisela Urzua–Zamarripa,4 Juan Carlos Mendieta–Tapia,4 María Elsa Mendoza–Hernández,5 Lucía Concepción Valenzuela–Molina,4 Sofía Jiménez–Lomas,4 Luis David Sánchez–Velázquez,6 José Fernando Amador–Santander,4 Laura Vázquez–Pavón,4 René Méndez–Lucero,4 David Venegas–Álvarez,1 Luis Pedro Ambriz–Nava,4 y Silvia Alejandra Ortega–Alvarado7
1 Médico cardiólogo adscrito a la Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Hospital General Dr. Caudencio González Garza. Centro Médico Nacional La Raza. IMSS. Vallejo y Jacarandas sin número, colonia La Raza. México, D.F. Teléfono: 5724 5900 Ext. 23427.
2 Médico especialista urgencias medicoquirúrgicas adscrito a la Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Hospital General Dr. Caudencio González Garza. Centro Médico Nacional La Raza. IMSS. Vallejo y Jacarandas sin número, colonia La Raza. México, D.F. Teléfono: 5724 5900 Ext. 23427.
3 Médica especialista en el enfermo en estado crítico Jefa de la Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Hospital General Dr. Caudencio González Garza. Centro Médico Nacional La Raza. IMSS. Vallejo y Jacarandas sin número, colonia La Raza. México, D.F. Teléfono: 5724 5900 Ext. 23427.
4 Médico especialista en el enfermo en estado crítico adscrito a la Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Hospital General Dr. Caudencio González Garza. Centro Médico Nacional La Raza. IMSS. Vallejo y Jacarandas sin número, colonia La Raza. México, D.F. Teléfono: 5724 5900 Ext. 23427.
5 Médica internista adscrita al servicio de Medicina Interna. Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Hospital General Dr. Caudencio González Garza. Centro Médico Nacional La Raza. IMSS. Vallejo y Jacarandas sin número, colonia La Raza. México, D.F. Teléfono: 5724 5900 Ext. 23427.
6 Doctor en Ciencias Médicas adscrito a la Unidad de Investigación del Centro Médico Nacional Siglo XXI. IMSS.
7 Médica internista Jefa de la División de Cardioneumología y Medicina. Unidad de Terapia Intensiva Postquirurgica Cardiovascular. Hospital General Dr. Caudencio González Garza. Centro Médico Nacional La Raza. IMSS. Vallejo y Jacarandas sin número, colonia La Raza. México, D.F. Teléfono: 5724 5900 Ext. 23427.
Autor para correspondencia:
Gustavo Díaz Arrieta.
Retorno 2 de Ings. Militares. Edificio 53–B, depto.203.
Unidad Habitacional Lomas de Sotelo. México, D.F.
C.P. 11200,
Teléfono: 55 57 35 41. Fax: 55 57 12 53.
Correo electrónico: gustavodiazarrieta@yahoo.com
Recibido el 08 de octubre de 2008.
Aceptado el 24 de abril de 2009.
Resumen
Una de las complicaciones más frecuentes de la cirugía cardiaca es el infarto miocárdico perioperatorio (IMP). Su incidencia muestra una variación amplia debido a la dificultad para su diagnóstico en el postoperatorio temprano. Los objetivos del presente estudio fueron determinar, en nuestra población de pacientes, la incidencia de IMP en las primeras 72 horas del postoperatorio de cirugía de corazón, así como las asociaciones entre los criterios aceptados para el diagnóstico de esta entidad.
Pacientes y métodos: Se estudiaron 164 pacientes adultos sometidos a cirugía cardiaca electiva. Contando con estudios básales preoperatorios, se les realizaron otros electrocardiográficos, enzimáticos [determinación sérica de la banda miocárdica de la creatinfosfocinasa (CK–MB)] y ecocardiográficos seriados durante las primeras 72 horas del postoperatorio. El diagnóstico de IMP fue establecido con dos o los tres criterios positivos [electrocardiográfico (ECG), enzimático (CK–MB) y ecocardiográfico (ECO)].
Resultados: En 24 (15%) pacientes fue diagnosticado IMP. Dentro de dicho grupo, en 13 (54%) pacientes fueron positivos los 3 criterios. En 8 (33%) la CK–MB y el ECO y en 3 (13%) la CK–MB y el ECG.
Conclusiones: En la población estudiada, la incidencia de IMP (15%) coincide con la reportada en la literatura. En la mayoría de los casos de IMP, los 3 criterios diagnósticos, son positivos. Cuando el diagnóstico se realiza con sólo 2 criterios positivos, en la mayoría de los casos éstos son la CK–MB y el ECO.
Palabras clave: Diagnóstico; Infarto miocárdico perioperatorio; Cirugía cardiaca.
Abstract
One of the most frequent complications of cardiac surgery is the perioperative myocardial infarction (PMI). Incidence of PMI shows a wide variation because an accurate detection of this complication is difficult in the early postoperative stage. The objectives of the present study were to determine in our population of patients the incidence of PMI during the first seventy two hours after cardiac surgery as well as associations among the accepted criteria to diagnose this complication.
Patients and methods: One hundred sixty four adults patients undergoing elective cardiac surgery were studied. With baselines preoperative studies, serial electrocar–diographic, enzymatic [(determination of serum creatine kinase isoenzyme (CK–MB)] and echo–cardiographic studies were performed during the first 72 hours after cardiac surgery. Diagnosis of PMI was established with two or all the three positive criteria [electrocardiographic (ECG), enzymatic (CK–MB) and echocardiographic (ECHO)].
Results: In 24(15%) patients PMI was diagnosed. In this group 13(54%) all the three criteria were positive. In 8(33%) patients CK–MB and ECHO were positive. In 3(13%) patients CK–MB and ECG were positive.
Conclusions: In our population the incidence of PMI (15%) is agree with the reported in previous studies. In most of cases of PMI all the three diagnostic criteria are positive. When diagnosis is established only with two criterial, in most of cases these are CK–MB and ECHO.
Key words: Diagnostic; Perioperative myocardial infarction; Cardiac surgery.
Antecedentes
El infarto miocárdico perioperatorio (IMP) es una de las complicaciones más serias que pueden enfrentar los pacientes sometidos a cirugía de corazón.1–22
De acuerdo con los estudios publicados, el IMP tiene una incidencia de 2 a 30%.14 Tan amplia variación numérica obedece a la dificultad para llevar a cabo una detección precisa en el postoperatorio temprano de la cirugía cardiaca, así como a las diferencias en los criterios diagnósticos utilizados.1,2,14
Aunque los pacientes operados de revascularización miocárdica con puentes aortocoronarios (RVM) integran la mayoría de los casos, este problema también se presenta en pacientes intervenidos quirúrgicamente por cardiopatías distintas a la isquémica debida a la aterosclerosis coronaria.9,14,19,20
Los pacientes con IMP tienen peor pronóstico. Aproximadamente un 15% de los enfermos operados de corazón que desarrollan IMP sufren choque cardiogénico.14 Además, hasta 49% de los pacientes con IMP tienen eventos cardiacos adversos después de 2 años.5
La detección postoperatoria del IMP puede representar dificultades por varios motivos:
En las primeras horas posteriores a la cirugía puede no contarse con evidencia sintomática por el efecto anestésico residual y la intubación endotraqueal.
Ocurre también que en ocasiones puede ser confundido el dolor producido por isquemia con el generado por la incisión de la pared del tórax, la pleura, por la colocación de las sondas torácicas y/o por pericarditis.8
Además, debido a los efectos de la derivación cardiopulmonar, hipotermia, pericarditis postoperatoria, la permanencia de las sondas torácicas y/o medicamentos (digoxina) pueden observarse una gran variedad de anomalías inespecíficas del segmento ST y de la onda T, que no deben tomarse como base para diagnosticar el IMP.68
Tomando en cuenta lo anterior, los cambios electrocardiográficos registrados apoyan el diagnóstico de IMP cuando se observa un patrón evolutivo característico.58,15,16
La existencia de onda Q con duración mayor de 0.04 s, de reciente aparición y que persiste en los registros electrocardiográficos seriados (que pueden originarse casi de manera inmediata, varias horas después o incluso días posteriores a la cirugía) es uno de los signos diagnósticos más confiables.68Asimismo, la reducción de las ondas R mayor del 25% en por lo menos dos derivaciones correspondientes ha sido considerado como criterio electrocardiografía) de IMP.17,22
En relación con el criterio enzimático para el diagnóstico de esta complicación diversos marcadores bioquímicos han sido propuestos a través del tiempo.1–15,17,19–22 La CK–MB es uno de ellos y mantiene un lugar entre los utilizados actualmente en la evaluación diagnóstica del IMP.1,5,14.15.17,22
Puesto que la liberación de CK y CK–MB ocurre comúnmente durante la cirugía cardiaca, no debe diagnosticarse infarto del miocardio a menos que la elevación de la CK–MB sea significativa.2
Califf y colaboradores, después de su extensa evaluación sobre mionecrosis posterior a procedimientos de revascularización, concluyeron que aquellos pacientes con elevaciones de CK–MB de 5 veces o más en relación con el límite superior, después de la cirugía cardiaca, deben ser considerados pacientes con IMP.6
Por último, en el diagnóstico de IMP, además de los criterios enzimáticos y electrocardiográfico, el ecocardiográfico es el tercero aceptado. El movimiento anormal circunscrito a uno o más segmentos parietales es el dato a considerar, en particular cuando es posible demostrar que se trata de una alteración nueva en comparación con un estudio ecocardiográfico preoperatorio.3,10,12,14,17,22
Los criterios aceptados hasta el momento para el diagnóstico de IMP son los mismos (el electrocardiográfico, el enzimático y el ecocardiográfico o de medicina nuclear) independientemente de la patología cardiaca del paciente operado de corazón. Sin embargo, la positividad de dichos criterios, así como la relación encontrada entre ellos al establecer el diagnóstico de IMP muestra diferencias significativas entre los diversos estudios publicados sobre el tema.3–7,12–17
Los objetivos de nuestro trabajo fueron determinar la tasa de incidencia de IMP dentro de las primeras 72 horas posteriores a la cirugía de corazón, así como la frecuencia de presentación de cada uno de los criterios diagnósticos de IMP, además de las asociaciones que se establecen entre ellos al diagnosticar esta complicación en la población de pacientes que son operados en nuestro centro hospitalario.
Pacientes y métodos
Población de estudio
Durante el periodo comprendido del 01 de abril del 2005 al 30 de septiembre del 2005 fueron estudiados pacientes mayores de 17 años de edad, operados de cirugía cardiaca electiva quienes ingresaron a la Unidad de Terapia Intensiva Postquirúrgica Cardiovascular (UTPQX) del Hospital General "Dr. Gaudencio González Garza" del Centro Médico Nacional "La Raza", inmediatamente después de haber finalizado el acto quirúrgico. Fueron incluidos pacientes operados de RVM, cirugía valvular cardiaca y cierre de defectos septales congénitos. Las indicaciones para el procedimiento quirúrgico fueron: Angina estable (12), angina inestable (72), infarto reciente (3), insuficiencia cardiaca (81) (Tabla 1).

Los pacientes contaban por lo menos con un electrocardiograma de superficie de 12 derivaciones, una determinación enzimática de CK–MB y un estudio ecocardiográfico preoperatorios. No fueron incluidos pacientes que cursaran con alguno de los síndromes coronarios agudos, que hubiese iniciado dentro de las 72h previas a la cirugía, así como pacientes con CK–MB prequirúrgica sobre valores normales y/o ECG que mostrara alteraciones isquémicas agudas o bloqueo de la rama izquierda del haz de Hiss (BRIHH).
De igual manera, no fueron considerados para el estudio, pacientes con diagnósticos preoperatorios documentados de hipotiroidismo o miopatías, así como pacientes sometidos a cardioversión o desfibrilación eléctricas a consecuencia de arritmias ocurridas en el transoperatorio. Cada uno de los pacientes consintió en participar en el estudio y el protocolo fue aprobado por el Comité de Investigación del Hospital.
Anestesia y técnica operatoria
Todos los pacientes fueron premedicados 1 hora antes de la cirugía con diazepam (0.1 mg/kg). La anestesia fue inducida con fentanilo (10 μ/kg a 25 μ/kg), diazepam (0.1 mg/kg a 0.2 mg/kg y vecuronio (0.1 mg/kg) y mantenida con suplementos de las mismas drogas y bajas concentraciones de sevoflorane (0.6% a 1.0%).
En todos los casos se llevó a cabo monitoreo electrocardiográfico continuo, mediciones de la tensión arterial radial, de la presión venosa central y en la mayoría de los casos de la tensión en la arteria pulmonar, así como de la diuresis.
Los valores de electrolitos séricos, gases arteriales, glucemia y hemoglobina fueron medidos cada 30 minutos. Se administró heparina (3 mg/kg a 5 mg/kg) antes del inicio de la circulación extracorpórea. El procedimiento quirúrgico fue realizado por esternotomía media y canulación de la raíz aórtica, así como de la aurícula derecha. La cirugía fue realizada haciendo uso de las técnicas estándar de circulación extracorpórea con bomba de oxigenación e hipotermia sistémica moderada (22 °C a 25 °C). Todos los procedimientos (anastomosis coronarias, plastías y cambios valvulares, así como cierre de defectos septales congénitos) fueron terminados durante un solo periodo de pinzamiento aórtico. El paro cardiaco fue alcanzado por infusión de solución cardiopléjica cristaloide fría con potasio (4°C) inicialmente administrada anterógrada y retrógradamente, y repetida cada 30 minutos por vía retrógrada.
Electrocardiograma
Al ingreso a la UTPQX, de cada paciente se obtuvo un electrocardiograma de superficie de 12 derivaciones, así como a las 8,16, 24, 48 y 72 horas con un electrocardiógrafo de un canal marca Burdick, modelo EK 10. Cuando en alguno de los registros electrocardiográficos obtenidos en los tiempos señalados con anterioridad se observó desnivel positivo del segmento ST igual o mayor de 2 mm, onda Q incipiente de nueva aparición o reducción en la amplitud de la R > 25% en dos o más derivaciones correspondientes, continuaron los seguimientos electrocardiográfico y enzimático cada 8 horas durante las 24 horas siguientes, para después continuar cada 24 horas hasta el término de las 72 horas posteriores al primer registro con las alteraciones descritas. Cada registro fue interpretado por lo menos por dos médicos (cardiólogos e intensivistas) con experiencia en el análisis de este tipo de estudios.
Determinación enzimática
En cada paciente fue tomada una muestra de sangre venosa (3 ml) en un tubo, sin anticoagulante, y enviada al laboratorio para determinación de CK–MB, al ingreso a la UTPQx, a las 8, 16, 24, 48 y 72 horas. Se empleó un aparato marca I lab 600 y el método enzimático ultravioleta para dichas determinaciones. Los valores normales considerados fueron de 1.5 U/L – 18.5 U/L. Cuando fueron reportados valores de CM–MB > 92.5 U/L (5 veces el valor normal máximo) en cualquiera de las determinaciones hechas en los tiempos antes señalados, se continuó el seguimiento enzimático y electrocardiográfico cada 8 horas durante las 24 horas siguientes, para después continuar cada 24 horas hasta el término de las 72 horas, posteriores a la primera alteración descrita.
Ecocardiograma
Se realizó un ecocardiograma transtorácico en modos bi–dimensional, M y Doppler a todo paciente que presentó, durante el seguimiento enzimático, un valor de CK–MB > 92.5 U/L (criterio enzimático positivo) y/u ondas Q de reciente aparición o en su defecto pérdida en el voltaje de la R > 25% en relación con el estudio preoperatorio que persistieron en los registros electrocardiográficos seriados (criterio electrocardiográfico positivo). Se usó un ecocardiógrafo marca Hewlett Packard, modelo Agilent SONOS 5500 con transductor de 2.5MHz. La movilidad segmentaria ventricular fue evaluada en vistas paraesternales en ejes largo y corto, así como apicales de dos y cuatro cámaras, atendiendo al esquema de 16 segmentos establecido por la Sociedad Americana de Ecocardiografía.
En las vistas apicales de 4 cámaras y 2 cámaras fue determinada la FEVI por el método de Simpson modificado y se obtuvo un promedio con los resultados.
En pacientes con ventana ecocardiográfica inadecuada para una visualización correcta se realizó ecocardiograma transesofágico.
En todos los casos el ecocardiograma se llevó a cabo después de un periodo no menor de 48 horas consideradas a partir del ingreso del paciente a la UTPQx.
Todos los ecocardiogramas fueron realizados por personal médico (cardiólogos e intensivistas) con adiestramiento específico para efectuar este tipo de estudios. En aquellos casos en que surgió duda en relación con alguno de los hallazgos, los estudios fueron revisados por los 3 operadores asignados a su realización y las decisiones alcanzadas por consenso.
Durante el estudio, la observación de segmentos hipocinéticos, acinéticos o discinéticos, en modos bidimensional y M del ecocardiograma no documentados en estudios previos al acto quirúrgico, fue considerada como criterio ecocardiográfico positivo.
El IMP fue diagnosticado cuando fueron positivos por lo menos 2 de los siguientes criterios:
1) Valor de CK–MB > 92.5 Ul/L (5 veces el límite superior de normalidad) durante las primeras 72 horas del postoperatorio.
2) Presencia de ondas Q con duración >0.04 s y/o pérdida en el voltaje de la R > 25% ambas de reciente aparición, observadas en dos o más derivaciones correspondientes a una misma cara y persistentes en los registros electrocardiográficos seriados.
3) Existencia de alteraciones en la movilidad segmentaria tales como hipocinesia, acinesia o discinesia, observadas mediante ecocardiografía bidimensional y M no documentadas en estudios ecocardiográficos previos al acto quirúrgico.
Análisis estadístico
Se llevó a cabo estadística descriptiva empleando medidas de tendencia central y de dispersión, proporciones y tasa de incidencia acumulada de infarto perioperatorio así como de mortalidad relacionada con el mismo.
Para la estadística inferencial se utilizaron Prueba de T de student para comparación de medias y prueba de x2 para comparación de proporciones. La significancia estadística se estableció con p < 0.05
Todos los cálculos fueron realizados usando el paquete estadístico SPSS v. 13 (SPSS®, Chicago, IL, USA).
Resultados
Fueron incluidos en el estudio 164 pacientes cuyas características demográficas y clínicas preoperatorias se muestran en la Tabla 1.
Ochenta y seis (53%) pacientes habían sido sometidos a cirugía de revascularización miocárdica y 78 (47%) a cirugías de cambio valvular y cierre de defectos septales congénitos (Tabla 2).
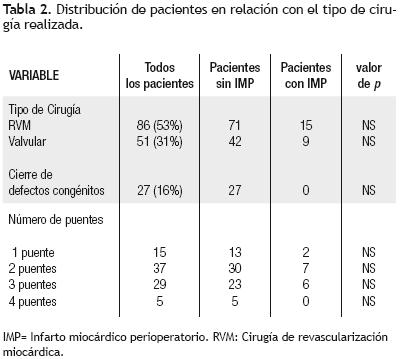
De los 27 (16%) pacientes en quienes se había llevado a cabo cierre quirúrgico de defectos septales congénitos, en 26 se realizó cierre de comunicación interauricular (CÍA) y en un paciente se efectuó cierre de comunicación interventricular (CIV).
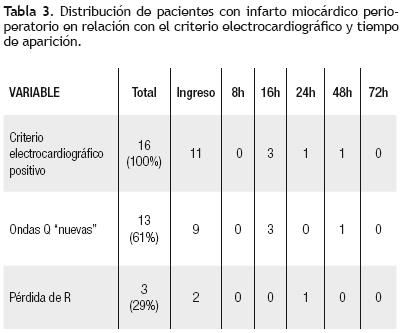
De la totalidad de los pacientes, en 16 (10%) estuvo presente el criterio electrocardiográfico y en la mayoría de ellos desde el registro de ingreso (Tabla 3). En 12 pacientes las alteraciones electrocardiográficas fueron observadas en la cara inferior, en 2 en la cara anterior y en los 2 restantes en la cara lateral.
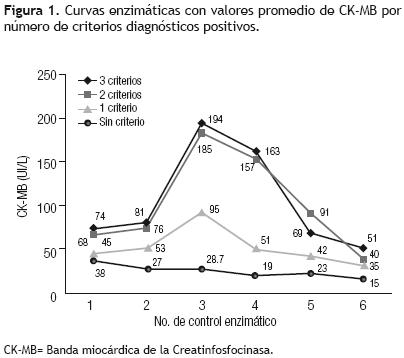
El criterio enzimático fue positivo en 60 (37%) pacientes. El valor máximo (pico) de CK–MB en ese grupo de pacientes fue de 264±85U/L (Figura 1).
En 13 de los pacientes que tuvieron el criterio enzimático, fueron positivos también los otros dos criterios (Tabla 4).
En 76 (46%) pacientes se realizó ecocardiograma por haber sido positivos los criterios electrocardiografico y/o enzimático. En 21 (13%) fueron observados trastornos en la movilidad segmentaria que no fueron evidenciados en ecocardiogramas realizados antes de la cirugía. En 12 pacientes dicha alteración se observó en la cara inferior, en 5 en la cara anterolateral y en 4 en la cara anterior.
En 22 pacientes se realizó estudio transesofágico por mala ventana ecocardiográfica. Se estableció el diagnóstico de IMP en 24 (15%) pacientes (Tabla 4). La incidencia relativa de IMP entre pacientes operados de RVM fue de 17.4% y entre los operados de cirugía valvular de 17.6% (p = NS).En ninguno de los pacientes que fueron intervenidos quirúrgicamente para cierre de defectos septales congénitos se estableció el diagnóstico de IMP, aun cuando 16 (59%) de ellos tuvieron criterio enzimático positivo (Tabla 4).
Del total de casos de IMP en 13 (54%) pacientes fueron positivos los tres criterios y en 11 (46%) sólo dos. En 8 (33%) fueron positivos los criterios enzimático y ecocardiográfico y en los 3 (13%) restantes el enzimático y el electrocardiografico (Tabla 4). El diagnóstico apoyado en los 3 criterios fue establecido con mayor frecuencia en los pacientes que habían sido intervenidos de RVM en relación con aquellos que habían sido operados de cirugía valvular (p < 0.0002) (Tabla 4).
En todos los pacientes con IMP el criterio enzimático fue positivo y los valores máximos (pico) de CK–MB fueron encontrados en la determinación realizada a las 16 horas a partir del ingreso a la UTPQx (3er control). Dichos valores en todos los casos fueron superiores a 120UI/L (Figura 1). Los valores de CK–MB obtenidos en los primeros 3 controles, incluyendo el valor pico de la enzima fueron significativamente más altos en los grupos de pacientes que tuvieron 2 y 3 criterios diagnósticos positivos en relación con el que tuvo 1 criterio positivo solamente (p < 0.003), así como frente al grupo que no cubrió criterio alguno (p < 0.0002) (Figura 1). No existieron diferencias significativas en relación con los valores de CK–MB encontrados en los controles mencionados anteriormente entre el grupo con 3 criterios positivos y el grupo con 2 criterios. Por otro lado, los niveles de CK–MB en los grupos que reunieron 2 y 3 criterios (pacientes con IMP) se mantuvieron en rangos de positividad durante más tiempo en relación con los grupos con 1 criterio y sin criterio diagnóstico (p = 0.04) (Figura 1). En el control 6 (72 horas) los valores enzimáticos continuaban por arriba de 30 Ul/L (aun cuando ya no se encontraban en el rango de positividad) en los grupos con 3, 2 y 1 criterio positivos (Figura 1). Sólo en el grupo sin criterio diagnóstico para IMP, los valores de CK–MB en el control 6 se encontraban ya dentro de la normalidad (Figura 1). Cuando el diagnóstico de IMP fue realizado con 2 criterios donde uno de ellos fuera el ecocardiográfico el otro siempre fue el enzimático. En ningún caso se estableció el diagnóstico con los criterios electrocardiográfico y ecocardiográfico únicamente.
No fueron encontradas diferencias significativas en relación con la prevalencia de factores de riesgo aterogénico, FEVI prequirúrgica ni antecedente de infarto del miocardio previo a la cirugía entre los grupos de pacientes con y sin IMP (Tabla 1). Sin embargo, los tiempos de anestesia, de derivación cardiopulmonar (TDCP) y de pinzamiento aórtico (TPA) fueron significativamente más prolongados en el grupo de pacientes con infarto.
El sangrado transquirúrgico también fue mayor en el grupo de pacientes con diagnóstico de IMP (Tabla 5).
No existieron diferencias significativas en relación con las variables antes mencionadas entre el grupo con 3 criterios diagnósticos positivos y el grupo con 2 criterios. Las complicaciones perioperatorias que se presentaron durante el periodo de estudio fueron hipertensión arterial sistémica descontrolada en 15 (9%) pacientes, arritmias ventriculares en 11 (7%), choque cardiogénico en 10 (7%), arritmias supraventriculares en 7 (4%) y tamponade en 2 (1%). En el grupo de pacientes con IMP sólo fueron significativamente más frecuentes las arritmias ventriculares (p < 0.005) y el choque cardiogénico (p < 0.04).
Discusión
El IMP es una complicación grave que puede presentarse después de cualquier cirugía de corazón y no sólo de la RVM.
La gran mayoría de los estudios publicados sobre el tema han sido realizados en pacientes de cirugía coronaria, siendo escasos aquellos efectuados en pacientes intervenidos de cirugía valvular y más todavía de cirugía correctiva de defectos cardiacos congénitos, aun cuando la causa principal de morbimortalidad precoz de la cirugía cardiaca valvular convencional, es el choque cardiogénico postoperatorio que puede ser producido por isquemia, aturdimiento o infarto agudo del miocardio.14
Y es que en la patogénesis del IMP se ha demostrado la participación de varios mecanismos y no sólo oclusión arterial coronaria.1,6 De hecho desde hace varios años se ha demostrado en grandes estudios necrópsicos de pacientes operados de cirugía coronaria que usualmente los injertos son permeables en casos fallecidos con IMP.23
En el contexto de la cirugía de RVM con puentes aortocoronarios algunos de los mecanismos involucrados, efectivamente guardan relación con el injerto como son la oclusión, la torsión y la compresión del puente, así como la estenosis en el sitio de la anastomosis o el espasmo del puente. Sin embargo, existen otros no relacionados con el injerto que pueden presentarse tanto en la cirugía de RVM como en otros tipos de cirugía cardiaca, tales como la perfusión cardiopléjica y protección miocárdica inadecuadas y la microembolización coronaria distal por manipulación quirúrgica.1
El diagnóstico de IMP puede ofrecer ciertas dificultades. Debido a que existen limitaciones en la interpretación de cada una de las pruebas de laboratorio y gabinete empleadas para su diagnóstico, es necesaria la combinación de los resultados obtenidos con ellas para lograr una mayor precisión en el mismo.
En el presente trabajo estudiamos el IMP utilizando para su diagnóstico el electrocardiograma, como herramienta de imagen el ecocardiograma y como prueba enzimática las determinaciones seriadas de CK–MB.
Aun cuando han surgido con el paso del tiempo nuevos marcadores bioquímicos de necrosis miocárdica, la CK–MB, ésta enzima ha continuado vigente como una de las herramientas de laboratorio utilizadas para el diagnóstico de IMP.6,15 Esta enzima cuenta además con la ventaja de una mayor disponibilidad en nuestras instituciones de salud.
Es cierto que isoformas cardiacas de la troponinas particularmente la troponina (cTnl), han mostrado tener en estudios diversos mayor sensibilidad y especificidad que la CK–MB para la detección de necrosis miocárdica,1,5,11–14 Sin embargo, otros han mostrado que la CK–MB y la cTnl tienen una sensibilidad similar para detectar infarto agudo del miocardio.24–2
Ahora bien, en lo referente a la especificidad de la CK–MB ha sido demostrado que ésta es altamente dependiente de la magnitud de su incremento sobre los valores de normalidad. Así, ha quedado establecido con base en los resultados de múltiples estudios, que una elevación de esta enzima 5 veces o más sobre el límite normal constituye una sólida evidencia de lesión miocárdica en el periodo postoperatorio y que como en el caso de la troponina I también tiene implicaciones pronosticas.6
Por otro lado, si bien es cierto que los niveles de CK–MB no son capaces de discriminar entre IMP relacionado con el injerto de aquél que no lo ésta como lo hace la cTnl, sí ha demostrado tener un poder mayor y más temprano para discriminar entre IMP "en general" y la liberación "inherente" de marcadores cardiacos posterior a cualquier cirugía de revascularización miocárdica.1
Haciendo uso de los 3 criterios aceptados para establecer el diagnóstico de esta complicación, en el presente estudio encontramos una incidencia de IMP de 15% en nuestra población con base en la positividad de por lo menos 2 de ellos.
Dicha afra es acorde con las reportadas por otros autores que sobre el tema han publicado en años recientes.1,14
En nuestra investigación, la mayoría de los pacientes con diagnóstico de IMP reunieron los 3 criterios a diferencia de lo ocurrido en otras series como la de Guiteras y colaboradores en que el diagnóstico fue establecido con sólo con dos de ellos en la mayoría de los casos.2 Sin embargo, debe considerarse que en dicho estudio fue utilizada la medicina nuclear (pirofosfato de tecnecio 99) como criterio de imagen y no el ecocardiograma, lo que pudo contribuir a tal diferencia. En la población total de pacientes que estudiamos el criterio que fue cubierto con mayor frecuencia fue el enzimático, seguido del ecocardiográfico y por último el electrocardiográfico.
En el grupo con IMP en todos los casos la CK–MB fue encontrada en niveles de positividad, sin embargo muchos pacientes sin infarto también mostraron criterio enzimático positivo, como fue el caso de más de la mitad de pacientes que habían sido operados de cierre de CÃA, que cubriendo el criterio enzimático no sumaron alguno de los otros dos. En este grupo en particular, tal situación puede ser atribuida a la liberación de enzimas musculares originada tanto por la auriculotomía como por la sutura del parche que se coloca para cerrar el defecto septal durante la cirugía.
Por otro lado, aun cuando el criterio electrocardiográfico fue de los 3 el que con menor frecuencia estuvo presente en la población estudiada, en la mayoría de los casos su positividad se asoció con el diagnóstico de IMP.
Los hechos antes mencionados son acordes con lo reportado por González– Hermosillo y colaboradores quienes determinaron en relación con las enzimas cardiacas (CK–MB) para el diagnóstico de IMP una sensibilidad relativa de 100% y una especificidad relativa de 71.8% frente al electrocardiograma con 71.4% y 97.5, respectivamente.21
Sobre este último punto nuestros resultados son también congruentes con los obtenidos por Greenson y colaboradores quienes en su estudio realizado en pacientes operados de RVM y de CVA reportaron una especificidad del electrocardiograma de 90% con baja sensibilidad para el diagnóstico de IMP.5
En ninguno de los pacientes en quienes establecimos el diagnóstico de infarto con 2 criterios únicamente, encontramos la asociación de los criterios electrocardiográfico y ecocardiográfico.
El ecocardiograma mostró mayor utilidad en pacientes que tuvieron incremento en la liberación de CK–MB únicamente, que en aquéllos que sólo habían mostrado las alteraciones electrocardiográficas características.
En nuestra investigación no encontramos diferencias significativas en relación con las variables prequirúrgicas evaluadas entre los grupos con y sin infarto. Sin embargo, las variables quirúrgicas que mostraron relación significativa con la incidencia de IMP estuvieron tuvieron que ver en su conjunto con isquemia miocárdica transoperatoria, lo cual sugiere que el incremento en el tiempo del procedimiento y la pérdida de sangre durante el mismo son los mayores determinantes de IMP.
Limitaciones del estudio
El presente estudio tiene algunas limitaciones: Una de ellas tiene que ver con el hecho de que el seguimiento ecocardiográfico postoperatorio que se dio a los pacientes, no fue seriado ni por un tiempo mayor de 72 horas, condición que pudo ser detectada como alteraciones "nuevas" en la movilidad parietal compatibles con infarto, en realidad trastornos debidos al aturdimiento miocárdico postquirúrgico que hubiesen revertido con el paso de los días.
Aun cuando buscando atenuar tal riesgo, los estudios ecocardiográficos en ningún caso fueron realizados antes de 48 horas a partir del ingreso de los pacientes a la terapia intensiva y que sólo fueron consideradas positivas las alteraciones segmentarias y no globales de la movilidad, cabe la posibilidad de haber sobreestimado la positividad ecocardiográfica.
Otra limitación tiene que ver con la disminución en la sensibilidad tanto de la electrocardiografía como de la ecocardiografía para detectar necrosis aguda perioperatoria que anatómicamente no tenga distribución transmural, sino preferentemente subendocárdica. Ésta se caracterizaría por ausencia de nuevas ondas Qy podría dar alteraciones sutiles en la movilidad parietal que no hubieran sido detectadas con el ecocardiograma, existiendo la posibilidad de que dichas zonas de necrosis hubiesen existido en algunos de los pacientes que tuvieron el criterio enzimático positivo.
De igual manera, sin bien la presente investigación nos permitió conocer la incidencia de IMP en pacientes operados de corazón en nuestro hospital; es cierto que en ella fueron incluidos enfermos con patologías heterogéneas, que no proporciona información intra ni intergrupal referente al grado de participación de factores relacionados y no relacionados con el injerto y que por ello tampoco permite establecer comparaciones de causalidad de IMP entre los tres grupos.
Para obtener información sobre todos los puntos antes citados, habrán de ser realizados futuros estudios con el diseño y elementos de evaluación adecuados para tales propósitos.
Conclusiones
El presente trabajo muestra que la incidencia global de IMP en la población estudiada es acorde con la reportada en la literatura y que en la mayoría de los casos al efectuar el diagnóstico de esta complicación están presentes los 3 criterios aceptados.
Cuando el diagnóstico se realiza sólo con 2 criterios, la asociación más frecuente se da entre el enzimático y el ecocardiográfico.
El criterio electrocardiográfico es el que con menor frecuencia es encontrado en los pacientes operados de corazón sin embargo, su presencia se relaciona en la mayoría de los casos con el diagnóstico de IMP.
Nuestra investigación deja claro que el IMP es un problema que se presenta no sólo en pacientes operados de RVM, sino también en operados de cirugía valvular cardiaca y se asocia con el desarrollo de graves complicaciones como arritmias ventriculares y choque cardiogénico por lo que debe realizarse en forma rutinaria su búsqueda temprana.
Bibliografía
1. Thielmann M, Massoudy P, Schmermund A, Neuhäuser M, Marggraf G, Kamler M, et al. Diagnostic discrimination between graft–related and non–graft–related perioperative myocardial infarction with cardiac troponin I after coronary artery bypass surgery. Eur Heart J 2005;26:2440–7. [ Links ]
2. Guiteras P, Conrad L, Galinanes M, Jais J, Chaitman B, Dupras G, et al. Diagnostic criteria and prognosis of perioperative myocardial infarction following coronary bypass. J Thorac Cardiovasc Surg 1983;86:878–86. [ Links ]
3. Greaves S, Rutherford J, Aranki S, Cohn L, Couper G, Adams D, et al. Current incidence and determinants of perioperative myocardial infarction in coronary artery surgery. Am Heart J 1996;132:572–8. [ Links ]
4. Force T, Hibberd P, Weeks G, Kemper A, Blomfield P, Tow D, et al Perioperative myocardial infarction during coronary artery bypass surgery–begin event or prognostic omen? Circulation 1990;82:903–8. [ Links ]
5. Greenson N, Macoviak J, Krishnaswamy P, Morrisey R, James C, Clopton P, et al. Usefulness of cardiac troponin I in patients undergoing open heart surgery. Am Heart J 2001;141:447–55. [ Links ]
6. Califf R, Abdelmeguid A, Kuntz R, Popma J, Davidson C, Cohen E, et al. Myonecrosis after revascularization procedures. J Am Coll Cardiol 1998;31:241–51. [ Links ]
7. Bruss J, Meyerowitz C, Greenspan A, Spielman S. The significance of the electrocardiogram after open heart surgery. En: Kotler M, Alfieri A. editors. Cardiac and noncardiac complications of open heart surgery: Prevention, diagnosis and treatment. Ed Mt. Kisco, N.Y. Futura 1992. p 130–69. [ Links ]
8. Antman E. Tratamiento médico del paciente sometido a cirugía cardiaca. En: Braunwald E. Ed. Tratado de Cardiología. Vol. 2. 5ªEd. McGraw–Hill Interamericana, 1999. p 1879–905. [ Links ]
9. Turina J, Stark T, Seifert B, Turina M: Predictors of the Long–Term Outcome After Combined Aortic and Mitral Valve Surgery. Circulation 1999;100 suppl 11:48–53. [ Links ]
10. Dahlin L, Olin C, Svedheholm R. Perioperative myocardial infarction in cardiac surgery–risk factors and consequences. A case control study. Scand Cardiovasc J 2000;34(5):522–7. [ Links ]
11. Adams J, Abendschein D, Jaffe A. Biochemical markers of myocardial injury. Circulation 1993;88(2):750–63. [ Links ]
12. Gensini G, Fusi C, Conti A, Calamai G, Montesi G, Galanti G, et al. Cardiac troponin I and Q–wave perioperative myocardial infarction after coronary artery bypass surgery. Crit Care Med 1998;26:1986–91. [ Links ]
13. Bonnefoy E, Filley S, Kirkorian G, Guidollet J, Roriz R, Robin J, et al Troponin I, troponin T, or creatine kinase–MB to detect perioperative myocardial damage after coronary artery bypass surgery. Chest 1998;114:482–6. [ Links ]
14. Ponce G, Romero J, Hernández G, Padrón A, Cabrera E, Abad C. El infarto sin onda Q en cirugía cardíaca valvular convencional. Diagnóstico mediante la troponina I cardíaca. Rev Esp Cardiol 2001;54:1175–82. [ Links ]
15. Klatte K, Chaitman B, Theroux P, Gavard J, Stocke K, Boyce S, et al. Increased mortality after coronary artery bypass graft surgery is associated with increased levels of postoperative creatinekinase –myocardial band isoenzyme release. Results from the GUARDIAN trial. J Am Coll Cardiol 2001;38(4):1070–7. [ Links ]
16. Pahlm U, Chaitman B, Rautaharju P, Selvester R, Wagner G. Comparison of the various electrocardiographic scoring codes for estimating anatomically documented sizes of single and multiple infarcts of the left ventricle. Am J Cardiol 1998;81:809–15. [ Links ]
17. Onorati F, De Feo M, Mastroroberto P, Cristodoro L, Pezzo F, Renzulli A, et al Determinants and prognosis of myocardial damage after coronary artery bypass grafting. Ann Thorac Surg 2005;79(3):837–45. [ Links ]
18. Meluzin J, Cerny J, Nemec P, Frélich M, Stetka F, Spinarová L. Do the presence and amount of dysfunctional but viable myocardium affect the preoperative outcome of coronary artery bypass graft surgery? Int J Cardiol 1999;71:265–72. [ Links ]
19. Jarvinen A, Mattila T, Kyosola K. Serum CK–MB isoenzyme after aortic and mitral valve replacements. Ann Clin Res 1983;15(5–6):189–93. [ Links ]
20. McGregor C, MacLeod M, Muir A, Smith A, Hannan W, Miller H. Myocardial infarction related to valve replacement surgery. Br Heart J 1984;51(6):612–7. [ Links ]
21. González Hermosillo J, Rubio E, Manzanares E, Fernández G, Casanova J, Quijano F. The diagnosis of perioperative myocardial infarction in heart surgery. Arch Inst Cardiol Mex 1990;60:267–76. [ Links ]
22. Vishwas M, Shilaja K, Ujjwal C, Lakshmy R, Sandeep C, Usha K Myocardial injury in coronary artery bypass grafting. Tex Heart lnst J 2006;33:321–7. [ Links ]
23. Morlans K, Saínz H, González Prendes C, Morlans J. Infarto agudo del miocardio en la revascularización miocárdica. Rev Cubana Cardiol Cir Cardiovasc 1997; 11 (1 ):5–11. [ Links ]
24. Cummins B, Auckland M, Cummins P. Cardiac–specific troponin–l radioimmunoassay in the diagnosis of acute myocardial infarction. Am Heart J 1987;113:1333–44. [ Links ]
25. Larue C, Calzolari C, Bertinchant J, Leclercq F, Grolleau R, Pau B. Cardiac–specific immunoenzymometric assay of troponin I in the early phase of acute myocardial infarction. Clin Chem 1993; 39: 972–9. [ Links ]
26. Mair J, Morandell D, Genser N, Lechleitner P, Dienstl F, Puschendorf B. Equivalent early sensitivities of myoglobin, creatine kinase MB mass, creatine kinase isoform ratios and cardiac troponins I and T for acute myocardial infarction. Clin Chem 1995;41:1266–72. [ Links ]














