Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.79 n.2 Ciudad de México Apr./Jun. 2009
Artículo de investigación: cardiópatas congénitas
Cierre percutáneo del conducto arterioso persistente con dispositivo Amplatzer en niños: resultados inmediatos y a un año
Transcatheter closure of patent ductus arteriosus using the Amplatzer duct occluder in children: Initial and one–year results
J Rafael Parra–Bravo,1* Arturo Cruz–Ramírez,3 Alejandra Toxqui–Terán,2 Enriqueta Juan–Martínez,2 Alejandro Chávez–Fernández,3 César Lazo–Cárdenas,1 Luisa Beirana–Palencia,1 y José Estrada–Flores1
Hospital de Pediatría. Centro Médico Nacional, Siglo XXI. Instituto Mexicano del Seguro Social (IMSS). México, DF. México.
1 Servicio de Cardiología y Hemodinamia Pediátrica.
2 Médico Pediatra en adiestramiento en el Servicio de Cardiología Pediátrica.
3 Médico Residente de Cardiología Pediátrica.
*Autor para correspondencia:
Dr. José Rafael Parra Bravo.
Hospital de Pediatría, Centro Médico Nacional Siglo XXI, IMSS.
Servicio de Cardiología Pediátrica.
Av. Cuauhtémoc No. 330, Col. Doctores. 06720 México, D.F. México.
Teléfono: 5627.6900 ext. 22270 Fax: 5593.6300.
Correo electrónico: rafaelparrabravo@yahoo.com.mx ; rafaelparrabravo@gmail.com
Recibido el 16 de noviembre de 2007.
Aceptado el 12 de febrero de 2009.
Resumen
Introducción y objetivos: El cierre percutáneo del conducto arterioso persistente (CAP) es una técnica bien establecida. Nuestro objetivo fue evaluar la seguridad y eficacia del oclusor de Amplatzer en el tratamiento del conducto arterioso persistente en la edad pediátrica.
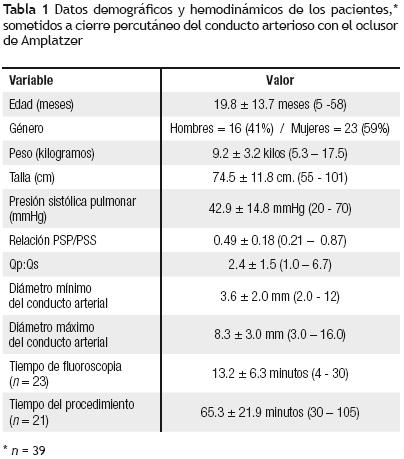
Material y métodos: De noviembre de 2005 a junio de 2007 analizamos el expediente clínico de 39 pacientes (23 niñas y 16 niños), con una edad de 19.8 ± 13.7 meses y peso de 9.2 ± 3.2 kg, sometidos a oclusión percutánea del CAP con dispositivo Amplatzer. El 41% (16/39) de los pacientes eran lactantes con edad < a un año y 71.8% (28/39) con peso < a 10 kg. La edad de los niños con peso < 10 kg fue de 13.1 ±6.1 meses. Mediante aortografía en proyección lateral se determinó la morfología del CAP de acuerdo con la clasificación de Krichenko. En todos se hizo seguimiento (mediana de 10 meses), mediante control radiológico y ecocardiográfico a las 24 horas, y a 1, 3, 6 y 12 meses después del implante.
Resultados: En los 39 pacientes el diámetro mínimo del conducto varió de 2 a 12 mm (3.6 ± 2.0 mm). Los tipos de CAP, de acuerdo con Krichenko, fueron: A = 25 (64.1%), B = 1 (2.6%), C = 5 (12.8%), D = 2 (5.1%) y E = 3 (7.7%). Tres pacientes (7.7%) tenían conducto residual posterior a ligadura quirúrgica. La relación Qp/Qs fue de 2.4 ± 1.5 y la relación PSP/PSS fue de 0.49 ± 0.18 En 16 pacientes (41%) existía hipertensión pulmonar. El dispositivo fue implantado con éxito en 36 de 39 pacientes (92.3%). El procedimiento falló en tres casos debido a: dificultad para colocar el dispositivo; a una valoración incorrecta del tamaño del conducto; y por dificultad en hacer avanzar el dispositivo por angulación del sistema de liberación y migración del dispositivo a la aorta descendente. La media de tiempo de fluoroscopia y del tiempo del procedimiento fue de 13.2 ± 6.3 minutos y 65.3 ± 21.9 minutos, respectivamente. No hubo fallecimientos con el procedimiento. En ocho pacientes, todos excepto uno, con peso menor a 10 kg, ocurrieron complicaciones menores y mayores. De los 36 pacientes, un aortograma mostró oclusión completa del conducto en 26 (66.7%); fuga intraoclusor en seis (15.4%), fuga leve en cuatro (10.3%) y fuga moderada en dos (5.1%). En el ecocardiograma control de 24 horas la tasa de oclusión fue de 82.1% (32/36). La oclusión del conducto fue completa en 35 pacientes (97.2%) al tercer mes de seguimiento. En cuatro pacientes no se logró el cierre percutáneo y tres de ellos tuvieron que ser operados. En el seguimiento tres pacientes desarrollaron estenosis leve en la rama pulmonar izquierda, y dos gradientes de presión leve en la aorta descendente.
Conclusiones: El cierre percutáneo del conducto arterioso persistente con el dispositivo de Amplatzer es un método eficaz y seguro, especialmente útil en el tratamiento de conductos de tamaño moderado a grande. En conductos arteriosos persistentes mayores de 2 mm de diámetro el oclusor de Amplatzer se considera como una alternativa al tratamiento quirúrgico. La frecuencia de complicaciones es mayor en pacientes con pesos menores de 10 kg.
Palabras clave: Conducto arterioso persistente; Cierre percutáneo; Amplatzer; México.
Abstract
Objective: Percutaneous closure of patent ductus arteriosus (PDA) is a well established technique. Our objective was to determine the safety and efficacy of the Amplatzer occluder for the treatment of PDA in children.
Methods: From November 2005 to June 2007 we reviewed the clinical records of 39 patients (23 girls and 16 boys), with a mean age of 19.8 ± 13.7 months and weight 9.2 ± 3.2 Kg, who underwent percutaneous closure of a PDA with an Amplatzer device. The forty one percent of the patients (16/39) were < 1 year of age, and 71.8 % (28/39) weighed < 10 Kg. The age of children with body weight < 10 Kg was 13.1 ±6.1 months (range 5–33 months). The morphology of the PDA was determined by a lateral aortogram and classified according to Krichenko. All the patients were followed–up with radiologic and echocardiographic control at 24 hours, 1, 3, 6 and 12 months postinsertion (median 20 months).
Results: The PDA diameter ranged between 2.0 mm to 12 mm (3.6 mm ± 2.0 mm) in the 39 patients included. PDA types according to Krichenko were: type A = 25 (64.1%), type B = 1 (2.6%), type C = 5 (12.8%), type D = 2 (5.1%) and type E = 3 (7.7%). Three patients had a residual PDA post–surgical closure attempt. Qp/Qs ratio was 2.4 ± 1.5 (range 1.0–6.7) and the relation PSP/PSS was 0.49 ± 0.18 (range: 0.21–0.87). Pulmonary hypertension was present in 16 patients (41%). The Amplatzer occluder was implanted successfully in 36/39 patients (92.3%). The procedure failed in three cases: 1) difficulty to place the device due to wrong assessment of the ductus size; 2) difficulty to advance the device due to angulation (kinking) of the releasing system; 3) migration of the device to descending aorta. The mean time of fluoroscopy and for the entire procedure was 13.2 ± 6.3 minutes and 65.3 ± 21.9 minutes, respectively. There were no deaths with the procedure. Minor and mayor complications occurred in eight patients, all of them but one, in children with body weight < 10 Kg. In the 36 successful insertions an aortogram showed complete occlusion in 26 (66.7%), trivial leak through the occluder in 6 (15.45), mild leak in 4 (10.3%), and moderate leak in 2 (5.1%). A control echocardiogram 24 h after the insertion showed a successful rate of 82.1% (32/36). Complete occlusion of the PDA was obtained in 35/36 patients (97.2%) at 3 months follow–up study. In 4 patients the percutaneous occlusion technique did not result in PDA closure, and 3 of them underwent a surgical closure. On follow–up, 3 patients developed mild stenosis of the left pulmonary artery and two a mild pressure gradient in the descending aorta.
Conclusions: Percutaneous closure of PDA with an Amplatzer is a safe and effective technique. In children with ductus arteriosus diameters 2 mm the Amplatzer device should be recommended over surgical closure. The incidence of complications after the procedure is higher in patients under 10 kg of body weight.
Key words: Persistent ductus arteriosus; Percutaneous closure; Amplatzer duct occluder; Mexico.
Introducción
El conducto arterioso persistente (CAP) representa de 5% a 10% de todas las cardiopatías congénitas. De manera habitual, una vez que se establece el diagnóstico de CAP, debe considerarse su tratamiento, ya sea por cirugía o por cierre percutáneo. En la última década el cierre percutáneo es considerado como el tratamiento de elección del CAP para la gran mayoría de los pacientes pediátricos.
A partir de la primera descripción del cierre transcatéter del CAP por Porstmann, en 1967,1,2 diversos investigadores han descrito varias técnicas y dispositivos para el cierre no quirúrgico del CAP.3–7
El cierre transcatéter del CAP utilizando coils de Gianturco se describió por primera vez en 1992.4 Desde 1996 los espirales con sistema de liberación controlada se han utilizado ampliamente.5–8 Si bien, en el cierre del conducto arterioso pequeño (< 2 mm) se han obtenido resultados satisfactorios con el uso de espirales de liberación controlada,8 la frecuencia de cortocircuito residual, de hemólisis y de embolización es mayor en los CAP de mayor tamaño.9 Por tal motivo, la ligadura quirúrgica se consideraba el tratamiento de elección en tales casos.
En 1998, Masura y colaboradores10 publicaron la primera serie de casos de cierre percutáneo del conducto arterioso, utilizando el nuevo dispositivo de Amplatzer especialmente diseñado para conductos de tamaño moderado a grande, y como una alternativa a la ligadura quirúrgica. El oclusor de conducto de Amplatzer (ADO, Amplatzer Duct Occluder) se ha utilizado ampliamente en diferentes centros de cardiología pediátrica, con menor frecuencia de fuga residual, embolización y estenosis de la arteria pulmonar izquierda.11–12
En nuestro servicio la experiencia en el cierre percutáneo del CAP se inició en el año 2000. En vista de los resultados con el dispositivo de Amplatzer, publicados por diversos grupos,12–14 iniciamos su uso a fines de 2005.
El objetivo de este trabajo es relatar nuestra experiencia en la eficacia y seguridad del oclusor Amplatzer, en forma inmediata y a un año de seguimiento, en el cierre del conducto arterioso persistente de pacientes pediátricos.
Material y Métodos
De noviembre de 2005 a junio del 2007 analizamos el expediente clínico de 39 pacientes con diagnóstico de CAP, sometidos a cierre percutáneo con el dispositivo Amplatzer. De los 39 pacientes, 23 corresponden al sexo femenino (59%) y 16 al sexo masculino (41%). En todos realizamos radiografía de tórax, electrocardiograma y ecocardiograma transtorácico (ETT) previo al procedimiento, y se obtuvo el consentimiento informado de sus padres o tutores. Los criterios de inclusión fueron: peso mayor de 5 kg, resistencias vasculares pulmonares < 8 Unidades Wood/m,2 y tamaño del conducto > 2.0 mm de diámetro mínimo. La edad de los pacientes osciló entre 5–58 meses (mediana 15 meses; media 19.8 ± 13.7 meses), y su peso entre 5.3–17.5 kg (mediana 8.0 kg; media 9.2 ± 3.2 kg). El 71.8% (28/39) eran lactantes con peso < 10 kg, y 41% (17/41) menores a un año. La edad de los niños con peso < 10 kg fue de 13.1 ±6.1 meses (límites: 5–33 meses). Treinta y tres pacientes (84.6%) tenían un CAP como lesión aislada y seis (15.4%) tenían anomalías cardiacas asociadas, confirmadas por ecocardiografía y angiografía. Seis pacientes tenían síndrome de Down. En ninguno se había intentado previamente el cierre del conducto. La forma del conducto se determinó con base en la clasificación de Krichenko.15 Tres pacientes tenían un conducto reabierto que había sido ligado quirúrgicamente.
Dispositivo
El oclusor de conducto Amplatzer y su sistema de liberación Amplatzer TorqVeu (AGA Medical Corporation, Golden Valley, MN USA) se utilizó en todos los pacientes. La descripción detallada de este dispositivo ha sido ampliamente descrita.10–12,14
Protocolo de implante del dispositivo
El protocolo para implante del ADO (Amplatzer Duct Occluder), ha sido referido con amplitud.10,16 El procedimiento se realizó bajo sedación. Se canalizaron en todos los pacientes la arteria y vena femorales, y se administraron 100 UI/kg de heparina sódica. Después de registrar las presiones pulmonares y sistémicas se realizó un aortograma en proyecciones lateral y oblicua anterior derecha a 30°, para definir la morfología y el tamaño del conducto (Figura 1A). El conducto se canalizó por vía anterógrada en todos los casos, sustituyendo el catéter multipropósito por el sistema de liberación, con guía de intercambio de Amplatz de 0.035". En ningún paciente se abordó el conducto por vía retrógrada. Se seleccionó un dispositivo por lo menos 1 a 2 mm mayor al diámetro del extremo pulmonar del conducto, y el dispositivo se introdujo atornillado a la punta del cable liberador, y a través del sistema de liberación se llevó hasta la aorta descendente; en este sitio se retiró la camisa del sistema para abrir el disco de retención, el cual se posicionó en el extremo aórtico de la ámpula del conducto. Manteniendo la tensión sobre el cable se retiró el resto de la camisa del sistema hacia el tronco de la arteria pulmonar, situando la porción tubular del Amplatzer dentro del conducto. Con el dispositivo aún anclado al cable liberador se realizó un nuevo aortograma (Figura 1B) y, una vez comprobada una posición adecuada del oclusor, éste fue liberado mediante rotación antihoraria del cable (Figura 1C).
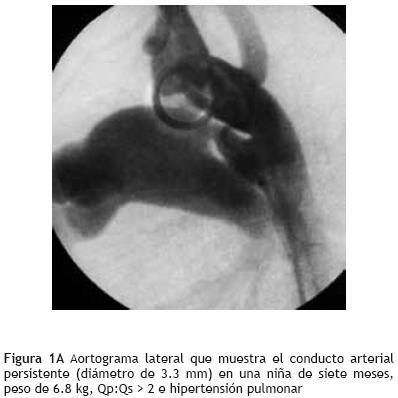


Diez minutos después del implante del ADO se realizó una angiografía en aorta descendente, para determinar el cortocircuito residual (Figura 1C). Arbitrariamente definimos como fuga trivial la observada intraoclusor; fuga leve, la observada hasta el tronco pulmonar sin visualizar la válvula pulmonar, y fuga moderada la observada en el tronco pulmonar principal hasta el nivel de la válvula pulmonar. Se registró presión de retiro en la aorta descendente y en la rama pulmonar izquierda, para descartar que hubiera una obstrucción.
Los problemas técnicos relacionados con el procedimiento, fueron: 1) imposibilidad para posicionar el dispositivo dentro del ámpula aórtica, por no haber valorado correctamente el tamaño del CAP; 2) cualquier dificultad relacionada con el avance, implante y retiro del dispositivo, y 3) funcionamiento inadecuado del mismo dispositivo o cualquier componente del sistema de liberación.
A las 24 horas siguientes se efectuaron un ecocardiograma transtorácico y una radiografía de tórax, para evaluar la forma y posición del dispositivo. Se utilizó el Doppler color para detectar y cuantificar cualquier cortocircuito residual. Definimos fuga trivial, con un diámetro en color < de 1 mm; fuga leve, con un diámetro en color de 1–2 mm, y fuga moderada con un diámetro en color > 2 mm. Con el Doppler pulsado y continuo se establecieron los patrones de flujo y velocidad máxima en aorta descendente y arteria pulmonar, para descartar estenosis.
El seguimiento con EET se realizó a 1, 3, 6 y 12 meses después del implante. En cada valoración se describieron y analizaron las complicaciones mayores o menores relacionadas con el implante del dispositivo.
Las complicaciones mayores fueron: mortalidad relacionada con el procedimiento, lesión de la arteria femoral, sangrado mayor de 5% del volumen sanguíneo estimado, o migración del dispositivo hacía la luz de una rama pulmonar o aorta descendente.
Las complicaciones menores fueron: protrusión del dispositivo hacía la luz de la rama pulmonar izquierda o de la aorta descendente, que produjera un gradiente mayor de 10 mmHg, o la presencia de espasmo de la arteria femoral.
Se indicó durante los seis meses posteriores al procedimiento profilaxis contra endocarditis bacteriana, así como el uso de ácido acetilsalicílico (5mg/kg/día).
Análisis estadístico
Las variables continuas, según fuera apropiado, se expresan como media ± desviación estándar o como mediana y límites. Las variables categóricas, como valor absoluto y porcentaje. Se empleó la prueba t de Student para la comparación de las variables continuas y la exacta de Fisher para las variables categóricas. La frecuencia de complicaciones entre pacientes con peso menor o mayor a 10 kg fue comparada utilizando la prueba de χ2).
Resultados
Se hizo el cierre percutáneo del conducto arterioso permeable (CAP) > 2.0 mm en 39 pacientes (Figura 2). La Tabla 1 muestra las características demográficas, hemodinámicas y angiográficas de nuestros pacientes. Las lesiones cardiacas asociadas al CAP fueron dos casos de comunicación interauricular y uno de comunicación interventricular, de estenosis pulmonar y de anillo vascular, respectivamente. Seis pacientes tenían síndrome de Down. El implante del dispositivo tuvo éxito en 36 de 39 pacientes (92.3%). El diámetro menor del conducto arterioso fue de 3.6 ± 2.0 mm (límites: 2.0–12 mm) y el mayor de 8.3 ± 3.0 mm (límites: 3–16 mm). La morfología del conducto, según la clasificación de Krichenko15 fue: tipo A en 25 pacientes (64.1%), tipo B en un paciente (2.6%), tipo C en cinco pacientes (12.8%), tipo D en dos pacientes (5.1%) y tipo E en tres pacientes (7.7%). En los tres pacientes restantes (7.7%) se trataba de un conducto arterial residual ligado quirúrgicamente. En 16 pacientes (41%) había hipertensión pulmonar (54.4 ± 11.7 mmHg), con una relación de presión pulmonar/sistémica de 0.49 ± 0.18 (límites: 0.21–0.87). El tiempo de fluoroscopia fue de 13.2 ± 6.3 minutos (límites: 4–30 minutos) y el tiempo del procedimiento fue de 65.3 ± 21.9 minutos (límites: 30–105 minutos). No se presentaron muertes con el procedimiento. El tamaño de los dispositivos implantados fue 6/4 en 16 pacientes, 8/6 en 13 pacientes, 10/8 en seis pacientes y 12/10 en cuatro pacientes. En un paciente hubo necesidad de retirar el primer ADO (antes de su liberación) para implantar otro de mayor tamaño (8/6 por 6/4).

Se encontraron problemas relacionados con el implante del dispositivo en dos pacientes (5.1%). Uno de ellos (con peso < a 10 kg) se debió a la angulación de la camisa del sistema de liberación a nivel del CAP (conducto complejo y elongado), que dificultó su colocación y, en el otro, por haber infravalorado el diámetro angiográfico del conducto y no contar con otro oclusor de mayor tamaño o tipo. Una complicación mayor del implante fue la migración del dispositivo hacía la aorta descendente en un caso, que se retiró con un catéter de doble lazo; posteriormente se logró la oclusión total del conducto con otro tipo de oclusor (Nit–Occlud). Un aortograma, realizado diez minutos después del implante del dispositivo, mostró un cortocircuito residual en 12 pacientes (30.8%), siendo trivial o intraoclusor en seis de ellos (15.4%). Después del implante del dispositivo ningún paciente mostró gradiente de presión entre la aorta ascendente a la descendente, o entre la arteria pulmonar izquierda y el tronco arterial pulmonar.
El seguimiento varió de 0.5 a 22 meses (mediana 10 meses; límites 15 días a 2 meses).
Se encontraron complicaciones menores y mayores en ocho pacientes (23%).
Las complicaciones mayores las registramos en dos ocasiones (5.1%): migración del dispositivo y trombosis de la arteria femoral, en un mismo paciente. La trombosis de la arteria femoral ocurrió después de retirar el dispositivo con catéter de doble lazo, requiriendo de trombectomía dentro de las primeras 24 horas, de emplear heparina intravenosa por 72 horas, y de anticoagulación oral por tres meses. Su evolución posterior fue aceptable; sólo hubo disminución en la amplitud del pulso femoral. Ocurrieron complicaciones menores en siete pacientes (17.9%). Dos tuvieron espasmo de la arteria femoral; en cinco pacientes, con peso < 10 kg, el dispositivo hizo protrusión hacía la luz de la aorta descendente o de la rama izquierda pulmonar. En el seguimiento a largo plazo, todos los pacientes se encontraban asintomáticos y sin evidencia, en la radiografía de tórax, de migración tardía del dispositivo.
El ecocardiograma transtorácico subsiguiente mostró oclusión total a las 24 horas en 82.1% (32/36) de los casos y del 97.2% (35/36) a los tres meses. El éxito final de cierre del CAP con el ADO se logró en 89.7% de los pacientes (35/39). Tres de los pacientes restantes (7.7 %) se enviaron a cirugía y en uno se implantó otro tipo de oclusor (Figura 2).
El estudio Doppler, 24 horas después del procedimiento mostró, en dos pacientes, aumento en la velocidad máxima de flujo en la aorta descendente, mayor a 10 mmHg y menor de 15 mmHg. En ambos, el aumento de la velocidad de flujo ocurría sólo en la sístole, con velocidad de flujo diastólico y patrón de flujo normal en la aorta descendente. En tres casos aumentó la velocidad máxima de flujo en la rama pulmonar izquierda (2.3 m/s en un paciente y 2.0 m/s en dos pacientes). Estos tres pacientes pesaban menos de 10 kg y el conducto arterioso era tipo A de Krichenko. La frecuencia de problemas o complicaciones fue mucho mayor en pacientes con peso < a 10 kg, comparada con pacientes con mayor peso (p < 0.05). No hubo, en ningún paciente, eventos adversos sistémicos relacionados con el implante del dispositivo.
Discusión
El presente estudio demuestra los excelentes resultados del cierre transcatéter del CAP, utilizando el dispositivo Amplatzer, con una tasa de oclusión de 97.2% a tres meses de seguimiento.11–18 A la fecha, el cierre percutáneo del CAP es un procedimiento bien establecido. Se recurre a la cirugía convencional para conductos grandes y pacientes prematuros sintomáticos.19,20 Después del primer cierre percutáneo del conducto arterioso persistente efectuado por Porstmann,1,2 se han utilizado varios dispositivos y espirales.3–8 Los espirales de liberación controlada han mostrado su eficacia en el cierre de CAP < 2 mm.4 Por el contrario, en CAP mayores a este diámetro existe un mayor número de complicaciones (cortocircuito residual, embolización, necesidad de dos o más dispositivos, entre otras). Masura y colaboradores10 han utilizado el oclusor de Amplatzer para el cierre transcatéter del conducto arterioso de tamaño moderado a grande. Las mejoras en el dispositivo de Amplatzer, que toman en cuenta el menor tamaño de los sistemas de liberación (5–9 French) y la forma cónica de la prótesis, facilitan su utilización, aun en lactantes con bajo peso y prematuros sintomáticos con CAP de un tamaño moderado a grande.13,17,21,22 Se ha demostrado la seguridad del cierre percutáneo del CAP utilizando el Amplatzer, tanto en el seguimiento inmediato como a largo plazo.10–14,21 Basados en estos informes es evidente la seguridad y eficacia de este dispositivo en niños y adolescentes, pero se presentan pocos informes sobre su uso en lactantes.11,14,21
La falla del procedimiento ha sido bien documentada.10–14 En nuestra experiencia, el procedimiento falló en dos casos: en un paciente con peso de 6 kg, por problemas en la colocación del oclusor, debido al angulamiento de la camisa de liberación en un conducto de forma y orientación anormal y, en el otro, debido a la incapacidad de posicionar el dispositivo, por haber sido infravalorado el tamaño del conducto. Las complicaciones en el cierre percutáneo del CAP con el dispositivo Amplatzer son raras, y sólo se han descrito las inmediatas.
La mortalidad es excepcional.11–13,21–24 En nuestro estudio no hubo mortalidad asociada al procedimiento y la frecuencia de complicaciones en ocho pacientes (23%) fue mayor a lo señalado en otras series; sin embargo, todas, excepto dos (5.1%), fueron complicaciones menores. Bilkis y colaboradores.11 en una serie de 205 pacientes de cierre del CAP con dispositivo Amplatzer tuvieron complicaciones en seis pacientes (3%): tres con embolización del dispositivo, las cuales que requirieron cirugía; un lactante menor de 5 kg con estenosis aórtica leve que se produjo después del implante de un dispositivo grande y, finalmente, dos pacientes que requirieron transfusión sanguínea por sangrado excesivo.12,14
Se ha descrito que la embolización del dispositivo ocurre en forma inmediata o dentro de las primeras 24 horas, como sucedió en nuestro único caso; no observamos casos con embolización tardía.11,12,21,25 La embolización puede reducirse con la selección de un dispositivo de tamaño apropiado.
Las fugas residuales de alta velocidad son también raras, por lo cual la hemólisis mecánica es infrecuente.23 La formación de trombos, o el desarrollo de endocarditis infecciosa, no se han descrito, debido a que se recomienda en todos los pacientes el uso de ácido acetilsalicílico (5 mg/kg/día) y profilaxis antibiótica por seis meses.
La obstrucción aórtica es una complicación del cierre transcatéter del CAP, con el uso del ADO, principalmente en niños menores de un año de edad.17 En la mayoría de los pacientes no da lugar a síntomas y sólo se le reconoce en el estudio ecocardiográfico.5,11,24,25 El ecocardiograma Doppler en nuestro grupo, a las 24 horas del procedimiento, mostró velocidades de flujo máximo mayores a 1.7 m/s en la aorta descendente en dos pacientes, ambos menores de 1 año de edad y con peso menor de 10 kg. El peso relativamente bajo del paciente y principalmente en menores de 5 kg se ha considerado que contribuye a la protrusión del disco aórtico del oclusor, en el ángulo que forma la aorta descendente con el conducto arterioso.11,13,14,17 Para evitar la obstrucción en la aorta descendente el tamaño del disco de retención aórtico del dispositivo no debe exceder el diámetro mayor del CAP. Actualmente, se cuenta con el nuevo dispositivo de Amplatz con un disco de retención angulado (ADO II)26 especialmente diseñado para solventar estos problemas, en niños de bajo peso.
En casos de obstrucción de la rama pulmonar izquierda,11,21 se produce aumento de la velocidad máxima de flujo superior a 2 m/s mediante ecocardiografía Doppler, como en tres de nuestros pacientes, todos con un peso < 10 kg (dos de ellos < 1 año). El bajo perfil que muestra el extremo pulmonar del Amplatzer, comparado con la sombrilla de Rashkind, debería evitar incrementos en la velocidad máxima de flujo > 1.5 m/s. Se ha descrito que con el crecimiento gradual del paciente las velocidades de flujo máximo pueden disminuir en ambos sitios.14
La eficacia del cierre percutaneo del CAP utilizando el ADO ha sido ampliamente demostrada, tanto en forma inmediata como en el seguimiento.10–14,21,27 En este estudio la implantación del ADO se realizó en forma consecutiva en 39 pacientes , con éxito en 92.3%, de ellos, cifra ligeramente menor a lo descrito por otros autores.11–13,16–21,25 Las fugas triviales frecuentemente se ven en el aortograma después del implante del ADO; y se observaron en 33% de nuestros pacientes. Sin embargo, un cortocircuito residual puede persistir después de 24 horas de seguimiento, pero con alta frecuencia de cierre en el seguimiento a un año.11,12,16,25 Nuestros resultados muestran una tasa de oclusión de 71.8% a las 24 horas y de 97.2% a los tres meses. El éxito final del cierre del CAP con el ADO se demostró en el seguimiento en 89.7% de los pacientes (35/39). La reapertura posterior a la oclusión exitosa del conducto con espirales se ha descrito durante el seguimiento. En contraste, la reapertura después del implante exitoso del ADO no se ha descrito y no se detectó en este estudio.
Publicaciones recientes,1113 refieren una mayor frecuencia de complicaciones relacionadas con el procedimiento en niños menores de un año de edad. Faella y Hijazi12 observaron 8.2% de complicaciones en niños < 1 año, comparada con 3.8% de los niños mayores. Otros autores concluyen que en manos experimentadas el cierre percutáneo del CAP en lactantes sintomáticos menores de un año de edad, o con peso < 10 kg es un procedimiento seguro y eficaz.13,17,21
En nuestra serie de 39 pacientes 71.8 % pesaba < 10 kg y 41% tenían una edad de < 1 año. Las complicaciones en los ocho pacientes, excepto uno, se presentaron en quienes pesaban menos de 10 kg. Esto sugiere que, aunque el Amplatzer es generalmente seguro y eficaz, pueden presentarse problemas en niños con peso < 10 kg. Estudios previos apoyan la recomendación del fabricante de no intentar la implantación del ADO en pacientes con peso inferior a 5 kg, debido a las dificultades técnicas y a las complicaciones que han surgido.11,17,18 Sin embargo, las mismas dificultades técnicas llegan a observarse en lactantes con peso > 5 kg.17 Un punto crítico del procedimiento es cuando el dispositivo conectado al cable de liberación es impulsado de la curva de la vía de salida del ventrículo derecho a la arteria pulmonar, debido a un ángulo más o menos recto que forman ambas estructuras, y que puede angular la camisa del sistema de liberación, lo que a su vez impide un avance adecuado del oclusor.
Esta dificultad puede evitarse utilizando una camisa del sistema de liberación de mayor tamaño o la técnica retrógrada con catéter lazo.17
Ambos procedimientos incrementan los tiempos de fluoroscopia y del procedimiento mismo. Haciendo una comparación entre los niños menores de 10 kg y los mayores a este peso la media de tiempo de fluoroscopia y del procedimiento fueron relativamente más grandes en los < 10 kg, pero sin significado estadístico.
La obstrucción aórtica debido a la protrusión del disco aórtico del dispositivo y la obstrucción de la arteria pulmonar izquierda ocurren con mayor frecuencia en este grupo de pacientes.13,17,24–27 En nuestra serie, los cinco pacientes con aumento en la velocidad máxima de flujo en la aorta descendente o en la rama pulmonar izquierda fueron niños menores de 1 año de edad y peso menor de 10 kg. En estos pacientes debemos poner especial atención en la selección del tamaño apropiado y en la implantación del Amplatzer y su seguimiento.
Se requieren estudios con seguimiento a largo plazo para establecer cualquier limitación potencial relacionada con el uso de este dispositivo en niños < 1 año de edad.13,17,21 Coincidimos con lo señalado por otros autores13,17,27 en que la implantación del Amplatzer puede ser una alternativa al uso de espirales11,13,21,22 en CAP de menor tamaño (< 2 mm), si la anatomía del CAP es favorable y si el diámetro mínimo de éste, permite el paso de la vaina 5 French.
Conclusiones
Desde 1996,10 el oclusor Amplatzer de ductus (ADO) ha demostrado ser un dispositivo eficaz y seguro para el cierre percutáneo del conducto arterioso persistente, y especialmente útil en CAP de tamaño moderado a grande. En nuestra experiencia, en niños con conducto arterioso persistente mayor de 2 mm, el oclusor de Amplatzer generalmente es seguro y eficaz, y debe recomendarse como alternativa al tratamiento quirúrgico. La frecuencia de problemas y complicaciones relacionadas con el procedimiento es mayor en niños con peso menor de 10 kg. Son necesarias series más grandes de pacientes y seguimientos más prolongados, para definir la eficacia, seguridad e indicaciones de este dispositivo.
Bibliografía
1. Porstmann W, Wierny L, Warnke H. Der vershuss des ductus arteriosus in persistens ohne thorakotomie. Thoraxchirurgie 1967;15:109–203. [ Links ]
2. Porstmann W, Wierny L, Warnke H, Gerstberger G, et al. Catheter closure of patent ductus arteriosus: Sixty–two cases treated without thoracotomy. Radiol Clin North Am 1971;9:203–18. [ Links ]
3. Rashkind WJ, Cuaso CC. Transcatheter closure of a patent ductus arteriosus: Successful use in a 3.5 kg infant. Pediatr Cardiol 1979; 1:3–7. [ Links ]
4. Lloyd TR, Fedderly R, Mendelshon AM, Sandhu SK, et al. Transcatheter occlusion of patent ductus arteriosus with Gianturco coils. Circulation 1993;88:1412–20. [ Links ]
5. Podnar T, Masura J. Percutaneous closure of patent ductus arteriosus using special screwing detachable coils. J Cath Cardiovasc Diagn 1997;41:386–91. [ Links ]
6. Grifka RG, Mullins CE, Gianturco C, Nihill MR, et al. New Gianturco–Grifka vascular occlusion device. Initial studies in a canine model. Circulation 1995;91:1840–6. [ Links ]
7. Tometzki A, Redel DA, Wilson N. Total UK multicentre experience with a novel arterial occlusion device (Duct–Occlud). Heart 1996;76:520–4. [ Links ]
8. Tometzki A, Arnold R, Peart I, Sreeram N, et al. Transcatheter occlusion of the patent ductus arteriosus with Cook detachable coils. Heart 1996;76:531–5. [ Links ]
9. Uzun O, Veldtman GR, Dickinson DF, Parson JM, et al. Haemolysis following implantation of ductus occlusion coils. Heart 1999;81:160–1. [ Links ]
10. Masura J, Gavora P, Podnar T. Catheter closure of moderate or moderate–to large–sized patent ductus arteriosus using the new Amplatzer duct occluder: Immediate and short term results. J Am Coll Cardiol 1998;31:878–82. [ Links ]
11. Bilkis AA, Alwi M, Hasri S, Haifa AL, et al. The Amplatzer duct occluder: Experience en 209 patient. J Am Coll Cardiol 2001;37:258–61. [ Links ]
12. Faella H, Hijazi ZM. Closure of the patent ductus arteriosus with Amplatzer PDA device: Immediate results of the international clinical trial. J Cath Cardiovasc Interv2005;1:50–4. [ Links ]
13. Al–Ata J, Arfi AM, Hussain A, Kovatli AA, et al. The efficacy and safety of the Amplatzer ductal occluder in young children and infants. Cardiol Young 2005; 15:279–85. [ Links ]
14. Masura J, Tittel P, Gavora P, Podnar T. Long–term outcome of transcatheter patent ductus arteriosus closure using Amplatzer duct occluders. Am Heart J 2006; 151:755–7. [ Links ]
15. Kritchenko A, Benson LN, Burrows P, Möes CAF, et al. Angiographic classification of the isolated, persistently patent ductus arteriosus and implications for percutaneous catheter occlusion. Am J Cardiol 1989;63:877–80. [ Links ]
16. Thanapoulos BD, Hakim FA, Hiari A, Goussos Y, et al. Further experience with transcatéter closure of de patent ductus arteriosus using the Amplatzer duct occluder. J Am Coll Cardiol 2000;35:1016–21. [ Links ]
17. Fischer G, Stich J, Grabitz R, Kramer HH. Transcatheter closure of persistent ductus arteriosus in infants using the Amplatzer duct occluder. Heart 2001;86:444–7. [ Links ]
18. Fernández A, Del Cerro MJ, Rubio D, Castro MC, et al. Cierre percutáneo del ductus arterioso persistente con dispositivo de Amplatz: resultado inmediato y seguimiento a medio plazo. Rev Esp Cardiol 2002;55:1057–62. [ Links ]
19. Tometzky A, Arnold AR, Peart I, Sreeram N, et al. Transcatheter occlusion of the patent ductus arteriosus with Cook detachable coils. Heart 1996;76:531–5. [ Links ]
20. Wang JK, Wu MH, Hwang JJ, Chiang FT, et al. Transcatheter closure of moderate to large PDA with Amplatzer duct occluder. Catheter Cardiovasc Interv 2007;69:572–8. [ Links ]
21. Butera G, De Rosa G, Chessa M, Piazza L, et al. Transcatheter closure of persistent ductus arteriosus with the Amplatzer duct occluder in very young symptomatic children. Heart 2004;90:1467–70. [ Links ]
22. Roberts P, Adwani S, Archer N, Wilson N. Catheter closure of the arterial duct in preterm infants. Arch Dis Child Fetal Neonatal Ed 2007;92:F248–F50. [ Links ]
23. Godart F, Rodés J, Rey C. Severe haemolysis after transcatheter closure of a patent arterial duct with the new Amplatzer duct occluder. Cardiol Young 2000; 10:265–7. [ Links ]
24. Duke C, Chan KC. Aortic obstruction caused by device occlusion of patent arterial duct. Heart 1999;82:109–11. [ Links ]
25. Pass RH, Hijazi ZM, Hsu DT, Lewis B, et al. Multicenter USA Amplatzer patent ductus arteriosus occlusion device trial. Initial and one–year results. J Am Coll Cardiol 2004;44:513–9. [ Links ]
26. Masura J, Gavora P, Podnar T. Transcatheter occlusion of patent ductus arteriosus using a new angled Amplatzer Duct occluder: Initial clinical experience. Catheter Cardiovasc Interv 2003;58:261–7. [ Links ]
27. Sandhu SK, KingTD, Troutman WB, Hixon RL, et al. Transcatheter closure of patent ductus arteriosus with the Amplatzer duct occluder: Short–term follow–up. J Invas Cardiol 2001; 13:298–302. [ Links ]














