Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.79 n.2 Ciudad de México Apr./Jun. 2009
Artículo de investigación: cardiopatías congénitas
Tronco común. Variantes anatómicas, tratamiento quirúrgico y evolución
Truncus arteriosus, anatomy, surgical treatment, follow up
Irma Miranda–Chávez,1* Javier Figueroa–Solano,1 Alejandro Hernández–Godínez,1 Alfredo de Micheli,1 Samuel Ramírez–Marroquín,1 y Alfonso Buendía–Hernández1
1 Instituto Nacional de Cardiología Ignacio Chávez. México, D.F. México.
*Autor para correspondencia:
Dra. Irma Miranda Chávez.
Instituto Nacional de Cardiología Ignacio Chávez.
Departamento de Cardiología Pediátrica.
Juan Badiano # 1, Col Sección XVI, México, D.F. México.
Teléfono: 55732911 extensión 1193. Fax: 55730994
Correo electrónico: imirch@yahoo.com.mx
Recibido el 19 de diciembre de 2008.
Aceptado el 19 de mayo de 2009
Resumen
Objetivo: Evaluar la anatomía y resultados obtenidos en el tratamiento de los niños operados de tronco arterioso (TA) en el Instituto Nacional de Cardiología Ignacio Chávez.
Material y métodos: Cohorte histórica. De enero de 2000 a diciembre de 2005 se estudiaron 28 pacientes con diagnóstico de tronco arterioso, a quienes se les hizo corrección total de la cardiopatía congénita.
Resultados: Del total de pacientes, 54% eran del género masculino. La mediana de edad al momento de la cirugía era de 10.5 meses y 6 kg de peso. El 100% de los casos presentó la variedad aorta dominante. Se colocó tubo de woven–dacrón a 25 pacientes, Hancock a dos de ellos y cirugía de Barbero–Marcial a uno. El promedio del diámetro del tubo para 27 pacientes fue 14 ± 2 mm. Además, dos enfermos requirieron cambio valvular aórtico (prótesis mecánica) durante el procedimiento y dos más en el seguimiento. En el posquirúrgico, 50% de los pacientes cursaron con crisis hipertensiva pulmonar. Se presentaron tres defunciones: una por choque cardiogénico, otra por crisis hipertensiva pulmonar y otra por obstrucción de la cánula de traqueostomía. Al seguimiento, tres pacientes (10.7%) requirieron intervencionismo: uno para dilatar el tubo y dos para dilatar ramas y colocar stent. Un enfermo requirió cambio de tubo 4.2 años después de la corrección y en dos casos más se realizó cambio valvular aórtico con evolución favorable. El resto de los enfermos se mantienen sin lesiones residuales significativas. La sobrevida a 30 días fue de 96.42% y 88.9% a uno y cinco años.
Conclusiones: En nuestro medio, la corrección quirúrgica se efectúa a mayor edad y la mortalidad es baja; sin embargo, nuestro tiempo de seguimiento aún es corto.
Palabras clave: Tronco común; Tratamiento quirúrgico; Seguimiento; México.
Abstract
Objective: To evaluate through a retrospective cohort the anatomy and results of patients that were operated of truncus arteriosus.
Material and methods: Historic cohort. From January 2000 to December 2005 twenty eight patients with troncus arteriosus were operated.
Results There were fifteen male (53.6%) and 13 female patients (46.4%). The median age, at the time of the surgery, was 10.5 months. The median weight, at the time of the surgery was 6 kg. All the patients were dominant aortic. A woven–dacron tube was used in 25 cases, Hanc–kock to 2 and Barbero Marcial procedure in one. The media diameter for the tube for the 27 patients (96.4%) was of 14 ± 2 mm. Two patients required aortic valvular replacement at the same time of the surgery and two more during follow up, after the first surgery. Fifty per cent of the patients had pulmonary hypertension crisis after de surgery. There were three deaths: one patient had cardiogenic shock; another had pulmonary hypertension and one more had obstruction of the traqueostomy cannula. During study monitoring, 3 patients (10.7%) needed interventionist procedures. One case needed dilatation of the tube and two cases needed dilatation of the pulmonary branches to implant a stent device. There has been one tube change 4.2 years after the correction. Actuarial survival after 30 days was of 96.42%, and 88.9%after one and five years.
Conclusions: The surgical correction of the truncus arteriosus has allowed changing the natural history of this disease. Mortality is low however our follow up is not very long yet.
Key words: Truncus arteriosus; Surgical treatment; Follow up; Mexico.
Antecedentes
El tronco arterioso (TA) es una anomalía congénita, en la cual un solo vaso arterial emerge del corazón y da origen a la circulación coronaria, sistémica y pulmonar.1 No se puede establecer la incidencia y prevalencia de esta entidad por varias razones: algunos estudios son descripciones posmortem; otros se han practicado durante la vida fetal; otros más no toman en cuenta la edad y, debido a todo esto, los resultados son diversos.
La historia natural de esta cardiopatía congénita muestra que los pacientes que nacen y no son tratados quirúrgicamente, tienen un mal pronóstico: 50% muere en el primer mes de edad, 18% sobrevive 6 meses y sólo 12% llega al primer año de vida.2 A lo largo del tiempo se han formulado varias preguntas acerca de este padecimiento: las variantes anatómicas, las lesiones asociadas, la edad óptima para la corrección, el material utilizado durante la cirugía, los factores de riesgo asociados a defunción, el tiempo de sobrevida después de la cirugía y la necesidad de reintervenciones. Sin embargo, las respuestas han sido inconsistentes. El propósito de este estudio ha sido dar a conocer nuestra experiencia en el manejo de estos pacientes.
Material y métodos
Cohorte histórica. Se evaluaron los pacientes con diagnóstico de TA, operados de enero de 2000 a diciembre de 2005 en el Departamento de Cardiología Pediátrica del Instituto Nacional de Cardiología Ignacio Chávez, sito en México, D.F., México. Se revisaron todos los expedientes de pacientes con diagnóstico de tronco arterioso común, de uno u otro sexo, menores de 18 años de edad. Se excluyeron los expedientes incompletos. Se registraron las variables clínicas y demográficas: edad al momento del diagnóstico, sexo, peso, presencia de deleción del par 22, anatomía y función de la cardiopatía (tipo de tronco, número de valvas de la válvula troncal, grado de estenosis y suficiencia), arterias coronarias, lesiones en ramas pulmonares y anomalías cardiacas asociadas. Cuando se efectuó cateterismo, se determinaron, además, las presiones de la arteria pulmonar, las resistencias vasculares pulmonares (RVP), las sistémicas (RVS) y el patrón coronario. Las variables quirúrgicas analizadas fueron edad y peso del paciente al momento de la cirugía, el tiempo de circulación extracorpórea, pinzamiento aórtico, tipo de cirugía, material y diámetro del tubo. Las variables posquirúrgicas tempranas: sobrevida y complicaciones (hemodinámicas, respiratorias, infecciosas, sangrados y arritmias); las tardías: defectos residuales, características de la vía de salida del ventrículo izquierdo, derecho y ramas pulmonares, tiempo de sobrevida, necesidad de dilatación con balón del tubo, colocación de stent en ramas pulmonares, cambio valvular (neoaorta) o cambio de tubo. La mortalidad operatoria se definió como la defunción durante los primeros treinta días después de la cirugía. Las reintervenciones incluyeron cateterismo terapéutico y reoperaciones.
Análisis estadístico
Se utilizó estadística descriptiva: promedio y desviación estándar para variables numéricas con distribución Gaussiana, o mediana con mínimos y máximos en caso contrario; frecuencias y proporciones para las variables categóricas. El análisis de supervivencia se realizó con el método Kaplan–Meier. La evaluación de los factores de riesgo asociados a mortalidad sólo fue posible a través de análisis univariado.
Resultados
Demográficos y clínicos. Entre el año 2000 al 2005, de entre todos los pacientes operados se encontraron 28 con tronco común, a quienes se les realizó corrección total. Quince pacientes (54%) eran del sexo masculino y 13 (46%) del femenino. La mediana de edad al momento de la cirugía fue de 10 meses, con una mínima de 2 y máxima de 36. La mediana del peso al momento de la cirugía fue de 6 kg, con una mínima de 2.6 kg y máxima de 13 kg. En todos los casos, el diagnóstico definitivo se estableció por ecocardiografía. De acuerdo con la clasificación de Collett y Edwards, 21 (75%) de los sujetos correspondieron al tipo I y siete (25%) al tipo II; según van Praagh modificado, todos pertenecieron al tipo IA y, de acuerdo con la nueva clasificación, todos fueron del grupo tronco arterioso con aorta dominante y ramas confluentes o casi confluentes. La válvula troncal más frecuente fue trivalva en 13 casos (46.4%), cuatrivalva en 12 (42.9%) y bivalva en tres (10.7%). Veintisiete pacientes tuvieron algún tipo de lesión valvular (96.4%): 16 (57.1%) doble lesión; 10 (35.7%) sólo insuficiencia; un paciente, exclusivamente estenosis y, en otro, no se evidenció lesión alguna. En 17 pacientes (60.7%) la insuficiencia fue ligera, moderada en siete (25%) e importante en dos (7.1%). Dieciséis (57.1%) niños tuvieron gradiente medio < 50 mmHg, 11 (39.3%) < 10 mmHg y uno con gradiente medio > 50 mmHg. Siete pacientes (25%) presentaron, antes de la cirugía, estenosis de ramas pulmonares: cuatro de la rama derecha, dos de ambas ramas (7.1%) y uno de la rama izquierda con hipoplasia. En 11 casos (39.3%), el arco aórtico estuvo a la derecha. Ningún enfermo presentó interrupción del arco aórtico ni coartación aórtica. Las lesiones asociadas fueron: comunicación interatrial tipo fosa oval en cinco casos (17.9%), foramen oval permeable en cuatro (14.3%). En todos los pacientes se realizó hibridación fluorescente in situ (FISH); en 9 (32.1%), se demostró deleción del cromosoma 22q11 (Tabla 1).

Diecinueve pacientes (67.85%) ameritaron cateterismo prequirúrgico para evaluar la respuesta de los vasos pulmonares y la anatomía de las ramas pulmonares; la edad de éstos fue de 2 a 36 meses con mediana de 16 meses. El promedio de la presión sistólica de la arteria pulmonar (PSAP) fue de 62 ± 15 mmHg; el de la presión media de la arteria pulmonar (PMAP), de 41 ± 11 mmHg; y el de la presión diastólica de la arteria pulmonar (PDAP), de 32 ± 10 mmHg. La media de la resistencia arteriolar pulmonar fue de 2.4 ± 0.9 unidades Woods, y el cociente de presiones sistólicas (PSAP/PSAS), de 0.95 ± 0.42 (Tabla 2). En cuatro pacientes se documentaron anomalías coronarias: en uno, la descendente anterior tuvo su origen en la coronaria derecha; en otro, el ostium de la coronaria derecha se localizó en el seno no coronariano; en otro más, la coronaria derecha nacía del tronco de la coronaria izquierda y el último con ostium coronario único.

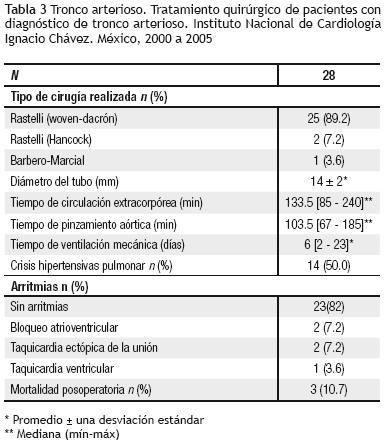
Quirúrgicos. En veintisiete pacientes (96.4%) se realizó cirugía tipo Rastelli y Barbero–Marcial en un caso. El tiempo de circulación extracorpórea tuvo una mediana de 133.5 minutos, con un mínimo de 85 y máximo de 240 minutos, y el de pinzamiento aórtico, una mediana de 103.5 minutos, con un mínimo de 67 y máximo de 185 minutos. Se colocó tubo de woven–dacrón en 25 casos, Hancock en dos y cirugía de Barbero–Marcial en uno. El promedio del diámetro del tubo para los 27 pacientes (96.4%) fue de 14 ± 2 mm. En los dos pacientes con insuficiencia valvular troncal importante, de 34 y 36 meses de edad, se colocó tubo de Hancock y prótesis mecánica en la neoaorta (St Jude 19 mm y ATS 23 mm, respectivamente).
Posquirúrgicos. Dieciséis pacientes presentaron complicaciones hemodinámicas después de la cirugía: 14, crisis hipertensiva pulmonar; dos, choque cardiogénico. Seis de los pacientes desarrollaron infección: cuatro, sepsis sin germen aislado y dos, neumonía asociada al ventilador. En cinco pacientes, hubo arritmias: dos enfermos con bloqueo atrioventricular completo; dos con taquicardia ectópica de la unión y un sujeto con taquicardia ventricular. Un paciente desarrolló neumotórax. Se presentaron tres defunciones (10.7%), todos con insuficiencia moderada de la válvula troncal; dos de ellos, además, con estenosis (gradiente de 30 mmHg) (Tabla 3). Las causas fueron: crisis hipertensiva pulmonar, choque cardiogénico y obstrucción de la cánula de traqueostomía. Dos de estos pacientes tuvieron deleción del par 22 y uno, anomalía coronaria. El tiempo de ventilación mecánica presentó una mediana de 6 días con un mínimo de 2 y máximo de 23 días. Dado que sólo tres pacientes fallecieron, se realizó únicamente un análisis univariado a través de una prueba exacta de Fisher. La variable "insuficiencia troncal" se categorizó como significativa, cuando el paciente tuvo una lesión moderada o importante y, ausente, en caso contrario. Se encontró asociación significativa entre esta variable y la mortalidad (p = 0.018); el resto de las lesiones investigadas no mostró asociación.
Seguimiento
Intervencionismo. Tres enfermos (10.7%) requirieron cateterismo intervencionista en el seguimiento. Un paciente, 30 meses después de la cirugía, presentó obstrucción de la porción proximal del tubo de woven–dacrón. Se llevó a dilatación con balón reduciendo el gradiente sistólico de 67 a 20 mmHg. Otro paciente, 23 meses después de la intervención quirúrgica, mostró estenosis en la rama derecha con un gradiente de 22 mmHg. Ésta se dilató y colocó un stent, el gradiente residual fue de 4 mmHg. La niña tratada con técnica de Barbero–Marcial presentó, 38 meses después del procedimiento, estenosis proximal de ambas ramas (derecha con gradiente de 60 mmHg; izquierda de 25 mmHg), por lo que se dilataron y se colocó stent en cada una con gradiente residual de 6 mmHg en ambas.
Procedimientos quirúrgicos subsecuentes. Un paciente ameritó cambio de tubo 4.2 años después de la corrección con evolución favorable; dos requirieron cambio de la válvula troncal (7.2%); una, operada a los cuatro meses de edad, a quien se colocó tubo de woven–dacrón de 14 mm La válvula troncal era trivalva y tenía doble lesión: insuficiencia ligera y estenosis importante con gradiente máximo de 70 mmHg y gradiente medio de 42 mmHg. Se le realizó comisurotomía en el transquirúrgico inicial; sin embargo, 4 meses después se documentó insuficiencia importante y estenosis con gradiente residual de 26 mmHg. Se hizo cambio valvular y colocación de prótesis St Jude de 19 mm. En el otro caso, se documentó válvula troncal cuatrivalva con doble lesión: insuficiencia ligera y estenosis con gradiente medio de 55 mmHg. Durante el procedimiento de Barbero–Marcial se realizó comisurotomía. Cuatro años después de la cirugía y 12 meses después de la colocación de stent bilateral se documentó insuficiencia valvular importante. Se colocó prótesis ATS 23 mm, además de efectuar una ampliación de ambas ramas pulmonares con parche de pericardio bovino.
Pacientes libres de reintervención. En 23 casos (82%) no se han evidenciado, hasta el momento, lesiones residuales significativas que ameriten tratamiento intervencionista o quirúrgico adicional. El tiempo máximo de seguimiento de este grupo de pacientes es de 68 meses (5 años, 8 meses). La supervivencia en nuestro Instituto a 30 días fue de 96.42%; al año, de 88.9% y a los 5 años se mantiene sin cambio (Figura 1).

Discusión
El tronco común es una cardiopatía que fue descrita por primera vez en 1798 por Wilson. En 1949 Collet y Edwards propusieron la primera clasificación y en 1965 van Praagh sugirió una clasificación alternativa.2–4
La de Collet y Edwards apoya su nomenclatura en el origen de las arterias pulmonares. El tipo I tiene septum aórtico pulmonar formado parcialmente y, por lo tanto, el tronco de la arteria pulmonar está presente. En el tipo II, las ramas izquierda y derecha nacen directamente de la cara posterior del tronco arterial común, adyacentes una de la otra. En el tipo III, ambas ramas pulmonares nacen a cada lado del tronco arterial común, y en el tipo IV (pseudotronco), las ramas pulmonares no nacen del tronco arterial común, sino como colaterales aortopulmonares. Actualmente la mayoría no considera que el tipo IV sea un tronco arterioso, sino una atresia pulmonar con comunicación interventricular y ramas pulmonares no confluentes.3
La clasificación de Van Praagh y Van Praagh no sólo considera el origen de las arterias pulmonares, también toma en cuenta la presencia o no de comunicación interventricular y la interrupción o no del arco aórtico. La nomenclatura incluye una letra (A o B según tenga comunicación interventricular o no, respectivamente) y un número: 1, si existe tronco pulmonar; 2, si no existe tronco pero las ramas nacen directamente del tronco común sin importar su cercanía; 3, si el origen de una de las ramas no es del tronco arterioso común, sino de un conducto o colateral aórtica y 4, cuando el arco aórtico está interrumpido y existe un gran conducto que alimenta la aorta descendente.4
Ambas clasificaciones están limitadas por su frecuente inconsistencia entre la descripción (especialmente entre el tipo I y II de Collet y Edwards y tipo A1 y A2 de Van Praagh que se hace con los métodos diagnósticos y los hallazgos reales durante el acto quirúrgico, al grado que con frecuencia el cirujano describe la anatomía del tronco como tipo 1½. Por otro lado, la ausencia de comunicación interventricular en un tronco común es rara y más bien corresponde a una atresia aórtica o pulmonar. Lo mismo que el tipo IV de Collet y Edwards, que corresponde a una atresia pulmonar con comunicación interventricular.
En el año 2000, en el consenso de expertos, se informó que una mejor manera de clasificar esta entidad era la siguiente: A) Tronco arterioso común con aorta dominante y ramas cercanas –incluye a los tipos I, II y III de Collet y Edwards, y a los tipos A1 y A2 de Van Praagh–; B) aorta dominante con ausencia de una rama –corresponde al tipo A3 de Van Praagh–; C) tronco arterioso común con pulmonar dominante con interrupción del arco aórtico o coartación aórtica grave –incluye el tipo A4 de Van Praagh.
La descripción anatómica de los pacientes que analizamos correspondió, en 21 casos al tipo I, y en siete, al tipo II según Collet y Edwards. Todos correspondieron al tipo A1 de Van Praagh o al tronco arterioso con aorta dominante y ramas pulmonares cercanas según la nueva clasificación. No tuvimos ningún caso con aorta dominante y ausencia de una rama ni tronco arterioso con pulmonar dominante (Tabla 4).

Debido a la alta mortalidad que este grupo de pacientes presenta si no se operan a edades tempranas, se han practicado diversos tratamientos quirúrgicos.2
En forma inicial, se realizó bandaje pulmonar como tratamiento paliativo; sin embargo, el resultado fue ineficiente y con mortalidad promedio de 51 %.5
Posteriormente, con la idea de reestablecer la continuidad del ventrículo derecho con la arteria pulmonar, se empleó un tubo valvado y esto abrió la puerta a la corrección primaria.6 Desde hace 42 años el manejo quirúrgico se ha enfocado en dicha corrección, pero no hay un consenso para determinar cuál es el tiempo óptimo para la cirugía. Se ha propuesto que, para evitar los efectos deletéreos de la hipertensión arterial pulmonar, el tratamiento quirúrgico debe llevarse a cabo en la etapa neonatal.
En nuestra serie, la mediana de la edad al momento de la cirugía fue de 10 meses, con una mínima de 2 y máxima de 36, que difiere notablemente de las últimas series publicadas. El motivo es que, como el diagnóstico no se efectúa en etapas tempranas, el envío a nuestro centro de trabajo es tardío.
Para tomar la decisión quirúrgica se realizó cateterismo a 19 enfermos, siendo la mediana de la edad 16 meses. La PSAP en promedio fue de 62 ± 15 mmHg y la PMAP, de 41 ± 11 mmHg; la resistencia arteriolar pulmonar media fue 2.4 ± 0.9 unidades Woods. En 1974, el grupo de Mair informó que los pacientes con menos de 8 U/m2 tuvieron una mortalidad de 10%. Para los que tuvieron de 8–12 U/m2, la mortalidad fue de 33%. Todos los pacientes con resistencias mayores de 12 U/m2 murieron. En estos pacientes, las edades de la cirugía oscilaron entre 23 meses a 18 años.7
En los estudios histológicos pulmonares practicados en el grupo de enfermos que fallecieron, se encontró, de acuerdo con la clasificación de Collet y Edwards, que los pacientes que tenían menos de 8 U/m2 RVP los cambios eran de tipo I y II; para los que tenían resistencias de 8–12 U/m2, los cambios correspondían al grado III y para los que tenían más de 12 U/m2, eran 3 y 4. Por otro lado, en esta serie sólo dos pacientes fueron menores de 2 años de edad y siete menores de 4. La serie fue de 37 pacientes.7 A pesar de ser una serie corta, ésta brinda información valiosa a los centros cardiológicos como el nuestro en que la corrección se lleva a cabo en etapas más tardías, siempre y cuando se efectúe cateterismo para determinar la reversibilidad de la hipertensión arterial pulmonar como se hizo en la mayor parte de nuestros enfermos.
Debemos comentar que la reversibilidad de la hipertensión arterial pulmonar se evalúa de manera cuantitativa y cualitativa. Hemos mostrado nuestros resultados acerca de la primera; para la segunda, en otro momento realizaremos varias evaluaciones en forma ciega para que los resultados se puedan ponderar de manera significativa.
Existen inconsistencias acerca de los factores de riesgo relacionados con mortalidad: las descripciones siguientes fueron hechas por grupos que llevaron a cabo análisis uni y multivariados para la evaluación de sus resultados: para el grupo de Lacour Gayet, en 1996, el análisis univariado mostró que la reconstrucción no anatómica, la insuficiencia posquirúrgica de la válvula pulmonar, la edad menor de 30 días y la colocación de tubos diferentes al dacrón, fueron los factores asociados. Sin embargo, al realizar el análisis multivariado persistió sólo la reconstrucción no anatómica.8
Para el grupo de Rajasinghe, en 1997, la interrupción del arco aórtico estaba asociada a mortalidad en ambos análisis.9 Por otro lado, para el grupo de Brown, en el 2001, la interrupción del arco aórtico y el periodo en que se hizo la cirugía fueron los factores asociados también en ambos análisis.10 Cabe mencionar que, en los dos últimos, la insuficiencia de la válvula troncal no tuvo significancia estadística. En 2001 Thompson informó que, en una regresión de Cox, el cambio valvular troncal era la única variable que se asoció a baja sobrevida.11 En 2007, Henaine informó que la insuficiencia moderada o severa, en análisis uni y multivariados, se asociaron a reoperación, mientras que el cambio inicial de la válvula troncal se asoció a mortalidad.12
Por otro lado, en los mismos estudios, se analizó la edad al momento de la cirugía. Para el grupo de Lacour Gayet, la edad menor de 30 días sólo en el análisis univariado tuvo significancia estadística.8 Para el de Rajasinghe la edad menor de 3 meses no tuvo significancia estadística, en ninguno de los dos análisis.9 Para el de Brown, la edad menor a un mes tampoco fue significativa.10 y en el de Henaine no fue analizada. Con lo anterior, se plantea una reflexión acerca de si verdaderamente la edad ideal para la cirugía es la etapa neonatal.
Para reconstruir la vía de salida del ventrículo derecho se han utilizado varias técnicas: reconstrucción anatómica con válvula pulmonar trisigmoidea; reconstrucción no anatómica con xenoinjertos, como dacrón, tubo de politetrafluoroetileno y vena yugular bovina, u homoinjertos pulmonar o aórtico. Mc Elhinney informó que, en su serie de 159 pacientes; la mediana para la edad fue de 91 días con extremos de 2 y 121 días. Se utilizaron 98 xenoinjertos y 61 homoinjertos; de estos últimos, 44 fueron de origen aórtico y 17 de origen pulmonar. La mediana del diámetro fue de 12 mm, con extremos de 9 y 20 mm. La curva libre de reintervenciones a 5 años fue de 45%. La única variable predictiva independiente para prolongar el cambio de tubo fue la colocación de homoinjertos, a pesar de que fueron los niños más pequeños, a quienes se les colocó. Se practicaron 92 reintervenciones en 75 pacientes.13 El grupo de Brown informó que, en su serie de 60 pacientes, se colocaron 19 tubos de 8 a 10 mm y 41 de 11 a 15 mm. El tiempo de seguimiento fue de 10 años y se requirieron 30 reintervenciones en 23 pacientes. La curva libre de reoperación a 7 años fue de 64%, y de 36% a 10 años. Llama la atención que el cambio se decidió cuando el gradiente del tubo tenía una mediana de 49 mmHg con extremos de 18 y 129 mmHg.10 En nuestra serie, sólo un paciente, 50 meses después de su corrección total, requirió cambio de tubo. El tubo inicial fue de woven–dacrón de 14 mm y se sustituyó por uno de 18 mm. Para el resto de los pacientes, el seguimiento aún es corto y estamos pendientes de su evolución con la realización de ecocardiogramas en forma periódica.
La suficiencia troncal es otro tema de discusión. Existe un grupo de pacientes con tronco arterioso en los que, además de cerrar la comunicación interventricular y establecer la continuidad ventrículo derecho–arteria pulmonar, se requiere manejo quirúrgico de la insuficiencia troncal. Se han propuesto varias alternativas: plastía troncal, colocación de homoinjerto y cambio valvular por prótesis mecánica. En el análisis multivariado realizado por Danton, la insuficiencia por lo menos moderada de la válvula troncal fue el factor de riesgo para mortalidad.14 En nuestra serie, la insuficiencia troncal moderada o importante también se asoció significativamente a mortalidad. Estos hallazgos contrastan con lo encontrado por Henaine, en cuyo análisis multivariado se demostró que la insuficiencia moderada o importante en la presentación inicial de esta cardiopatía fue factor de riesgo para reoperación de la válvula truncal, pero no para mortalidad.12
Recientemente, el intervencionismo ha ocupado un lugar importante en el manejo del paciente operado de tronco arterioso ya que, en algunos casos, prolonga el tiempo libre de reoperación por intervenciones directas en el tubo. En la serie de Mc Elhinney se requirieron 12 dilataciones con balón en 128 sobrevivientes.13 En el grupo de Brown, 7 de 53 sobrevivientes requirieron dilatación de la anastomosis y del conducto valvado.10 De nuestro grupo, tres enfermos (10.7%) requirieron intervencionismo: uno para dilatar el tubo, otro para dilatar el tubo y colocar stent en ramas (al que se practicó cirugía de Barbero) y el último para dilatar ramas.
Rajasinghe reportó sobrevida de 90% a 5 años, 85% a 10 años y 83% a 15 años.9 La sobrevida en nuestro Instituto a 30 días fue de 96.42%, al año y a los 5 años, de 88.9%, similar a lo que se reporta en la literatura.
Desde hace más de 40 años se han estudiado dos síndromes: el velocardiofacial y el de Di George, ambos comparten características como la facies y cardiopatías troncoconales. Se ha comprobado que tienen un defecto genético común, que es la deleción de la región q11 del cromosoma 22 y se denomina 22q11.2. Esta deleción se observa mediante una técnica de Ínmunofluorescencia in situ –FISH–, que marca de manera puntual la región ausente del cromosoma.15 En un estudio realizado por Goldmuntz en 251 pacientes con diversas alteraciones troncoconales, se demostró que el 34.5% (10/29) de los pacientes portadores de tronco arterioso tenían deleción del cromosoma 22.16 El 32% de nuestros pacientes (9) la presentó. Con ello se corrobora la etiología génica de la cardiopatía.
Futuro. Es claro que la anatomía y las alteraciones hemodinámicas de esta cardiopatía impactan en la técnica quirúrgica y su evolución por lo que, para el futuro, se ha propuesto llevar a cabo una descripción completa de esta entidad que incluya: anatomía y función de la válvula troncal: número de valvas, presencia o no de displasia, grado de cabalgamiento sobre los ventrículos, presencia o no de estenosis o insuficiencia, además del grado de dichas lesiones. Otras, como la hipoplasia de uno de los ventrículos, dependiendo del grado de cabalgamiento de la válvula troncal, las anomalías coronarias y, por último, la deleción del par 22. Esto permitirá homogeneizar criterios para registrar y analizar los datos que establezcan riesgos y criterios terapéuticos.1 Parece justo agregar otras perspectivas como la implantación percutánea de prótesis pumlonar en los tubos valvulados, lo que ya es una realidad en algunos centros.
Conclusiones
• Debido al sistema de referencia de nuestros pacientes, la edad al momento de la cirugía fue mayor que la descrita en los últimos años en la literatura.
• Ninguno de los pacientes cateterizados antes de la cirugía tuvo criterios hemodinámicos que contraindicaran el tratamiento correctivo.
• El momento ideal para la corrección quirúrgica pudiera no estar limitado a la etapa neonatal.
• La presencia de insuficiencia troncal significativa (moderada o importante) fue el único factor de riesgo que se asoció a mortalidad.
• El procedimiento intervencionista parece ser una opción terapéutica adecuada en el manejo de la estenosis del tubo o ramas pulmonares, aumentando su tiempo de funcionalidad.
• La necesidad de cambio de tubo, hasta el momento, es baja, y la funcionalidad de las prótesis mecánicas en posición troncal ha sido favorable.
• No tenemos experiencia con homoinjertos, de tal suerte que nuestros resultados ofrecen una alterativa de manejo en centros cardiológicos semejantes al nuestro.
Limitaciones. Se trata de una serie corta, con poco tiempo de evolución para poder evaluar adecuadamente otros factores de riesgo y desenlaces a corto, mediano y largo plazo, como son tiempo ideal de la corrección, funcionalidad del tubo o de la prótesis, crecimiento, desarrollo, capacidad física, impacto de la cardiopatía en el núcleo familiar, y comportamiento ante enfermedades adquiridas en la etapa adulta.
Bibliografía
1. Jacobs ML. Congenital heart surgery nomenclature and database project: truncus arteriosus. Ann Thorac Surg 2000;69:S50–5. [ Links ]
2. Kirklin B, Kouchoukos N, Blackstone E, Doty D, et al. Cardiac Surgery. Morphology, diagnosis criteria, natural history, techniques, results and indications. In: Troncus arteriosus. 3rd Ed. Philadelphia (PA): Elsevier 2003; 1200–21. [ Links ]
3. Collett R W, Edward J E. Persistent truncus arteriosus. A classification according to anatomic types. Surg Clin North Am 1949;29:1245–70. [ Links ]
4. Van Praagh R, Van Praagh S. The anatomy of common aortic pulmonary trunk (truncus arteriosus communis) and its embryonic implications. A study of 57 necropsy cases. Am J Cardiol 1965;16:406–25. [ Links ]
5. Apppelbaum A, Bargeron A, Pacifico A, Kirklin J. Surgical treatment of truncus arteriosus, with emphasis on infant and small children. J Thoracic Cardiovasc Surg 1976; 71 (3):436–40. [ Links ]
6. Rastelli GC, Titus JL, McGoon DC. Homograft of ascending aorta and aortic valve as a right ventricular outflow: an experimental approach to the repair of truncus arteriosus. Arch Surg 1967;95:698–708. [ Links ]
7. Mair DD, Ritter DG, Davis GD, Wallace RB, et al. Selection of patients with truncus arteriosus for surgical correction: anatomic and hemodynamic considerations. Circulation 1974;49:144–51. [ Links ]
8. Lacour–Gayet F, Serraf A, Koyima T. Truncus arteriosus repair: influence of techniques of right ventricular outflow tract reconstruction. J Thorac Cardiovasc Surg 1996;111:849–56. [ Links ]
9. Rajasinghe HA, McElhinney DB, Reddy VM, Mora BN, et al. Long term follow–up of truncus arteriosus repaired in infancy: a twenty year experience. J Thorac Cardiovasc Surg 1997;113:869–79. [ Links ]
10. Brown J, Ruzmetov M, Okada Y, Vijay P, et al. Truncus arteriosus repair: outcomes, risk factors, reoperation and management. Eur J Cardiothorac Surg 2001 ;20:221–7. [ Links ]
11. Thompson L, Mc Elhinney D, Reddy M, Petrossian D, et al. Neonatal repair of truncus arteriosus: continuous improvement in outcomes. Ann Torac Surg 2001;72:391–5. [ Links ]
12. Henaine R, Azarnoush K, Belli M, Capderou A, et al. Fate of the truncal valve in troncus arteriosus. Ann Thorac Surg 2008;85:172–8. [ Links ]
13. Mc Elhinney DB, Rajasinghe HA, Mora BN, Reddy M, et al. Reinterventions after repair common arterial trunk in neonates and young infants. J Am Coll Cardiol 2000;35:1317–22. [ Links ]
14. Danton MHD, Stumper B, Wrigth JG, De Giovanni J, et al. Repair of troncus arteriosus: a considered approach to right ventricular outflow tract reconstruction. Eur J Cardiothorac Surg 2001;20:95–104. [ Links ]
15. Buendía–Hernández A, Calderón–Colmenero J, Aizpuru E, Attie CL, et al. Deleción en el cromosoma 22 (22q.11.2). Etiología de cardiopatías congénitas troncoconales. Arch Inst Cardiol Mex 2000;70:148–53. [ Links ]
16. Goldmuntz E, Clark B, Mitchell L, Jalad A, Cuneo. Frequency of 22q11 deletion in patients with conotruncal defects. J Am Coll Cardiol 1998;32:492–8. [ Links ]














