Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.79 no.1 Ciudad de México ene./mar. 2009
Artículo de investigación: cardiología clínica
Enfermedad de Kawasaki: comportamiento clínico y complicaciones cardiovasculares en niños atendidos en un hospital de tercer nivel
Kawasaki disease: clinical behaviour and cardiovascular complications in children in a tertiary–care level hospital
Mariana Gil Velozª, Eric M. Flores Ruizb, Luisa G. Beirana Palenciac, María Guadalupe Miranda Novalesb, Gloria C. Huerta Garcíab y Fortino Solórzano Santosd,*
ª Departamento de Pediatría Médica, Hospital de Pediatría, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social, México D.F. , México.
b Departamento de Infectología, Hospital de Pediatría, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social, México D.F. , México.
c Departamento de Cardiología, Hospital de Pediatría, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social, México D.F. , México.
d Dirección Médica, Unidad Médica de Alta Especialidad, Hospital de Pediatría, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social, México D.F. , México.
*Autor para correspondencia.
Correo electrónico: solorzanof@terra.com.mx; forsosa@starmedia.com.
Recibido el 30 de noviembre de 2007.
Aceptado el 30 de octubre de 2008.
Resumen
Objetivos: Describir las características clínicas, la evolución y la respuesta al tratamiento en una serie de pacientes con enfermedad de Kawasaki (EK).
Métodos: Serie de casos, revisión de expedientes clínicos de niños con diagnóstico de EK atendidos de noviembre de 1999 a septiembre de 2006.
Resultados: Se analizó a 22 pacientes; la relación varones: mujeres fue 1,4:1; el 82% de los sujetos eran menores de 5 años, y el 14% tuvo una presentación atípica. Diez de los 22 (45%) pacientes recibieron tratamiento con gammaglobulina intravenosa (GGIV) a dosis y tiempo recomendado; de éstos, 4/10 presentaron alteración de las arterias coronarias, que desapareció en el seguimiento. Ocho sujetos recibieron GGIV en dosis o tiempo inadecuado; 6 de ellos presentaron alteración de las arterias coronarias y 2 pacientes tuvieron aneurismas residuales. Cuatro pacientes no recibieron GGIV, 2 con aneurismas coronarios residuales. Al evaluar las complicaciones coronarias residuales, los sujetos que recibieron tratamiento adecuado no tuvieron lesiones coronarias residuales (0/10); en el grupo de pacientes que recibieron un tratamiento inadecuado o no lo recibieron, se presentaron aneurismas coronarios residuales en el 33% (4/12), pero la diferencia no fue estadísticamente significativa (p = 0,0636).
Conclusiones: La EK es una entidad poco frecuente en nuestro país, la mayoría de los casos cumple con los criterios clínicos clásicos, pero la referencia tardía y el retraso en el inicio del tratamiento ensombrecen el pronóstico.
Palabras clave: Enfermedad de Kawasaki; Aneurismas coronarios; Gammaglobulina intravenosa; Cardiopatía adquirida.
Abstract
Objectives: To describe the clinical characteristics, outcome, and treatment response in a series of patients with Kawasaki disease (KD).
Methods: Case–series, review of clinical records of children with KD diagnosis cared for from november 1999 to september 2006.
Results: 22 patients were included, male:female ratio, 1.4:1, 82% younger than 5 years, 14% with atypical presentation. Of the 22 patients, 10 (45%) received intravenous gammaglobulin (IVGG) in the first 10 days of symptoms onset at the recommended dose; four of them had coronary artery damage but none developed residual aneurysmatic lesions. Eight received IVGG in a different dose or after 10 days, six of them had coronary lesions and in two the damage was permanent. Four patients did not receive IVGG, and two had residual aneurysmatic lesions. None of those who received adequate treatment developed coronary residual damage, in comparison with 33% who received inadequate or no treatment, but difference was not statistically significant (P =.06).
Conclusions: KD is a rare clinical entity in our country; even though most of the cases occurred with classic clinical criteria, late referral and delay of treatment worsen the prognosis.
Keywords: Kawasaki disease; Coronary aneurysm; Intravenous gammaglobulin; Acquired cardiopathy.
Introducción
La enfermedad de Kawasaki (EK) es una vasculitis sistémica que se presenta principalmente en niños. Afecta en forma predominante a las arterias de mediano calibre, lo que repercute en diferentes órganos y tejidos. Se describió por primera vez en 1961 por el Dr. Tomisaku Kawasaki, quien realizó un reporte exhaustivo de las características clínicas de 50 pacientes1. El mayor número de casos de la enfermedad se registran entre el primer y segundo año de vida. El 80% de los pacientes son menores de 5 años, con una relación varón:mujer de 1,5:12. Tiene una presentación bimodal durante el año, con picos en los meses de enero y junio/julio, y un número mínimo en octubre3.
En el ámbito internacional, Japón tiene la incidencia más alta de EK, con 112 casos/100.000 niños menores de 5 años; le sigue Hawaii, con una incidencia de 45,2 casos/100.000 niños menores de 5 años; en Irlanda se reporta una incidencia de 16 casos/100.000 niños menores de 5 años; en EE. UU. la incidencia es de 17,1 casos/100.000 en menores de 5 años, y en México la incidencia se desconoce4,5. En Japón y EE. UU. se han reportado varias epidemias de la enfermedad (1979, 1982 y 1986, y 1976 y 1985, respectivamente).
La etiología de la enfermedad aún no está bien definida, aunque hay evidencia que sugiere que están involucrados agentes infecciosos, como son la evolución aguda, los picos estacionales, el aumento de la frecuencia en ciertas áreas geográficas y las epidemias reportadas. La hipótesis más aceptada es que algunas toxinas bacterianas actúan como superantígenos; éstos desencadenan la cascada de eventos inflamatorios que ocasionan la enfermedad, aun cuando los estudios, hasta el momento, no son concluyentes6–9.
El diagnóstico es clínico. Los criterios originalmente propuestos por el Dr. Kawasaki se confirmaron posteriormente por la American Heart Association (AHA) y se aceptan universalmente10. Estos incluyen: fiebre de más de 5 días sin causa aparente, exantema polimorfo, adenopatías cervicales agudas no supurativas, congestión no exudativa de la conjuntiva bulbar, extremidades con eritema y edema en la fase aguda, con descamación periungueal en la fase de convalecencia y alteraciones orofaríngeas (labios congestivos y fisurados, hiperemia faríngea, lengua aframbuesada). Los hallazgos de laboratorio encontrados en la EK no son específicos ni diagnósticos. En la fase aguda de la enfermedad se encuentran leucocitosis con aumento de las formas inmaduras, anemia normocítica normocrómica y aumento de la velocidad de sedimentación globular y de la proteína C reactiva. El recuento plaquetario es normal los primeros días y aumenta a partir de la segunda semana, hasta alcanzar grados extremos de plaquetosis. Puede haber hipoalbuminemia, alteración de los lípidos, elevación de la troponina cardíaca I y deshidrogenasa láctica (DHL)11. El concepto de Kawasaki atípico o incompleto se propuso en las últimas décadas y se aplicó a pacientes que no cumplían los criterios de forma completa una vez descartados otros diagnósticos diferenciales. Esta forma de presentación se ha reportado con mayor frecuencia en menores de 6 meses (32%) comparado con mayores de esa edad (12%) (p = 0,025)12,13.
Aunque la carditis no es un criterio diagnóstico de la enfermedad, la afección cardíaca es característica y la principal causa de morbilidad y mortalidad a largo plazo; se reconoce como la cardiopatía más frecuente adquirida en la niñez. La manifestación más grave de la EK es la dilatación de las arterias coronarias, que se presenta en la fase aguda hasta en un 20% de los pacientes11.
En México, el primer caso fue descrito por Rodríguez14 en 1977. Desde entonces se han publicado varias series de casos con la descripción clínica de la EK, la evolución, los reportes de complicaciones graves (infarto agudo de miocardio y muerte súbita) en pacientes no tratados y la respuesta al tratamiento.
En total, se han reportado aproximadamente 99 casos, incluidos los 22 casos que presentamos en este estudio1523.
Pacientes y métodos
Es un estudio de serie de casos. Se revisaron los expedientes clínicos de niños con edades comprendidas entre los 0 y los 16 años de edad, con EK registrada tanto como motivo de hospitalización como motivo de consulta externa, atendidos de noviembre de 1999 a septiembre de 2006.
Se analizaron las características generales de los pacientes, los criterios clínicos (fiebre de más de 5 días sin causa aparente y al menos 4 de los siguientes criterios: a) congestión no exudativa de la conjuntiva bulbar; b) alteraciones orofaríngeas: labios congestivos y fisurados, hiperemia faríngea, lengua aframbuesada; c) extremidades con eritema y edema en la fase aguda, y en la fase de convalecencia descamación periungeal; d) exantema polimorfo, y e) adenopatías cervicales agudas no supurativas y una enfermedad no explicable por otra afección) y pruebas de laboratorio que sustentaron el diagnóstico de EK, así como la evolución ecocardiográfica de las lesiones cardíacas presentadas según lo recomendado por la AHA11. Se definieron dilatación coronaria como la presencia de una arteria coronaria con un diámetro interno mayor al esperado según la superficie corporal del paciente11 y aneurisma como la presencia de una dilatación sacular de las arterias coronarias, con un tamaño > 3 mm en < 5 años o > 4 mm en > 5 años, o diferencia de 1,5 veces a un segmento adyacente. Según el tamaño, fueron pequeños si medían < 5 mm de diámetro interno; medianos, entre 5 y 8 mm de diámetro interno, y gigantes si medían > 8 mm11. Se consideró miocarditis la presencia de insuficiencia cardíaca, alteraciones del ritmo, disminución generalizada del voltaje del QRS, alteraciones de la repolarización y, en el ecocardio–grama, presencia de dilatación de cavidades cardíacas, con o sin disminución de la fracción de eyección. Se definió como pericarditis la presencia de líquido en el saco pericárdico o frote pericárdico, intervalo PR prolongado, cambios en el segmento ST y onda T.
De acuerdo con la indicación de gammaglobulina intravenosa (GGIV), se consideraron 3 grupos: a) con dosis adecuada los que recibieron 2 g/kg en infusión de 12 h, antes del día 10 de evolución; b) con dosis inadecuada cuando la administración de gammaglobulina se realizó a una dosis menor o después del día 10 de evolución, y c) los que no recibieron GGIV; se evaluaron la evolución y la presencia de complicaciones en cada grupo.
Se obtuvieron medidas de resumen para variables cualitativas y cuantitativas, y comparación de proporciones mediante la prueba exacta de Fisher para la frecuencia de aneurismas en relación con el tratamiento.
Resultados
Se revisaron los expedientes de 22 niños, 13 varones y 9 mujeres (relación 1,4:1); 18 (82%) eran menores de 5 años de edad, con una mediana de 32 meses (intervalo 3–132 meses). De acuerdo con el grupo de edad, el 36% eran lactantes, el 41% preescolares y el 23% escolares. El estado nutricional era normal en el 86% de los casos; 21 pacientes eran originarios y residentes de la ciudad de México. El mayor número de casos se presentó en invierno (8) y primavera (8) (distribución mensual: enero 2, febrero 3, marzo 3, abril 2, mayo 2, junio 1, agosto 1, septiembre 2, noviembre 3 y diciembre 3).
Con respecto al momento del diagnóstico, se detectó a 14 (63%) pacientes en fase aguda, 5 (23%) en fase subaguda y 3 (14%) en fase de convalecencia. La mediana de la evolución con fiebre fue de 8 días (intervalo 4–28 días).
La presentación típica se encontró en 19 (86%) de los 22 casos. En la tabla 1 se describen las manifestaciones clínicas encontradas, tanto las que se incluyen como criterio diagnóstico como aquellas que se presentan en forma infrecuente. Los pacientes con presentación atípica tuvieron al menos 3 de los criterios clínicos (inyección conjuntival, cambios en cavidad oral, exantema polimorfo o linfadenopatía); todos fueron preescolares.
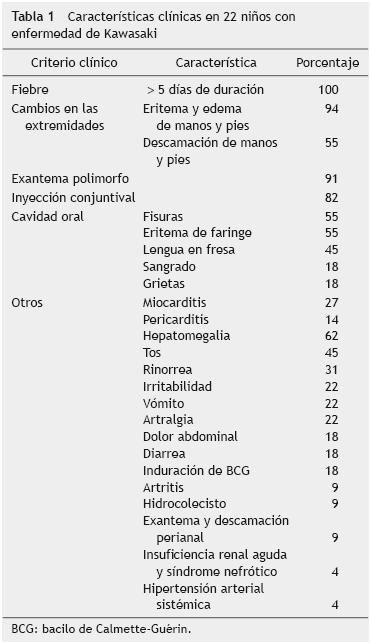
En 9 (41%) pacientes se encontró miocarditis y en 5 (23%) sujetos, pericarditis. En el 54,5% (n = 12) de los pacientes se encontró afección coronaria; uno de ellos presentó dilatación de la coronaria izquierda y aneurisma de la coronaria derecha; 7 (32%) pacientes presentaron sólo dilatación, 3 en la coronaria derecha, 1 en la coronaria izquierda y en 3 casos el compromiso fue de ambas. En 4 (18%) pacientes se detectó aneurisma de las arterias coronarias, en 2 casos se presentó en la arteria coronaria derecha, 1 de éstos se clasificó como gigante, y 2 pacientes presentaron aneurisma en ambas arterias, 1 de ellos tuvo un aneurisma derecho moderado e izquierdo gigante y el otro presentó aneurismas gigantes en la arteria coronaria derecha, izquierda y circunfleja. En relación con el momento del diagnóstico, se diagnosticó a 5 pacientes en la fase aguda de la enfermedad, 5 en la fase subaguda y 2 en fase de convalecencia.
Las alteraciones de laboratorio más frecuentemente encontradas fueron: leucocitosis con neutrofilia en el 95% de los pacientes; DHL > 100 U/dl en el 86%; proteína C reactiva > 10 mg/dl en el 78%; plaquetosis > 500.000 en el 72%; albúmina < 3 g/dl en el 50%; transaminasemia en el 36%; velocidad de sedimentación glomerular > 10 mm/h en el 36%; piuria estéril en el 27%; anemia < 10 mg/dl en el 27%; proteinuria en el 22%, e hiperbilirrubinemia a expensas de la bilirrubina indirecta en el 22%.
Con respecto al tratamiento, a 18 (81%) niños se les administró una primera dosis de GGIV y a 3 pacientes, por persistencia de la fiebre, se les administró una segunda dosis, con la que hubo defervescencia. A 19 (86%) de los 22 pacientes además se les administraron salicilatos a dosis antiinflamatorias. Ningún paciente recibió tratamiento con esteroides.
De los 10 pacientes que recibieron GGIV en forma adecuada, 6 no presentaron ninguna alteración coronaria, 3 tuvieron dilatación de las arterias coronarias y 1 presentó aneurisma en la fase aguda (que remitió en el cuarto mes de seguimiento). Ningún niño de este grupo presentó lesiones residuales. En el 80% desapareció la fiebre en las primeras 48 h.
En el grupo de 8 pacientes que recibieron la GGIV después del día 10 de evolución, 2 sujetos no tuvieron ninguna alteración, 4 presentaron dilatación de las arterias coronarias, de los cuales 1 caso fue persistente, y 2 pacientes desarrollaron aneurismas, de los cuales sólo en 1 caso persistieron. De estos pacientes, en el 62% hubo desaparición de la fiebre en las primeras 48 h posteriores a la aplicación de la GGIV.
En 4 de los 22 niños no se administró GGIV; 1 tuvo una alte ración coronaria y 2 desarrollaron aneurismas que fueron persistentes en el seguimiento (tabla 2).
Todos los pacientes con dilatación o aneurismas coronarios recibieron tratamiento de sostén con ácido acetilsalicílico a dosis baja hasta que se documentó la regresión de la lesión.
A 3 pacientes, por la gravedad de las lesiones observadas en el ecocardiograma, se les realizó un cateterismo cardíaco diagnóstico: 1 paciente presentó un aneurisma coronario derecho gigante ectásico de 9 × 40 mm y en la arteria co ronaria descendente anterior, un aneurisma sacular de 6 × 11 mm (fig. 1); en el segundo paciente se encontró un aneurisma gigante fusiforme en el tronco de la arteria coronaria izquierda, de 13 × 14 mm, y un aneurisma moderado en la arteria coronaria derecha, de 6,1 mm, y el tercer paciente presentó aneurismas saculares del tercio proximal de la circunfleja y descendente anterior, con trayecto arrosariado de la coronaria derecha. En ninguno de los 3 pacientes fue necesaria la colocación de un stent. En los aortogramas de los 3 pacientes no se documentó afección de otras arterias principales. En los 3 casos el manejo con IGGV fue inadecuado o no se administró; actualmente, los pacientes reciben tratamiento con ácido acetilsalicílico a dosis baja y warfarina, hasta el momento ningún paciente ha fallecido.

Discusión
La EK es una vasculitis sistémica que afecta a las arterias de mediano calibre. El diagnóstico se basa primordialmente en criterios clínicos y requiere de sospecha. Se carece de pruebas de diagnóstico específicas, lo que puede afectar a la incidencia reportada. A pesar de que en Japón y en EE. UU. es una afección endémica y se tiene conocimiento de su incidencia anual3,4, en México no se conoce su incidencia real. De acuerdo con los reportes disponibles en la literatura médica nacional en revistas indexadas y no indexadas, de 1977 a la actualidad se han identificado 77 casos publicados14–23. Sin embargo, no es una enfermedad de notificación obligatoria, por lo que es más probable que la frecuencia sea mayor que la reportada. Con este estudio se agregan 22 pacientes (tabla 3) a los anteriores análisis. De acuerdo con la presentación estacional, resalta que el 50% de los casos se presentan en primavera y, en segundo lugar, en invierno. Existe un predominio de varones; casi el 95% tuvo la presentación típica, con trombocitosis en el 74% de los casos: En general, la EK tiene una letalidad baja.
En esta serie de casos registrados entre 1999 y 2006, el grupo etario más afectado fueron los menores de 5 años (78%), con una relación varón:mujer de 1,5:1, similar a la reportada en el ámbito mundial2. Respecto a la temporalidad, el mayor número de casos lo encontramos en primavera e invierno, y la mayor incidencia en febrero y marzo; los hallazgos son diferentes de los reportados por Burns1, por lo que probablemente la estacionalidad sea variable, dependiendo del país analizado1,3.
Para poder minimizar la posibilidad de secuelas, la oportunidad del diagnóstico y el tratamiento son cruciales. En este estudio se diagnosticaron después de la fase aguda un 37% de los casos, lo que denota la falta de sospecha de la enfermedad, que empobrece el pronóstico. Por lo expuesto, la enfermedad debe considerarse como un diagnóstico diferencial en todo menor de 5 años con fiebre persistente y alguno de los 5 criterios ya descritos. En la presente serie, la presentación típica se encontró en el 86% de los casos, por lo que la correcta aplicación de los criterios clínicos permitió establecer el diagnóstico con una elevada probabilidad. De los 5 criterios clínicos, el que se presentó con menor frecuencia fue la linfadenopatía cervical (63%), lo que coincide con lo que se reporta en la literatura científica. El resto de los criterios se presenta habitualmente con una frecuencia mayor al 90%. En nuestro estudio sólo la inyección conjun tival bulbar sin exudados (78%) no cumplió con esta condición6.
Se ha descrito la inflamación de la cicatriz de BCG en niños con EK; este dato sólo se encontró en el 18% de los pacientes (casos típicos y atípicos), lo que sugiere una baja frecuencia de este signo24.
En general, las alteraciones de las arterias coronarias se presentan en el 20% de los pacientes, con regresión de las lesiones en el 50% de los casos. El objetivo de un tratamiento adecuado (salicilatos a dosis antiinflamatoria y GGIV) es disminuir la frecuencia de aneurismas a un 3%. La dosis de GGIV recomendada que ha mostrado mejor evidencia en la prevención de la formación de aneurismas coronarios es de 2 g/kg en infusión continua durante 12 h, comparada con dosis menores fraccionadas. En esta serie, cuando el manejo fue adecuado, no hubo pacientes con lesiones coronarias residuales, en comparación con los sujetos que no la recibieron o la recibieron en dosis inadecuada o tardía (0/10 frente a 4/12; p > 0,06). Esta comparación no es estadísticamente significativa, probablemente por el tamaño de la muestra, pero apoya la propuesta terapéutica de administrar GGIV25. El mecanismo por el cual la GGIV produce la mejoría en esta afección aún no está claro. La GGIV es un potente inmunomodulador; la rapidez con la que actúa sugiere la neutralización de las toxinas bacterianas que actúan como superantígenos, así como el bloqueo de citocinas pro–inflamatorias, lo que, probablemente, explique la mejoría del cuadro clínico y la prevención de la formación de aneurismas coronarios26. Newburger et al27 realizaron un ensayo clínico controlado con el tratamiento habitual más esteroides en un grupo; no encontraron diferencia en relación con el número de días con fiebre, necesidad de retratamiento con GGIV o efectos adversos, por lo que su uso no se recomienda28.
Los datos sugieren que cuando los pacientes ingresan en la fase temprana de la enfermedad y reciben tratamiento adecuado, se evitan las lesiones cardíacas permanentes. En esta serie, llama la atención que un 50% de los pacientes llegó en forma tardía o con alteraciones coronarias. Probablemente la enfermedad no se sospecha oportunamente en la primera fase, cuando es susceptible de tratamiento, por lo que se requiere de una mayor difusión de los criterios diagnósticos que ayuden a una sospecha temprana. El retraso en el diagnóstico se asocia a mayor frecuencia de lesiones de las arterias coronarias29.
Los pacientes con EK pueden clasificarse, según el riesgo de presentar isquemia del miocardio, en 5 niveles, lo que permite individualizar el tratamiento y el seguimiento de cada paciente para disminuir el riesgo de trombosis11:
— Nivel 1: paciente sin cambios en las arterias coronarias en ningún momento de la afección. En este grupo no se recomienda tratamiento antiplaquetario; no tienen restricción física después de la fase aguda; no se recomienda cateterismo, y el seguimiento debe realizarse cada 5 años.
— Nivel 2: pacientes con alteraciones transitorias de las arterias coronarias (desaparecen de 6 a 8 semanas después de iniciada EK). No requieren tratamiento anti–plaquetario después de la resolución de las lesiones; no tienen restricción de la actividad física; no se recomienda cateterismo y el seguimiento debe hacerse cada 3 a 5 años.
— Nivel 3: pacientes con aneurisma coronario pequeño o mediano (> 3 mm o < 6 mm). Tratamiento con ácido acetilsalicílico hasta que remita el aneurisma; en la primera década de la vida la actividad física no se restringe, después de la segunda década debe evitarse actividad física intensa. Debe realizarse una prueba de estrés con evaluación de la perfusión miocárdica anual y angiografía si hay alteración. El seguimiento por el servicio de cardiología pediátrica debe ser anual.
— Nivel 4: pacientes con 1 o más aneurismas grandes (> 6 mm) y pacientes con alteración de una arteria coronaria en varios segmentos. Se recomienda tratamiento antiplaquetario y anticoagulación con warfarina o heparina de bajo peso molecular. La actividad deportiva intensa no está recomendada y la actividad deportiva o recreativa cotidiana puede realizarse si no hay evidencia de isquemia miocárdica inducida por estrés. Se recomienda realizar un cateterismo cardíaco de 6 a 12 meses después de la fase aguda de la enfermedad. El seguimiento debe realizarse cada 6 meses por un cardiólogo pediatra.
— Nivel 5: pacientes con obstrucción coronaria confirmada. Deben recibir tratamiento antiplaquetario y anticoagulante a largo plazo: debe considerarse un bloqueador beta para disminuir el consumo de oxígeno. La actividad física se recomienda según el resultado de pruebas de estrés, con imágenes de perfusión miocárdica con radioisótopos. El estudio angiográfico debe realizarse para evaluar la posibilidad de revascularización. Debe realizarse una evaluación cardiológica cada 6 meses.
Agradecimientos
Al Dr. José Luis Acosta Valdez por facilitarnos las imágenes angiográficas.
Bibliografía
1. Burns JC. Commentary: translation of Dr. Tomisaku Kawasaki's original report of fifty patients in 1967. Pediatr Infect Dis J. 2002;21:993–5. [ Links ]
2. Saulsbury F. Kawasaki syndrome. En: Mandel GL, Bennett JE, Dolin R, editors. Principles and practice of infectious disease. 6.ª ed. New York: Churchill Livingston; 2005. p. 2983–6. [ Links ]
3. Burns JC, Cayan DR, Tong G, Bainto E V, Turner CL, Shike H, et al. Seasonality and temporal clustering of Kawasaki syndrome. Epidemiology. 2005;16:220–5. [ Links ]
4. Holman RC, Curns AT, Belay ED, Steiner CA, Schonberger LB. Kawasaki syndrome hospitalizations in United States, 1997 and 2000. Pediatrics. 2003;112:495–501. [ Links ]
5. Lynch M, Holman RC, Mulligan A, Belay ED, Schonberger LB. Kawasaki syndrome hospitalization in Ireland, 1996 through 2000. Pediatr Infect Dis J. 2003;23:959–62. [ Links ]
6. Burns JC, Glodé M P. Kawasaki syndrome. Lancet. 2004;364: 533–44. [ Links ]
7. Leung DH, Meissner CH, Shulman S T, Mason WH, Gerber MA, Glode M P, et al. Prevalence of superantigen–secreting bacteria in patients with Kawasaki disease. J Pediatr. 2002;140:742–6. [ Links ]
8. Wang Ch, Wu Y, Liu C. KawasakidDisease infection, Immmunity and genetics. Pediatr Infect Dis J. 2005;24:998–1004. [ Links ]
9. Meissner CH, Donald YM, Leung M. Superantigens, conventional antigens and the etiology of Kawasaki syndrome. Pediatr Infect Dis J. 2000;19:91–4. [ Links ]
10. Teral M. Diagnostic guidelines for Kawasaki disease. Engl J Med. 1991;32:1633–9. [ Links ]
11. Newburger JW, Takahashi M, Gerber MA, Gewitz MH, Tani LY, Burns JC, et al. Diagnosis, treatment and long term management of Kawasaki disease. Circulation. 2004;110:2747–71. [ Links ]
12. Rowley A. Incomplete Kawasaki disease. Pediatr Infect Dis J. 2002;21:563–5. [ Links ]
13. Feng–Yu C, Hwang B, Chen SJ, Lee PC, Meng CC, Lu JH. Characteristics of Kawasaki disease in infants younger than six months of age. Pediatr Infect Dis J. 2006;25:241–4. [ Links ]
14. Rodríguez RS. Síndrome linfo–nodo–mucocutáneo. Reporte de un caso. Bol Med Hosp Infant Mex. 1977;34:53–7. [ Links ]
15. González–Glanares M, Urban–Vazquez H, Santamaría–Díaz H. Enfermedad de Kawasaki en México: análisis de 13 casos. Bol Med Hosp Infant Mex. 1991;48:409–16. [ Links ]
16. Vizcaíno–Alarcón A, Arévalo–Salas A, Rodríguez–López AM. Enfermedad de Kawasaki en niños mexicanos. Bol Med Hosp Infant Mex. 1991;48:398–408. [ Links ]
17. Rodríguez–Herrera R, Carbajal–Rodríguez L, Reynés–Manzur JN. Enfermedad de Kawasaki. Acta Pediatr Mex. 2001;22:97–103. [ Links ]
18. Sotelo–Cruz N, González–Ramos LA, Gómez–Rivera N. Enfermedad de Kawasaki. Experiencia en siete niños. Rev Mex Pediatr. 2001;68:189–95. [ Links ]
19. Frenkel–Salamon M, Ocaña–García LA, Bautista–Santos A. Enfermedad de Kawasaki: experiencia con ocho casos del centro médico ABC. An Med Asoc Med Hosp ABC. 2004;49:66–72. [ Links ]
20. Coria–Lorenzo J, Cervantes–Parra V, Urtiz–Jerónimo F, Reyes–López A, Coria–Guerrero A. Características clínicas de niños con Kawasaki atípico en un hospital de alta especialización. Rev Mex Pediatr. 2007;74:9–15. [ Links ]
21. Sotelo N, Gonzalez LA. Kawasaki disease: a rare pediatric pathology in Mexico. Twenty cases report from the Hospital Infantil del Estado de Sonora. Arch Cardiol Mex. 2007;77:299–307. [ Links ]
22. Alva–Espinoza C, Díaz–Arauzo A, Mojarro–Ríos J, Jiménez–Zepeda D, Martínez–Sanchez A. Enfermedad de Kawasaki: diagnóstico ecocardiográfico de los aneurismas coronarios. Informe de dos casos. Arch Inst Cardiol Méx. 1995;65:75–7. [ Links ]
23. Cervantes–Salazar JL, Calderón–Colmenero J, García–Montes JA, Patiño–Bahena EJ, González–Pacheco H, Soule–Egea M, et al. Enfermedad de Kawasaki, conceptos sobre la cirugía de revascularización coronaria en edad pediátrica. Arch Cardiol Mex. 2006;76:75–9. [ Links ]
24. Sinha R. BCG reactivation: a useful diagnostic tool even for incomplete Kawasaki disease. Arch Dis Child. 2005;90:891. [ Links ]
25. Oates–Whitehead RM, Baumer JH, Haines L, Love S, Maconochie IK, Gupta A, et al. Intravenous immunoglobulin for the treatment of Kawasaki disease in children. Cochrane Database of Systematic Reviews. 2003;4: CD004000. [ Links ]
26. Leung D. Kawasaki syndrome: immunomodulatory benefit and potential toxin neutralization by intravenous immune globulin. Clin Exp Immunol. 1996;104 Suppl 1:49–54. [ Links ]
27. Newburger JW, Takahashi M, Burns JC, Beiser AS, Chung KJ, Duffy CE, et al. The treatment of Kawasaki syndrome with intravenosus gamma globulin. N Engl J Med. 1986;315:341–7. [ Links ]
28. Newburger J, Sleeper l, McCrindle B, Minich L, Gersony W, Vetter M, et al. Randomized trial of pulsed corticosteroid therapy for primary treatment of kawasaki disease. N Engl J Med. 2007; 356:663–75. [ Links ]
29. Wilder MS, Palinkas LA, Kao AS, Bastian J F, Turner CL, Burns JC. Delayed diagnosis by physicians contributes to the development of coronary artery aneurysms in children with Kawasaki syndrome. Pediatr Infect Dis J. 2007;26: 256–60. [ Links ]














