Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.78 n.4 Ciudad de México Oct./Dec. 2008
Imagen en cardiología
Importancia de la detección de viabilidad miocárdica: evaluación con tomografía por emisión de positrones con 18F–FDG
Value of the assessment of myocardial viability: evaluation with positron emission tomography 18F–FDG
Erick Alexánderson Rosas,* Pedro Alberto Lamothe Molina,** Fernando Iñarra Talboy,** Rodrigo Calleja Torres,** Alfonso Martínez García,** Juan Manuel Ochoa López,** Aloha Meave González*
* Instituto Nacional de Cardiología Ignacio Chávez y Unidad PET/CT Ciclotrón, Facultad de Medicina, UNAM.
** Unidad PET/CT Ciclotrón, Facultad de Medicina, UNAM.
Correspondencia:
Dr. Erick Alexánderson.
Departamento de Medicina Nuclear.
Instituto Nacional de Cardiología Ignacio Chávez
(INCICH, Juan Badiano Núm. 1, Col. Sección XVI,
Tlalpan 14080. México D.F.).
Tel. 55732911
Recibido: 26 de mayo de 2008
Aceptado: 26 de septiembre de 2008
Resumen
Solía pensarse que las secuelas de la enfermedad arterial coronaria (EAC) eran irreversibles y que el pronóstico del paciente estaba limitado al grado de disfunción ventricular. Este paradigma cambió radicalmente cuando se dio a conocer el concepto de miocardio hibernante, el cual plantea la existencia de tejido que, tras la restauración de su aporte sanguíneo, recupera su función contráctil. Esto introdujo un nuevo concepto en la cardiología: la viabilidad miocárdica. En este trabajo presentamos un ejemplo claro de la importancia de realizar la detección de viabilidad miocárdica, en determinados pacientes, debido al impacto que tiene la presencia de viabilidad tanto en el tratamiento como en el pronóstico. Así mismo, se hace énfasis en la utilidad que tiene la tomografía por emisión de positrones (PET) para la detección de viabilidad, siendo este método el estándar de oro para esa tarea.
Palabras clave: Viabilidad miocárdica. Miocardio hibernante. Tomografía por emisión de positrones (PET).
Abstract
It used to be thought that the consequences of coronary artery disease were final, and that the prognosis of the patient was limited to the extent of the ventricular dysfunction. This paradigm changed radically when the concept of hibernating myocardium was introduced, which states the existence of tissue that can regain contractile function after being revascularized. This introduced a new concept in cardiology: myocardial viability. This work presents a clear example of the importance of detecting myocardial viability in selected patients, due to the impact not only in treatment but in prognosis as well. It is also emphasized that positron emission tomography (PET) is the gold standard method to detect myocardial viability.
Key words: Myocardial viability. Hibernating myocardium. Positron emission tomography (PET).
Introducción
Este reporte de caso pretende ilustrar la fisiopatología del miocardio hibernante y la viabilidad miocárdica, así como también ejemplificar que la tomografía por emisión de positrones (PET) es un método no invasivo efectivo en la detección de viabilidad miocárdica. La detección de viabilidad miocárdica es un concepto actual y de alta trascendencia en la práctica cotidiana de la cardiología.
Presentación del paciente:
Paciente masculino de 58 años de edad, con obesidad, tabaquismo, hipertensión arterial sistémica y diabetes mellitus tipo 2. Cardiopatía isquémica; infarto anteroseptal y posteroinferior hace 1 y 3 meses respectivamente. El paciente presenta actualmente disnea de medianos esfuerzos, sin embargo no refiere dolor precordial.
Debido a los infartos y a la disnea del paciente, se le realizó un ecocardiograma bidimensional transtorácico para evaluar función ventricular. En el ecocardiograma basal se encontró el ventrículo izquierdo (VI) dilatado, adelgazamiento y acinesia inferior, anteroapical y de los 2/3 inferiores del septum. Movilidad lateral y anteroseptal basal normales. Se determinó una fracción de eyección del ventrículo izquierdo (FEVI) de 20%.
Debido a los infartos recientes y a la mala función ventricular, se decidió valorar viabilidad por medio de un ecocardiograma con dobutamina. Se administraron 40 gamas de dobutamina alcanzando el 81% de la frecuencia cardíaca máxima esperada (FCME), sin atropina. El paciente no presentó cambios electrocardiográficos ni síntomas. Tampoco presentó cambios en la movilidad de los segmentos afectados previamente mencionados. Por lo anterior, el diagnóstico ecocardiográfico final fue de cardiopatía isquémica, con infarto antiguo septoapical y posteroinferior, sin viabilidad miocárdica.
Se solicitó revaloración de viabilidad miocárdica con tomografía por emisión de positrones (PET), para considerar revascularización coronaria. Se practicó estudio de perfusión miocárdica con 13N–amonio PET en reposo y en esfuerzo farmacológico con adenosina para descartar isquemia residual, evaluar función ventricular y para utilizar las imágenes de perfusión en reposo como referencia contra la captación de 18F–FDG. Posteriormente también se realizó un estudio de viabilidad miocárdica con 18 F 2–deoxi–2 fluoro D glucosa (18F–FDG) PET.
En el estudio de perfusión (Fig. 1) se encontró:
1. Infarto transmural del ápex, septum y del tercio apical y medio de la pared anterior y no transmural en la porción basal de la pared anterior.
2. Infarto transmural de localization inferior, sin isquemia de tejido residual.
3. Isquemia ligera de la porción basal de la pared anterior.
4. Isquemia moderada de localization lateral.
En el estudio PET sincronizado con electrocardiograma se pueden obtener los volúmenes del ventrículo izquierdo tanto en sístole como en diastole, y por tanto la FEVI. Debido a la vida media corta del radiotrazador 13N–amonio, es posible evaluar la función ventricular tanto en reposo como en esfuerzo. La función ventricular se encontró de la siguiente manera (Figs. 2 y 3): Discinesia septal e hipocinesia anteroseptal, inferior y lateral. Disminución del engrasamiento sistólico anteroseptal, apical e inferior. FEVI del 27% en reposo y del 31% en esfuerzo. Aun cuando en este caso, la función ventricular izquierda está muy deteriorada, ésta mejora con el esfuerzo. Esto se debe probablemente a que prácticamente no se presenta isquemia en este caso, lo cual empeoraría la función ventricular durante el esfuerzo si existiese.


En el estudio de viabilidad (Fig. 4), se observa buena captación de 18F–FDG en el septum y en la pared inferior, así como moderada captación en la pared anterior y del ápex.
En el mapa polar de captación (Fig. 5) podemos apreciar un patrón discordante en la región anteroseptal, en el ápex y en la pared inferior (este patrón es indicativo de viabilidad miocárdica). No hay perfusión con 13N–amonio en estas regiones pero sí existe evidencia de actividad metabólica con 18F–FDG.

La región anterolateral perfunde bien, sin embargo, no existe captación de 18F–FDG. Esto se debe probablemente a que en condiciones normales, el miocardio consume ácidos grasos como principal fuente energética y no glucosa. Como el 18F–FDG es un trazador derivado de la glucosa, las células miocárdicas normales no lo captan tanto como las células hibernantes. Es importante señalar que el estudio de viabilidad miocárdica con 18F–FDG siempre debe ser comparado con un estudio de perfusión en reposo. Si en este caso no se hubiera observado el estudio de perfusión en reposo se podría pensar que existe un defecto en la región anterolateral que en realidad es la mejor perfundida.
También se puede evaluar la función ventricular con 18F–FDG. En la Figura 6 se puede observar que existe buena captación de 18F–FDG en la pared septal, inferior y en el ápex, pero no se observa movilidad ni engrasamiento sistólico en estas regiones. Esto se debe probablemente a que se trata de miocardio hibernante, es decir, tejido vivo, metabólicamente activo pero sin sus propiedades contráctiles.

En la Tabla I se pueden ver los valores de la función ventricular izquierda con los diferentes trazadores.

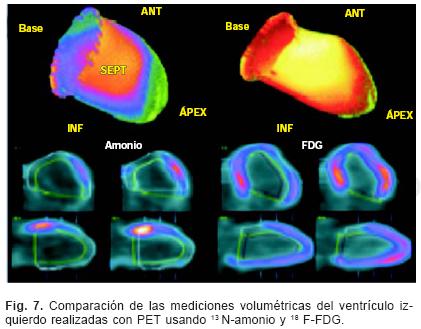
La evaluación de los parámetros de la función sistólica del ventrículo izquierdo se hace delimitando los contornos endocárdicos de forma automática por medio de programas de inteligencia artificial. Como podemos observar en la Figura 7, en el estudio de perfusión con 13N–amonio, no es posible delimitar correctamente estos contornos debido a que existen importantes defectos de perfusión sobre todo en la pared septal lo que altera la determinación de la fracción de eyección. Como se mencionó anteriormente, en el estudio de 18FDG existe captación de radiotrazador en las regiones no perfundidas con 13N–amonio (patrón discordante). Por lo tanto, los contornos endocárdicos son mejor delimitados en este estudio y los valores de la función ventricular izquierda son más fidedignos.
Se demostró en el estudio de viabilidad con 18F–FDG PET importante cantidad de tejido viable en las zonas de infarto transmural sin isquemia residual definida en la perfusión.
Discusión
La viabilidad miocárdica es un concepto clave en la enfermedad arterial coronaria (EAC). Antes se pensaba que las secuelas de un infarto del miocardio (IM) eran irreversibles, y que el principal factor pronóstico en estos pacientes era la gravedad de la disfunción ventricular. Este paradigma cambió radicalmente cuando se introdujo el concepto de miocardio hibernante, el cual plantea que la disfunción ventricular crónica en pacientes con EAC puede ser reversible, tras una terapia de revascularización. Por lo tanto, se puede definir a la viabilidad miocárdica como el potencial de recuperación de la función ventricular después de la revascularización. l,2
El miocardio en condiciones normales utiliza la vía de la β–oxidación de los ácidos grasos como fuente de energía celular. Ante una disminución persistente del flujo sanguíneo o de la reserva de perfusión, el miocardio presenta cambios en las vías metabólicas, cambiando la vía normal de la β–oxidación a la glucólisis anaerobia como fuente de energía. Esta respuesta es una adaptación fisiológica a la isquemia en donde se disminuye el metabolismo celular para disminuir los requerimientos celulares energéticos y evitar la muerte celular. Éste es un tejido vivo pero sin propiedades contráctiles. El miocardio en hibernación es tejido con miocitos viables, los cuales recuperarán su función contráctil una vez restaurado el aporte sanguíneo.2,3
Antes del advenimiento de técnicas para detectar el miocardio en estado hibernante, los pacientes con insuficiencia cardíaca eran relegados al tratamiento médico, el cual está asociado con una alta mortalidad.4
Está ampliamente demostrado que la detección de miocardio hibernante es de gran trascendencia clínica. Determinar si existe viabilidad miocárdica en un paciente post–infartado es de suma importancia ya que permite identificar a los pacientes que se podrían beneficiar de una terapia de revascularización. También nos permite evitar llevar a un procedimiento invasivo a aquellos que no tendrían beneficio. De esta forma se puede identificar correctamente a todos los pacientes candidatos a una revascularización coronaria, lo cual tiene un gran impacto en la sobrevida, ya que se observa una importante mejoría en la función ventricular regional y global y una menor incidencia de eventos cardíacos en pacientes revascularizados con viabilidad miocárdica.5
Las indicaciones para realizar un estudio para determinar viabilidad miocárdica son las siguientes: infarto del miocardio transmural y extenso, sin isquemia del tejido residual y que condicione disfunción sistólica ventricular izquierda importante.
El infarto debe ser transmural, de lo contrario se considera que existe tejido vivo en la porción infartada y no sería necesario valorar viabilidad. Por otro lado, los infartos no transmurales tienden a afectar poco la función ventricular. No debe existir isquemia residual, ya que si existe, esto sería una indicación per se para un procedimiento invasivo de reperfusión coronaria. Debe de tener disfunción sistólica importante para que amerite el riesgo de revascularización en casos de tener miocardio viable. Se han descrito diversas técnicas para la detección de viabilidad miocárdica, tales como el Ecocardiograma con dobutamina (sensibilidad 70–90%, especificidad 73–90%),6 la cardiología nuclear con Talio 201 (sensibilidad 83–90%, especificidad 43–51%)7 con Tecnecio 99m sestamibi (sensibilidad 83%, especificidad 69%),3 la resonancia magnética cardiovascular (sensibilidad 88%, especificidad 87%)8 y el PET, que es el estándar de oro para la detección de viabilidad miocárdica, debido a las bases fisiopatológicas de la misma enfermedad.7,9 Esto se debe a que al estudiar viabilidad miocárdica con PET, se utiliza 18F–FDG, el cual siendo un análogo de la glucosa, es captado preferentemente por los miocitos en estado hibernante, que utilizan la vía de la glucólisis anaerobia como fuente de energía, como ya se describió anteriormente.1
La combinación de un estudio de perfusión con 13N–amonio PET y un estudio de viabilidad con 18F–FDG permite establecer dos patrones para la evaluación de la viabilidad:
1. El patrón concordante es aquel en el que se observa una ausencia o una disminución importante en la captación, tanto en el estudio de perfusión, como en el de viabilidad, en un mismo segmento miocárdico, lo que implica la existencia de un infarto transmural sin viabilidad miocárdica detectable.
2. El patrón discordante es en el que se observa una captación reducida de forma importante o ausente en el estudio de perfusión, pero existe una captación incrementada en el estudio de viabilidad de forma desproporcionada en el mismo segmento. Este patrón representa al miocardio hibernante y por lo tanto representa el patrón de viabilidad miocárdica.10,11 En este caso, el paciente tuvo un patrón discordante, indicando tejido viable, en la región anteroseptal, en el ápex y en la pared inferior.
Conclusión
La detección de viabilidad miocárdica en un paciente con EAC e insuficiencia cardíaca es una conducta obligada, cuando cumple los criterios para su búsqueda, ya que permitirá normar la conducta terapéutica y se podrá discernir a los pacientes que son candidatos a una revascularización coronaria, obteniendo mejoría en la función ventricular y por lo tanto en su expectativa de vida, de aquellos que no se beneficiarán ante una terapéutica invasiva y agresiva, impactando de manera importante en la calidad de vida de los pacientes y disminuyendo de manera importante los costos de hospitalización asociados.
El PET es una herramienta de diagnóstico no invasiva que permite estudiar muy eficientemente el miocardio disfuncional tanto en la perfusión como en su metabolismo. Permite ayudar a la toma de decisiones terapéuticas y ayuda a la estratificación pronostica del paciente con EAC y disfunción ventricular.
Referencias
1. ALEXÁNDERSON E, RICALDE A, MEAVE A: Viabilidad miocárdica, su importancia en la decisión terapéutica. Arch Cardiol Mex 2005; 75: 13–22. [ Links ]
2. RAHIMTOOLA SH: The hibernating myocardium. Am Heart J 1989; 117: 211–21. [ Links ]
3. WIJNS W, VATNER S, CAMICI P: Hibernating Myocardium. N Engl J Med 1998; 339 (3): 173–81. [ Links ]
4. FITZGERALD J, PARKER A, DANIAS P: F–18 fluoro–deoxyglucose SPECT for assessment of myocardial viability. J Nucl Cardiol 2000; 7(4): 382–7. [ Links ]
5. BOUNOUS EP, MARK DB, POLLOCK BG: Surgical survival benefits for coronary disease patients with left ventricular dysfunction. Circulation 1998; 78: 151–57. [ Links ]
6. ARMSTRONG WF, BOSSONE E: Evaluation ofmyocardial viability using stress echocardiography. Prog Cardiovasc Dis 1997; 39: 555–66. [ Links ]
7. SCHELBERT HR: Metabolic imaging to assess myocardial viability. J Nucl Med 1994; 35: 8S. [ Links ]
8. STILLMAN AE, WILKE N, JEROSCH–HEROLD M: Myocardial Viability. Radiol Clin North Am 1999; 37(2): 361–78. [ Links ]
9. ALEXANDERSON E, KERIK N, UNZEK S, FERMON S: Principios y aplicaciones de la tomografía poremisión de positrones (PET) en la cardiología. PET en México: una realidad. Arch Cardiol Mex 2002; 72: 157–64. [ Links ]
10. BAX JJ, VEENING MA, VISSER FC, VAN LINGEN A, HEINE RJ, COMEL JH, VISSER CA: Optimal metabolic conditions during fluorine–18 fluoro–deoxyglucose imaging; a comparative study using different protocols. Eur J Nucl Med. 1997; 24(1): 35–41. [ Links ]
11. ALEXÁNDERSON E, RICALDE A, ZERÓN J, TALAYERO JA, CRUZ P, ADAME G, MENDOZA G, MEAVE A: El patrón discordante, representación visual de viabilidad miocárdica con PET. Arch Cardiol Mex 2006; 76: 347–54. [ Links ]














