Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.78 no.2 Ciudad de México abr./jun. 2008
Avances tecnológicos
Tomografía computada multidetector de arterias coronarias: estado del arte. Parte II: Aplicaciones clínicas
Multidetector Computed Tomography of Coronary Arteries: state of the art, Second Part: Clinical Applications
Aloha Meave González,*,** Erick Alexánderson Rosas,*,***,**** Mónica Rodríguez Valero,**** Gabriela Meléndez Ramírez,*,** Alfonso Martínez García,**** Carlos Sierra Fernández,**** Rodrigo Calleja Torres,**** Leonardo García–Rojas Castillo,**** Pedro Alberto Lamothe Molina,**** Mary Carmen Herrera Zarza,*,** Martha Armas de Ávila,*,** Juan Manuel Ochoa López,**** Jorge Vázquez–Lamadrid,***** Eric Kimura Hayama*,*****
* Departamento de Tomografía Cardíaca del Instituto Nacional de Cardiología Ignacio Chávez. Ciudad de México, México.
** Departamento de Resonancia Magnética del Instituto Nacional de Cardiología Ignacio Chávez. Ciudad de México, México.
*** Departamento de Medicina Nuclear del Instituto Nacional de Cardiología Ignacio Chávez. Ciudad de México, México.
**** Unidad PET–Ciclotrón, Facultad de Medicina UNAM. Ciudad de México, México.
***** Departamento de Radiología e Imagen del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Ciudad de México, México.
Correspondencia:
Dr. Erick Kimura Hayama.
Departamento de Tomografía Cardíaca,
Instituto Nacional de Cardiología Ignacio Chávez.
(INCICH, Juan Badiano Núm 1, Col. Sección XVI,
Tlalpan 14080, México, D.F.).
Correo electrónico: chinitokimura@gmail.com
Recibido: 27 de junio de 2007
Aceptado: 22 de noviembre de 2007
Resumen
En los inicios de la evaluación de enfermedad coronaria la tomografía computada multidetector de arterias coronarias (TCMD) se limitaba casi exclusivamente a la detección de placas calcificadas en las arterias coronarias con el cálculo del índice de Calcio, cuyo valor por sí solo es limitado. Sin embargo, en la actualidad gracias al advenimiento de nueva tecnología, las aplicaciones clínicas potenciales de este método incluyen la detección de estenosis arterial coronaria, la evaluación de puentes coronarios y la evaluación de anomalías coronarias. La visualización y evaluación reproducible de la luz de los stents coronarios con TCMD aún no es posible en la actualidad, pero tal vez sea una realidad con el desarrollo tecnológico de las nuevas generaciones de tomógrafos. Los resultados publicados al momento son prometedores, sin embargo el creciente entusiasmo generado por este innovador método en la comunidad médica deberá estar acoplado a un entrenamiento adecuado y a métodos de validación y credencialización apropiados.
Palabras clave: Tomografía computada. Tomografía computada multidetector. Tomografía computada coronaria.
Abstract
At the beginning of the evaluation of Coronary Artery Disease (CAD), Coronary Multidetector Computed Tomography (MDCT) was exclusively used to detect calcified plaques in coronary arteries through the Calcium Score, whose value by itself is limited. Nowadays, thanks to the technological advancements, potential clinical applications, with this method, include detection of coronary arterial stenosis, assessment of coronary bridges, and evaluation of anomalous coronaries. The intraluminal coronary stent evaluation is not possible yet, but this might become possible with the new–generation scanners. At the moment, the published results seem to be promising, nonetheless, the enthusiasm generated by this method should be accompanied by adequate training, as well as by its validation and certification.
Key words: Computed tomography, Multidetector computed tomography. Coronary computed tomography.
Introducción
Hasta el momento no existen indicaciones plenamente establecidas de la tomografía computada (TC) de arterias coronarias. Sin embargo, la gran mayoría de los estudios clínicos se han enfocado en la evaluación y detección de placas en las arterias coronarias. El desempeño del método se ha comparado contra el estándar de oro: la angiografía coronaria invasiva. La gran mayoría de los estudios publicados se han realizado en centros médicos con gran experiencia en tomografía coronaria multidetector (TCMD) de arterias coronarias. Si bien los estándares de entrenamiento han sido recientemente propuestos por la American Heart Association (AHA),1 poco se sabe sobre los requerimientos de entrenamiento, curva de aprendizaje o exactitud del método en operadores menos experimentados en la realización e interpretación de dichos estudios.
En los inicios de la evaluación de enfermedad coronaria, la TCMD se limitaba casi exclusivamente a la detección de placas calcificadas en las arterias coronarias con el cálculo del índice de Calcio, cuyo valor por sí solo es limitado. Sin embargo, en la actualidad gracias al advenimiento de nueva tecnología, las aplicaciones clínicas potenciales de este método incluyen la detección de estenosis arterial coronaria, la evaluación de puentes coronarios y la evaluación de anomalías coronarias. La visualización y evaluación reproducible de la luz de los stents coronarios con TCMD aún no es posible en la actualidad, pero tal vez sea una realidad con el desarrollo tecnológico de las nuevas generaciones de tomógrafos. En la Tabla I se resumen las principales indicaciones y contraindicaciones del método.2,3–15
Por otra parte, hoy día la TCMD de corazón también está siendo evaluada y validada en otras áreas diferentes al estudio de enfermedad coronaria,15,16 como lo son su rol en morfología, movilidad y función cardíaca,17–20 miocardiopatías, valvulopatías,21 enfermedades del pericardio, tumores cardíacos,8 evaluación de la placa y remodelación coronaria,22,23 dolor torácico agudo,24 perfusión miocárdica y viabilidad. Sin embargo, en estas aplicaciones, otros métodos no invasivos como la ecocardiografía y la resonancia magnética (RM), siguen siendo consideradas como de elección, reservándose la TC para indicaciones específicas.
a) Detección de estenosis arterial coronaria
Antes del año 2000 la gran mayoría de los estudios eran practicados con TC por emisión de haz de electrones (TCEE). Los primeros trabajos con TCMD aparecieron hacia principios de este siglo siendo su objetivo principal mostrar la capacidad técnica del método para visualizar las arterias coronarias.25 Actualmente, con el rápido desarrollo de la TCMD, prácticamente la totalidad y ahora el objetivo se ha enfocado a la evaluación del grado de estenosis gracias a la exactitud diagnóstica del método. Los resultados de los principales estudios se muestran en la Tabla II 26–32
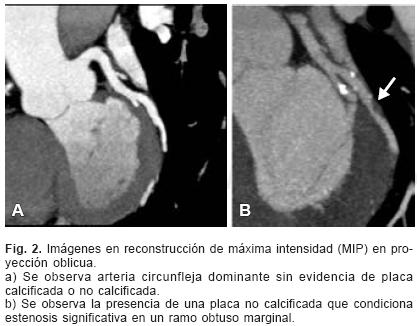
Los reportes iniciales de casi todos estos trabajos fueron llevados a cabo en poblaciones de estudio pequeñas y pre–seleccionadas, por lo que sus resultados sobrevaloraban la capacidad diagnóstica del método. Además, la sensibilidad (S), especificidad (E), exactitud (Ex) y valores predictivos (VP) reportados correspondían únicamente a los segmentos valorables, omitiendo de dichos análisis la gran cantidad de segmentos no valorables (aproximadamente 30% de los segmentos). Sin embargo, a la par del desarrollo de tomógrafos más rápidos y de mayor resolución, los estudios incluyen un mayor número de pacientes, poblaciones no seleccionadas y los valores de S, E, Ex y VP son calculados incluyendo los segmentos no valorables, los cuales a su vez han disminuido (de aproximadamente 30% en sistemas de 64 detectores a 5% en los equipos de 4 detectores).33 Por otra parte, además de los tradicionales análisis por segmento (15 segmentos por paciente de acuerdo a la nomenclatura de la AHA),34 que pueden tanto mejorar como demeritar la exactitud del método debido a que agrupan observaciones intraindividuales, cada vez más trabajos incluyen los análisis por paciente (perpatient–based analysis). Estos análisis reflejan de mejor manera la habilidad de la angioTC para reconocer e identificar a aquellos pacientes que padecen de por lo menos una estenosis coronaria significativa (Figs. 1 y 2). Esto es de gran importancia, ya que las implicaciones de diagnosticar o no diagnosticar la presencia o ausencia de cualquier obstrucción coronaria significativa son más relevantes desde la perspectiva de cada paciente. El resto de los parámetros no ha mostrado cambios significativos con el desarrollo tecnológico (Tabla II). Si bien existe una importante mejoría en la resolución espacial de los tomógrafos, la estimación del grado de estenosis sigue siendo cualitativa. No obstante, cada vez existen más programas disponibles dedicados a la evaluación cuantitativa, no sólo del grado de estenosis, sino también de múltiples parámetros de la función ventricular.

La mayor parte de las publicaciones emplean un umbral de estenosis > 50% para definir una estenosis como "clínicamente significativa". Debido a que el flujo de reserva coronaria típicamente no compromete la luz sino hasta que existe una obstrucción > 70–75%, las sensibilidades y valores predictivos positivos (VPP) de una gran cantidad de estos estudios no permitían distinguir a aquellos pacientes candidatos a revascularización. Además del VPP, la especificidad en el análisis por paciente, también es relativamente baja en todos los estudios.33 En otras palabras, la angiografía por TCMD tendería a sobreestimar el grado de estenosis6 con el consecuente incremento de falsos positivos. Sin embargo, en este punto la pregunta que podría surgir es si esos pacientes son en realidad falsos positivos de la TCMD o pacientes no diagnosticados correctamente por angiografía convencional (falsos negativos), debido a que es bien conocida la mejor sensibilidad de la TC en la evaluación e identificación de los cambios por aterosclerosis de la pared sobre la angiografía invasiva (por ejemplo, en aquellos pacientes con remodelación positiva) (Fig. 3).35
Pese al relativo bajo desempeño en especificidad y VPP, el principal objetivo del método diagnóstico no invasivo sería el de evitar el cateterismo cardíaco en aquellos pacientes que no ameritan de terapias de revascularización, y en el contexto clínico, que la TC no dejara de diagnosticar a aquellos pacientes con enfermedad coronaria significativa. De esta forma, aún tomando en cuenta los segmentos no valorables, el valor predictivo negativo (VPN) es uniformemente alto en todos los estudios (> 95%),33 incluso en aquellos pacientes con una moderada a alta probabilidad pre–prueba de padecer de enfermedad arterial coronaria o en aquellos grupos de estudio donde la prevalencia de dicha enfermedad es elevada como en el estudio de Hoffman y cois.36 Este elevado VPN permitiría descartar de manera confiable la presencia de enfermedad coronaria significativa en ausencia de hallazgos visibles por TCMD. Es decir, aquellos pacientes en quienes la angioTC muestra coronarias normales, la angiografía coronaria no sería necesaria.

Por otro lado, el bajo umbral establecido de estenosis coronaria (< 50%) utilizado para definir una estenosis como clínicamente significativa, disminuye la probabilidad de error en la detección de pacientes que ameritan angiografía coronaria. Así, la angioTC pudiese reemplazar aquellos cateterismos cardíacos solicitados con el fin de descartar estenosis significativas en pacientes cuyos factores de riesgo coronario sean de probabilidad baja o intermedia, como por ejemplo aquellos pacientes quienes serán sometidos a cirugía cardíaca no coronaria, por ejemplo valvulopatías o cardiopatías congénitas, en aquellos pacientes con miocardiopatía de etiología incierta o en pacientes con dilatación de la raíz aórtica, en los cuales la canulación de las coronarias resulta técnicamente difícil (Fig. 4). Cabe recalcar que la relación costo–eficacia del método para descartar coronariopatía en estas situaciones dependerá de las circunstancias particulares de cada institución, como lo son la prevalencia de la enfermedad, así como del costo del estudio y experiencia del personal encargado de la realización e interpretación de dichos exámenes.

Los trabajos publicados a la fecha muestran resultados de pacientes en donde la angioTC coronaria (ATCC) no necesariamente correspondió al estudio inicial. No existen estudios sobre el desempeño diagnóstico y el costo–beneficio de la ATCC como estudio inicial; y existen pocos trabajos que lo comparen contra las pruebas de estrés convencionales.37
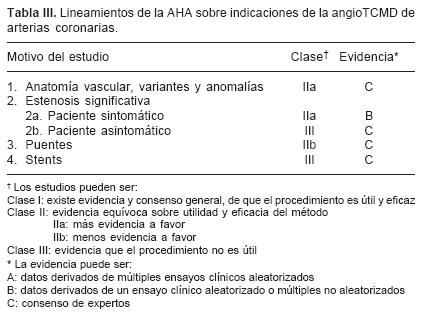
En la práctica diaria, el verdadero papel de este novedoso método sería el de una prueba diagnóstica en pacientes con factores de riesgo intermedio de Framingham, dolor torácico o síntomas atípicos, pacientes con pruebas de estrés convencionales no concluyentes, o ambos.38 De acuerdo a los lineamientos de la AHA, recientemente publicados (Tabla III), la categoría de la TCMD de arterias coronarias en la evaluación de estenosis coronaria es clase Ha con nivel de evidencia B, en pacientes sintomáticos con probabilidad baja a intermedia de padecer una estenosis significativa; y, clase III con nivel de evidencia C, en pacientes asintomáticos.38 Es decir, con la información disponible en este momento, la ATCC no está indicada en aquellos pacientes asintomáticos ni en aquel grupo de pacientes con una alta probabilidad de requerir una intervención coronaria percutánea como aquellos pacientes con angina típica, pacientes isquémicos ya conocidos (salvo en la evaluación de puentes y stents, ver siguiente apartado), pruebas de estrés inequívocas en pacientes con riesgo elevado de enfermedad o enfermedad ya conocida, o en aquellos sujetos con hallazgos bioquímicos o ECG de un síndrome coronario agudo.
La importancia pronostica de la angiografía coronaria selectiva está bien establecida, sin embargo aún hacen falta estudios similares para ATCC. Por ejemplo, aún no es conocido si un manejo agresivo con o sin revascularización en pacientes con estenosis de alto grado detectadas incidentalmente en estudios de ATCC, mejoran el desenlace a largo plazo de pacientes asintomáticos.
b) Hemoductos coronarios
La permeabilidad a 10 años de los hemoductos venosos oscila alrededor del 60%, mientras que para los arteriales es mayor (90%). Clínicamente, existe recurrencia del dolor tipo anginoso a un año en el 24% de los pacientes y en más del 40% de los pacientes a 6 años.39 Los síntomas generalmente son debido a progresión de la enfermedad de las coronarias nativas y a enfermedad de novo en los hemoductos venosos, mientras que los injertos arteriales generalmente permanecen libres de enfermedad. Debido a que el pronóstico clínico está relacionado directamente con su permeabilidad y desarrollo de estenosis en el puente, el seguimiento es indispensable. La angiografía coronaria invasiva es hoy día el estándar de oro en el estudio de este grupo de pacientes. Sin embargo, los riesgos asociados al método y su costo, han motivado la búsqueda de métodos no invasivos alternos. En este contexto, pese a que la TC ha sido investigada para la evaluación de conductos venosos desde la década de los 80, sólo recientemente la angiografía coronaria con TCMD ha demostrado su utilidad (Fig. 5). Este método se ha propuesto debido a que a diferencia de las coronarias nativas, los puentes se encuentran relativamente fijos y no presentan tanta movilidad, su calibre generalmente es mayor y no muestran tanto grado de calcificación.
Además de la evaluación convencional con reconstrucciones multiplanares y en máxima intensidad de proyección (MIP), las técnicas de reformateo 3D y 4D permiten conocer de una manera rápida y sencilla la anatomía del injerto (sitio de anastomosis proximal y distal), especialmente en aquellos pacientes con múltiples puentes,40 lo cual ayuda a guiar al hemodinamista en el cateterismo posterior. A diferencia de los estudios con TCEE41 y equipos multidetector de menos de 16 detectores42,43 en donde el porcentaje de puentes no valorables, principalmente los arteriales, era relativamente alto (16 y 43% respectivamente), numerosos estudios enfocados en conocer cuál es el papel de la TCMD44–48 en la evaluación de los injertos coronarios han demostrado 3 cosas principalmente: 1. La TCMD de > 16 detectores permite diferenciar de manera confiable entre la permeabilidad u oclusión del injerto (sensibilidad del 93–100%, y especificidad (98–100%). 2. Prácticamente el 100% de las anastomosis proximales pueden valorarse adecuadamente, sin embargo, sólo el 75% de las anastomosis distales lo son. 3. En el diagnóstico de estenosis mayor al 50%, en cualquier punto del puente desde la anastomosis proximal hasta la distal, la sensibilidad de la ATCC oscila del 80 al 96%, con una especificidad del 95 al 100%, VPP del 75 al 81% y VPN del 86 al 99%.
La experiencia con tomógrafos de 64 detectores (D) aún es limitada, sin embargo, los resultados iniciales son prometedores. Con esta tecnología se puede evaluar prácticamente la totalidad de las anastomosis distales (94%), con valores de sensibilidad (97%), especificidad (89%), VPP (90%) y VPN (97%) adecuados.49
En base a estos resultados, la angioTC puede no permitir el estudio de las anastomosis distales en todos los casos. El porcentaje de anastomosis distales no valorables podría en un futuro disminuir con equipos de mayor resolución espacial y temporal. Por otra parte, la exactitud diagnóstica depende principalmente de la localization, tipo y número de clips vasculares, los cuales pueden obstaculizar grandes porciones de los puentes e interferir con la evaluación segmentaria en búsqueda de zonas de estenosis. Si la anastomosis distal es paralela al plano de imagen, puede que sólo se vea en 1 ó 2 cortes, lo cual a su vez explicaría porqué en el 25% de los casos no es posible definir la presencia de estenosis en estas anastomosis. Es necesario enfatizar la necesidad de evaluar únicamente a aquellos pacientes con frecuencia cardíaca baja y utilizar múltiples fases de reconstrucción, ya que en un porcentaje elevado de los segmentos no valorables la causa es la presencia de artificios por movimiento.43
De acuerdo a los lineamientos de la AHA, la evaluación de pacientes con injertos coronarios mediante TCMD es clase lib con nivel de evidencia C.38
La TC también es una herramienta preoperatoria de gran valor que permite optimizar la planeación quirúrgica/intervencionista con información adicional. Por ejemplo, durante la intervención quirúrgica el corazón es llevado a cardioplejía, la cual predispone a aterosclerosis en los troncos supraaórticos y por ende un mayor riesgo de eventos vasculares cerebrales. La evaluación prequirúrgica permite reconocer placas en estos vasos; visualizar la aorta proximal y descartar su patología (placas de ateroma, aneurismas y/o disección), ya que este es el sitio donde se realiza la anastomosis proximal en caso de injertos venosos; y conocer el estado, trayecto, tamaño y ramas de las arterias mamarias internas y arterias coronarias, así como la presencia de puentes miocárdicos, en el caso de seleccionar estos vasos para realizar los injertos.50–51
c) Stents coronarios
La angioplastía transluminal percutánea con colocación de stent es considerada como la primera línea de tratamiento debido a que es un procedimiento mínimamente invasivo. Cada año se practican en los Estados Unidos cerca de 500 mil procedimientos y del 30–40% de los pacientes tratados desarrollan reestenosis durante el primer año posterior a la colocación del stent.52 Si bien el índice de re–estenosis intra–stent ha disminuido tras la aparición de stents medicados, ésta debe de considerarse en aquellos pacientes con dolor torácico recidivante. La visualization no invasiva del lumen del stent sería ideal en este grupo de pacientes.
La TCMD se ha empleado de forma exitosa en la descripción de estenosis intra–stent e incluso de hiperplasia de la íntima en stents de mayor tamaño, como lo son los ilíacos y carotídeos.53 Sin embargo, en vasos más pequeños como lo son las arterias coronarias, la visualización adecuada de su luz se encuentra obstaculizada por los artificios de volumen parcial generados por el material metálico del stent. Estos artificios de blooming (exageración de las estructuras hiperdensas), y de "endurecimiento del haz" (beam–hardening) exageran el tamaño real del stent y oscurecen su luz, por lo que el grado de estenosis puede sobreestimarse, incluso llegando a generar imágenes de obstrucción completa.10,54 Con la tecnología actual y con la aplicación de filtros de reconstrucción adecuados que permiten delimitar mejor los bordes del stent (B46f), la presencia de estos artificios relacionados al stent se han reducido pero no eliminado, sin embargo el índice señal–ruido disminuye por incremento del ruido. El empleo de filtros convencionales de reconstrucción (B30f) ha demostrado recientemente que incrementa el grado de adelgazamiento de la luz del stent hasta en un 37% de la luz real,55 mientras que experimentos in vitro con el empleo de aquellos filtros que realzan los bordes del stent mejoran la visualización de la luz hasta en un 23%.56 Hoy día, los estudios de TCMD permiten visualizar aproximadamente el 70% de la luz de algunos tipos de stent (Fig. 6)56,57
La falta de opacificación de la coronaria distal al stent refleja claramente la re–estenosis u oclusión del stent. Sin embargo, si bien la gran mayoría de los estudios iniciales con TCEE asumían como permeable un stent cuando se lograba identificar material de contraste distal al mismo,58–60 hoy día se reconoce que dicho contraste puede deberse a la presencia de flujo colateral. De esta forma, la visualización directa de la luz del stent continúa considerándose el factor ideal de permeabilidad del mismo. Los principales determinantes para una adecuada visualización de la luz del stent son su calibre (≥ 3.5 mm), su localization (coronaria izquierda principal, segmento proximal de la descendente anterior (DA), o puentes venosos), así como el tipo de stent.56
Actualmente existen todavía pocos trabajos que hayan evaluado el papel de la TCMD en condiciones postintervención coronaria. Además, la gran mayoría de estos estudios incluyen poblaciones de estudio seleccionadas y pequeñas.61"65 Con el empleo de tomógrafos de ≥ 16 detectores en pacientes con una alta prevalencia de stents de gran calibre, sólo es posible obtener imágenes de calidad diagnóstica en el 75% de los pacientes. Para aquellos segmentos valorables, la detección de una estenosis de por lo menos el 50% tiene una sensibilidad del 78 al 100%, con una especificidad del 92 al 100%. La especificidad disminuye al 75% cuando todos los segmentos coronarios son incluidos para el análisis Si se consideran todos los grados de estenosis intra–stent (< 50%, > 50% y oclusiones completas), el desempeño de la TCMD es bajo, sin embargo éste aumenta sustancialmente cuando únicamente son consideradas las estenosis significativas, con VPN por arriba del 90% (IC 95%, 84.6–96.8), lo cual permitiría a la TCMD descartar de manera confiable aquellos pacientes con estenosis significativas.62
Por ende, la utilidad clínica actual de la angio–TC está limitada únicamente a la detección de oclusión del stent. La evaluación de estenosis intra–stent–, probablemente pueda ser una realidad con el desarrollo de tomógrafos con mayor resolución espacial.6 Actualmente se encuentran bajo desarrollo equipos prototipo con resolución espacial hasta de 0.2 mm.4
d) Anomalías coronarias
Las anomalías coronarias son raras (0.3–1.3% de los pacientes) y se asocian a síntomas potencialmente mortales en el 20% de los casos (arritmias, síncope, infarto del miocardio o muerte súbita).66"68 De hecho, estas anomalías son una de las causas más frecuentes de muerte cardíaca en atletas jóvenes.69,70
Se agrupan en 3 grandes categorías (Fig. 7): a) origen ectopico desde el seno coronario u otra arteria coronaria b) ausencia de arteria coronaria, y c) origen ectópico desde la arteria pulmonar (síndrome de Bland–White–Garland) siendo los 2 primeros grupos los más frecuentes.66 El curso de aquellas arterias con origen ectópico puede subdividirse a su vez en 4 grupos: 1) anterior al tracto de salida del ventrículo derecho (curso "anterior" o "prepulmonar"), 2) posterior a la raíz aórtica (curso "retroaórtico"), 3) entre la aorta y la arteria pulmonar (curso "interarterial") (Figs. 4 y 8) a través del surco interventricular (curso "septal" o "subpulmonar").67,68 Otro tipo de anomalía corresponde a las fístulas arteriovenosas las cuales representan aproximadamente el 13% de todas las anomalías.66 Estas anomalías se pueden presentar de forma aislada o asociadas a otras cardiopatías congénitas.67
No en todas ellas se requiere conocer con exactitud su trayecto proximal, de hecho la gran mayoría de ellas no son clínicamente importantes.66 Por ejemplo, cuando la circunfleja se origina del seno de Valsalva derecho o de la porción proximal de la coronaria derecha, su curso es invariablemente retroaórtico. En algunos casos es importante determinar si la porción proximal de la coronaria anómala se encuentra anterior a la arteria pulmonar, posterior a la aorta, o entre dichos vasos. Esta distinción tiene valor pronóstico debido a que aquellas coronarias que emergen del lado opuesto a su territorio perfusorio o que muestran un trayecto entre la aorta y la arteria pulmonar, se asocian a un riesgo mayor de isquemia miocárdica y muerte súbita, particularmente si el territorio perfusorio abastece la distribución de la coronaria izquierda.66,70–72 El mecanismo propuesto es isquemia y su mecanismo fisiopatológico es multifactorial. Durante el ejercicio físico, existe dilatación de la aorta y de la arteria pulmonar debido al incremento del gasto cardíaco, lo cual comprime el ostium y trayecto proximal del vaso anómalo.71 También se ha postulado que la hipo–perfusión es debida a una angulación extrema del origen arterial, ostium con forma de "hendidura", disminución en el diámetro del ostium, inserción intramural (dentro de la túnica media), y a vasoespasmo coronario resultado de daño endotelial.70,72 Estos pacientes pueden requerir reimplantes coronarios.71–73 El otro grupo de anomalías que requieren una adecuada evaluación y reconocimiento anatómico son aquéllos con origen a partir de la arteria pulmonar y las fístulas o malformaciones arteriovenosas de alto flujo.
La angiografía convencional es el método más comúnmente empleado en su evaluación. Sin embargo, su origen puede ser difícil de identificar principalmente en aquellos casos con un "acodamiento" del mismo, y su curso preciso puede ser difícil de delinear debido a la compleja geometría tridimensional mostrada en un plano bidimensional.68 En manos experimentadas, el diagnóstico puede establecerse angiográficamente sólo en aproximadamente la mitad de los casos.67,68 Sin embargo, es un estudio invasivo, potencialmente prolongado y técnicamente difícil, y que puede requerir catéteres adicionales así como grandes cantidades de material de contraste.66 La evaluación no invasiva incluye a la ecocardiografía,74 a la angioRM y a la angioTC. Las desventajas principales de la ecocardiografía son el ser un método operador–dependiente, puede requerir un tiempo prolongado de exploración y la evaluación anatómica puede no ser exacta. Aunque la angiografía coronaria por RM ha demostrado su utilidad,75,76 tiene algunas desventajas: el ser un estudio prolongado (aproximadamente 45 min a 1 hora); el estar contraindicado en pacientes con marcapasos, desfibriladores automáticos, pacientes claustrofóbicos; y el ser limitado en pacientes con algunas arritmias y baja resolución espacial.66
Dentro de los métodos no invasivos la TCEE y posteriormente la TCMD han demostrado ser una herramienta de gran utilidad en la evaluación de este grupo de pacientes. 66–68,77,78 Su capacidad multiplanar y alta resolución espacial permiten evaluar de forma exacta (hasta en el 100% de casos)67,68 y relativamente sencilla el origen y trayecto coronario, así como sus relaciones anatómicas con los grandes vasos y cámaras cardíacas incluso en aquellos pacientes con anomalías complejas (por ej. fístulas), en quienes las reconstrucciones volumétricas son particularmente útiles. Además, permite reconocer si existe o no "acodamiento" de su origen y otras anomalías asociadas.
Si bien, no corresponden a anomalías coronarias en su origen, los puentes miocárdicos pueden visualizarse de manera relativamente sencilla por TCMD. Los puentes miocárdicos se definen como aquellos trayectos coronarios completamente rodeados de tejido miocárdico. La frecuencia de estos puentes es alta (aproximadamente 30% en la DA). Durante la contracción sistólica, el segmento coronario afectado es comprimido y puede asociarse a alteración del flujo coronario, isquemia y angina. La TC también es de utilidad en la evaluación de aneurismas coronarios.4
De acuerdo a los lineamientos de la AHA, la angioTC de coronarias en la evaluación de anomalías coronarias se considera clase Ha con nivel de evidencia C38 (Tabla III).
Desventajas y limitaciones del método
Aunque la TCMD es un estudio no invasivo, exacto, no–operador dependiente y rápido, la exposición a radiación ionizante y el uso de materiales de contraste yodados pueden limitar su uso. Pese a que la cantidad de medio de contraste es similar a la administrada durante una angiografía coronaria convencional (60–70 mL), con la excepción de los protocolos de injertos coronarios, los principales efectos adversos son la nefrotoxicidad y las reacciones alérgicas. Las contraindicaciones absolutas incluyen falla renal (creatinina > 1.5 mg/dL) y reacciones alérgicas graves.
La radiación recibida es de alrededor de 10–15 mSv. Aunque los riesgos a largo plazo asociados a este nivel de exposición son relativamente bajos, persiste la preocupación en repetir el estudio en jóvenes. Además, este nivel de radiación es equivalente a la recibida durante pruebas de estrés por medicina nuclear; y en la actualidad existen esquemas de protección y modulación de la corriente que han demostrado reducción de la radiación aproximadamente en 50%, así como protocolos de bajo amperaje/voltaje en la adquisición del Score de Calcio. Otra limitación importante del método es el número de segmentos no valorables debido a artificios por movimiento y secundarios a placas calcificadas. El primer grupo de artificios se puede evitar con una apropiada preparación del paciente y con el advenimiento de tecnología más rápida (256 detectores o aparatos duales). Sin embargo, la presencia de placas calcificadas es un factor no modificable y causa principal de resultados falsos positivos en el diagnóstico de estenosis significativa. De hecho, debido a que la prevalencia y la gravedad de las calcificaciones se incrementan con la edad, es probable que la exactitud del método disminuya al avanzar la edad del paciente. Cabe recordar, que en la práctica clínica cotidiana, se realiza un estudio simple con baja radiación para el cálculo del Score de Calcio con el objeto de identificar aquellos pacientes con calcificación extensa (> 1.000 UA), en quienes el procedimiento contrastado puede no ser de utilidad.
Otras desventajas son la disponibilidad del método, así como las inherentes a todos los equipos de tomografía, como lo es por ejemplo que el paciente debe de ser transportado a la sala de tomografía. No obstante, hoy día es mayor el número de centros hospitalarios que cuentan con salas de tomografía en las unidades de urgencia. La frecuencia cardíaca óptima en equipos tanto de 16 como de 64 detectores, oscila alrededor de 65 latidos por minuto (lpm) o menos y con un ritmo regular, por lo que en aquellos pacientes arrítmicos, inestables o "taquicárdicos" (FC > 70 lpm), las imágenes obtenidas pueden no ser de suficiente calidad diagnóstica debido a la falta de mayor resolución temporal. Si bien existen algoritmos de reconstrucción que mejoran la resolución temporal, equipos con mayor velocidad de giro del gantry o los sistemas duales (con resolución temporal cercana a los 100 ms) probablemente permitirán la exploración más eficiente de este grupo de pacientes.
Pese a la excelente resolución espacial de los equipos disponibles en la actualidad, la evaluación del grado de estenosis en los vasos distales y < 1.5–2 mm continúa limitada.27,35 La resolución espacial de la angiografía invasiva es superior (0.2 mm) y dado que la información obtenida es tridimensional (voxel), la resolución angiográfica en 3 dimensiones es aproximadamente 8 veces mejor en la prueba considerada hasta hoy estándar de oro.
A pesar de que las indicaciones del método han aumentado, con la información disponible ahora no está suficientemente claro ¿cómo la angio–TC coronaria debe integrarse a la práctica diaria?, o ¿sí podría ser empleada como una prueba de escrutinio en pacientes asintomáticos en riesgo?, o ¿sí debe la angioTC coronaria ser la primera prueba en la evaluación de pacientes con dolor torácico o como un complemento en pacientes con pruebas de estrés no concluyentes? Estudios futuros nos permitirán conocer la respuesta a éstas y otras interrogantes. Está claramente establecido que la información pronostica derivada del análisis lipídico, electrocardiográfico, estudios de perfusión miocárdica y estrés por ecocardiografía son independientes a los resultados angiográficos. Por lo tanto, la TCMD no podrá eliminar de manera absoluta la necesidad de esos estudios. Sin embargo, este método surge como una nueva herramienta complementaria en la evaluación de aterosclerosis coronaria.
Conclusiones
Los primeros años de este nuevo milenio muestran un continuo e impresionante desarrollo de la TC y sus aplicaciones. La velocidad con la que aparece nueva tecnología no deja de sorprender; pero acaso la Ley de Moore, quien predijo que cada 18 meses se duplica la capacidad de las computadoras ¿seguirá aplicable a la TC? Mientras tanto, los objetivos futuros e inmediatos de las casas comerciales serán dos: 1) incrementar la resolución temporal de los equipos para disminuir aún más la presencia de artificios por movimiento y la radiación efectiva del paciente, así como permitir la exploración de pacientes sin la necesidad de β–bloqueo; y, 2) mejorar la resolución espacial con el fin de realizar un análisis cuantitativo del grado de estenosis, descartar estenosis intra– stent, y que acoplado a sistemas híbridos (PET–TC) permitiría la caracterización de la placa.
Los resultados publicados al momento son prometedores, sin embargo debe considerarse que son producto de centros hospitalarios experimentados y en población seleccionada. Mientras tanto, el creciente entusiasmo generado por este innovador método en la comunidad médica deberá estar acoplado a un entrenamiento adecuado y a métodos de validación y credencialización apropiados.
Referencias
1. BUDOFF MJ, COHEN MC, GARCIA MJ, HODGSON JM, HUNDLEY WG, LIMA JA, ET AL: American College of Cardiology Foundation, American Heart Association, American College of Physicians Task Force on Clinical Competence and Training, American Society of Echocardiography, American Society of Nuclear Cardiology, Society of Atherosclerosis Imaging, Society of Cardiovascular Angiography & Interventions: ACCF/AHA clinical competence statement on cardiac imaging with computed tomography and magnetic resonance: A report or the American College of Cardiology Foundation/American Heart Association/ American College of Physicians Task Force on Clinical Competence and Training. J Am Coll Cardiol 2005; 46: 383–402. [ Links ]
2. SCHOENHAGEN P, STILLMAN AE, HALLIBURTON SS, KUZMIAK SA, PAINTER T, WHITE RD: Non–invasivecoronary angiography with multi–detector computed tomography: Comparison to conventional X–ray angiography. Int J Cardiovasc Imag 2005; 21: 63–72. [ Links ]
3. GARCIA MJ: Noninvasive Coronary Angiography. Hype or New Paradigm ? JAMA 2005; 293: 2531–3. [ Links ]
4. SCHOEPF UJ, BECKER CR, OHNESORGE BM, YUCEL EK: CT of coronary artery disease. Radiology 2004; 232: 18–37. [ Links ]
5. SCHOEPF UJ, BECKER CR, HOFFMAN LK, KENT YUCEL E: Multidetector–row CTofthe heart. Radiol Clin N Am 2004; 42: 635–49. [ Links ]
6. BECKER CR: Coronary CT angiography in symptomatic patients. Eur Radiol 2005; 15(Suppl2):B33–B41. [ Links ]
7. KOPP AF, HEUSCHMID M, REIMANN A, KUETTNER A, BECK T, BURGSTAHLER C, ET AL: Advances in imaging protocols for cardiac MDCT: from 16– to 64–row multidetector computed tomography. Eur Radiol 2005; 15(Suppl5): E71–E77. [ Links ]
8. STANFORD W: Advances in cardiovascular CT imaging: CT clinical imaging. Int J Cardiovasc Imag 2005; 21: 29–37. [ Links ]
9. SCHOENHAGEN P, HALLIBURTON SS, STILLMAN AE, KUZMIAK SA, NISSEN S, MURAT E, ET AL: Noninva–sive imaging of coronary arteries: Current and future role of multi–detector row CT. Radiology 2004; 232: 7–17. [ Links ]
10. GERBER TM, BREEN JF, KUZO RS, KANTOR B, WILLIAMSON EE, SAFFORD RE, ET AL: Computed Tomographic Angiography of the Coronary Arteries: Techniques and Applications. Semin Ultrasound CT MRI 2006; 37: 42–55. [ Links ]
11. WINTERSPERGER BJ, NIKOLAOU K: Basics of cardiac MDCT: techniques and contrast application. Eur Radiol 2005; 15(Suppl2): B2–B9. [ Links ]
12. BUDOFF MJ, GUL K: Computed tomographic cardiovascular imaging. Semin Ultrasound CT MRI 2006; 27: 32–41. [ Links ]
13. LAWLER LP, PANNU HK, FISHMAN EK: MDCT evaluation of the coronary arteries, 2004: How we do it—Data acquisition, postprocessing, display, and interpretation. AJR 2005; 184: 1402–12. [ Links ]
14. RODENWALDT J: Multislice computed tomography of the coronary arteries. Eur Radiol 2003; 13: 748–757. [ Links ]
15. GASPAR T, HALON D, RUBINSHTEIN R, PELED N: Clinical applications and future trends in cardiac CTA. Eur Radiol 2005; 15(Suppl 4): D10–D14. [ Links ]
16. WOODARD PK, BHALLA S, JAVIDAN–NEJAD C, GUTIERREZ FR:Non–coronary cardiac CT imaging. Semin Ultrasound CT MRI 2006; 27: 56–75. [ Links ]
17. MOCHIZUKI T, HOSOI S, HIGASHINO H, KOYAMA Y, MIMA T, MURASE K: Assessment of coronary arteries and cardiac function using multidetector CT. Semin Ultrasound CT MRI 2004; 25: 99–112. [ Links ]
18. HEUSCHMID M, ROTHFUSS JK, SCHROEDER S, FENCHEL M, STAUDER N, BURGSTAHLER C, ET AL: Assessment of left ventricular myocardial function using 16–slice multidetector–row computed tomography: Comparison with magnetic resonance imaging and echocardiography. Eur Radiol 2006; 16: 551–9. [ Links ]
19. KOCH K, OELLIG F, OBERHOLZER K, BENDER P, KUNZ P, MILDENBERGER P: Assessment of right ventricular function by 16–detector–row CT: comparison with magnetic resonance imaging. Eur Radiol 2005; 15: 312–8. [ Links ]
20. JUERGENS KU, FISCHBACH R: Left ventricular function studied with MDCT. Eur Radiol 2006; 16: 342–57. [ Links ]
21. ALKADHI H, WILDERMUTH S, BETTEX DA, PLASS A, BAUMERT B, LESCHKA S, ET AL: Mitral regurgitation: Quantification with 16–detector row CT Initial experience. Radiology 2006; 238: 454–63. [ Links ]
22. LEBER A, KNEZ A, BECKER A, BECKER C, REISER M, STEINBECK G, ET AL: Visualizing noncalcified coronary plaques by CT. Int J Cardiovasc Imag 2005; 21:55–61. [ Links ]
23. ACHENBACH S, ROPERS D, HOFFMANN U, MACNEILL B, BAUM U, POHLE K, ET AL: Assessment of coronary remodeling in stenotic and nonstenotic coronary atherosclerotic lesions by multidetector spiral computed tomography. J Am Coll Cardiol 2004; 43: 842–7. [ Links ]
24. HOFFMAN U, PENA AJ, CURY RC, ABBARA S, FERENCIK M, MOSELEWSKI F, ET AL: Cardiac CT in emergency department patients with acute chest pain. Radiographics 2006; 26: 963–78. [ Links ]
25. ACHENBACH S, ULZHEIMER S, BAUM U, KACHELRIEB M, ROPERS D, GIESLER T ET AL: Noninvasive coronary angiography by retrospectively ECG–Gated multislice spiral CT. Circulation 2000; 102: 2823–8. [ Links ]
26. NIEMAN K, RENSING BJ, VAN GEUNS RJ, VOS J, PATTYNAMA PM, KRESTIN GP, ET AL: Non–invasive coronary angiography with multislice spiral computed tomography: impact of heart rate. Heart 2002; 88: 470–4. [ Links ]
27. LEBER AW, KNEZ A, VON ZIEGLER F, BECKER A, NIKOLAOU K, PAUL S, ET AL: Quantification of obstructive and nonobstructive coronary lesions by 64–slice computed tomography: A comparative study with quantitative coronary angiography and intravascular ultrasound. J Am Coll Cardiol 2005; 46:147–54. [ Links ]
28. HEUSCHMID M, KUETTNER A, SCHROEDER S, TRABOLD T, FEYER A, SEEMANN MD, ET AL: ECG–gated 16–MDCT of the coronary arteries: Assessment of image quality and accuracy in detecting stenoses. AJR 2005; 184: 1413–9. [ Links ]
29. HABERL R, TITTUS J, BÖHME E, CZERNIK A, RICHARTZ BM, BACK J, ET AL: Multislice spiral computed tomographic angiography of coronary arteries in patients with suspected coronary artery disease: An effective filter before catheter angiography? Am Heart J 2005; 149: 1112–9. [ Links ]
30. KUETTNER A, TRABOLD T, SCHROEDER S, FEYER A, BECK T, BRUECKNER A, ET AL: Noninvasive detection of coronary lesions using 16–detector multislice spiral computed tomography technology: Initial clinical results. J Am Coll Cardiol 2004; 44: 1230–7. [ Links ]
31. JOHNSON T, NIKOLAOU K, WINTERSPERGER BJ, LEBER AW, VON ZIEGLER F, RIST C, ET AL: Dual–source CT cardiac imaging: Initial experience. Eur Radiol 2006; 16: 1409–15. [ Links ]
32. ACHENBACH S, GIESLER T, ROPERS D, ULZHEIMER S, DERLIEN H, SCHULTE C, ET AL: Detection of coronary artery stenoses by contrast–enhanced, retrospectively electrocardiographically–gated, multislice spiral computed tomography. Circulation 2001; 103: 2535–8. [ Links ]
33. HAMON M, BIONDI–ZOCCAI G, MALAGUTTI P, AGOSTONI P, MORELLO R, VALGIMIGLI: Diagnostic performance of multislice spiral computed tomography of coronary arteries as compared with conventional invasive coronary angiography. A meta–analysis. JACC 2006 7; 48(9): 1896–910. [ Links ]
34. SCANLON PJ, FAXON DP, AUDET AM, CARABELLO B, DEHMER GJ, EAGLE KA, ET AL: ACC/AHA guidelines for coronary angiography: executive summary and recommendations—a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Coronary Angiography) developed in collaboration with the Society for Cardiac Angiography and Interventions. Circulation 1999; 99: 2345–57. [ Links ]
35. NIKOLAOU K, KNEZ A, RIST C, WINTERSPERGER BJ, LEBER A, JOHNSON T, ET AL: Accuracy of64–MDCT in the diagnosis of ischemic heart disease. J Am Coll Cardiol 2004; 43: 831–9. [ Links ]
36. HOFFMAN MH, SHI H, SCHMITZ BL, SCHMID FT, LIEBERKNECHT M, SCHULZE R, ET AL: Noninvasive coronary angiography with multislice computed tomography. JAMA 2005; 293: 2471–8. [ Links ]
37. HACKER M, JAKOBS T, MATTHIESEN F, VOLLMAR C, NIKOLAOU K, BECKER C, ET AL: Comparison of spiral multidetector CT angiography and myo–cardial perfusión imaging in the noninvasive detection of functionally relevant coronary artery lesions: First clinical experiences. J Nucl Med 2005;46:1294–1300. [ Links ]
38. BUDOFF MJ, ACHENBACH S, BLUMENTHAL RS, CARR JJ, GOLDIN JG, GREENLAND P, ET AL: Assessment of coronary artery disease by cardiac computed tomography. A scientific statement from the American Heart Association Committee on Cardiovascular Imaging and Intervention, Council on Cardiovascular Radiology and Intervention, and Committee on Cardiac Imaging, Council on Clinical Cardiology. Circulation 2006; 17; 114(16): 1761–91. [ Links ]
39. CAMERON A, DAVIS KB, ROGERS WJ: Recurrence of angina after coronary artery bypass surgery: predictors and progression (CASS registry). JACC 1995; 26: 895–9. [ Links ]
40. FRAZIER AA, QURESHI F, READ KM, GILKESON RC, POSTON RS, WHITE CS: Coronary artery bypass grafts: Assessment with multidetector CT in the early and late postoperative settings. Radiographics 2005; 25: 881–96. [ Links ]
41. ACHENBACH S, MOSHAGE W, ROPERS D, NOSSEN J, BACHMANN K: Noninvasive, three–dimensional visualization of coronary artery bypass grafts by electron beam tomography. Am J Cardiol 1997; 79: 856–61. [ Links ]
42. ROPERS D, ULZHEIMER S, WENKEL E, BAUM U, GIESLER T, DERLIEN H, ET AL: Investigation of aortocoronary artery bypass grafts by multislice spiral computed tomography with electrocardiographic–gated image reconstruction. Am J Cardiol 2001; 88: 792–5. [ Links ]
43. NIEMAN K, PATTYNAMA PM, RENSING BJ, VAN GEUNS RJ, DE FEYTER PJ: Evaluation of patients alter coronary artery bypass surgery: CT angiographic assessment of grafos and coronary arteries. Radiology 2003; 229: 749–56. [ Links ]
44. SCHLOSSER T, KONORZA T, HUNOLD P, KULH H, SCHMERMUND A, BARKAUSEN J: Noninvasive visualization of coronary artery bypass grafts using 16–detector row computed tomography. J Am Coll Cardiol 2004; 44: 1224–9. [ Links ]
45. MARTUSCELLI E, ROMAGNOLI A, DÉLISEO A, TOMASSINI M, RAZZINI C, SPERANDIO M, ET AL: Evaluation of venous and arterial conduit patency by 16–slice spiral computed tomography. Circulation 2004; 10: 3234–8. [ Links ]
46. BURGSTAHLER C, KUETNNER A, KOPP AF, HERDEG C, MARTENSEN J, CLAUSSEN CD, ET AL: Non–invasive evaluation of coronary artery bypass grafts using multi–slice computed tomography: Initial clinical experience. Int J Cardiol 2003; 90: 275–80. [ Links ]
47. MARANO R, STORTO ML, MADDESTRA N, BONOMO L: Non–invasive assessment of coronary artery bypass graft with retrospectively ECG–gated tour–row multi–detector spiral computed tomography. Eur Radiol 2004; 14: 1353–62. [ Links ]
48. CHIURLIA E, MENOZZI M, RATTI C, ROMAGNOLI R, MODENA MG: Follow–up of coronary artery bypass graft patency by multislice computed tomography. Am J Cardiol 2005; 95: 1094–7. [ Links ]
49. PACHE G, SAUERESSIG U, FRYDRYCHOWICZ A, FOELL D, GHANEM N, KOTTER E, ET AL: Initial experience with 64–slice cardiac CT: non–invasive visualization of coronary artery bypass grafts. Eur Heart J 2006; 27: 976–80. [ Links ]
50. HERZOG C, DOGAN S, DIEBOLD T, KHAN MF, ACKERMANN H, SCHALLER S, ET AL: Multi–detector row CT versus coronary angiography: preoperative evaluation before totally endoscopic coronary artery bypass grafting. Radiology 2003; 229: 200–8. [ Links ]
51. FERNÁNDEZ GC: Bypass graft imaging and coronary anomalies in MDCT. Eur Radiol 2005; 15(Suppl2):B59–B61. [ Links ]
52. SERRUYS PW, UNGER F, SOUSA JE, JATENE A, BONNIER HJ, SCHONBERGER JP, ET AL: Arterial revascularization therapies study group. Comparison of coronary–artery bypass surgery and stenting for the treatment of multivessel disease. NEJM 2001; 344: 1117–24. [ Links ]
53. CADERMARTIRI F, MOLLET N, NIEMAN K, KRESTIN GP, DE FEYTER PJ: Images in cardiovascular medicine. Neointimal hyperplasia in carotid stent detected with multislice computed tomography. Circulation 2003; 108:e147. [ Links ]
54. PUGLIESE F, CADEMARTIRI F, VAN MIEGHEM C, MEIJBOOM WB, MALAGUTTI P, MOLLET NR, ET AL: Multidetector CT for visualization of coronary stents. Radiographics 2006; 26: 887–904. [ Links ]
55. SEIFARTH H, RAUPACH R, SCHALLER S, FALLENBERG EM, FLOHR T, HEINDEL W, ET AL: Assessment of coronary artery stents using 16–slice MDCT angiography: evaluation of a dedicated reconstruction kernel and a noise reduction filter. Eur Radiol 2005; 15: 721–6. [ Links ]
56. MAINTZ D, JUERGENS KU, WICHTER T, GRUDE M, HEINDEL W, FISCHBACH R, ET AL: Imaging of coronary artery stents using multislice computed tomography: in vitro evaluation. Eur Radiol 2003; 13: 830–5. [ Links ]
57. HALON DA, GASPAR T, PELED N, ADAWI S, HEBRON D, SCHLIAMSER J, ET AL: Assessment of luminal diameter of coronary stents using a novel 40–slice multi–detector CT scanner. Circulation 2004; 110: EI–563. [ Links ]
58. CHIURLIA E, MENOZZI M, RATTI C, ROMAGNOLI R, MODENA MG: Follow–up of coronary artery bypass graft patency by multislice cometed tomography. Am J Cardiol 2005; 95: 1094–7. [ Links ]
59. PUMP H, MOHLENKAMP S, SEHNERT CA, SCHIMPF SS, SCHMIDT A, ERBEL R, ET AL: Coronary arterial stentpatency: Assessment with electron–beam CT. Radiology 2000; 214: 447–52. [ Links ]
60. KNOLLMANN FD, MOLLER J, GEBERT A, BETHGE C, FELIX R: Assessment of coronary artery stent patency by electron–beam CT. Eur Radiol 2004; 14: 1341–7. [ Links ]
61. KHAN MF, HERZOG C, LANDENBERGER K, MAATAOUI A, MARTENS S, ACKERMANN H, ET AL: Visualization of non–invasive coronary bypass imaging: 4 row vs 16–row multidetector computed tomography. Eur Radiol 2005; 15: 118–26. [ Links ]
62. GASPAR T, HALON DA, LEWIS BS, ADAWI S, SCHLIAMSER JE, RUBINSHTEIN R, ET AL: Diagnosis of coronary in–stent restenosis with multidetector row spiral computed tomography. JACC 2005; 46: 1573–9. [ Links ]
63. CADERMATIRI F, MOLLET N, LEMOS PA, PUGLIESE F, BAKS T, GEBERT A, ET AL: Usefulness of multislice computed tomographic coronary angiography to assess in–stent restenosis. Am J Cardiol 2005; 96: 799–802. [ Links ]
64. SCHUIJF JD, BAX JJ, JUKEMA JW, LAMB HJ, WARDA HM, VLIEGEN HW, ET AL: Feasibility of assessment of coronary stent patency using 16–slice computed tomography. Am J Cardiol 2004; 94: 427–30. [ Links ]
65. GILARD M, CORNILY JC, RIOUFOL G, FINET G, PENNEC PY, MANSOURATI J, ET AL: Noninvasive assessment of left main coronary stent patency with 16–slice computed tomography. Am J Cardiol 2005; 1;95(1): 110–2. [ Links ]
66. DATTA J, WHITE CS, GILKESON RC, MEYER CA, KANSAL S, JANI ML, ET AL: Anomalous coronary arteries in adults: depiction at multi–detector row CT angiography. Radiology 2005; 235: 812–8. [ Links ]
67. SCHMITT R, FROEHNER S, BRUNN J, WAGNER M, BRUNNER H, CHEREVATYY O, ET AL: Congenital anomalies of the coronary arteries: imaging with contrast–enhanced, multidetector computed tomography. Eur Radiol 2005; 15: 1110–21. [ Links ]
68. SHI H, ASCHOFF AJ, BRAMBS HJ, HOFFMANN MH: Multislice CT imaging of anomalous coronary arteries. Eur Radiol 2004; 14: 2172–81. [ Links ]
69. MARON BJ: Sudden death in young athletes. NEJM 2003; 349: 1064–75. [ Links ]
70. BASSO C, MARON BJ, CORRADO D, THIENE G: Clinical profile of congenital coronary artery anomalies with origin from the wrong aortic sinus leading to sudden death in young competitive athletes. J Am Coll Cardiol 2000; 35: 1493–1501. [ Links ]
71. BARTH CW III, ROBERTS WC: Left main coronary artery originating from the right sinus of Valsalva and coursing between the aorta and pulmonary trunk. J Am Coll Cardiol 1986; 7: 366–73. [ Links ]
72. TAYLOR AJ, BYERS JP, CHEITLIN MD, VIRMANI R: Anomalous right or left coronary artery from the contralateral coronary sinus: «High–risk» abnormalities in the initial coronary artery course and heterogenous clinical outcomes. Am Heart J 1997; 133:428–35. [ Links ]
73. THOMAS D, SALLOUM J, MONTALESCOT G, DROBINSKI G, ARTIGOU JY, GROSGOGEAT Y: Anomalous coronary arteries coursing between the aorta and pulmonary trunk. Clinical indication for coronary artery bypass. Eur Heart J 1991; 12: 832–34. [ Links ]
74. PELLICCIA A: Congenital coronary artery anomalies in young patients: new perspectives for timely identification. J Am Coll Cardiol 2001; 37: 598–600. [ Links ]
75. MCCONNELL MV, GANZ P, SELWYN AP, LI W, EDELMAN RR, MANNING WJ, ET AL: Identification of anomalous coronary arteries and their anatomic course by magnetic resonance coronary angiography. Circulation 1995; 92: 3158–62. [ Links ]
76. POST JC, VAN ROSSUM AC, BRONZWAER JG, DE COCK CC, VISSER CA: Magnetic resonance angiography of anomalous coronary arteries: a new gold standard for delineating proximal course ? Circulation 1995; 92: 3163–71. [ Links ]
77. ROPERS D, MOSHAGE W, DANIEL WG, JESSL J, GOTTWIK M, ACHENBACH S: Visualization of coronary artery anomalies and their anatomic course by contrast–enchanced electron beam tomography and three–dimensional reconstruction. Am J Cardiol 2001; 87: 193–7. [ Links ]
78. VAN OOIJEN PM, DORGELO J, ZULSTRA F, OUDKERK M: Detection, visualization and evaluation of anomalous coronary anatomy on 16– slice multide–tector–row CT. Eur Radiol 2004; 14: 2163–71. [ Links ]














