Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.78 no.1 Ciudad de México ene./mar. 2008
Investigación clínica
Alteraciones de las lipoproteínas de alta y baja densidad en pacientes coronarios con C–LDL en meta pero C–HDL y triglicéridos anormales**
High and low density lipoprotein abnormalities in coronary patients with LDL–C at target and uncontrolled HDL–C and triglycerides
Carlos Posadas–Romero,* Rosalinda Posadas–Sánchez,* Juan Gabriel Juárez–Rojas,* Aída Medina–Urrutia,* Esteban Jorge–Galarza,* Guillermo Cardoso–Saldaña,* Nacu Caracas–Portilla,* Enrique Mendoza–Pérez*
* Departamento de Endocrinología, Instituto Nacional de Cardiología Ignacio Chávez.
Correspondencia:
Posadas–Romero Carlos.
Instituto Nacional de Cardiología Ignacio Chávez.
(INCICH, Juan Badiano Núm. 1,
Sección XVI, 14080, México, D.F.).
Tel: (55) 5573 – 2911 Ext. 1272 Fax: (55) 5573 – 4687
Correo electrónico: cposadasr@yahoo.com
Recibido: 11 de diciembre de 2007
Aceptado: 13 de diciembre de 2007
Resumen
Objetivo: Investigar la distribución de las subclases de las lipoproteínas de alta densidad (HDL) y su composición química, así como el tamaño y oxidabilidad de las lipoproteínas de baja densidad (LDL), en hombres con enfermedad arterial coronaria (EAC) tratados con estatinas, y colesterol de LDL en valores meta (< 100 mg/dL), pero con concentraciones anormales de colesterol HDL (< 40 mg/dL) y triglicéridos (TG ≥ 150 mg/dL). El grupo control estuvo formado por hombres con EAC, tratados con estatinas, que tenían C–LDL en meta y valores normales de C–HDL y TG.
Material y métodos: Las subclases de HDL y el tamaño de LDL se determinaron mediante electroforesis en gel de gradiente. La susceptibilidad de LDL a la oxidación se determinó midiendo la duración de la fase de latencia después de agregar el agente oxidante.
Resultados: En comparación con el grupo control (n = 35), los pacientes con C–HDL bajo y TG altos (n = 34) se caracterizaron por tener proporciones menores de HDL grandes y mayores de HDL pequeñas. Además, estos pacientes tuvieron HDL de composición anormal y LDLs de tamaño menor y más susceptibles a la oxidación (p < 0.05 para todas las diferencias).
Conclusiones: Los pacientes coronarios con C–LDL < 100 mg/dL en respuesta a estatinas, pero con C–HDL bajo y TG altos, tienen anormalidades en las características de HDL y LDL que se asocian con un riesgo más alto de eventos coronarios recurrentes.
Palabras clave: Tamaños de HDL y LDL. Subclases de HDL. Oxidabilidad de LDL y aterosclerosis.
Abstract
Objective: To investigate the high density lipoprotein (HDL) subclasses distribution and chemical composition, as well as low density lipoprotein (LDL) size and LDL oxidation, in coronary male patients treated with statins, that had LDL–cholesterol levels at target (< 100 mg/dL), but whose HDL–cholesterol (< 40 mg/dL) and triglycerides (TG ≥ 150 mg/dL) levels were abnormal. The control group was formed by statin treated coronary male patients with LDL–C below 100 mg/dL and normal HDL–C and TG levels.
Material and methods: HDL subclasses and LDL size were determined by gradient gel electrophoresis. LDL susceptibility to oxidation was determined by measuring lag phase duration, after adding the oxidant agent.
Results: Compared with the control group (n = 35), patients with low HDL–C + high TG (n = 34) showed significantly lower proportions of large HDL and higher proportions of small HDL particles. In addition, these patients had abnormal HDL composition, smaller LDL size, and higher LDL susceptibility to oxidation (p < 0.05 for all).
Conclusions: Coronary patients with optimal LDL–C levels on statin therapy but with low HDL–C and high TG, have HDL and LDL abnormalities that have been shown to be associated with a higher risk of new coronary events.
Key words: HDL particle size. HDL subclasses. LDL particle size. LDL oxidability and atherosclerosis.
Introducción
En los últimos años, el tratamiento regulador de lípidos para prevenir la enfermedad cardiovascular se ha dirigido primariamente a modificar el colesterol de las lipoproteínas de baja densidad (C–LDL). Los estudios de prevención primaria y secundaria han mostrado que el tratamiento con estatinas, reduce significativamente los eventos cardiovasculares en sujetos con amplia variedad de concentraciones basales de C–LDL y perfiles de riesgo cardiovascular.1 Sin embargo, la reducción del riesgo relativo en estos estudios, incluyendo aquellos que han logrado valores de C–LDL muy por debajo de los recomendados,2,3 ha oscilado entre 25–35%, indicando que los eventos coronarios continúan presentándose en la mayoría de los pacientes tratados. Una de las posibles explicaciones para la persistencia del riesgo alto, es la presencia de otras anormalidades, como concentraciones bajas del colesterol de las lipoproteínas de alta densidad (C–HDL) y/o los valores altos de triglicéridos (TG). Estas alteraciones son también factores de riesgo independientes para la enfermedad arterial coronaria (EAC).4,5
Las lipoproteínas de alta densidad (HDL) son un grupo heterogéneo de partículas que pueden ser clasificadas, por tamaño descendente en HDL2b, HDL2a, HDL3a, HDL3b, y HDL3c.6 Estas subclases de HDL difieren en composición de lípidos y apolipoproteínas(apos), tamaño, densidad y carga.7 También se ha documentado que estas diferencias fisicoquímicas determinan diferencias en la función biológica de las subclases.8
Los estudios epidemiológicos han mostrado que las concentraciones bajas del C–HDL constituyen un factor de riesgo importante e independiente de EAC.9 Sin embargo, evidencias recientes indican que los cambios en la distribución de las subclases de las HDL son de mayor utilidad que las concentraciones de C–HDL en la predicción de eventos coronarios.10 También se ha informado que en los individuos con valores bajos de C–HDL, las HDL están enriquecidas en TG y depletadas de esteres de colesterol (EC).11,12 Esta composición anormal se asocia a reducción de sus efectos antioxidante,11,12 antiinflamatorio13 y a menor capacidad para promover el eflujo de colesterol,14 lo que puede disminuir la actividad ateroprotectora de las HDL.
Además de reducir las concentraciones en plasma de C–LDL y TG y producir aumentos modestos de C–HDL, las estatinas modifican favorablemente algunas características de las HDL15,16 no medidas rutinariamente en el laboratorio. A pesar de estos efectos, recientemente se informó que en los pacientes coronarios tratados con estatinas, el riesgo de eventos recurrentes fue 2 veces más alto en aquéllos con valores bajos de C–HDL.17 Este hallazgo nos condujo a postular la hipótesis de que los pacientes en tratamiento con estatinas y C–LDL en meta (< 100 mg/dL), pero con valores bajos de C–HDL y altos de TG, pueden tener anormalidades en las características cualitativas de las HDL que atenúan su efecto protector contra la aterosclerosis. El objetivo de este trabajo fue estudiar la composición química y la distribución de las subclases de HDL en pacientes coronarios tratados con estatinas y C–LDL en meta, pero con C–HDL bajo y triglicéridos altos. Además, examinamos el tamaño y la susceptibilidad a la oxidación de las LDL.
Material y métodos
Población
Los pacientes fueron seleccionados de la consulta externa del Servicio de Cardiología de nuestro Hospital. Se eligieron pacientes del sexo masculino, con diagnóstico de EAC estable, definida por historia personal de infarto al miocardio, angina de pecho, angioplastía, cirugía de revascularización, o estenosis coronaria mayor al 50% evaluada por angiografía. Todos los pacientes recibían tratamiento con una estatina y tenían C–LDL en valores meta (< 100 mg/dL). De acuerdo a los valores de TG y de C–HDL, los pacientes se dividieron en dos grupos. El primero, incluyó 34 pacientes con TG entre 151 y 500 mg/dL y C–HDL por debajo de 40 mg/dL, y se consideró como el grupo de hipoalfalipoproteinemia combinada con hipertrigliceridemia (HA + HTG). El grupo de comparación lo conformaron 35 pacientes que además de tener C–LDL en meta, cursaban con valores normales de triglicéridos (< 150 mg/dL) y de C–HDL (> 40 mg/dL). En el escrito estos pacientes se describen como normolipidémicos (NL) o grupo control. Participaron únicamente los pacientes que después de conocer las características del estudio, aceptaron firmar la forma de consentimiento informado. No se incluyeron pacientes con eventos cardiovasculares agudos en los tres meses previos, insuficiencia cardíaca congestiva, índice de masa corporal (IMC) > 35 kg/m2, diabetes mellitus descontrolada, disfunción tiroidea, miopatía, ni aquéllos con enfermedad renal o hepática. Tampoco se incluyeron pacientes tratados con fibratos, niacina o resinas.
Métodos clínicos y de laboratorio
En todos los pacientes se aplicó un cuestionario para obtener información familiar y personal sobre factores de riesgo cardiovascular, actividad física y consumo de alcohol y tabaco. Los pacientes que no participaban en ningún tipo de deporte o actividad física en su tiempo libre fueron considerados como sedentarios,18 y como fumadores aquellos que consumían más de 1 cigarrillo por día.19 Se registró el tipo y dosis de estatina, así como las terapias concomitantes (antihipertensivos, betabloqueadores, inhibidores de la ECA, diuréticos, aspirina y otros antiagregantes plaquetarios) al momento del estudio. Se midieron el peso, la talla, la circunferencia de cintura, la frecuencia cardíaca y la presión arterial. El IMC se calculó con la fórmula: peso (kg)/talla (m2). El sobrepeso se definió como un IMC de 25 – 29.9kg/m2,la obesidadcomoIMC > 30 kg/m2 y la adiposidad central como circunferencia de cintura > 90 cm.20 En ayuno de 12 horas y después de reposo durante 20 minutos en posición sedente, se colectaron 15 mL de sangre venosa en tubos con EDTA. Después de centrifugar, el plasma fue separado en alícuotas a las que se le añadieron inhibidores de proteasas (aprotinina 100 KIU/mL, benzamidina 1 mM) antes de almacenarlas a –70 °C para su análisis posterior.
Análisis de laboratorio
La determinación de lípidos y lipoproteínas en plasma, así como el análisis de la composición química de HDL, se realizaron en un autoanalizador Hitachi 902 (Boheringer Mannheim), utilizando estuches enzimáticos comerciales (Roche Diagnostics, Mannheim Alemania y Wako Chemicals, USA). El colesterol de las lipoproteínas de alta densidad se determinó mediante un método enzimático homogéneo (Roche Diagnostics, Mannheim Alemania).21 El colesterol de las lipoproteínas de baja densidad se estimó con la fórmula de Friedewald modificada por De Long.22 El colesterol esterificado, contenido en las HDL, se calculó mediante la siguiente fórmula: CE–Hdl = (CTHDL – C libre Hdl)*1.68.23 En nuestro laboratorio, la precisión y exactitud de las determinaciones de lípidos son evaluadas periódicamente por el Centro para el Control y Prevención de Enfermedades de Atlanta, GA (CDC, por sus siglas en inglés).
Las subpoblaciones de HDL fueron determinadas en HDL aisladas por ultracentrifugación secuencial, mediante electroforesis en gradiente (4% al 30%) en gel de poliacrilamida en condiciones nativas (PAGE).24 Como referencia se utilizaron marcadores de alto peso molecular (Pharmacia, Piscataway, NJ) con diámetros conocidos (tiroglobulina 17 nm, ferritina 12.2 nm, catalasa 10.4 nm, lactato deshidrogenasa 8.2 nm, y albúmina 7.1 nm). Previa tinción con azul de Coomassie R250, las proporciones relativas a las diferentes subpoblaciones de HDL se cuantificaron por densitometría óptica en un densitó–metro (modelo 620; Bio–Rad, Hertfordshire, UK), que utiliza el programa de análisis molecular Bio–Rad versión 1.1. Los intervalos utilizados para las diferentes subpoblaciones fueron: HDL3c 7.21–7.76 nm, HDL3b 7.76–8.17 nm, HDL3a 8.178.77 nm, HDL2a 8.77–9.71 nm y HDL^9.7112.93 nm. Los coeficientes de variación fueron menores al 10% para todas las subpoblaciones. El tamaño promedio de la partícula de HDL está determinado por la proporción relativa de cada una de sus subclases,25 por lo que se obtuvo sumando el tamaño promedio (nm) de cada subfracción, multiplicado por su proporción relativa, y la suma total se dividió entre 100. El coeficiente de variación para el tamaño promedio de partícula fue menor del 1%.
El contenido de apos en HDL se determinó semicuantitativamente mediante electroforesis en gradiente (4–21%) en gel de poliacrilamida (SDS–PAGE).26 Las apos fueron teñidas con azul de Coomassie e identificadas de acuerdo a su peso molecular (apo A IV 46 KD, apo E 34 KD, apo AI 28 KD, apo AII 17 KD, apos C), utilizando marcadores de peso molecular conocido (fosforilasa 97 KD, albúmina 66 KD, ovoalbúmina 45 KD, anhidrasa carbónica 30 KD, inhibidor de tripsina 20.1 KD, a–lactoglobulina 14.4 KD). El porcentaje de área bajo la curva, correspondiente a cada apoproteína, se cuantificó por densitometría óptica.
Los tamaños de LDL se determinaron con el método de Krauss y Burke27 ligeramente modificado. Las muestras de plasma total en condiciones nativas, se aplicaron a un gel en gradiente de poliacrilamida (2% – 14%). Los tamaños de LDL se calcularon interpolando los resultados de la muestra problema en una curva de tamaños conocidos de LDL (cortesía del Dr. R. Krauss, Donner laboratorios, Berkeley, CA). Para estandarizar las determinaciones, en cada gel se incluyó además una curva con marcadores de alto peso molecular (Pharmacia, Piscataway, NJ), y una cama de látex de 38 nm. Los geles se analizaron por densitometía óptica. Los coeficientes de variación intra– e interensayo para esta medición fueron del 0.66% y 1.46%, respectivamente.
La susceptibilidad a la oxidación de las LDL fue determinada por el método de Esterbauer et al.28 con ligeras modificaciones. Utilizando métodos estandarizados, las LDL se aislaron previamente mediante ultracentrifugación a 4°C. El intervalo de tiempo en minutos que transcurre desde la adición de Cu 2+ al ensayo, hasta el comienzo de la fase rápida de oxidación, es conocido como fase de latencia (fase lag LDL), y representa el tiempo que tarda la partícula de LDL en comenzar a oxidarse. En la curva de oxidación se calcula como la intersección entre la línea basal y la tangente de la fase de propagación. El coeficiente de variación inter–ensayo fue menor a 3.5%
Análisis estadístico
El análisis de resultados se realizó con el paquete estadístico SPSS 10 para Windows (SPSS, Chicago IL). Las características clínicas y bioquímicas de los pacientes se expresan como valores medios ± desviación estándar (D.E.) y la frecuencia de factores de riesgo cardiovascular como porcentaje. Para comparar valores medios se utilizó la prueba paramétrica t–Student de dos colas y para comparar frecuencias, se usó la prueba de chi2. Las variables que mostraron distribución asimétrica fueron transformadas logarítmicamente para su análisis. Para conocer la correlación de las variables clínicas y bioquímicas con el diámetro promedio de las partículas de HDL y con el tamaño y la susceptibilidad a la oxidación de las LDL, se utilizó un análisis de correlación de Pearson. La independencia de estas asociaciones se determinó por análisis de regresión múltiple por pasos y todos los valores de p < 0.05 se consideraron estadísticamente significativos.
Resultados
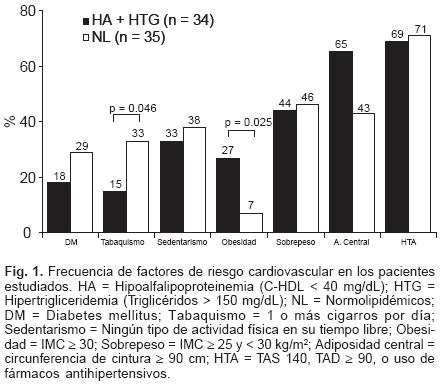
Al momento de aplicar el cuestionario, realizar la antropometría y tomar la muestra de sangre, todos los pacientes incluidos en el estudio estaban en tratamiento con alguna estatina. La droga más frecuentemente empleada fue la simvastatina (49%), seguida por la atorvastatina (23%), rosuvastatina (21%) y pravastatina (6%). Al comparar los dos grupos, no se encontraron diferencias significativas en la proporción de pacientes que recibían las diferentes estatinas, ni en las dosis utilizadas. Tampoco se identificaron diferencias en las frecuencias de utilización de otras drogas anti–isquémicas o anti–hipertensivas. En los dos grupos, todos los pacientes tuvieron valores de C–LDL inferiores a 100 mg/dL. Por diseño del estudio, los pacientes HA+HTG mostraron valores significativamente más altos del TG y más bajos de C–HDL (Tabla I). Aunque las concentraciones en plasma del colesterol total y del C–LDL fueron muy similares en los dos grupos, los valores altos en las relaciones CT/C–HDL y C–LDL/C–HDL caracterizaron a los pacientes con HA+HTG. Además, estos pacientes tuvieron valores más altos de IMC (p = 0.024) y en la circunferencia de cintura (p N.S). Los valores medios de edad, tensión arterial y concentraciones de glucosa fueron similares en los dos grupos. En la Figura 1 se muestra que la hipertensión arterial fue el factor de riesgo coronario más frecuente en los dos grupos de pacientes. La frecuencia de obesidad fue significativamente más alta en el grupo HA+HTG, mientras que la proporción de fumadores fue mayor en el grupo control. Aunque sin significado estadístico, la prevalencia de obesidad central fue más alta en los pacientes con HA+HTG. Por el contrario, la diabetes se encontró con mayor frecuencia en el grupo control, pero la diferencia tampoco fue significativa.
Como se describió en material y métodos, la distribución de las subclases de las HDL se determinó mediante electroforesis en gradiente de 4% a 30%. Los resultados en la Tabla II muestran la proporción relativa de cada subclase de HDL. En comparación con los pacientes control normolipidémicos, los pacientes con HA+HTG tuvieron proporciones significativamente más bajas de las HDL grandes (HDL2b y HDL2a), y proporciones más altas de las HDL pequeñas (HDL3b y HDL3c). Como consecuencia de estos cambios en la distribución de subclases, el diámetro promedio de las HDL fue significativamente menor en el grupo con HA+HTG. La composición química de las HDL también mostró diferencias entre los dos grupos. Las HDL de los pacientes con HA+HTG mostraron mayor proporción de TG y tendencia a menor contenido en colesterol libre y en esteres de colesterol. Adicionalmente, las HDL de estos pacientes se caracterizaron por menor proporción de apo A–I y mayor contenido de apos C. En las dos variables las diferencias fueron significativas en comparación con el grupo control.
Los pacientes con HA+HTG no solamente mostraron anormalidades en el tamaño de las HDL, sino también, como se muestra en la Figura 2, tuvieron partículas de LDL con tamaño significativamente menor que las LDL de los pacientes control. La fase de latencia, definida como el intervalo entre la adición del agente oxidante y el inicio de la oxidación de las LDL, fue significativamente más corto en los pacientes con HA+HTG, indicando mayor susceptibilidad a la oxidación de las LDL en este grupo (Fig. 2).
En la Figura 3 se muestran los resultados del análisis de correlación del tamaño promedio de las HDL con variables antropométricas y bioquímicas en los 69 pacientes estudiados. La asociación del tamaño de HDL fue positiva con la edad y las concentraciones del C–HDL, mientras que una asociación negativa se observó con IMC, circunferencia de cintura, CT, C–LDL, TG.

Todas estas correlaciones tuvieron significado estadístico (P < 0.05), pero las asociaciones más importantes fueron con los índices CT/C–HDL y C–LDL/C–HDL. Por otro lado, el tamaño de LDL se relacionó directamente sólo con los valores de C–HDL (r = 0.396, p = 0.001), y en forma inversa con los TG (r = –0.265, p = 0.032) y el índice CT/C–HDL (r = –0.32, p = 0.008). La fase de latencia se asoció con los valores de CT(r = 0.263, p = 0.049), de C–LDL (r = 0.280, p = 0.035) y de TG (r = –0.274, p = 0.039). El análisis de regresión múltiple se utilizó para determinar la independencia de estas asociaciones. Como variables independientes se incluyeron en el modelo la edad, IMC, circunferencia de cintura, las concentraciones de los diferentes lípidos y los índices CT/C–HDL y C–LDL/C–HDL; y como variables dependientes entraron al modelo el tamaño de HDL y LDL y la fase de latencia. El índice CT/C–HDL explicó el 38.4% de la varianza en tamaño de HDL; el C–HDL explicó 15.7% en la varianza del tamaño de LDL; y el CLDL y el índice CT/C–HDL explicaron el 7.9% y el 11.7%, respectivamente, de la varianza en la susceptibilidad a la oxidación de las LDL (fase de latencia).
Discusión
Los estudios epidemiológicos han establecido claramente que los valores bajos de C–HDL constituyen un factor de riesgo independiente para la aterosclerosis prematura y la EAC.9 Sin embargo, investigaciones recientes indican que el análisis de las subclases de HDL puede mejorar la predicción de la EAC.10 La resistencia a la insulina, la obesidad y la diabetes frecuentemente cursan con valores subnormales de C–HDL y concentraciones altas de triglicéridos.29 Se ha mostrado que esta dislipidemia también incluye una disminución en tamaño de las HDL resultante de las concentraciones menores de HDL grandes y aumento de las HDL pequeñas.30 También se ha informado que estas partículas de HDL tienen una composición anormal, con aumento en el contenido de triglicéridos y disminución de los ésteres de colesterol.12
Los resultados del presente estudio en pacientes coronarios tratados con estatinas y con CLDL en meta (< 100/dL), pero con persistencia de C–HDL bajo y triglicéridos altos, mostraron disminución en las proporciones de HDL grandes y aumento de las HDL pequeñas. También se observó un aumento significativo en el contenido de triglicéridos en las partículas de HDL. Además, en estos pacientes las partículas de LDL fueron de tamaño significativamente menor y más susceptibles a la oxidación.
Aunque estudios iniciales no mostraron datos convincentes sobre la utilidad de medir las subfracciones de HDL.31,32 en los últimos años, varias investigaciones han señalado que la caracterización más detallada de las HDL mejora la capacidad para evaluar el riesgo de EAC. Un estudio de casos y controles mostró que los pacientes coronarios tienen concentraciones significativamente más bajas de HDL grandes y valores más altos de HDL pequeñas que los controles.33 Después de ajustar por factores de riesgo tradicionales, este patrón anormal se encontró asociado a la prevalencia de EAC,34 y también mostró relación independiente con la mayor recurrencia de eventos coronarios en pacientes con EAC y C–HDL bajo.10 Algunos estudios no han mostrado efectos de las estatinas sobre el tamaño de lasHDL,35,36 pero Asztalos ycols.37 recientemente reportaron que las estatinas aumentan las HDL grandes y disminuyen las LDL pequeñas. Estos efectos, más notables con rosuvastatina y atorvastatina en comparación con simvastatina y pravastatina, mejoran pero no logran normalizar la distribución de las subclases de HDL.37 Las anormalidades en las subclases de HDL observadas en nuestros pacientes coronarios tratados con diferentes estatinas, son consistentes con los hallazgos de esos estudios. El transporte reverso de colesterol es considerado como el mecanismo principal involucrado en el papel protector de las HDL contra la aterosclerosis,38 sin embargo, hay evidencias de que las actividades anti–inflamatoria y antioxidante de las HDL también tienen efectos benéficos en la pared arterial.39,40 En comparación con las HDL grandes, las HDL pequeñas son mejores promotoras del eflujo de colesterol, ejercen más actividad antioxidante8 y tienen mayor capacidad para inhibir la expresión de moléculas de adhesión.41 Pero esta actividad biológica de las subclases de HDL se encuentra alterada en individuos con C–HDL bajo. Se ha informado que la capacidad antioxidante de todas las HDL pequeñas (3a, 3b, 3c) está significativamente disminuida en pacientes con síndrome metabólico.12 La atenuación de la actividad antioxidante de las HDL pequeñas se asoció con partículas de HDL enriquecidas en triglicéridos y depletadas en ésteres de colesterol y, también, con un estado inflamatorio crónico, expresado por elevación significativa en los valores de proteína C reactiva.12 Anormalidades similares en la capacitad antioxidante de las HDL fueron documentadas por el mismo grupo de investigación en hombres con C–HDL bajo y valores normales de colesterol, triglicéridos y glucosa.11 En este tipo de pacientes también se ha demostrado disminución en la actividad antiinflamatoria13 y en la capacidad para promover eflujo de colesterol.14 Con base en estos estudios, pensamos que en nuestros pacientes con C–HDL bajo y triglicéridos altos, es posible que las actividades ateroprotectoras de las HDL se encuentren disminuidas. Sin embargo, se requieren estudios adicionales que confirmen esta posibilidad.
Varios estudios prospectivos han demostrado que el aumento de las LDL densas y pequeñas es un factor de riesgo independiente para eventos cardiovasculares futuros.42,43 Uno de los factores que contribuyen a la acción aterogénica de las LDL pequeñas es su mayor susceptibilidad a la oxidación.44 El potencial proaterogénico de las LDL oxidadas puede estar mediado por múltiples mecanismos, pero los considerados como más importantes son su mayor captación por los macrófagos, su actividad quimioatrayente de monocitos circulantes, inhibición de la motilidad de los macrófagos tisulares, alteración de la vasomoción coronaria mediada por óxido nítrico, estimulación de la agregación plaquetaria y su actividad procoagulante.45 En el presente estudio se demostró que, en comparación con las LDL de los pacientes control, las LDL de los pacientes con HA+HTG tuvieron un tamaño significativamente menor y fueron más susceptibles a la oxidación. Estos resultados son consistentes con las observaciones de que las HDL de pacientes con C–HDL bajo son menos eficientes para proteger a las LDL contra la oxidación.11,12 Aunque las estatinas pueden disminuir la oxidabilidad de las LDL,46 nuestros resultados sugieren que la acción antioxidante de estas drogas, no es de efectividad suficiente en los pacientes con HA+HTG.
Limitaciones del estudio
Este estudio tiene algunas limitaciones. Primera, estudiamos únicamente pacientes del sexo masculino, por lo que los resultados pudieran no ser aplicables en las mujeres. En estudios futuros, consideramos no solamente justificable sino necesario incluir pacientes del sexo femenino. Segunda, los métodos utilizados para evaluar las características de las HDL y de LDL en los pacientes estudiados, no están disponibles para la práctica clínica. Sin embargo, la información obtenida por este tipo de estudios contribuye a mejorar el conocimiento sobre las anormalidades lipoproteicas que pueden participar en la progresión del proceso aterogénico. Tercera, reconocemos el hecho de que no se practicó alguna medición (ejemplo: la función endotelial por métodos no invasivos), que pudiera reflejar alteraciones funcionales asociadas al metabolismo anormal de HDL y LDL. Cuarta, la ausencia de un grupo de sujetos sanos normolipidémicos pudiera ser otra limitación del estudio. Sin embargo, el objetivo principal del trabajo fue identificar diferencias entre los pacientes con HA + HTG y aquéllos con todos los lípidos en valores meta. Por otra parte, la principal fortaleza del trabajo es que los resultados muestran por vez primera, anormalidades cualitativas de HDL y LDL con potencial aterogénico, en pacientes tratados con estatinas que han logrado concentraciones meta de C–LDL pero continúan con valores anormales de C–HDL y TG.
Conclusiones
Los pacientes con EAC establecida, tratados con estatinas, que han alcanzado valores meta de C–LDL pero que cursan con C–HDL bajo y triglicéridos altos, presentan anormalidades tanto en la composición química y en la distribución de subclases de HDL, como en el tamaño y la oxidabilidad de las LDL. Estas alteraciones se han encontrado asociadas a disfunción de las HDL y a mayor riesgo cardiovascular. Es plausible que el mayor número de eventos coronarios en pacientes con C–HDL bajo y C–LDL con valores inferiores a 80 mg/dL, observado en el estudio de tratamiento para lograr nuevas metas (TNT por sus siglas en inglés)17 pueda ser debido, al menos en parte, a las anormalidades cualitativas en las partículas de HDL y LDL identificadas en el presente estudio. Aunque la reducción de las concentraciones del C–LDL continúa siendo la meta principal del tratamiento, este y otros estudios sugieren que los valores bajos del C–HDL deberían también ser considerados como objetivo de la terapia reguladora de lípidos. Esta posición es apoyada por el reporte de que el aumento en las concentraciones de las HDL grandes en respuesta al tratamiento con simvastatina más niacina, se asoció significativamente a menor progresión de estenosis coronaria.47
Referencias
1. LaRosa JC, He J, Vupputuri S: Effect of statins on risk of coronary disease: a meta–analysis of randomized controlled trials. JAMA 1999; 282: 2340-2346. [ Links ]
2. Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, et al: Intensive versus moderate lipid lowering with statins after acute coronary syndromes. The Pravastatin or Atorvastatin Evaluation and Infection Therapy–Throm–bolysis in Myocardial Infarction 22 Investigators. N Engl J Med 2004; 350: 1495–1504. [ Links ]
3. La Rosa JC, Grundy SM, Waters DD, Shear C, Barter P, Fruchart JC, et al: Treating to New Targets (TNT) Investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352: 1425–1435. [ Links ]
4. Gordon DJ, Probstfield JL, Garrison RJ, Neaton JD, Castelli WP, Knoke JD, et al: High–density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies. Circulation 1989; 79: 8–15. [ Links ]
5. Hokanson JE, Austin MA: Plasma triglyceride level is a risk factor for cardiovascular disease independent of high–density lipoprotein cholesterol level: a meta–analysis of population–based prospective studies. J Cardiovasc Risk 1996; 3:213–219. [ Links ]
6. Williams PT, Krauss RM, Nichols AV, Vranizan KM, Wood PD: Identifying the predominant peak diameter of high–density and low–density lipoproteins by electrophoresis. J Lipid Res 1990;31: 1131–1139. [ Links ]
7. Von Eckardstein A, Huang Y, Assmann G: Physiological role and clinical relevance of high–density lipoprotein subclasses. Curr opin Lipidol 1994; 5: 404–416. [ Links ]
8. Kontush A, Chantepie S, Chapman MJ: Small, dense HDL particles exert potent protection of atherogenic LDL against oxidative stress. Arterioscler Thromb Vasc Biol 2003; 23: 1881–1888. [ Links ]
9. Gordon T, Castelli WP, Hjortland MC, Kannel WB, Dawber TR: High density lipoprotein as a protective factor against coronary heart disease. The Framingham Study. Am J Med 1977; 62:707–714. [ Links ]
10. Asztalos BF, Collins D, Cupples LA, Demissie S, Horvath KV, Bloomfield HE, et al: Value of high–density lipoprotein (HDL) subpopulations in predicting recurrent cardiovascular events in the Veterans Affairs HDL Intervention Trial. Arterioscler Thromb Vasc Biol 2005; 25: 2185–2191. [ Links ]
11. Kontush A, de Faria EC, Chantepie S, Chapman MJ: A normotriglyceridemic, low HDL–cholesterol phenotype is characterised by elevated oxidative stress and HDL particles with attenuated antioxidative activity. Atherosclerosis 2005; 182: 277–285. [ Links ]
12. Hansel B, Giral P, Nobecourt E, Chantepie S, Bruckert E, Chapman MJ, et al: Metabolic syndrome is associated with elevated oxidative stress and dysfunctional dense high–density lipoprotein particles displaying impaired antioxidative activity. J Clin Endocrinol Metab 2004; 89: 4963–4971. [ Links ]
13.Calabresi L, Gomaraschi M, Villa B, Omoboni L, Dmitrieff C, Franceschini G: Elevated Soluble Cellular Adhesion Molecules in Subjects With Low HDL–Cholesterol. Arterioscler Thromb Vasc Biol 2002; 22: 656–661. [ Links ]
14. Brites FD, Bonavita CD, De Geitere C, Cloes M, Delfly B, Yael MJ, et al: Alterations in the main steps of reverse cholesterol transport in male patients with primary hypertriglyceridemia and lowHDL–cholesterol levels. Atherosclerosis 2000;152: 181–192. [ Links ]
15. Asztalos BF, Horvath KV, McNamara JR, Roheim PS, Rubinstein JJ, Schaefer EJ: Comparing the effects of five different statins on the HDL subpopulation profiles of coronary heart disease patients. Atherosclerosis 2002; 164: 361–369. [ Links ]
16. Ansell BJ, Navab M, Hama S, Kamranpour N, Fonarow G, Hough G, et al: Inflammatory/anti–inflammatory properties of high–density lipoprotein distinguish patients from control subjects better than high–density lipoprotein cholesterol levels and are favorably affected by simvastatin treatment. Circulation 2003; 108: 2751–2756. [ Links ]
17. Barter P, Gotto A, La Rosa J, Grundy S, Kastelein J, Bittner V, et al: On–treatment levels of HDL–C and the ratio of LDL–C/HDL–C as predictors of cardiovascular events in the treating to new targets (TNT) study. ACC 55th Annual Scientific 2006 (Abstract): 914–203. [ Links ]
18. Barengo NC, Hu G, Lakka TA, Pekkarinen H, Nissinen A, Tuomilehto J: Low physical activity as a predictor for total and cardiovascular disease mortality in middle–aged men and women in Finland. Eur Heart J 2004; 25: 2204–2211. [ Links ]
19. Andersen LB, Schnohr P, Schroll M, Hein HO: All–cause mortality associated with physical activity during leisure time, work, sports, and cycling to work. Arch Intern Med 2000; 160: 1621–1628. [ Links ]
20. Sánchez–Castillo CP, Velázquez–Monroy O, Berber A, Lara–Esqueda A, Tapia–Conyer R, James WP: Anthropometric cutoff points forpredicting chronic diseases in the Mexican National Health Survey 2000. Obes Res 2003; 11:442–451. [ Links ]
21. Sugiuchi H, Uji Y, Okabe H, Irie T, Uekama K, Kayahara N, et al: Direct measurement of High–Density lipoprotein cholesterol in serum with polyethylene gycol–modified enzymes and sufated a–cyclodextrin. Clin Chem 1995; 41: 717–723. [ Links ]
22. De Long D, De Long E, Wood P, Lippel K, Rifkind BM: A comparison of methods for the estimation of plasma low– and very low– density lipoprotein cholesterol. JAMA 1986; 256: 2372–2377. [ Links ]
23. Tailleux A, Torpier G, Caron B, Fruchart JC, Fievet C: Immunological properties of apo B– containing lipoprotein particles in human atherosclerotic arteries. J Lipid Res 1993; 34: 719–728. [ Links ]
24. Blanche P, Gong E, Forte T, Nichols AV: Characterization of human high–density lipoproteins by gradient gel electrophoresis. Biochim Biophys Acta 1981; 665: 408–419. [ Links ]
25. Perusse M, Pascot A, Despres JP, Couillard C, Lamarche B: A new method for HDLparticle sizing by polyacrylamide gradient gel electrophoresis using whole plasma. J Lipid Res 2001; 42: 1331–1334. [ Links ]
26. Laemmli U: Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970; 227: 680–685. [ Links ]
27. Krauss RM, Burke DJ. Identification of multiple subclasses of plasma low density lipoproteins in normal humans. J Lipid Res 1982; 23: 97–104. [ Links ]
28. Esterbauer H, Striegl G, Puhl H, Rotheneder M: Continuous monitoring of in vitro oxidation of human low density lipoprotein. Free Radic Res Commun 1989; 6: 67–75. [ Links ]
29. Godsland IF, Crook D, Walton C, Wynn V, Oliver MF: Influence of insulin resistance, secretion, and clearance on serum cholesterol, triglycerides, lipoprotein cholesterol, and blood pressure in healthy men. Arterioscler Thromb 1992;12: 1030–1035. [ Links ]
30. Garvey WT, Kwon S, Zheng D, Shaughnessy S, Wallace P, Hutto A, et al: Effects of insulin resistance and type 2 diabetes on lipoprotein subclass particle size and concentration determined by nuclear magnetic resonance. Diabetes 2003;52: 453–462. [ Links ]
31. Puchois P, Kandoussi A, Fievet P, Fourrier JL, Bertrand M, Koren E, et al: Apolipoprotein A–I containing lipoproteins in coronary artery disease. Atherosclerosis 1987; 68: 35–40. [ Links ]
32. Stampfer MJ, Sacks FM, Salvini S, Willett WC, Hennekens CH: A prospective study of cholesterol, apolipoproteins, and the risk of myocardial infarction. N Engl J Med 1991; 325: 373–381. [ Links ]
33. Asztalos BF, Roheim PS, Milani RL, Lefevre M, McNamara JR, Horvath KV, et al: Distribution of ApoA–I–containing HDL subpopulations inpatients with coronary heart disease. Arterioscler Thromb Vasc Biol 2000; 20: 2670–2676. [ Links ]
34. Asztalos BF, Cupples LA, Demissie S, Horvath KV, Cox CE, Batista MC, et al: High–Density Lipoprotein Subpopulation Profile and Coronary Heart Disease Prevalence in Male Participants of the Framingham Offspring Study. Arterioscler Thromb Vasc Biol 2004; 24: 2181–2187. [ Links ]
35. Franceschini G, Sirtori M, Vaccarino V, Gianfranceschi G, Chiesa G, Sirtori CR: Plasma lipoprotein changes after treatment with pravastatin and gemfibrozil in patients with familial hipercolesterolemia. J Lab Clin Med 1989; 114: 250–259. [ Links ]
36. Homma Y, Ozawa H, Kobayashi T, Yamaguchi H, Sakane H, Nakamura H: Effects of simvastatin on plasma lipoprotein subfractions, cholesterol esterification rate, and cholesteryl ester transfer protein in type II hyperlipoproteinemia. Atherosclerosis 1995; 114: 223–234. [ Links ]
37. Asztalos BF, MCTaggarr F, Horvath KV, Lemaulf F, Dallal GE, Schaefer EJ: Effect of maximal statin therapy on the high density lipoprotein (HDL) subpopulation profiles of hypercholesterolemic subjects. (Abstract). Atherosclerosis supplements 2006; 7: 580. [ Links ]
38. Assmann G, Nofer JR: Atheroprotective effects of high–density lipoproteins. Annu Rev Med 2003; 54: 321–341. [ Links ]
39. Xia P, Vadas MA, Rye KA, Barter PJ, Gamble JR: High density lipoproteins (HDL) interrupt the sphingosine kinase signaling pathway. A possible mechanism for protection against atherosclerosis by HDL. J Biol Chem 1999; 274: 33143–33147. [ Links ]
40. Barter PJ, Baker PW, Rye KA: Effect of high–density lipoproteins on the expression of adhesion molecules in endothelial cells. Curr Opin Lipidol 2002; 13: 285–288. [ Links ]
41. Ashby DT, Rye KA, Clay MA, Vadas MA, Gamble JR, Barter PJ: Factors influencing the ability of HDL to inhibit expression of vascular cell adhesion molecule–1 in endothelial cells. Arterioscler Thromb Vasc Biol 1998; 18: 1450–1455. [ Links ]
42. Lamarche B, Tchernof A, Moorjani S, Cantin B, Dagenais GR, Lupien PJ, et al: Small, dense low–density lipoprotein particles as a predictor of the risk of ischemic heart disease in men. Prospective results from the Québec Cardiovascular Study. Circulation 1997; 95: 69–75. [ Links ]
43. Stampfer MJ, Krauss RM, Ma J, Blanche PJ, Holl LG, Sacks FM, et al: A prospective study of triglyceride level, low–density lipoprotein particle diameter, and risk of myocardial infarction. JAMA 1996; 276: 882–888. [ Links ]
44. Dejager S, Bruckert E, Chapman MJ: Dense low density lipoprotein subspecies with diminished oxidative resistance predominate in combined hyperlipidemia. J Lipid Res 1993; 34: 295–308. [ Links ]
45. Witztum JL, Steinberg D: Role of oxidized low density lipoprotein in atherogenesis. J Clin invest 1991; 88: 1785–1792. [ Links ]
46. Salonen R, Nyssonen K, Porkkala–Sarataho E, Salonen JT: The Kuopio Atherosclerosis Prevention Study (KAPS): effect of pravastatin treatment on lipids, oxidation resistance of lipoproteins, and atherosclerotic progression. Am J Cardiol 1995; 76: 34C–39C. [ Links ]
47. Asztalos BF, Batista M, Horvath KV, Cox CE, Dallal GE, Morse JS, et al: Change in alphal HDL concentration predicts progression in coronary artery stenosis. Arterioscler Thromb Vasc Biol 2003; 23: 847–852. [ Links ]
** Este trabajo recibió el premio "Ignacio Chávez" de Investigación Clínica en el XXV Congreso Nacional de Cardiología, Veracruz, noviembre de 2007.














