Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.77 no.4 Ciudad de México oct./dic. 2007
Imagen en cardiología
Síndrome de ventrículo izquierdo hipoplásico. Reporte de una enferma en edad adulta
Hypoplastic left ventricle syndrome. Report of a case in an adult woman
Irma Miranda Chávez,* Nilda Espínola Zavaleta,** Luis Muñoz Castellanos,*** Alfredo de Micheli,**** Alfonso Buendía Hernández,***** y Carlos Zamora González******
* Médico Adjunto al Servicio de Cardiología Pediátrica INCICH.
** Ecocardiografía en Consulta Externa INCICH.
*** Jefe del Depto. de Embriología INCICH.
**** Investigador del INCICH.
***** Jefe del Servicio de Cardiología Pediátrica INCICH.
****** Consulta de Cardiopatías Congénitas en Adultos INCICH.
Correspondencia:
Dra. Irma Miranda Chávez.
Servicio de Cardiología Pediátrica.
Instituto Nacional de Cardiología Ignacio Chávez
(INCICH Juan Badiano Núm. 1, Sección XVI,
Tlalpan 14080, México D.F.).
Teléfono: 55732911 extensión 1193.
Fax: 55730994.
Correo electrónico: imirch@yahoo.com.mx
Recibido: 12 de abril de 2007.
Aceptado: 25 de mayo de 2007.
Resumen
Los pacientes con síndrome de ventrículo izquierdo hipoplásico, sin tratamiento quirúrgico, mueren durante el primer año de vida. En la literatura hay sólo un reporte de una paciente, de nuestra misma institución, que alcanzó la segunda década de la vida. El propósito de este trabajo es presentar el caso de una joven de 24 años con síndrome de ventrículo izquierdo hipoplásico, la que sin tratamiento quirúrgico ha llegado a la edad adulta y cuya sobrevida probablemente se deba a la presencia de un conducto arterioso, una comunicación interatrial e hipertensión arterial pulmonar secundaria.
Palabras clave: Síndrome de ventrículo izquierdo hipoplásico. Paciente adulta. Ecocardiograma.
Abstract
Patients with hypoplastic left heart syndrome without surgery dye during the first year of life. In the literature there is only one report from our institution of a patient who survived to the second decade of life without surgery. The purpose of this work is to describe a case of a 24 years old female with hypoplastic left heart syndrome, who has survived until now in functional class I of New York Heart Association without surgery. In our patient, the survival is probably related with the presence of a ductus arteriosus, an interatrial septal defect and the secondary pulmonary arterial hypertension.
Key words: Hypoplastic left heart syndrome. Adult patient. Echocardiography.
Introducción
El síndrome de ventrículo izquierdo hipoplásico es un término que ha sido utilizado para describir un grupo heterogéneo de malformaciones cardíacas, que consisten en grados variables de falta de desarrollo del complejo corazón izquierdo–aorta. Esto produce una obstrucción significativa del flujo sanguíneo e inhabilidad del corazón izquierdo para manejar la circulación sistémica. El 25% de los pacientes muere en la primera semana de vida y es poco habitual que sobrevivan después del mes de edad.1 Sólo se reportó en la literatura el caso de una paciente que llegó a la edad adulta sin tratamiento quirúrgico.2 El propósito de este trabajo es presentar el caso de una joven de 24 años, con síndrome de ventrículo izquierdo hipoplásico, que ha sobrevivido a la historia natural de la cardiopatía.
Descripción del caso
Se trata de una paciente de 24 años, originaria y procedente de Pachuca. Primer producto de madre de 17 años, que cursó con embarazo de término sin complicaciones. Lloró y respiró al nacer y el peso al nacimiento fue de 2,600 g. Desde el punto de vista cardiovascular, presentó fatiga con la alimentación desde el nacimiento. Se detectó soplo a los 2 meses y se envió al Instituto Nacional de Cardiología para su manejo. La exploración física inicial (18–07–83) mostró: Peso 3,550 g. FC 150x, edad aparente menor a la cronológica, ruidos cardíacos rítmicos, soplo regurgitante en mesocardio, soplo continuo infraclavicular izquierdo, pulsos amplios en las 4 extremidades, cianosis ligera. El ECG inicial informó crecimiento del atrio derecho, pocas fuerzas del ventrículo izquierdo. La radiografía de tórax inicial reveló cardiomegalia grado I, cefalización de flujo pulmonar. El cateterismo cardíaco realizado en septiembre de 1983 informó: hipoplasia del corazón izquierdo, hipoplasia marcada de la aorta ascendente, comunicación interauricular, persistencia del conducto arterioso e hipertensión arterial pulmonar con PSAP 91 mm Hg. Se consideró candidata para tratamiento quirúrgico, que no fue aceptado por los padres. Por este motivo se mantuvo vigilancia periódica a través de la consulta externa (3–4 consultas por año).
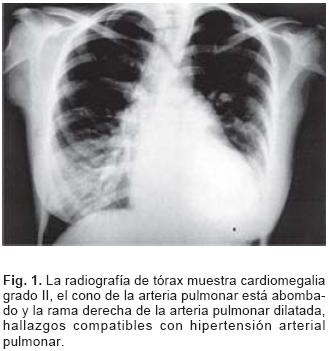
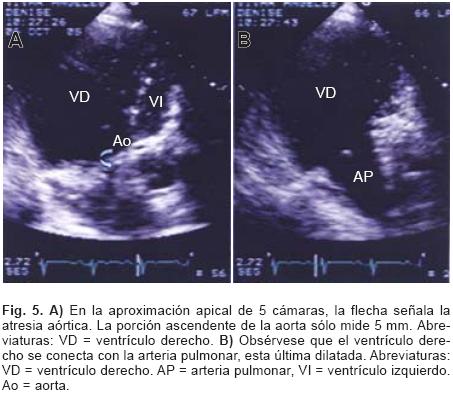
Continuó con dificultad para ganar peso durante la lactancia y las etapas preescolar y escolar. En febrero de 1993 cursó con algunos episodios de palpitaciones, el Holter (18–02–93) mostró ritmo sinusal con extrasístoles ventriculares monomórficas aisladas. Se acordó que sólo requería observación. En la exploración física más reciente no se auscultaban soplos, el componente pulmonar del segundo ruido estaba aumentado, pulsos amplios en las 4 extremidades, cianosis ligera. La radiografía de tórax actual muestra cardiomegalia grado II, el cono pulmonar abombado, la rama derecha de la arteria pulmonar dilatada (Fig. 1).El electrocardiograma actual (Fig. 2) muestra corazón semivertical dextrorrotado, crecimiento del ventrículo derecho por sobrecarga sistólica (TIDI = 80 mseg en VI) y bloqueo de rama derecha del Haz de His de grado intermedio (por efecto de la sobrecarga sistólica predomina el aumento de voltaje de la onda R sobre la duración de sus empastamientos en VI). Las morfologías correspondientes a la pared libre del ventrículo izquierdo, qRs con aumento del voltaje de la R no empastada y TIDI = 80 mseg, se registran en V4–6. En aVF la onda R es bífida, con un primer pico a los 45 mseg y un segundo pico a los 80 mseg. Esto podría hacer pensar en la coexistencia de un bloqueo de la subdivisión posterior izquierda (BSPI) pero no hay empastamiento en el vértice de la onda R. El desnivel positivo del segmento RS–T en aVR representa la imagen en espejo del desnivel negativo de dicho segmento en V5 y V6. QTc = VM + 50 mseg en V6. El ecocardiograma (16 de enero de 2007) reportó situs solitus atrial y levocardia. La aorta hipoplásica con diámetro de 5 mm, el atrio izquierdo de 21 mm, el diámetro diastólico del ventrículo izquierdo de 18 mm, el grosor de la pared libre de dicho ventrículo de 8 mm, el grosor de la pared libre del ventrículo derecho de 12.5 mm y el diámetro del anillo pulmonar de 25 mm con ramas pulmonares de 11 mm, respectivamente. Los retornos venosos sistémico y pulmonar fueron normales. Se observó atresia mitral, atresia aórtica, hipoplasia de la aorta ascendente, comunicación interauricular de 10 mm con cortocircuito de derecha a izquierda, comunicación interventricular de 26 mm con cortocircuito bidireccional, conducto arterioso permeable de 6 mm con cortocircuito de derecha a izquierda (Figs. 3, 4 y 5), insuficiencia tricuspídea ligera e hipertensión arterial pulmonar severa con presión sistólica de arteria pulmonar de 113 mm Hg. El Holter realizado el 5 de enero del 2006 mostraba ritmo sinusal, extrasístoles auriculares aisladas y bloqueo de rama derecha del Haz de His. Actualmente tiene 24 años, realiza actividades propias de un adulto joven, estudia psicología y ocasionalmente presenta episodios de palpitaciones de inicio y fin súbito.



Discusión
El síndrome de ventrículo izquierdo hipoplásico incluye un grupo heterogéneo de malformaciones cardíacas, que consisten en grados variables de desarrollo deficiente del complejo corazón izquierdo–aorta.1 El primer relato de atresia aórtica fue hecho por Canton en 1850. Bockman en 1950 señaló que el 50% de los casos de atresia mitral coexistían con atresia aórtica En 1952 Lev informó que un grupo de malformaciones del corazón izquierdo se asociaban a pobre desarrollo de las cavidades izquierdas y de la aorta ascendente. En 1958 Noonan y Nadas introdujeron el término de Síndrome de ventrículo izquierdo hipoplásico. Robert en 1976 sugirió que, cuando un defecto interventricular estaba presente, permitía el desarrollo del ventrículo izquierdo. Muchos neonatos mueren durante la primera o segunda semanas después del nacimiento. El 40% sobrevive después de la etapa neonatal y son pocos los que alcanzan los 6 meses de vida. El tratamiento quirúrgico fue iniciado por Cayler en 1950.3 Varios reportes de tratamiento quirúrgico fueron publicados en los siguientes 13 años; sin embargo, no hubo sobrevivientes. En 1983 Norwood realizó un tratamiento paliativo que sería el paso previo a la cirugía de Fontan.4 El trasplante para esta entidad data de 1985;3 sin embargo, no es una realidad viable para muchos centros cardiológicos. En el año 2000, debido a la heterogeneidad de la entidad, se hizo una base de datos para establecer la nomenclatura del síndrome de ventrículo izquierdo hipoplásico. Se acordó incluir los casos con atresia o estenosis mitral; atresia o estenosis aórtica, la combinación de ellas, hipoplasia de la aorta ascendente, del arco aórtico con o sin coartación aórtica y las respectivas lesiones de las que dependen, como comunicación interatrial o foramen oval y conducto arterioso. Los casos de estenosis mitral con doble salida del ventrículo derecho y comunicación interventricular también se incluyen en este grupo de cardiopatías.1
Hemos comentado previamente que los pacientes sin tratamiento quirúrgico mueren durante el primer año de edad y solamente encontramos el reporte de una paciente de nuestra misma institución que alcanzó la segunda década de la vida.2 En el caso que nos ocupa, la sobrevida de la enferma se debe a que, por medio de la comunicación interatrial, el retorno venoso pulmonar se vacía en el corazón derecho de donde, a través de la arteria pulmonar, alcanza primero la circulación pulmonar y por el conducto arterioso la circulación sistémica. En este caso, donde las lesiones principales son atresia mitral y aórtica, es discutible si la comunicación interventricular tiene algún significado, ya que permite el flujo a través de ambos ventrículos; sin embargo, las porciones de entrada y de salida del ventrículo izquierdo están presentes, pero de modo imperforado. La cavidad del ventrículo izquierdo está reducida a pesar de la existencia de una comunicación interventricular, por lo que la pared libre de este ventrículo se considera hipertrófica en base a los valores obtenidos en su medición. Estos hallazgos son compatibles con un espécimen correspondiente de esta patología, en el que el grosor de la pared libre del ventrículo izquierdo fue de 7 mm, lo cual contrastó con una cámara de tamaño reducido. La hipertensión pulmonar que ha permitido mantener la circulación sistémica a través del conducto puede ser la explicación de la sobrevida de nuestra enferma (Fig. 6). Existen lineamientos para el manejo de los pacientes con esta cardiopatía, que llegan a la edad adulta con y sin tratamiento quirúrgico pero, como es muy raro que los portadores de síndrome de ventrículo izquierdo hipoplásico sobrevivan sin tratamientos, no se ha establecido qué hacer con ellos.5

En una revisión realizada por el grupo de Toronto en el año 2006, se informó que los mecanismos de muerte para los pacientes adultos con cardiopatía congénita fueron: súbita en el 26%, insuficiencia cardíaca en el 21% y otras causas como endocarditis bacteriana, hemoptisis, cirrosis cardíaca e infarto, en menor proporción. En este grupo, las cardiopatías complejas fueron Tetralogía de Fallot, transposición de las grandes arterias, defecto de la tabicación atrioventricular, corazones univentriculares (algunos de ellos tratados quirúrgicamente y otros no tratados), aunque no se describen pacientes con síndrome de ventrículo izquierdo hipoplásico. En el mismo estudio, se observó que el promedio de vida para los pacientes con Síndrome de Eisenmenger fue 37 ± 12 años y la muerte fue súbita, por insuficiencia cardíaca y por otras causas.6 Continuaremos vigilando la historia natural del padecimiento, el comportamiento de la hipertensión arterial pulmonar secundaria y el impacto que las enfermedades crónico–degenerativas produzcan en su momento en esta paciente.
Conclusiones
El síndrome de ventrículo izquierdo hipoplásico comprende un grupo heterogéneo de malformaciones congénitas, que consisten en grados variables de falta de desarrollo del complejo corazón izquierdo–aorta. Sin tratamiento quirúrgico, pocos pacientes llegan a los 6 meses y son muy raros los enfermos que llegan a la edad adulta, como es el caso que nos ocupa. La sobrevida de nuestra paciente pudiera explicarse por la hipertensión pulmonar, la cual ha permitido mantener la circulación sistémica a través del conducto arterioso.
Referencias
1. Tchervenkov CI, Jacobs ML, Tahta SA: Congenital Heart Surgery Nomenclature and Database Project: Hypoplastic Left Heart Syndrome. Ann Thorac Surg 2000; 69: S 170–9. [ Links ]
2. Vargas Barrón J, Rijlaarsdam M, Romero Cárdenas A, Villegas M: Hypoplastic left heart syndrome: Report of a case of spontaneous survival to adulthood. Am Heart J 1992; 123: 1713–1719. [ Links ]
3. Kirklin B, Kouchoukos N, Blackstone E, Doty D, Hanley F, Karp R: Cardiac Surgery. Morphology, diagnosis criteria, natural history, techniques, results and indications. Aortic atresia and other forms of hypoplastic left heart physiology. 3° Ed. Philadelphia USA. Elsevier, 2003,1377–1400. [ Links ]
4. Norwood WI, Lang P, Hansen DD: Physiologic repair of aortic atresia–hypoplastic left heart syndrome. N Engl J Med 1983; 308(1): 23–26. [ Links ]
5. Deanfield J, Thaulow E, Warnes C, Webb G, Kolbel F, Hoffman A, et al: Management of grown up congenital heart disease. Eur Heart J 2003; 24: 1035–1084. [ Links ]
6. Oechslin EN, Harrison DA, Connelly MS, Webb GD, Siu SC: Mode of death in adults with congenital heartdisease. Am J Cardiol 2000; 86: 1111–1116. [ Links ]














