Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.77 no.4 Ciudad de México oct./dic. 2007
Investigación clínica
Detección de inflamación en placa aterosclerosa: rol de la tomografía por emisión de positrones y de la proteína C reactiva
Detection of inflammation in an atherosclerose plaque: the role of the positron emission tomography and C reactive protein
Erick Alexánderson,*,*** Raúl G Mendoza,* Gloria Adame,* José Antonio Talayero,* Carlos Sierra,* Patricio Cruz,* Leonardo García–Rojas,* Mónica Rodríguez–Valero,* Armando Flores,* Adolfo Zarate,* Aloha Meave,*,*** y Antonio Arauz**
* Unidad PET/CT–Ciclotrón, Facultad de Medicina UNAM.
** Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez.
*** Instituto Nacional de Cardiología Ignacio Chávez.
Correspondencia:
Dr. Erick Alexánderson Rosas.
Unidad PET/CT–Ciclotrón,
Facultad de Medicina,
Universidad Nacional Autónoma de México.
Ciudad Universitaria, DF, México 04510.
Correo electrónico: alexanderick@yahoo.com
Recibido: 20 de abril de 2007.
Aceptado: 30 de agosto de 2007.
Resumen
Objetivos: Demostrar que la inflamación de las placas ateromatosas carotídeas puede visualizarse mediante la tomografía por emisión de positrones con 18F–flúor–2–deoxi–D–glucosa (18FDG) en pacientes sintomáticos y correlacionarlos con marcadores de inflamación sistémica.
Material y métodos: Se estudiaron 15 pacientes con isquemia cerebral por enfermedad carotídea aterosclerosa. En ellos se valoró la captación del 18FDG con PET y se determinaron los niveles de proteína C reactiva de alta sensibilidad (PCRAs).
Resultados: La edad promedio de los pacientes estudiados fue de 66 años; 11 fueron masculinos (73%) y 4 femeninos (27%). El 18FDG PET fue positivo en 12 pacientes (80%), mientras que se obtuvo en el 100% PCRAs de bajo riesgo y cuenta leucocitaria normal.
Conclusiones: El PET–18FDG demuestra actividad inflamatoria activa en placas ateromatosas. Se encontró que no existe correlación entre la presencia de placas ateromatosas carotídeas, niveles de PCRAs y estudio de 18FDGPET.
Palabras clave: Tomografia por emisión de positrones (PET). Placa ateromatosa carotídea. Proteína C reactiva de alta sensibilidad.
Abstract
Objectives: To demonstrate that inflammatory atheromatose carotid plaques can be visualized with positron emission tomography with 18F–fluorodeoxyglucose (18FDG PET) in symptomatic patients, in order to correlate them with systemic inflammatory markers, such as CRP.
Method: Fifteen patients with cerebral ischemia due to atherosclerotic carotid disease were studied. 18FDG uptake with PET was considered and blood samples were taken for determining high sensibility C reactive protein (HsCRP).
Results: The mean age of the patients was 66 years; 11 of them were males (73%) and 4 were females (27%). 18FDG PET was positive in 12 patients (80%), while 100% of the studied population had low risk HsCRP with normal white cell count.
Conclusions: 18FDG PET proves active inflammation in carotid atheromatose plaques. There was no significant correlation between the presence of ahteromatose carotid plaques, HsCRP serum levels, and 18FDG PET study.
Key words: Positron emission tomography (PET). Atheromatose carotid plaque. High sensibility C reactive protein.
Introducción
La inflamación es un elemento importante en la patogénesis y evolución final de la aterosclerosis, que actualmente es considerada como una enfermedad inflamatoria.1 Las lesiones de la aterosclerosis representan una serie de cambios moleculares y celulares específicos que pueden ser mejor descritos como agregación e inflamación. Dichas lesiones presentes a lo largo de la vida del individuo, ocurren principalmente en las arterias de mediano y gran calibre.
Recientemente, estudios han demostrado que el proceso inicia con una disfunción del endotelio por diversas causas, tales como: elevación de lipoproteínas de baja densidad (LDL), radicales libres, tabaquismo, hipertensión arterial, diabetes mellitus, alteraciones genéticas, elevación de homocisteína en plasma, infecciones por herpes virus o Chlamydiapneumoniae, entre otros. Posteriormente, el reclutamiento de células inflamatorias, los cambios moleculares y estructurales a nivel de la célula endotelial más la acción trombótica de las plaquetas dan pie a la formación de lesiones aterosclerosas. Ante una respuesta inflamatoria constante e indefinida, se promueve la migración y proliferación de células del músculo liso, que se mezclan en el área de inflamación para crear una lesión intermedia. De continuar dicha respuesta, se adelgaza la pared de la arteria, lo cual se compensa mediante la dilatación gradual de la misma, fenómeno conocido como remodelación. Los ciclos de acumulo de células inflamatorias, proliferación de células musculares y la formación de tejido fibroso, conllevan a la elongación y reestructuración de la lesión la cual se cubre de una capa fibrosa con un centro de lípidos y tejido necrótico (lesión complicada). En algún momento la arteria ya no compensa la dilatación, la lesión obstruye el lumen y por lo tanto, altera el flujo sanguíneo. Los lípidos y las lipoproteínas causan daño endotelial y al músculo liso; la LDL sufre una oxidación progresiva, se internaliza mediante los macrófagos formando células espumosas.
Con un contenido elevado de células inflamatorias y macrófagos, las placas aterosclerosas (inestables) tienen un alto riesgo de ruptura, mientras que aquéllas con un menor número de células inflamatorias presentarán un menor riesgo.1 Las lesiones estables generalmente tienen cubiertas fibrosas, densas y uniformes. Las lesiones potencialmente peligrosas por lo general, no son oclusivas y por lo tanto, son difíciles de diagnosticar incluso mediante angiografía. A pesar de esto, en la autopsia la inflamación activa es evidente por el acumulo de macrófagos en los sitios de ruptura de la placa.
El conocimiento de los procesos fisiopatológicos provee potenciales blancos de medición como medios de identificación y monitoreo del proceso inflamatorio en curso. Estos incluyen factores de riesgo proinflamatorios tales como oxidación de LDL, citocinas proinflamatorias, adhesión de moléculas, productos de la estimulación hepática como el amiloide tipo A, proteína C reactiva y otros reactantes de fase aguda. El reconocimiento del componente inflamatorio en la aterogénesis provee la potencial utilización de dichos marcadores como indicadores de aterogénesis o predictores de complicaciones aterosclerosas.2,3
Entre los distintos marcadores, la evidencia actual apoya el uso de la proteína C reactiva de alta sensibilidad (PCRAs) como el reactivo de elección. Para disminuir la variabilidad intrínseca se debe realizar la prueba en pacientes metabólicamente estables, es decir, sin evidencia obvia de inflamación o infección. Los puntos de corte de bajo riesgo (< 1.0 mg/L), riesgo intermedio (1.0–3.0 mg/L) y alto riesgo (> 3.0 mg/ L) corresponden a los rangos de la PCRAs en la población adulta.4 Este marcador ha sido ampliamente utilizado en pacientes con riesgo coronario, donde se sabe que niveles elevados de dicha proteína están asociados con un mayor riesgo de problemas cardíacos en el futuro, lo que sugiere un valor pronóstico de la medición de la PCRAs. Hay pocos reportes en pacientes con eventos cerebrales vasculares (EVC), sin embargo la fisiopatología de la inflamación aterosclerosa es similar, por lo que se puede transpolar para su uso.5
Actualmente, el estándar de oro para diagnosticar obstrucción coronaria es la angiografía, la cual provee una alta resolución y definición del sitio y severidad de la estenosis, pero no así de la actividad inflamatoria de la placa.3 Existe la necesidad de cuantificar la inflamación para predecir el riesgo de ruptura de la placa y monitorizar los efectos de los tratamientos modificadores de la misma.1 Esto es importante debido a que hay estudios que sugieren que las estatinas promueven la estabilidad de la misma, mediante la reducción del contenido de macrófagos, sin una reducción significativa en el tamaño ni apariencia angiográfica. La visualizacion de una placa inflamada puede ayudar a identificar a pacientes de alto riesgo de desarrollar un evento isquémico agudo.
La 18FDG es un radiotrazador análogo de la glucosa el cual es captado por las células en relación a su actividad metabólica. Existen algunas publicaciones que han utilizado este marcador en estudios de tomografía por emisión de positrones (PET) para demostrar el grado de inflamación de las placas aterosclerosas en enfermedad carotídea.6,7 Se han reportado artículos donde se encontró una asociación significativa entre el síndrome metabólico y la inflamación vascular evaluada por 18FDG PET en pacientes que fueron sometidos a un estudio PET oncológico.8
Se propuso demostrar que la inflamación de las placas ateromatosas carotídeas pueda visualizarse mediante 18FDG PET en pacientes sintomáticos y establecer una correlación entre la placa carotídea sintomática y los marcadores de inflamación sistémica. Por lo anterior, se espera encontrar en este estudio que las placas carotídeas aterosclerosas sintomáticas tendrán captación con 18FDG mediante el estudio PET asociado a un incremento en las concentraciones séricas de PCPvAs.
Material y métodos
Se realizó un estudio prospectivo, observacional y comparativo de 15 pacientes, enviados de la clínica de Enfermedad Vascular Cerebral del Instituto Nacional de Neurología y Neurocirugía "Manuel Velasco Suárez" con diagnóstico de isquemia cerebral por enfermedad carotídea aterosclerosa. Se consideraron a pacientes con síntomas carotídeos de ataque isquémico transitorio o EVC isquémico con placa de origen ateromatoso, la cual fue corroborada mediante ultrasonido Doppler de los vasos del cuello, angiografía carotídea y angiotomografía computada para definir el grado de estenosis. Aquellos pacientes en quienes se sospechara o tuvieran datos clínicos de infección sistémica de cualquier localizacion se excluyeron del estudio. Se cuantificó en todos los pacientes PCPvA y leucocitos.
Se realizó un estudio PET en donde se administraron 555 MBq (15 mCi) de 18FDG endovenoso. Las imágenes fueron adquiridas en un equipo Siemens ECAT EXACT HR+, obteniendo imágenes de transmisión y emisión. Se obtuvieron imágenes en 2D a los 90 minutos de la administración de 18FDG, tiempo necesario para proveer un óptimo contraste entre la concentración de 18FDG en la placa y la región principal en segundo plano, es decir la sangre. Se utilizó un collarín para minimizar el movimiento del paciente y evitar así la captación del radiotrazador por músculos cervicales. Las imágenes fueron reconstruidas utilizando un algoritmo de retroproyección aplicando correcciones por atenuación, tiempo muerto, dispersión y coincidencias del azar.
Resultados
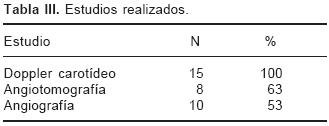
Se estudiaron un total de 15 pacientes; el promedio de edad fue de 66.1 (± 9.7) años, de los cuales 11 (73%) fueron masculinos. Los principales factores de riesgo fueron hipertensión arterial sistémica en 10 (66.6%), tabaquismo en 9 (60%), Diabetes Mellitus tipo 2 en 3 (20%) y dislipidemia en 11 (73%) (Tablas I y II). El diagnóstico de estenosis carotídea fue establecido por diferentes técnicas diagnósticas. Todos tuvieron un Doppler de vasos del cuello donde se estableció el sitio de la de estenosis carotídea, que se confirmó mediante tomografía computada o angiografía carotídea en el 63% y 53% de los casos respectivamente (Tabla III). Los resultados del PET se muestran en la Tabla IV. En 12 (80%) de los pacientes el estudio de PET fue positivo para la captación de 18FDG y en 5 (33.3%) de ellos la captación en el estudio fue de forma bilateral. De los 12 pacientes positivos a la captación de 18FDG, 6 (50%) pacientes coincidió el lado afectado con los hallazgos del US, TC o angiografía. En 5 (42%) de los pacientes la captación fue bilateral a pesar de que presentaban afección unilateral en los estudios previos. Un paciente (8%) presentó captación aumentada en la carótida derecha a diferencia de sus estudios anteriores que mostraron afección bilateral.

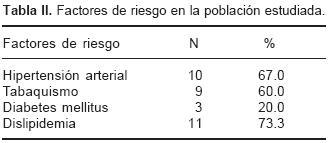

En la Figura 1 se muestran imágenes de PET con captación de 18FDG en carótidas, la Figura 2 ejemplifica un paciente sin captación de 18FDG, a nivel vascular. La Figura 3 muestra un paciente que presentó capitación aumentada a nivel carotídeo que se logra observar en un corte transversal y uno sagital. En todos los pacientes se obtuvieron PCRAs por debajo de 1 mg/dL, equivalente a bajo riesgo.

En ningún paciente se encontraron cuentas leucocitarias elevadas.
Cinco (33.3%) pacientes fueron sometidos a tratamiento con colocación de STENT de los cuales uno falleció por muerte vascular a los 3 días del procedimiento y en otro se documentó reestenosis en la angiografía de control.
Discusión
La inflamación tiene un papel muy especial en la patogénesis y en el desenlace de la ateroesclerosis. Las placas ateromatosas que contienen células inflamatorias, en particular macrófagos, presentan un alto riesgo de ruptura; mientras que las que poseen pocas células inflamatorias, tienen a la vez menor riesgo de ruptura.3 Actualmente existen diversos métodos para la detección de la placa ateromatosa, la angiografía es un estudio invasivo cuya indicación es la presentación de sintomatología; el ultrasonido Doppler es un estudio no invasivo, pero tiene la desventaja de ser operador–dependiente; la tomografía computada es otro estudio que ha resultado ser útil para la identificación de enfermedad aterosclerosa, sin embargo, ninguno de ellos muestra claramente si una placa está inflamada y por tanto, en riego de condicionar un síndrome isquémico.
El estudio con PET, utilizando 18FDG ha demostrado ser muy útil en la detección de actividad metabólica incrementada, por ejemplo, en la célula neoplásica, así como en tejidos inflamados.9
Actualmente con la presencia de equipos híbridos, PET/CT, se puede realizar la fusión de imágenes que permiten identificar con mayor facilidad la presencia de placas (a través de la tomografía computada) y valorar si tienen actividad metabólica incrementada mediante PET. Basado en esta premisa, se piensa que el 18FDG puede ser utilizado para la identificación de inflamación aguda en placas ateromatosas en la pared vascular. Nuestro grupo tiene experiencia en la detección de inflamación aguda en aorta en pacientes con enfermedad de Takayasu.14 El presente estudio demuestra que en enfermedad carotídea obstructiva condicionada por placas aterosclerosas, la 18FDG puede identificar la presencia de inflamación aguda diagnosticando así pacientes en riesgo. De hecho, en varios pacientes se observó captación bilateral mientras que el USG, la angiografía y la tomografía computada mostraron únicamente afección unilateral, por lo tanto el PET es sumamente sensible para detectar actividad en carótidas en comparación con otros métodos.
En estudios previos se ha demostrado que la 18FDG se acumula en mayor grado en áreas ricas en macrófagos, como las placas vulnerables.3,8 Esto conlleva a que el uso de 18FDG PET puede ser extremadamente útil para predecir la ruptura de una placa en el futuro y poder ofrecer así, un tratamiento oportuno.
Esta captación puede ser atribuida a los cambios activos de infiltración del endotelio por diversas células durante el proceso de ateroesclerosis. No se realizó un análisis histológico de las placas; sin embargo, existen otros estudios en donde se han comparado dichas lesiones existiendo así una correlación significativa entre el resultado histológico y la captación del radiofármaco.9,11 La identificación de placas sintomáticas mediante estudios no invasivos es un gran avance en la imagen vascular.9,12
El mayor beneficio que proporciona el estudio con PET es el hecho de establecer un análisis semicuantitativo de las lesiones3,13 para así correlacionar la actividad inflamatoria con el grado de captación del trazador en la placa. Se sugiere continuar con esta línea de investigación, buscando una relación más precisa en vasos metabólicamente activos, como en vasos cerebrales y coronarias, y por lo tanto, poder ofrecer un valor pronóstico para tales enfermedades.
La proteína C reactiva se ha asociado con aterosclerosis y trombosis.15 La PCR presenta actividad anticoagulante, antiinflamatoria y citoprotectora, por lo que es probable que participe en enfermedades crónico degenerativas relacionadas con radicales libres, incluyendo diabetes mellitus y aterosclerosis.16
En todos los pacientes se cuantificó PCRAs por debajo de 1 mg/dL, equivalente a bajo riesgo. Tahara N et al reportaron una relación significativa, entre la PCRA y la cuantificación de la captación de 18FDG en carótidas en pacientes con síndrome metabólico, lo que llama la atención es que dentro de la población estudiada los pacientes sometidos a un estudio PET, eran de carácter oncológico, sin especificar el resultado, siendo esto un factor confusor.8 En ningún paciente se encontró leucocitosis; en otras patologías, particularmente en estudios sobre isquemia miocárdica, se ha documentado una correlación importante de elevaciones de la misma con mayor aterosclerosis.2 En ningún caso se ha documentado recurrencia del infarto cerebral, sin embargo un seguimiento mayor será necesario.
Cuando se comparan los resultados del 18FDG PET con la PCRAs, esta última fue muy inespecífica y de poco valor para reconocer pacientes con placas carotídeas inflamadas o activas. En nuestro estudio fue importante identificar a la placa ateromatosa carotídea metabólicamente activa, porque puede representar un riesgo importante para la presentación de EVC, por lo que la detección oportuna es una oportunidad para iniciar un tratamiento antes de que se presente déficit neurológico. Desde el punto de vista teórico, tal premisa puede ser también aplicada a las arterias coronarias, aunque el tamaño menor de ellas, en relación a las carótidas, así como la captación de 18FDG por el miocardio pueden hacer más difícil su reconocimiento.
Conclusiones
1. El 18FDG PET demuestra actividad inflamatoria activa en placas ateromatosas carotídeas.
2. La identificación de dichas placas en pacientes sintomáticos y con mayor riesgo para EVC es fundamental para categorizar a los pacientes como candidatos a distintos tratamientos.
3. No existe correlación entre la presencia de placas ateromatosas carotídeas activas demostradas mediante 18FDG PET y niveles de PCRAs.
Referencias
1. Ross R: Atherosclerosis: an inflammatory disease. N Engl J Med 1999; 340: 115–26. [ Links ]
2. Pearson T, Mensah G, Alexander W: Markes of inflammation and Cardiovascular Disease. Circulation 2003; 28: 499–510. [ Links ]
3. Rudd J, Warburton E, Fryer T, et al: Imaging Atherosclerotic Plaque Inflammation with [18F]–fluorodeoxyglucose Positron Emission Tomography. Circulation 2002; 11:2708–11. [ Links ]
4. Adams HP Jr, Bendixen BH, Kapelle LJ, et al: Classification of subtype of acute ischemic stroke: definitions for use in a multicenter clinical trial: TOAST: trial of ORG 10172 in Acute Stroke Treatment. Stroke 1993; 24: 35–41. [ Links ]
5. Van den Mee I, De Mat M, Hak E, et al: C–Reactive Protein predicts progression of atherosclerosis measured at various sites in the arterial tree. The Rotterdam Stroke 2002; 33: 2750–55. [ Links ]
6. Lederman RJ, Raylman RR, Fisher SJ, et al: Detection of atherosclerosis using a novel positronsensitive probe and 18–fluorodeoxyglucose (FDG). Nuc Med Commun. 2001; 22: 747–53. [ Links ]
7. Davies JR, Rudd JH, Weissberg PL: Molecular and Metabolic Imaging of Atherosclerosis. J Nucl Med 2004; 45(11): 1898–1907. [ Links ]
8. Tahara N, Kai H, Yamagishi S, Mizoguchi M, Nakaura H, Ïshibashi M, et al: Vascular inflammation evaluated by 18F–fluorodeoxyglucose positron emission tomography is associated with the metabolic syndrome. J Am Coll Cardiol 2007; 49(14): 1533–39. [ Links ]
9. Ogawa M. Ishino S, Mukai T, et al: 18F–FDG accumulation in atherosclerotic plaques: immunohistochemical and PET imaging study. J Nucl Med 2004; 45(7): 1245–50. [ Links ]
10. Straus HW, Dunphy M, Tokita N: Imaging the vulnerable plaque: A Scintillating light at the end of the Tunnel. J Nucl Med 2004; 45(7): 1106–07. [ Links ]
11. Tawakol A, Migrino R, Bashian G, Bedri S, Vermylen D, Cury R, et al: In vivo 18F–Fluorodeoxyglucose Positron Emission Tomography imaging provides a non invasive measure of carotid plaque inflammation in patients. J Am Coll Cardiol, 2006; 48(9): 1818–24. [ Links ]
12. Tatsumi M, Cohade C, Nakamoto Y, Wahl RL: Fluorodeoxyglucose uptake in the aortic wall at PET/CT: possible finding for active atherosclerosis. Radiology 2003; 229(3): 831–37. [ Links ]
13. El–Haddad G, Alavi A, Mavi A: Normal variants in [18F]–fluorodeoxyglucose PET imaging. Radiol Clin N Am2004;42: 1063–81. [ Links ]
14. Alexanderson E, Soto ME, Ricalde A, Meave A, Reyes P: Inflammatory activity in Takayasu arteritis detection through positron emission tomography. Arch Cardiol Mex 2005; 75(1): 82–5. [ Links ]
15. Nan B, Yang H, Yan S, Lin PH, Lumstden AB, Yao Q, et al: C–reactive protein decreases expression of thrombomodulin and endothelial protein C receptor in human endothelial cells. Surgery 2005; 138(2): 212–22. [ Links ]
16. Yamaii K, Wang Y, Liu Y, Abeyama K, Hashiguchi T, Uchimura T, et al: Activated protein C, a natural anticoagulant protein, has antioxidant properties and inhibits lipidperoxidation and advanced glycation end products formation. Thromb Res 2005; 115(4): 319–25. [ Links ]














