Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.77 no.4 Ciudad de México oct./dic. 2007
Investigación básica
Estudio morfopatológico de la conexión anómala total de venas pulmonares
Morphopathologic study of total anomalous pulmonary venous connection
Luis Muñoz Castellanos,* Clementina Aurelia Sánchez Vargas,** y Magdalena Kuri Nivon**
* Instituto Nacional de Cardiología Ignacio Chávez.
** Escuela Superior de Medicina IPN.
Correspondencia:
Dr. Luis Muñoz Castellanos.
Departamento de Embriología.
Instituto Nacional de Cardiología Ignacio Chávez
(INCICH, Juan Badiano Núm. 1, Sección XVI,
14080, México, D.F.).
Correo electrónico: munoz–embriologia@hotmail.com
Recibido: 20 de agosto de 2007.
Aceptado: 30 de agosto de 2007.
Resumen
Se estudiaron con el sistema secuencial segmentario 106 corazones con conexión anómala total de venas pulmonares pertenecientes a la colección patológica del Instituto Nacional de Cardiología "Ignacio Chávez" para conocer sus características y la frecuencia de sus tipos. Se determinó situs atrial, conexiones de los segmentos cardíacos, morfología de las cámaras, tabique interatrial, colector venoso, sitios de conexión anómala, y malformaciones asociadas; se utilizó la clasificación de Darling modificada. El situs atrial fue solitus (73), dextroisomerismo (30), inversus (3). En el nivel supradiafragmático (83), la conexión supracardíaca (44) fue: a vena cava superior (24) y a vena vertical (20). La cardíaca (39) fue: a seno venoso coronario (22) y al atrio derecho (17). En el infradiafragmático (10) fue a vena porta. El grupo mixto (13) tuvo diferentes combinaciones. 100 presentaron comunicación interatrial y 6 foramen oval permeable. Los corazones con dextroisomerismo mostraron múltiples malformaciones; 14 especímenes tuvieron obstrucción del colector venoso. Tres aspectos importantes en el diagnóstico son: sitio de conexión anómala, dimensión de la comunicación interatrial y presencia de obstrucción del colector. Esta información es valiosa para comprender la fisiopatología, fundamentar el diagnóstico clínico y orientar al cirujano en la elección de la mejor estrategia quirúrgica.
Palabras clave: Conexión anómala de venas pulmonares. Cardiopatia congenita. Embriología.
Abstract
To know the morphological features and the frequency of pulmonary anomalous connection types, 106 hearts from the collection of the Instituto Nacional de Cardiología "Ignacio Chávez" were studied with the segmental sequential system. The atrial situs, connections of cardiac segments, morphology of cardiac chambers, interatrial septum, venous collector, sites of anomalous pulmonary venous connection and associated anomalies were determined. Darling's classification was used. The atrial situs was: solitus (73), dextroisomerism (30) and inversus (3). In the supradiaphragmatic level the supracardiac connection (44) was distributed into superior vena cava (24) and vertical vein (20). The cardiac level (39) was divided into venous coronary sinus (22) and to the right atrium (17). The infradiaphragmatic level was to the portal vein (10) and the mixed group (13) had different combinations. 100 hearts had atrial septal defect and 6 had patent foramen ovale. The hearts with dextroisomerism had several intracardiac malformations; 14 specimens had obstructed venous collectors. Three important aspects in diagnosis are: site of anomalous connection, size of atrial septal defect and obstruction in the venous collector; this information is valuable to understand the physiopathology, to establish the diagnosis and to help the surgeon to chose the best surgical strategy.
Key words: Anomalous pulmonary venous connection. Congenital heart disease. Embryology.
Introducción
La conexión anómala total de venas pulmonares (CATVP) es una cardiopatia congenita en la que está ausente la continuidad entre el seno venoso pulmonar (SVP) y el atrio izquierdo, por lo tanto la sangre que llega a ese seno drena al atrio derecho ya sea de manera directa o a través de sus sistemas venosos tributarios.1–16 La sangre venosa pulmonar y sistémica se mezclan en el sitio de conexión anómala y se establece un cortocircuito del atrio derecho al izquierdo a través de una comunicación interatrial de tipo orificio oval. Debido a la sobrecarga de volumen sanguíneo las cavidades derechas y la arteria pulmonar incrementan su tamaño por dilatación y se establece aumento del flujo sanguíneo pulmonar lo que a la larga desarrolla hipertensión pulmonar, proceso que incrementa la hipertrofia del ventrículo derecho.3,11–23 Esta malformación involucra a ambos pulmones y constituye el 1.5–5.0% de todas las cardiopatías congénitas;3,6,9,12,14,16–24 la incidencia es de 6.8 afectados por cada 100,000 individuos y el 68% de estos pacientes son diagnosticados en la etapa neonatal.11,25–27 Otros autores reportan edades desde los primeros días de nacidos13,17,2i,28,29 hasta los 6 años30 y es rara su presentación en adolescentes y adultos,13,27 lo que refleja los grados de severidad de esta cardiopatia congenita.
Para conocer las peculiaridades anatómicas de la CATVP es importante recurrir a la embriología del sistema venoso pulmonar ya que presta valiosa ayuda para entender con claridad la patogénesis de esta malformación.1–6,11,20 En este trabajo se presenta el análisis morfopatológico basado en una serie numerosa de especímenes con CATVP que permite conocer la frecuencia y las características de sus variantes, determinar el tipo y tamaño de la comunicación interatrial y las formas obstructivas de los colectores venosos. Este conocimiento lo requiere el clínico para comprender la fisiopatología, interpretar con precisión las imágenes diagnósticas y orientar al cirujano para planear la estrategia quirúrgica más adecuada.
Material y métodos
Se estudiaron ciento seis corazones portadores de CATVP pertenecientes a la colección patológica del Departamento de Embriología del Instituto Nacional de Cardiología "Ignacio Chávez". Cada corazón fue descrito según el sistema secuencial segmentario empleado en el diagnóstico anatómico de las cardiopatías congénitas.31,32 Se determinó situs atrial, tipos y modos de conexión atrioventricular y ventriculoarterial, sitios de la CATVP, morfología de las cámaras, válvulas cardíacas, tabique interatrial, sitios y tipos de obstrucción en los colectores venosos y se especificaron las anomalías asociadas. Para sistematizar el material anatómico se utilizó la clasificación de Darling33 y Darling modificada20 (Tabla I).

Resultados
Los ciento seis corazones estudiados representaron el 8.15% de los mil trescientos especímenes anatómicos con cardiopatia congenita de la colección patológica. Setenta y tres (68.87%) tuvieron situs sólitas, treinta (28.30%) dextroisomerismo y tres (2.8 %) situs inversas. La frecuencia de los niveles de CATVP fue mayor en el supradiafragmático seguido del grupo mixto y del infradiafragmático. Las frecuencias a vena cava superior, vena vertical y seno venoso coronario fueron similares con ligero predominio en la primera (Tabla II).
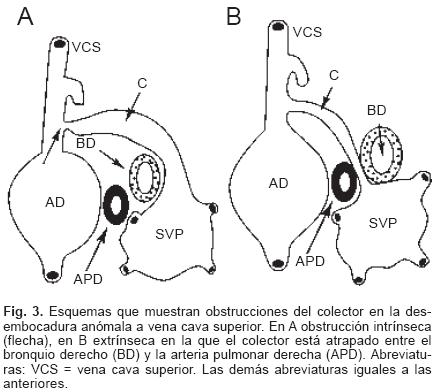
En todos los especímenes el SVP estuvo independiente, separado del atrio izquierdo y ubicado por detrás y un poco por encima de esta cámara cardíaca incompleta y pequeña (Figs. 1 y 2). El SVP se continuó con un vaso colector que siguió diferentes trayectos según el sitio de conexión anómala; en el tipo a vena cava superior el colector ascendió por detrás del bronquio derecho o del izquierdo según la posición de esa vena; en dos especímenes la obstrucción del colector fue intrínseca por estrechez del mismo en el sitio de su desembocadura (Figs. 3A y 4) y en un espécimen el colector siguió un trayecto anómalo entre la rama derecha de la arteria pulmonar y el bronquio derecho lo que provocó obstrucción extrínseca en el mismo (Fig. 3B). En el sitio de conexión anómala a la vena vertical el SVP recibió las venas de ambos pulmones y a través de un colector corto se continuó con la vena vertical ubicada del lado izquierdo, ésta a su vez lo hizo con el tronco venoso braquiocefálico izquierdo que desembocó en la vena cava superior y ésta en el atrio derecho (Fig. 5); en un espécimen existió obstrucción intrínseca en la vena vertical (Fig. 6).





En la CATVP al atrio derecho el SVP se integra en la parte posterosuperior de esta cámara a través de un colector muy corto (Fig. 7). En el sitio de conexión al seno venoso coronario el colector venoso desembocó en el extremo izquierdo de dicho seno el cual estuvo dilatado (Figs. 2 y 8). El orificio de desembocadura del seno venoso coronario en el atrio derecho fue muy amplio y se situó por debajo de la comunicación interatrial (Fig. 9). En un espécimen existió estrechez intrínseca del colector en el sitio en que se unió al seno venoso coronario. En la conexión anómala infradiafragmática el SVP recibió las venas de ambos pulmones y se continuó con un colector largo que acompañó al esófago, atravesó el hiato esofágico y descendió hasta desembocar en la vena porta justo antes de penetrar al hígado (Fig. 10). Todos los corazones de este grupo presentaron obstrucción extrínseca a nivel del hiato esofágico y en dos especímenes se agregó obstrucción intrínseca en el colector antes de su desembocadura en la vena porta (Fig. 10).
En el grupo mixto el trayecto de los colectores provenientes de cada pulmón dependió de los sitios de conexión anómala (Tabla II). Los setenta y tres corazones en situs solitus e inversas presentaron un defecto septal interatrial de tipo orificio oval (Figs. 2, 4, 7 y 9), mientras que en los treinta corazones con dextroisomerismo existió un atrio común y una bandeleta septal interatrial que separó dos grandes comunicaciones (Fig. 11). Todos los corazones presentaron dilatación de las cámaras derechas, del tronco y ramas de la arteria pulmonar así como hipertrofia del ventrículo derecho (Fig. 12). Respecto a las cámaras izquierdas el atrio fue pequeño e incompleto por carecer del SVP (Fig. 2), el ventrículo izquierdo y la válvula mitral tuvieron características normales. Las cardiopatías asociadas en los setenta y seis corazones con situs solitus e inversus se consignan en la Tabla III. Los treinta corazones con dextroisomerismo presentaron un patrón complejo de asociación de anomalías intracardíacas y vasculares (Tabla IV); en las Tablas V y VI se muestran respectivamente los tipos de conexión atrioventricular y ventriculoarterial en dextroisomerismo.










Discusión
Según Perlof7 la prevalencia de la CATVP es de cuatro a seis afectados por cien mil nacimientos, lo que representa el 2% de todas las malformaciones congénitas cardiovasculares en el primer año de vida. La frecuencia de CATVP en el material de necropsia de este trabajo fue de 8.15% cifra mayor a la encontrada en la literatura3,6,9,10,12,14,16,17 En las series de necropsia osciló entre 1 y 5%,9,13 esto difiere respecto a nuestra casuística debido a que los especímenes de este estudio fueron colectados en un período de 50 años en un hospital de concentración. En el presente trabajo no hubo diferencia significativa de género; en la literatura se ha señalado que el tipo infradiafragmático tiene preponderancia masculina de tres a uno3,7,9,12 y el orden de frecuencia de los diferentes tipos de CATVP fue a vena vertical seguida de la vena porta y del seno venoso coronario, siendo los tipos restantes menos frecuentes; en la serie de Delisle34 la frecuencia en los niveles de la clasificación de Darling modificada20 fue la siguiente: supracardíaco (45%), cardíaco (25%), infracardíaco (25%) y mixto (5%). Se ha mencionado que las formas aisladas de esta cardiopatia constituyen el 62% y las asociadas a cardiopatia congenita el 38%.8,18,27,30,35
En este estudio la frecuencia de los grupos supracardíaco, cardíaco y mixto fue la más elevada, con porcentajes de 53.01, 46.98 y 12.6 respectivamente y menor en el infracardíaco con 9.43%. La frecuencia de los sitios de conexión anómala en orden decreciente fue: vena cava superior, seno venoso coronario, vena vertical, atrio derecho y vena porta. Los sitios que estuvieron ausentes en este estudio fueron al cayado de la vena ácigos, a la porción suprahepática de la vena cava inferior (que es una forma de conexión anómala parcial) y las muy raras al conducto venoso, venas suprahepaticas y vena cava inferior.
La desembocadura anómala a vena cava superior se puede realizar en varios niveles: por encima del cayado de la vena ácigos, por debajo de la misma y justo en su entrada al atrio derecho. En la CATVP al seno venoso coronario, éste se verticaliza en su extremo distal y su dilatación es debida al flujo venoso pulmonar; la estenosis intrínseca del colector unido al seno coronario ocurre con poca frecuencia.6,7,10,25 En la CATVP a vena vertical la continuidad de ésta con el tronco venoso braquiocefálico izquierdo y con la vena cava superior derecha conforman la imagen cardioangiográfica de la cabeza del "8" o del "muñeco de nieve", mientras que su cuerpo lo forma la silueta cardíaca.8,10,19,35
En la CATVP al atrio derecho, se modifica la estructura de esta cámara ya que existen dos porciones sinusales, la que normalmente le pertenece (zona intercaval) y la izquierda representada por el SVP que en vez de haberse incorporado al atrio izquierdo quedó conectado al atrio derecho; son raras las obstrucciones en este sitio de conexión anómala, en cambio son frecuentes las anomalías cardíacas asociadas. La conexión anómala a la porción suprahepática de la vena cava inferior involucra sólo al pulmón derecho, por lo que es parcial y se considera en el grupo total cuando se acompaña de conexión anómala de las venas pulmonares izquierdas hacia cualquier sitio, situación que se contempla dentro del grupo mixto. Este tipo de conexión parcial se caracteriza por la presencia de un colector curvo que desciende desde el hilio pulmonar derecho hacia la vena cava inferior por encima del diafragma, trayecto que produce la imagen de la "cimitarra" y se acompaña de hipoplasia del pulmón derecho con secuestro pulmonar que caracterizan a este síndrome.12,36–38
En el nivel infradiafragmático el sitio de desembocadura anómala más frecuente es a vena porta y en la literatura son raros los casos informados a conducto venoso, venas suprahepáticas, hepáticas, cava inferior, esplénica y mesentérica superior.3,6,10,17 En este tipo de conexión anómala la obstrucción del colector puede ser anatómica o funcional, la primera es extrínseca (hiato esofágico) o intrínseca por estrechez del colector; en la segunda el efecto obstructivo lo produce la resistencia del flujo sanguíneo intrahepático que se interpone entre el sitio de conexión a la vena porta y la entrada de sangre al corazón.6–10
En el grupo mixto pueden encontrarse cualesquiera de las combinaciones potenciales entre los diferentes sitios de conexión anómala. En general las venas pulmonares izquierdas frecuentemente se conectan con las venas derivadas del sistema venoso embrionario cardinal izquierdo (seno venoso coronario, venas cava superior izquierda y vertical) mientras que las venas del pulmón derecho lo hacen en los derivados venosos del sistema cardinal derecho (vena cava superior derecha y cayado de la ácigos); sin embargo, el plexo venoso esplácnico del embrión (venas vitelinas) tiene posición medial, lo que explica la posibilidad de que exista conexión anómala cruzada (venas pulmonares izquierdas conectadas anómalamente con venas sistémicas derechas y viceversa).3,6,10,27,28,39
La presencia de una comunicación interatrial amplia permite un flujo adecuado del atrio derecho al izquierdo y lo contrario ocurre cuando es restrictiva. En raras ocasiones el tabique interatrial es íntegro, situación grave que bloquea ese cortocircuito y que puede desencadenar la muerte. Tres aspectos centrales de interés clínico y quirúrgico son: el sitio de conexión anómala de las venas pulmonares, la obstrucción del colector y las dimensiones de la comunicación interatrial.3,6,10,12,15,19,26,39 Es importante determinar el sitio de conexión anómala ya que éste impone las características peculiares de la cirugía que presenta dos fases, una que constituye la integración quirúrgica del SVP con el atrio izquierdo y la otra, la ligadura del colector que va a depender del sitio anatómico donde desemboque. La misión de la cirugía es restaurar la condición normal al integrar al SVP con el atrio izquierdo, proceso que no ocurrió durante el desarrollo embrionario.11,29
La obstrucción del colector venoso agrava el cuadro clínico al incrementarse la presión venocapilar lo que constituye un reto para la cirugía 7,10,24,39 Debido al hiperflujo se elevan las resistencias pulmonares; ambas situaciones al coexistir son responsables de la gravedad que se observa en el período perinatal y durante las primeras semanas postnatales. Fontana y Edwards13 señalan que los casos menos severos son los que logran sobrevivir a estas etapas, llegan a la adolescencia y en casos excepcionales hasta la edad adulta, etapa en la que empiezan a presentar sintomatología; también refieren las edades en que fallecieron los pacientes con esta malformación que fueron nueve días, siete semanas, cuatro meses, ocho meses y treinta y nueve años.
En el dextroisomerismo siempre está presente la CATVP; en esta condición ambos atrios tienen estructura morfológica derecha, y pueden ocurrir conexiones anómalas a venas cava superior, vertical y porta, mientras que está ausente la conexión a seno venoso coronario ya que esta cámara cardíaca no existe en este situs simétrico que presenta múltiples malformaciones cardiovasculares.
Conclusión
El estudio de la presente casuística permitió conocer con detalle los rasgos más relevantes de esta cardiopatía cuyo conocimiento anatómico es de gran utilidad para comprender la fisiopatología y el cuadro clínico; además constituye el marco referencial para interpretar con precisión el diagnóstico por imagen (ecocardiográfica, cardioangiográfica, tomografía computarizada y resonancia magnética nuclear). Se resaltan tres aspectos centrales en el diagnóstico morfológico: sitio de la conexión anómala, sitio y tipo de obstrucción del colector venoso y tamaño de la comunicación interatrial; este conocimiento es de gran utilidad para la planeacion de las estrategias quirúrgicas. En el dextroisomerismo siempre está presente esta malformación, la cual se suma al conjunto variado de alteraciones cardíacas presentes en este situs lo que agrava el cuadro clínico y ensombrece el pronóstico.
Referencias
1. Auer J: The development of the human pulmonary vein and its mayor variations. Anat Rec 1948; 101:581–595. [ Links ]
2. Neill CA: Development of the pulmonary vein with reference to the embryology of anomalies of pulmonary venous return. Pediatrics 1956; 18: 880–887. [ Links ]
3. Muñoz Castellanos L, García Cornejo M, Zawilski J, Corona E, Espino Vela J: Desembocadura anómala de venas pulmonares. Archlnst Cardiol Mex 1969; 38: 897–918. [ Links ]
4. Edwards JE, Helmholz HF: A classification of total anomalous pulmonary venous connection based on developmental considerations. Mayo Clin Proc 1956; 31: 151–160. [ Links ]
5. Edwards JE: Pathologic and developmental considerations in anomalous pulmonary venous connection. Mayo Clin Proc 1953; 28: 441–452. [ Links ]
6. Garson A, Bricker T: The science and practice of pediatric cardiology. Vol.2 Philadelphia. Lea & Fabiger, 1990:1145–1174. [ Links ]
7. Perloef KJ: The clinical recognition of congenital heart disease. Philadelphia, WB Saunders. Co, 1994: 334–348. [ Links ]
8. Freedom RM, Culham JAG, Moes CAF: Angiocardiography of congenital heart disease. New York, MacMillan Publishing Co, 1984: 274–288. [ Links ]
9. Bankl H: Congenital malformations of the heart and great vessels. Baltimore–Munich. Urban Schwarzenberg, 1977: 176–184. [ Links ]
10. Attie F: Cardiopatias congénitas. Morfología, cuadro clínico y diagnóstico. Barcelona–México. Salvat, 1985: 229–247. [ Links ]
11. Castañeda AR, Jonas RA, Mayer JE, Hanley FL: Cardiac surgery of the neonato and infant. Philadelphia. WB Saunders Co, 1994: 157–166. [ Links ]
12. Wilson AD: Total anomalous venous connection. Med J 2002; 3(7): 1–12. [ Links ]
13. Fontana RS, Edwards JE: Congenital cardiac disease. Philadelphia WB Saunders Co, 1962: 133–137. [ Links ]
14. Naranjo Ugalde AE, González Guillen A, Marcano Sañs L, Houssein S: Drenaje anómalo total de venas pulmonares. Nuestra experiencia. Rev Cubana Pediatr 2002; 74: 208–212. [ Links ]
15. Nabar A, Dalvi B: Obstructive total anomalous pulmonary venous drainage. Indian J Pediatr 1998; 65: 35–45. [ Links ]
16. Gulati G, Sharma S: A rare form of supracardiac total anomalous pulmonary venous drainage. Evaluation by computed tomography andmagnetic resonance imagin. Clin Radiol 2003; 58: 172–175. [ Links ]
17. Wyttenbach M, Carrel T, Schupbach P, Tschappeler H, Triller J: Total anomalous pulmonary venous connection to the portal vein. Cardiovasc Intervent Radiol 1996; 19: 113–116. [ Links ]
18. Raff GW, Geiss DM, Shah J, Bond LM, Carrol JA: Repair of transposition of the great arteries with total anomalous pulmonary venous return. Ann Thorac Surg 2002; 73: 655–657. [ Links ]
19. Al–Fadley F, Galal O, Wilson N, Aloufis: Cor triatriatum associated with total anomalous pulmonary venous drainage in the setting of mitral atresia and restricttive interatrial communication. Pediatr Cardiol 1992; 13: 125–126. [ Links ]
20. Becker AE, Anderson RH: Pathology of congenital heart disease. Londres. Butterworths 1981: 53–61. [ Links ]
21. Becher MW, Rockenmacher S, Marin–Padilla M: Total anomalous pulmonary venous connection: Persistence and atresia of the common pulmonary vein. Pediatr Cardiol 1992; 13: 187–189. [ Links ]
22. Dotter CT, Hardisty NM, Steinberg I: Anomalous right pulmonary vein entering the inferior vena cava: Two cases diagnosed during life by angiocardiography and cardiac catheterization. Am J Med Sci 1949; 218: 31–36. [ Links ]
23. Jaramillo M, Medrano GA, Attie F, Buendía A, de Micheli A, Ovseyevitz J: Estudio electrocardiográfico de la conexión anómala total de venas pulmonares. Arq Bras Cardiol 1985; 4(3): 157–161. [ Links ]
24. Toulemonte V, Sidi D, Kachaner J, Le Bidous J, Cohen L, Guarnera S, et al: Stenosis of the pulmonary veins in total anomalous pulmonary venous drainage associated with iatrogenic abnormality. Arch Mai Coeur 1990; 83: 633–639. [ Links ]
25. Bu'Lock FA, Jordan SC, Martin RP: Successful balloon dilatation of ascending vein stenosis in obstructed supracardiac total anomalous pulmonary venous connection. Pediatr Cardiol 1994; 15: 78–80. [ Links ]
26. Redington AN, Raine J, Shinebourne EA, Rig–by ML: Tetralogy of Fallot with anomalous pulmonary venous connection: A rare but clinically important association. Br Heart J 1990; 64: 325–328. [ Links ]
27. Cayre RO, Civetta JD, Roldan AO, Rousseau JJ, Knudson AO–Jr, Valdes Cruz IM: Mixed total anomalous pulmonary venous connection: Case report with bilateral venous collector. J Am Soc Echocardiogr 2003; 16: 84–87. [ Links ]
28. Anil Kumar D, Kumar RM, Narasinga Rao P, Mahmound HM, Chandran S, Dhir AK, et al: Repair of total anomalous pulmonary venous connection in early infancy. Asian Cardiovasc Thorac Ann 2003; 11: 18–22. [ Links ]
29. Tortoriello TA, Vick GW 3rd, Chung T, Bezoid LI, Vincent JA: Meandering right pulmonary vein to the left atrium and inferior vena cava: The first case with associated anomalies. Tex Heart Inst J 2002; 29: 319–323. [ Links ]
30. Oliver JM, Gallego P, González A, Domínguez FJ, Aroca A, Mesa JM: Sinus venosus syndrome: atrial septal defect or anomalous venous connection? A multiplane transoesophageal approach. Heart 2002; 88: 634–638. [ Links ]
31. Tynan MJ, Becker AE, Macartney FJ, Quero–Jiménez M, Shinebourne EA, Anderson RH: Nomenclature and classification of congenital heart disease. Br Heart J 1979; 41: 544–553. [ Links ]
32. Díaz Góngora G, Attie F, Quero–Jiménez M, Muñoz Castellanos L, Anderson RH, Baño–Rodrigo A: Secuencia diagnóstica de las cardiopatías congénitas. Arch lnst Cardiol Mex 1982; 52: 69–78. [ Links ]
33. Darling RC, Rothney WB, Craig JM: Total pulmonary venous drainage into the right side of the heart, report of 17 autopsied cases not associated with other major cardiovascular anomalies. Lab Invest 1957; 6: 44–64. [ Links ]
34. Delisle G, Ando M, Calder AL, Zuberbuhler JR, Rochenmacher S, Alday LE, et al: Total pulmonary venous connection. Report of 93 autopsied cases with emphasis on diagnostic and surgical considerations. Am Heart J 1976; 91: 99–122. [ Links ]
35. Zylac CJ, Eyler WR, Spizarnny DL, Stone C: Developmental lung anomalies in the adult: radiologic–pathologic correlation. Radio graphics 2002; 22: 526–543. [ Links ]
36. Neill CA, Ferencz C, Sabiston DC, Sheldon H: The familial occurrence ofhypoplastic right lung with systemic arterial supply and venous drainage "Scimitar syndrome". Bull Johns Hopkins Hosp 1977; 107: 1–21. [ Links ]
37. Espínola Zavaleta N, Muñoz Castellanos L, Játiva Chavez S, Zamora González C: Correlación anatomoecocardiográfica del síndrome de Cimitarra en el adulto y comentario embriológico. Arch Cardiol Mex 2005; 75: 165–175. [ Links ]
38. Sano S, Brawn WJ, Mee RBB: Total anomalous pulmonary venous drainage. J Thorac Cardiovasc Surg 1989; 97: 886–892. [ Links ]
39. Junega R, Saxena A, Kothari SS, Taneia K: Obstructed infracardiac total anomalous pulmonary venous connection in an adult. Pediatr Cardiol 1999; 20: 152–154. [ Links ]














