Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.77 n.2 Ciudad de México Apr./Jun. 2007
Investigación clínica
La cuantificación no invasiva del estrés parietal sistólico del ventrículo izquierdo en pacientes con insuficiencia cardíaca y su aplicación clínica
Non invasive quantification of the pariental systolic stress of the left ventricle in patients with heart failure. Its clinical application
José Fernando Guadalajara Boo,* Jaime González Zárate,* Eduardo Bucio Reta,* Patricia Pérez,** Ramón José Cué Carpio*
* Instituto Nacional de Cardiología Ignacio Chávez.
** Hospital Médica Sur
Correspondencia:
Dr. José Fernando Guadalajara Boo.
Instituto Nacional de Cardiología
(INCICH, Juan Badiano Núm. 1, Col.Sección XVI, Delegación Tlalpan,
14080, México, D.F.).
Tel. 55 73 29 11 Ext. 1136. Fax. 55 73 09 94.
Correo:guadalajara@cardiologia.com.mx
Recibido: 29 de marzo de 2007
Aceptado: 10 de abril de 2007
Resumen
El objetivo de este trabajo es la cuantificación no invasiva del estrés parietal sistólico del ventrículo izquierdo por medio de ecocardiografía en pacientes con insuficiencia cardíaca por daño miocárdico intrínseco y establecer su semiología clínica al compararla con la insuficiencia cardíaca causada por sobrecarga hemodinámica, con pacientes en los que el corazón es funcionalmente normal, así como con otros pacientes en los que existe hipertrofia inapropiada con disfunción diastólica. Se estudiaron 33 individuos portadores de insuficiencia cardíaca. No se encontró asociación estadísticamente significativa entre el estrés parietal sistólico por miocardiopatía dilatada y la fracción de expulsión, el acortamiento porcentual, la dp/dt o la masa ventricular en este grupo de pacientes. Se encontró asociación estadísticamente significativa entre el valor de la relación grosor/radio en sístole (h2/r4) y el estrés parietal sistólico. En este estudio se demuestra que cuando la falla contráctil es primaria, el grado de aumento de la poscarga es variable pero guarda relación inversa con el valor de la fracción de expulsión (r = 0.86); pero cuando la sobrecarga es la responsable de la insuficiencia cardíaca (estenosis aórtica o insuficiencia aórtica) la relación inversa es mayormente significativa (r = 0.93). Por su parte, la hipertrofia inapropiada (hipertensión arterial o estenosis aórtica con función sistólica normal), se acompaña de estrés sistólico bajo y, en estos casos, la alteración más frecuente es la disfunción diastólica. Finalmente, se demuestra que en pacientes con insuficiencia aórtica grave con función sistólica normal, el estrés sistólico está significativamente aumentado y se constituye como el mecanismo gatillo que genera la hipertrofia miocárdica compensadora, y por el contrario, en la insuficiencia mitral el estrés sistólico normal o bajo no genera hipertrofia compensadora y por ello, en estos pacientes se encuentra hipertrofia inadecuada con función sistólica normal.
Palabras clave: Estrés parietal sistólico. Relación h/r. Poscarga.
Summary
The purpose of this study is to calculate non invasivelly left ventricular systolic wall stress by echocardiography in patients with primary heart failure, and compare the results with those obtained in parients with overloaded heart failure, diastolic dysfunction by Inapropiatte hypertrophy, with normal ejection fraction and people with normal heart, there stablish the value of the results in clinical settings. We studied 33 patients with heart failure by dilated cardiomyopathy. There was no significant association between the systolic wall stress and the ejection fraction, fractional shortening, dp/dt or left ventricular mass in this group of study. There was a significant association between systolic h/r ratio and the systolic wall stress. This study shows that in primary heart failure the afterload increases and has inverse relationship with ejection fraction (r = 0.86); but, when heart failure obey to an excessive overload exists an exquisite inverse relationship between systolic wall stress and ejection fraction (r = 0.93). The excessive hypertrophy (Inappropriate) reduces the systolic wall stress but causes diastolic dysfunction. The increase of systolic wall stress in Aortic regurgitation with normal ventricular performance is responsible of adequate left ventricular hypertrophy, by other means, in mitral insufficiency the presence of low or normal systolic wall stress does not induce left ventricular hypertrophy, then diameter increases and the hypertrophy is inadequate, despite this, left ventricular function is normal.
Key words: Systolic wall Stress. h/r ratio. Afterload.
Introducción
Desde finales del siglo XIX Woods demostró que los principios de la ley de Laplace son aplicables al corazón humano y que esto nos permite realizar un cálculo de estrés de la pared.1
El estrés parietal es realmente la fuerza que se opone a la contracción ventricular (poscarga), de tal modo que cualquier condición que lo incremente (aumento de presión o de área sistólica ventricular) causa una mayor resistencia al vaciamiento ventricular; por el contrario, cuando la presión o el área sistólica disminuyen (disminución de la poscarga), la contracción ventricular se lleva a cabo en mayor facilidad; esto es, la función ventricular (fracción de expulsión) es inversamente proporcional a la poscarga (estrés parietal sistólico).3 Este comportamiento está de acuerdo con la ley de Laplace en donde el estrés (S) es directamente proporcional a la presión (P) por el radio (r), e inversamente proporcional al espesor de la pared 1
El estrés parietal es realmente la fuerza que se opone a la contracción ventricular (poscarga), de tal modo que cualquier condición que lo incremente (aumento de presión o de área sistólica ventricular) causa una mayor resistencia al vaciamiento ventricular; por el contrario, cuando la presión o el área sistólica disminuyen (disminución de la poscarga), la contracción ventricular se lleva a cabo en mayor facilidad; esto es, la función ventricular (fracción de expulsión) es inversamente proporcional a la poscarga (estrés parietal sistólico).3 Este comportamiento está de acuerdo con la ley de Laplace en donde el estrés (S) es directamente proporcional a la presión (P) por el radio (r), e inversamente proporcional al espesor de la pared (h).1,2

El estrés parietal miocárdico es uno de los principales determinantes del consumo miocárdico de oxígeno3 y ante cualquier sobrecarga hemodinámica, sea por aumento de la presión intraventricular (sistólica) o por aumento del radio de la cavidad (volumen diastólico), la hipertrofia miocárdica, no sólo aumenta la fuerza de contracción sino que también intenta mantener estable el MVO2,3 por lo que de esta forma se constituye en un mecanismo compensador para mantener normal la función ventricular ante una sobrecarga hemodinámica.4 Cuando la hipertrofia no logra normalizar el estrés parietal diastólico o sistólico, aparece insuficiencia cardíaca y se incrementa el costo metabólico de la contracción cardíaca (aumenta el MVO2).5
El estrés parietal del ventrículo izquierdo en seres humanos, originalmente se obtuvo a partir de estudios hemodinámicos invasivos con la cuantificación directa de las presiones intraventriculares y estudios angiográficos,4,6,7 con el advenimiento de la ecocardiografía, que posee como ventaja principal la de ser un método no invasivo, se ha logrado cuantificar este importante parámetro en forma incruenta.8,9 Posteriormente se ha utilizado la RMN para este mismo fin.11–13
El objetivo de este trabajo es cuantificar con un método no invasivo (ecocardiograma bidimensional) el estrés parietal sistólico del ventrículo izquierdo en pacientes con insuficiencia cardíaca por miocardiopatía dilatada para establecer su comportamiento en relación a otras variables hemodinámicas como son fracción de expulsión del VI (FEVI), acortamiento porcentual (AP), dp/dt, masa ventricular (MV) y relación grosor/radio (h/ r) en diástole y sístole, así como comparar el comportamiento del estrés parietal sistólico en pacientes con insuficiencia cardíaca, causada por sobrecargas hemodinámicas14,15 con sujetos normales10 y con otros pacientes con hipertrofia inapropiada por hipertensión arterial sistémica16 y estenosis aórtica y fracción de expulsión normal,14 finalmente compararlo también con los pacientes con insuficiencia aórtica15 e insuficiencia mitral17con función ventricular normal.
Material y métodos
Se estudió en forma prospectiva a 33 individuos con diagnóstico de insuficiencia cardíaca por miocardiopatía dilatada idiopática o isquémica (fracción de expulsión del VI menor de 50%) que acudieron a la clínica de insuficiencia cardíaca del Instituto Nacional de Cardiología en el período comprendido de Agosto del 2004 a Agosto del 2005.
Se les realizó historia clínica con medición de la presión arterial sistémica mediante un esfingomanómetro de mercurio; se les practicó estudio ecocardiográfico transtorácico, bidimensional, modo M, Doppler pulsado continuo y color con un ecocardiógrafo marca Hewlett–Packard Sonos 5500 con transductor de 2.5 Mhz acoplado a sistema Doppler en todas sus modalidades. Se obtuvieron imágenes en eje largo paraesternal, eje corto paraesternal y eje apical de cuatro cámaras. Se midió el espesor del septum interventricular (SIV), de la pared posterior del ventrículo izquierdo (PP), y las dimensiones del ventrículo izquierdo en diástole y sístole, cuidando que la incidencia del haz ultrasónico fuera perpendicular al ventrículo izquierdo18,siguiendo los lineamientos de la Sociedad Americana de Ecocardiografía.18,19
Se calculó la relación h/r (grosor/radio) en el eje corto paraesternal a nivel de los músculos papilares,10 midiendo con el lápiz electrónico el área epicárdica del ventrículo izquierdo (A1) y el área endocárdica (A2) en diástole y las áreas epicárdicas (A3) y endocárdica (A4) en sístole. Se calculó el radio de cada área trazada (r1, r2, r3 y r4 respectivamente), mediante la fórmula:
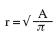
Con el valor del radio se calculó el espesor diastólico de la pared mediante la resta; r1–r2 = h1 y se dividió entre el radio de la cavidad (r2) para obtener la relación grosor/radio en diástole (h1/r2). El cálculo del espesor sistólico de la pared ventricular (h2) se obtuvo mediante la diferencia r3–r4. La relación entre el grosor de la pared (h2) y el radio de la cavidad (r4) constituyó la relación grosor/radio en sístole (h2/r4).11
Se realizó cálculo del estrés meridional sistólico de acuerdo con la siguiente fórmula:10
S = [PAS (A4) / A3 – A4] (1.35)
Donde
PAS = Presión arterial sistólica, ésta se cuantificó mediante esfigmomanómetro en todos los pacientes en el momento del estudio, excepto en los pacientes con estenosis aórtica, en los que se cuantificó directamente dentro del ventrículo izquierdo mediante cateterismo cardíaco.14
La constante 1.35 se utilizó para convertir mm Hg en g/cm.2,9 La determinación de la masa ventricular se realizó utilizando el método de área longitud (AL) propuesta por la Sociedad Americana de Ecocardiografía.18,19
Masa ventricular izquierda = 1.5 {5/6 [A1 (a+d+t)]–5/6 [A2 (a+d)]}
La fracción de expulsión se calculó mediante el método monoplano en los pacientes con miocardiopatía dilatada idiopática y con la técnica de Simpson modificado en aquellos pacientes con secuelas de cardiopatía isquémica.19,20
Las variables continuas se expresan como media ± desviación estándar. Las variables cualitativas se expresan de acuerdo a su distribución de frecuencia y se representan gráficamente. Para el análisis de la forma de asociación entre las variables de función ventricular se utilizó regresión lineal simple, así como para el análisis de la asociación entre las variables de todos los grupos.
Se tomaron las medias de los resultados obtenidos en estudios previos en los que se determinaron prospectivamente las mismas variables con la misma técnica, pero en distintas poblaciones de estudio: sujetos normales,10 en otros con estenosis aórtica con y sin insuficiencia cardíaca,14 pacientes con hipertensión arterial16 otros más con insuficiencia aórtica con y sin insuficiencia cardíaca,15 finalmente un grupo de pacientes con insuficiencia mitral pura.17
Resultados
Se estudiaron 33 pacientes con diagnóstico comprobado de insuficiencia cardíaca.
No se realizó el cálculo del estrés, de masa ventricular (MV), ni de relación grosor radio en diástole (h1/r2) y en sístole (h2/r4) en 3 pacientes debido a que no fue posible obtener una incidencia perpendicular del haz ultrasónico en el ventrículo izquierdo. No se determinó dp/dt en 2 pacientes debido a que no presentaban flujo regurgitante mitral.
En la Tabla I, se resumen las características generales de los pacientes; del grupo total 26 (78%) son del sexo masculino y 7 (22%) son del sexo femenino. La edad promedio fue de 49 ± 15 años y todos los pacientes estaban en insuficiencia cardíaca con FEVI promedio de 31% ± 9% y acortamiento porcentual promedio de 14% ± 6%. La presión arterial sistólica fue de 109 ± 17 mm Hg y la presión diastólica de 66 ± 11 mm Hg. Treinta pacientes (90%) se encontraban en ritmo sinusal, dos con fibrilación auricular (6%) y uno en ritmo de marcapaso (3%). Dieciocho pacientes (54%) presentaban bloqueo de rama izquierda del Haz de His y 4 (12%) presentaban bloqueo de rama derecha del Haz de His. En todos los pacientes el estrés parietal sistólico del ventrículo izquierdo se encontró aumentado (138 ± 47 g/cm2) así como la masa del ventrículo izquierdo (271 ± 113 g). La relación grosor/ radio en diástole (0.38 ± 0.09) y en sístole (0.48 ± 17) se encontraron disminuidas, lo que demuestra hipertrofia inadecuada.21,22

En la Tabla II, se demuestran los valores ecocardiográficos obtenidos en los pacientes con insuficiencia cardíaca comparados con los obtenidos con sujetos sanos, estos últimos tenían una edad significativamente (p < 0.001) menor que los enfermos (28 ± 3 vs 49 ± 15), el estudio ecocardiográfico demostró dilatación del ventrículo izquierdo (60 ± 9.8 mm vs 42 ± 8 mm) diámetro sistólico aumentado (52 ± 9 mm vs 24.4 ± 3 mm), disminución del acortamiento porcentual (14 ± 6.7 vs 41 ± 6%), disminución de la fracción de expulsión (32 ± 10 vs 70 ± 6), hipertrofia inadecuada: h1/r2 (0.38 ± 0.09 vs 0.047 ± 0.05) y estrés parietal sistólico elevado (133 ± 58 vs 41 ± 8 gm/cm²) todos estos parámetros con diferencia estadísticamente significativa en comparación con los sujetos sanos (Tabla II).
En la Figura 1 se muestra el coeficiente de correlación entre la fracción de expulsión y el estrés parietal sistólico en sujetos sanos, comparados con pacientes que padecen sobrecargas de presión (estenosis aórtica14 e hipertensión arterial16) y con sobrecarga de volumen (insuficiencia aórtica15 e insuficiencia mitral17) unos con función ventricular normal y otros con insuficiencia cardíaca, nótese la correlación inversa entre ambos parámetros (r = 0.86) . Finalmente, en la Figura 2, se muestra el coeficiente de correlación entre la fracción de expulsión de todos los sujetos estudiados, excepto los que padecen insuficiencia cardíaca congestiva por miocardiopatía dilatada. Cuando se excluyen los pacientes que padecen insuficiencia cardíaca primaria, la correlación inversa entre ambos parámetros es mayormente significativa (r = 0.93)


El análisis de correlación entre la relación grosor/ radio en diástole con el estrés parietal sistólico entre los grupos mostró un coeficiente de correlación de r = 0.648 con una asociación no significativa en el análisis de regresión linear (p = 0.116). El análisis de la asociación entre la relación grosor/radio en sístole y el estrés parietal sistólico entre los grupos mostró ser estadísticamente significativa (r = 0.819) (p = 0.024).
No se encontró asociación estadísticamente significativa entre el estrés parietal sistólico y la fracción de expulsión o el acortamiento porcentual en este grupo de pacientes con insuficiencia cardíaca por daño miocárdico primario.No se encontró asociación estadísticamente significativa entre el estrés parietal sistólico y la masa ventricular ni entre el estrés parietal sistólico y la dp/dt.
Cuando la función ventricular es normal en sujetos sanos11 o con sobrecarga diastólica15 o sistólica16,18 compensada, la poscarga (estrés sistólico) es normal; por el contrario, cuando la sobrecarga diastólica15, o sistólica16,18 está descompensada por insuficiencia cardíaca, el estrés sistólico es muy elevado, cabe mencionar que en la insuficiencia aórtica compensada15 (fracción de expulsión normal), el estrés sistólico está elevado, mientras que por el contrario, en la sobrecarga sistólica con función sistólica compensada14,16 el estrés sistólico se encuentra disminuido (Tabla III). En la Tabla III se comparan los resultados de los diferentes grupos estudiados, nótese que en los pacientes con insuficiencia aórtica la relación grosor/radio (h1/ r2) no tiene diferencia con los sujetos sanos (NL), (0.48 ± 0.06 vs 0.47 ± 0.05), a pesar de que el ventrículo izquierdo se encuentra significativamente dilatado (58 ± 5 mm vs 42 ± 4 mm) (hipertrofia adecuada).21,23 Por otro lado, la hipertensión arterial y la estenosis aórtica muestran una relación h1/r2 significativamente elevada (0.7 ± 0.16 y 0.97 ± 0.27)21,22 en comparación con los valores normales (0.47 ± 0.05) (hipertrofia inapropiada). Lo mismo sucede con esta relación en sístole (h2/r4: 1.79 ± 0.6 y 2.27 ± 0.74 vs 1.1 ± 0.02). En pacientes con insuficiencia aórtica con insuficiencia cardíaca (FE 41 ± 8), disminuye la relación h1/r2 significativamente a valores muy inferiores a los normales (0.35 ± 0.03 vs 0.47 ± 0.05) (hipertrofia inadecuada) y estos valores son semejantes a los encontrados en pacientes con insuficiencia cardíaca por daño miocárdico primario (0.35 ± 0.03 vs 0.38 ± 0.09). Cuando los pacientes con estenosis aórtica apretada caen en insuficiencia cardíaca (FE 30 ± 9) también disminuye la relación h1/r2 y se pseudonormaliza (0.50 ± 0.16) sin diferencia a los valores encontrados en sujetos sanos (0.47 ± 0.05).
Si analizan el comportamiento del estrés sistólico en los pacientes con insuficiencia cardíaca (Tabla III), se puede observar que si bien es cierto que en la miocardiopatía dilatada el estrés sistólico se encuentra elevado (133 ± 52 gm/cm²) en las sobrecargas hemodinámicas la elevación de este parámetro es significativamente mayor (p = 0.001) (Insuficiencia aórtica 179 ± 49 y estenosis aórtica 185 ± 61 gm/cm2) al encontrado en el grupo de IC. Nótese como a pesar de tener hipertrofia inadecuada (h1/r2 0.36 ± 0.05), los pacientes con insuficiencia mitral tienen una fracción de expulsión normal (70 ± 8), lo mismo que el estrés sistólico (47 ± 13 gm/cm2).
Finalmente, cuando se grafica la fracción de expulsión en relación con la poscarga, en todos los grupos estudiados encontramos un coeficiente de correlación inversa muy alto (r = 0.86). Los grupos que se alejan de la media, son aquéllos de insuficiencia aórtica y función cardíaca normal y aquellos otros de insuficiencia cardíaca por daño miocárdico primario (Fig. 1). Si excluimos el grupo de miocardiopatía dilatada (daño miocárdico intrínseco) el coeficiente de correlación se eleva (r = 0.93) (Fig. 2).
Discusión
La poscarga es una de las determinantes fundamentales de la función ventricular, en conjunto con contractilidad y la precarga.23 En la práctica clínica común, el cálculo de poscarga se utiliza poco, debido fundamentalmente a que se requiere estudio hemodinámico y angiográfico simultáneo.4,6,7 El estudio ecocardiográfico provee los elementos esenciales para poder calcular el estrés parietal meridional sistólico;8–10 mediante esfigmomanometría podemos tener con exactitud la presión sistólica máxima del ventrículo izquierdo,9 excepto en pacientes con estenosis aórtica, en quienes será necesario cuantificar la presión sistólica intraventricular izquierda para lograr un cálculo de estrés sistólico meridional del ventrículo izquierdo,14 de esta forma se construye la fórmula del estrés sistólico de acuerdo con la ley de Laplace.1,2,6,10 Este cálculo también ha sido posible llevarlo a cabo bajo los mismos principios mediante resonancia magnética nuclear.11–13
La función ventricular en la insuficiencia cardíaca (Tablas I y II)
La insuficiencia cardíaca se caracteriza por aumento de los diámetros diastólico y sistólico, disminución del acortamiento porcentual, de la fracción de expulsión y del dp/dt, lo cual se acompaña de hipertrofia ventricular izquierda a juzgar por el aumento de la masa ventricular (272 ± 113 gm), pero ésta es inadecuada a juzgar por una relación grosor/radio (h/r) disminuida (0.38 ± 0.09) en diástole (h1/r2)10,21,22.
Estos datos son la demostración objetiva de la disminución de la función contráctil, de la utilización del mecanismo de Starling, de la ineficiencia de la hipertrofia como mecanismo compensador al permitir que se eleven las cargas hemodinámicas (pre y poscarga) y con ello se deteriora aún más la función ventricular (hipertrófica inadecuada).9,21,23
Cuando la insuficiencia cardíaca es debida a un daño miocárdico primario (miocarditis, miocardiopatía dilatada, necrosis miocárdica extensa), la insuficiencia contráctil no logra aumentar el espesor de la pared a niveles normales durante la sístole y consecuentemente el radio sistólico queda aumentado, por lo que el estrés sistólico (poscarga) aumenta a pesar de que la presión sistólica sea normal; a su vez, el aumento de la poscarga, deprime la función sistólica ventricular debido a la relación inversa que existe entre ambos parámetros (Fig. 1).9,25 En otras palabras, el aumento de la poscarga en pacientes con insuficiencia cardíaca, es un factor de progresión de la misma.
Semiología de la poscarga en diferentes alteraciones de la función ventricular (Tabla III, Fig. 1).
1) Estrés sistólico en insuficiencia cardíaca Normalmente, el estrés sistólico se mantiene en cifras normales (41 = gm/cm²)10 debido a que la presión, el engrosamiento miocárdico y la reducción del área de la cavidad son normales (h2 /r4 de 1.1 ± 0.02). Como se mencionó en la insuficiencia cardíaca, cuando la hipertrofia es inadecuada21,22 (h1/r2 0.38 ± 0.09) y su engrosamiento sistólico precario (h2/r4 0.42 ± 0.17) el estrés sistólico (poscarga) necesariamente está aumentado (133 ± 52 gm/ cm²) aun cuando la presión sistólica sea normal (109 ± 17 mm Hg) nótese la correlación inversa entre fracción de expulsión y estrés sistólico (Fig. 1, Tabla II) debido a que cuan do la falla cardíaca se debe a daño miocárdico intrínseco, la disminución del engrosamiento sistólico es variable y depende del grado de daño miocárdico y por ello explica la menor correlación estadística entre estos parámetros (Fig. 1).
2) Estrés sistólico en insuficiencia aórtica (Tabla III, Fig. 1)
Cuando ante una sobrecarga de volumen (Insuficiencia aórtica), la hipertrofia normaliza el estrés diastólico (hipertrofia adecuada) ,21,22,24,26 la relación grosor/radio en diástole (h1/r2) es similar al valor encontrado en sujetos normales (0.48 ± 0.06 vs 0.47 ± 0.05) y aun cuando el estrés sistólico permanece elevado (70 ± 19 vs 41 ± 8 gm/cm² p < 0.001), la función ventricular, se mantiene normal (FE 71%). En estos casos, el aumento del estrés sistólico es el mecanismo gatillo que promueve la aparición de hipertrofia,27 sin activar al sistema neuroendocrino, y ello se debe a que el engrosamiento sistólico no logra normalizar la relación grosor/ radio (h2/r4) en sístole (0.92 ± 0.1 vs 1.1 ± 0.02). Este mecanismo permite al corazón normalizar el estrés diastólico y la función ventricular y así defenderse de la insuficiencia cardíaca. Cuando en estos pacientes la hipertrofia deja de ser un mecanismo útil para compensar la sobrecarga la relación grosor/radio en diástole disminuye (h1/r2 0.35 vs 0.47 normal), el engrosamiento sistólico se hace precario (h1/r2 de 0.49 vs 1.1 normal) (hipertrofia inadecuada) ,21,22,26 la función ventricular (FE) se va deteriorando paulatinamente hasta que sobreviene la insuficiencia cardíaca (FE 41%) en estas condiciones, el estrés sistólico que se encontraba aumentado cuando la función ventricular era normal (70 gm/ cm²), se eleva excesivamente (179 gm/cm²).15,26 En estos pacientes en los que ha aparecido insuficiencia cardíaca se activa el sistema neuroendocrino y entre más tiempo pase aparece más colágeno intersticial en el miocardio y la hipertrofia se torna patológica,27–29 por lo que la disminución de la fracción de expulsión puede ser debida a sobrecarga hemodinámica y/o a daño miocárdico, y es por ello que con el tratamiento quirúrgico, muestra una mayor mortalidad tanto operatoria como tardía,30 cuando el daño miocárdico es el responsable, mientras que si solamente es consecutiva a la sobrecarga diastólica, la cirugía reduce las dimensiones del corazón y normaliza la función.
3) El estrés sistólico en la insuficiencia mitral (Tabla III, Figs. 1 y 2)
En la Tabla III se puede constatar que a diferencia de la insuficiencia aórtica, el estrés sistólico no tuvo diferencia con los valores normales (47 ± 13 vs 41 ± 5 gm/cm2) en los pacientes con insuficiencia mitral pura y grave y la fracción de expulsión se encontró normal (70 ± 8) a pesar de que el ventrículo izquierdo se encontraba dilatado (61 ± 4 mm) y con hipertrofia inadecuada (h1/r2 0.36 ± 0.05 vs (normal) 0.47 ± 0.05); ello se puede interpretar en razón de que la sobrecarga diastólica activa el mecanismo de Starling y al contraerse el ventrículo izquierdo ante una poscarga normal o baja (flujo regurgitante mitral hacia la aurícula izquierda), mantiene una fracción de expulsión normal o alta (70 ± 8) al mismo tiempo cuando el estrés sistólico se encuentra bajo o normal,31 no se constituye como mecanismo gatillo para promover la hipertrofia miocárdica27 y ello explica la presencia de hipertrofia inadecuada. La elevación del estrés sistólico en estos pacientes es la primera manifestación de falla contráctil, pues ello significa que a pesar de tener la fuga hacia la aurícula izquierda el engrosamiento sistólico ya no es capaz de normalizar la poscarga, por lo que una FE normal (50–60%) realmente significa falla contráctil subclínica.17
4) El estrés sistólico en las sobrecargas de presión (Tabla III, Figs. 1 y 2)
a) Hipertensión arterial
Cuando la hipertensión arterial es importante, especialmente si existe hiperreninemia y se sostiene en el tiempo, el aumento del estrés sistólico y la activación del sistema neuroendocrino generan hipertrofia27,28 que usualmente es excesiva (hipertrofia inapropiada), 14,16,21,22,24 lo cual se demuestra cuando la relación grosor/radio en diástole (h1/r2) se encuentra excesivamente aumentada (0.70 ± 0.16 vs 0.47 ± 0.05 p < 0.001), lo que constituye hipertrofia inapropiada22,24 en estos pacientes con miocardio normal hipertrofiado genera un estado de hipercontractilidad que genera un engrosamiento sistólico también excesivo (h1/r4 1.79 ± 0.6 vs (normal) 1.1 ± 0.02 p < 0.001) y ello da lugar a que el estrés sistólico se normaliza y aun llega a ser menor que en sujetos normales (32 ± 12 vs 41 ± 8 gm/cm²) o sea en estos casos el estrés sistólico es bajo. 16,21,22,24
b) Estenosis aórtica apretada (Tabla III, Figs. 1 y 2)
Al igual que los pacientes hipertensos, los afectados por estenosis aórtica grave producen hipertrofia inapropiada 15,21,22,24 (h1/r2 0.97 ± 0.27 vs 0.47 ± 0.05 p < 0.001) y gracias a esta hipertrofia de un miocardio normal es que el engrosamiento sistólico logra vencer la elevada presión intraventricular que tienen estos pacientes para mantener la función ventricular normal, así, el engrosamiento sistólico excesivo (h1/r4 de 2.27 ± 0.74) logra normalizar el estrés sistólico (32 ± 14 gm/cm²) y mantener la función ventricular normal (FE 70 ± 10%).
Cuando el aumento de la presión intraventricular se mantiene en el tiempo, el mecanismo de la hipertrofia, puede dejar de ser suficiente para normalizar el estrés sistólico (poscarga) y permitir que ésta se eleve; como la poscarga tiene una relación inversa con la función ventricular,9,14.25,32,33 la fracción de expulsión empieza a deprimirse, hasta el grado de producir insuficiencia cardíaca (Fig. 1); así, cuando el estrés sistólico en estos pacientes se encuentra excesivamente elevado (185 ± 61 gm/cm²) la función ventricular puede estar importantemente deprimida (FE 30%), sin que el estado contráctil intrínseco se encuentre alterado,9,25,32,33 (afterload mismatch) ello, como se mencionó, es debido a que la hipertrofia se torna inadecuada, lo cual se manifiesta para pseudonormalización de la relación grosor/radio en diástole (h1/r4 de 0.50 ± 0.16) y la franca reducción del engrosamiento sistólico (h1/r4 de 0.6 ± 0.18) (Tabla III). Cuando la insuficiencia cardíaca en pacientes con estenosis aórtica es debida a una elevación excesiva de la poscarga, el tratamiento quirúrgico enseña buenos resultados en lo referente a la mortalidad operatoria 33 y a la sobrevida, por el contrario, cuando el estrés sistólico se encuentra pseudonormalizado (su elevación semeja al encontrado en insuficiencia cardíaca (Tabla III, Fig. 1), denota que existe daño miocárdico intrínseco y la reducción de la fracción de expulsión ya no es debido a la sobrecarga, en estas condiciones, el tratamiento quirúrgico lleva consigo una alta mortalidad y no cambia la historia natural de la enfermedad.33
Conclusiones
La poscarga (estrés parietal sistólico) es una determinante fundamental de la función ventricular en el corazón intacto y el entendimiento de sus cambios en relación con las alteraciones de la función ventricular, es indispensable para conocer en forma racional el pronóstico y tratamiento de diversas enfermedades cardíacas; así se corrobora en la clínica que la poscarga tiene una exquisita relación inversa con la función ventricular cuando es directamente responsable de ella (Figs. 1 y 2) tal y como se demuestra en otros estudios9,25 y éste. Dicha relación no es tan estrecha cuando el daño miocárdico intrínseco es el responsable de la falla ventricular (Fig. 1). El comportamiento de la hipertrofia está en relación con la semiología de la poscarga y la función ventricular, por lo que para la interpretación adecuada de las dos últimas es necesario el cabal conocimiento del comportamiento de la primera, tal y como también es demostrado en este estudio. Finalmente, en este estudio se destaca el concepto de la relación entre poscarga y función ventricular, 9,25,32,34 haciendo notar que cuando la poscarga es excesiva (Fig. 2) la función ventricular puede estar deprimida y que al eliminar el exceso de carga hemodinámica, la función ventricular se normaliza al no haber daño miocárdico intrínseco (afterload mismatch)34.
Referencias
1. Wood RN: A few applications of a physical theorem to membranes in the human body in a state of tension. J Anat Physiol 1892; 26: 302–310. [ Links ]
2. Sandler H, Dodge H: Left Ventricular Tension and Stress in man. Circulation Res 1963; 13: 91– 104. [ Links ]
3. Weber KR, Janiecky JS: Myocardiac oxygen consumption: The role of wall force and shortening. Am J Physiol 1977; 233(4): H421–H430. [ Links ]
4. Hood WP, Rackley CH E, Rolett EL: Wall Stress in the normal and Hypertrophied Human left ventricle. Am J Cardiol 1986; 22: 550–558. [ Links ]
5. Laskey WK, Reiche KN, Sulton JM, Tereker WJ, Hirsh JW: Matching myocardial oxygen consumption to mechanical load in human left ventricular hypertrophy and dysfunction. J Am Coll Cardiol 1984; 3: 291–300. [ Links ]
6. Mirsky I: Left ventricular stress in the intact human heart. Biophys J 1969; 9: 189–196. [ Links ]
7. Falsetti HL, Mates RE, Grant C, Greene DG, Bunnell IV: Left ventricular wall stress calculated from due–plane cineangiography. Circ Res 1970; 26: 71–83. [ Links ]
8. Douglas PS, Reichek N, Plappert T, Muhammad A, Sutton MG: Comparison of echocardiographic methods for assessment of left ventricular shortening and wall stress. J Am Coll Cardiol 1987; 9 (4): 945–51. [ Links ]
9. Colan SD, Borow KM, Neumann A: Left Ventricular end Systolic Wall Stress Velocity Fiber Shortening Relation: A load–independent index of myocardial contractily. J Am Coll Cardiol 1984; 4: 715–724. [ Links ]
10. Guadalajara JF, Martínez C, Gutiérrez PE, Zamora C, Huerta D: Estudio de la función ventricular mediante la cuantificación de la relación grosor/radio (h/r) del ventrículo izquierdo en sujetos sanos. Arch Inst Cardiol Mex 1989; 59: 293–300. [ Links ]
11. Balzer P, Furber A, Delépine S, Rouleau F, Lethimonnier F, Morell O, et al: Regional assessment of wall curvature stress in left ventricle with magnetic resonance imaging. Am J Physiol 1999; 277 (Heart Circ Physiol 46) H901–H910. [ Links ]
12. Delepine S, Furber AP, Beyqui F, Prunier F, Blazer P, LE Jeune JJ, Gelin P: 3–D MRI Assessment of regional left ventricular systolic wall stress in patients with reperfused M.I. Am J Physiol (Heart Circ Physiol) 2003; 284: H1190–1197. [ Links ]
13. Cué Carpio RJ, Meave A, Guadalajara–Boo JF: Estimación del Estrés parietal sistólico del ventrículo izquierdo por imagen de Resonancia Magnética Nuclear: una nueva aproximación al estudio de la poscarga. Arch Cardiol Mex 2005;5:1–70. [ Links ]
14. Guadalajara JF, Martínez C, Huerta D: La relación grosor/radio (h/r) del ventrículo izquierdo en la estenosis aórtica. implicaciones diagnósticas y terapéuticas. Arch Inst Cardiol Mex 1990; 60: 383–391. [ Links ]
15. Guadalajara JF, Gual J, Martínez SC, Monobe F, Alexanderson E, Cervantes JL: La hipertrofia miocárdica en la insuficiencia aórtica como mecanismo de compensación. Implicaciones para la indicación quirúrgica. Arch Inst Cardiol Mex 1992; 62: 351–360. [ Links ]
16. Guadalajara JF, Galván MO, Camacho P, Espinola N, Cervantes J, Huerta D: Cambios Estructurales y Funcionales en el corazón del hipertenso. Estudio Ecocardiográfico. Arch Inst Cardiol Mex 1995; 65: 31–38. [ Links ]
17. Guadalajara JF, Alexanderson E, Monobe F, Nieto S, Huerta D: La relación grosor/radio (h/r) del ventrículo izquierdo en la insuficiencia mitral pura. Arch Inst Cardiol Mex 1992; 62: 521–528. [ Links ]
18. Henry WL, De Maria A, Gramiack R, King DL, Kisslo JA, Popp RL: Report of the American Society of Echocardiography Committe on nomenclature and standards in two dimensional echocardiography. Circulation 1980; 62: 212–217. [ Links ]
19. Shiller NB, Shah PM, Crawford M: Recommendations for quantitation of the left ventricle by twodimensional echocardiography. J Am Soc Echocardiogr 1989; 2: 357–367. [ Links ]
20. Wahr DW, Wang YS, Shiller NB: Left Ventricular volume determined by two–dimensional echocardiography in normal adult population. J Am Coll Cardiol 1983; 81: 863–868. [ Links ]
21. Gaasch WH: Left ventricular radious to wall thickness ratio. Am J Cardiol 1979; 43: 1189– 1194. [ Links ]
22. Grossman W: Cardiac hypertrophy; useful adaptation or pathologic process. Am J Med 1980; 69: 576–582. [ Links ]
23. Braunwald E, Ross J Jr., Sonneblick EH: Mechanisms of contraction of the normal and failing heart. Boston, Little Brown, 1968. pag. 77. [ Links ]
24. Grossman W, Jones D, MC Laurin CP: Wall stress and Patterns of hypertrophy in human left ventricle. J Clin Invest 1975; 56: 56–64. [ Links ]
25. Grossman W, Braunwald E: The left ventricular end systolic stress–shortening and stress–length relations in humans. Am J Cardiol 1982; 50: 1301– 1308. [ Links ]
26. Osbakken M, Bove A, Span JF: Left Ventricular Function in Chronic Aortic Regurgitation With reference to Systolic Presure/volume and Stress relations. Am J Cardiol 1981; 47: 193–198. [ Links ]
27. Schunkert H, Jahn L, Isumo S: Localization and regulation of C–fos and C. jun protooncogene induction by systolic wall stress in normal and hypertrophied rat heart. Proc Natl Acad Sci 1991; 88: 11480–11484. [ Links ]
28. Morgan HE, Baker KM: Cardiac hypertrophy Mechanical, neural and endocrine dependence. Circulation 1991; 83: 13–25. [ Links ]
29. Weber LT, Brilla CG: Pathological hypertrophy and cardiac Interstitium Fibrosis and Renin–angiotensin–aldosterone system. Circulation 1991; 83: 1839–1865. [ Links ]
30. Verheul HA: Analysis of Risk Factors for excess mortality after aortic value replacement. J Am Coll Cardiol 1995; 26: 1280–1286. [ Links ]
31. Starling MR, Kirsh MM, Montgomery DG, Gross MD: Impaired Left Ventricular Contractile Function in Patients With Long Term Mitral Regurgitation and normal ejection fraction. J Am Coll Cardiol 1993; 22: 239–250. [ Links ]
32. Gunthe S, Grossman W: Determinants of Ventricular Function in pressure–overload hypertrophy in man. Circulation 1979; 59: 679–688. [ Links ]
33. Carabello BA, Green LH, Grossman W, Conh L, Koster K, Collins Jr. J: Hemodynamic determinants of prognosis of aortic valve replacement in critical aortic stenosis and advanced congestive heart failure. Circulation 1980; 62: 42–48. [ Links ]
34. Ross J. Jr: Afterload mismatch in Aortic and mitral valve disease implications of surgical therapy. J Am Coll Cardiol 1985; 5: 811–826. [ Links ]














