Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.77 no.2 Ciudad de México abr./jun. 2007
Investigación clínica
Reestenosis clínica en pacientes diabéticos con implante de stents liberadores de fármaco en lesiones de novo
Clinical restenosis in diabetic patients treated with drug eluting stents for de novo lesions
José Antonio Palomo Villada,* Enrique Bernal,** Jaime Santiago,** Arturo Abundes Velasco,* Armando Montoya Silvestre,* Jesús Flores Flores,* Belinda González Díaz,* Raúl Astudillo Sandoval,* Joel Estrada Gallegos,* Javier Farell Campa***
* Médico del Servicio de Hemodinamia.
** Médico Adiestramiento en Cardiología Intervencionista.
*** Jefe del Departamento de Hemodinamia. Hospital de Cardiología del Centro Médico Nacional Siglo XXI IMSS
Correspondencia:
José Antonio Palomo Villada.
Hospital de Cardiología,
CMN Siglo XXI, IMSS.
Av. Cuauhtémoc 330 Col Doctores
México D.F. 06720
Tel. 56 27 69 00 Ext. 22198
Recibido: 17 de febrero de 2006
Aceptado: 22 de febrero de 2007
Resumen
Revisamos la colocación de endoprótesis vasculares "stents" medicados y evaluamos los resultados clínicos y angiográficos, así como el seguimiento de los pacientes diabéticos que fueron sometidos a intervención coronaria percutánea (ICP).
Material y métodos: En el período comprendido del 1 de noviembre de 2004 al 31 de junio del 2005 durante el cual se realizaron 860 procedimientos de cardiología intervencionista, con aplicación de 112 stents medicados, de éstos a 42 pacientes con diagnóstico de diabetes mellitus (DM) con (2.6 stents por paciente), de tipo paclitaxel 60% y con sirolimus 40% con edades de 58 a 76 años promedio de 51.2 ± 9.6 de sexo masculino 25 (60%) y femenino 17 (40%). Con angina inestable 15 (35%) y angina estable 27 (65%) según la Canadian Cardiovascular Society (CCS). Con antecedentes de infarto del miocardio antiguo de localización anterior 20 (47%) inferior 8 (20%) y con enfermedad de múltiples vasos 16 (38%). El porcentaje promedio de obstrucción vascular fue de 85.9 ± 12.2 y la fracción de expulsión en rangos de 45 a 65 promedio (55 ± 10). Tiempo promedio de hospitalización 7 ± 5.4 días.
Resultados:El éxito clínico y angiográfico inmediato fue del 100%, el seguimiento clínico promedio fue de 7.6 ± 3.3 meses en 34 (80.9%) del total de los casos, sólo con revascularización de la lesión tratada (RLT) en 3 (7.1%). No reportamos eventos cardíacos adversos mayores: muerte, infarto o reinfarto (0%). Complicaciones: un paciente (2.3%) con insuficiencia renal aguda asociada al medio de contraste.
Conclusiones: Estos resultados sugieren que la aplicación de stents medicados (paclitaxel o sirolimus) en DM es un procedimiento exitoso clínico y angiográfico con bajo porcentaje de complicaciones y reestenosis a pesar de su mayor perfil de riesgo.
Palabras clave: Diabetes. Angioplastía. Stents medicados
Summary
We evaluated immediate and mid–term clinical and angiographic results in diabetic patients with percutaneous coronary intervention with deployment of drug eluting stents.
Methods:Between November of 2004 and June of 2005 percutaneous coronary interventions were performed 860 with the deployment of 112 drug eluting stents to 42 diabetic patients. The mean of stents was 2.6 per patient, and the type of drug eluting stent was paclitaxel in 60% and sirolimus in 40%. The average of age was 51.2 ± 9.6 years old. The gender was male in 25 (60%) of patients and female in 17 (40%). The indication of coronary angiography was unstable angina in 15 (35%) patients and stable angina in 27 (65%). There was history of anterior myocardial infarction in 20 (47%), inferior myocardial infarction in 8 (20%) and multiple vessel disease in 16 (38%). The stenosis severity of the lesion was 85.9% ± 12.2% and the left ventricular function was (55 ± 10). The hospital stay was 7 ± 5.4 days.
Results: Both clinical and angiographic immediate success was 100%. The average follow was 7.6 ± 3.3 months in 34 patients (80.9%). The target lesion revascularization (TLR) was 7.1%. (3 patients). Death, myocardial infarction o reinfarction (0%).
Complications: One patient (2.3%) developed contrast induced nephropathy.
Conclusions: These results suggest that the use of drug eluting stents (paclitaxel or sirolimus) in diabetic patients has a high rate of success with good angiographic and clinical results and with a low rate of complications or restenosis in this high risk group of patients.
Key words: Diabetes. Angioplasty. Eluting stents.
Introducción
La diabetes mellitus (DM) es una causa de morbilidad importante en la población mexicana, de 1980 a 2000 en el Instituto Mexicano del Seguro Social (IMSS) se observó un incremento del 350% en el número de consultas otorgadas, con un crecimiento de la población amparada por esta institución del 60% durante el mismo período.1 La distribución por grupos de edad mostró que el de mayor prevalencia (> 20%) fue de 60 a 69 años.2 La prevalencia de enfermedad coronaria en estos pacientes es del 55% comparado con el 2 a 4% de la población general y está asociada con incremento de la enfermedad arterial coronaria; multivaso, difusa, distal, vasos pequeños, presencia de trombo, circulación colateral pobre, enfermedad del tronco de la coronaria izquierda y peor función ventricular izquierda, además, se asocia más frecuente con mayor edad, obesidad, sexo femenino, hipertensión arterial, angina más severa,muerte súbita cardíaca e infarto del miocardio fatal y no fatal. La expectativa de vida se reduce entre 5 a 10 años.3 Actualmente, en el mundo existen más de 140 millones de personas con DM y según las estimaciones de la OMS, en el 2010 existirán más de 230 millones, preferentemente debido a un incremento de la DM tipo II, insulino–resistencia y el estado de hiperinsulinemia compensatoria que caracteriza al paciente DM. Estudios experimentales han demostrado que la insulina puede determinar directamente disfunción endotelial, incrementando el estrés oxidativo.4 El tratamiento es un desafío debido a la extensión de la enfermedad coronaria y a su progresión a través del tiempo.5–8 Los pacientes con DM frecuentemente desarrollan resultados adversos después de (ICP) incluyen una mayor tasa de eventos cardiovasculares mayores, reestenosis y revascularización de la lesión (RLT) y del vaso tratado (RVT). Diversas anormalidades biológicas y metabólicas existen, que se relacionan con una proliferación celular exagerada, lo cual se traduce en una mayor pérdida tardía, específicamente el engrosamiento vascular puede estar relacionado a la glucosilación de la elastina y el colágeno vascular.9 Otro contribuyente para un pronóstico adverso tanto angiográfico como clínico, es un estado alterado de la función plaquetaria, coagulación y fibrinólisis en esta población con DM, así como la disfunción endotelial, por lo que la terapia antiplaquetaria es muy importante10–14 La justificación de esta investigación es porque los stents liberadores de fármacos son efectivos en reducir la reestenosis en el tratamiento de lesiones de novo. En el subgrupo de alto riesgo de pacientes portadores de DM también ha demostrado su superioridad sobre los stents convencionales, por lo que es importante conocer la experiencia con el uso de estos dispositivos en este grupo de pacientes en nuestro medio. El objetivo fue conocer y evaluar el seguimiento tanto clínico como angiográfico, los resultados inmediatos y a mediano plazo con (ICP) más implantación de stent intracoronario liberador de fármaco, analizar los factores que influyeron en los resultados, determinar la reestenosis clínica y los eventos cardíacos adversos mayores a 6 meses, ya que hasta el momento existen muy pocos informes en la literatura internacional en este grupo de población y en nuestro medio no encontramos hasta el momento ningún informe, por tal razón, se consideró importante efectuar esta investigación.
Material y métodos
De noviembre del 2004 a junio de 2005, se implantaron 112 stents liberadores de fármacos en el Hospital de Cardiología del Centro Médico Nacional Siglo XXI del IMSS, a 42 pacientes con DM y se les dio seguimiento. Los criterios de inclusión fueron: DM tipo I y DM TII, ambas bajo control metabólico y que no presentaran complicaciones crónicas derivadas de DM como nefropatía etc. Con diagnóstico de cardiopatía isquémica por aterosclerosis coronaria, (angina estable, inestable e isquemia silente), que se encontrara la información completa de la base de datos creada ex profeso en el Servicio, tanto clínica, como angiográfica y en su defecto del archivo clínico del hospital.
Fueron excluidos: todos los enfermos con IAM, trombolizados, lesiones con trombo, bifurcadas, con calcificación severa, ruptura de músculo papilar, cuerdas tendinosas y/o ruptura de septum diagnosticados por ecocardiograma y enfermedad del tronco coronario izquierdo (TCI) > 50%, FE < 30%, con antecedentes de sangrado de tubo digestivo o de vías urinarias, cirugía mayor, hemoptisis, anticoagulación oral, así como hipertensión arterial sistólica mayor a 200 mm Hg, alérgicos a aspirina, clopidogrel y heparinas. De sexo masculino 25 (60%), femenino 17 (40%) con edades de 58 a 76 años promedio de 51.2 ± 9.6, con DM insulinodependiente sólo 4 (9.5%). El tipo de estudio fue prospectivo, descriptivo y observacional.
El protocolo para la intervención y aplicación de los stents fue el establecido en la literatura internacional.27-34 El tipo y número de stents, así como el balón fueron elegidos según el criterio del operador, utilizando dilatación previa siempre con balón, con relación 1:1, se prohibió la colocación de stent directo.
Las características de las lesiones encontradas se clasificaron de acuerdo a las guías de ACTP de Ryan y cols35,36 en: "B1 8.6% y B2 (60.8%)" de tipo tubulares, entre 10 a 20 mm de longitud, concéntricas, accesibles, contorno liso, segmento no angulado < 45°, no calcificadas y con ausencia de trombo. De tipo "C" (30.6%) lesiones difusas, de más de 2 cm de longitud, excesivamente tortuosas, con angulación > 90°, con oclusión total mayor a un mes y lesiones de injerto de vena safena reversa. La disección coronaria se definió de acuerdo a la clasificación de la NHLBI.35,36 Las indicaciones para el implante del stent: 1) de "novo" o primario en vasos > 3.0 mm, 2) por resultado "subóptimo" post ICP que mostrara lesión residual > 30% sin complicaciones angiográficas asociadas, 3) disección "B" o mayor, 4) amenaza de cierre abrupto o si se observa lesión residual > 50% asociada a disección aunque el flujo fuera TIMI grado 3. Las arterias seleccionadas para el procedimiento deberían tener un diámetro vascular > 3.0 mm. Todos los stents fueron dilatados a altas presiones luego de ser liberados en el segmento arterial de la obstrucción. Se consideró éxito técnico o angiográfico cuando el stent fue implantado en el sitio de la lesión, dejando una lesión residual ≤ 10%, sin evidencia de obstrucción aguda por la presencia de trombo o disección en el sitio del stent con flujo coronario normal. Resultado subóptimo fue definido como una estenosis residual ≥ 30% con flujo TIMI 3, o una estenosis residual <; 30% asociado con flujo TIMI 0–2. Un mal resultado angiográfico o ICP fallida fue definida como una estenosis residual > 50% o flujo TIMI < 2. Reestenosis clínica se definió como la presencia de sintomatología clínica de tipo anginoso o disnea, confirmada con los hallazgos de cambios ECG de isquemia en territorio de la arteria afectada, así como la presencia de PE eléctrica o por medicina nuclear durante el seguimiento.
Los eventos cardíacos adversos mayores fueron definidos como: muerte, infarto del miocardio, repetición de la revascularización de la lesión del vaso tratado por cirugía de revascularización miocárdica. El éxito clínico se definió por la mejoría de la sintomatología anginosa, ausencia de complicaciones mayores (reinfarto, isquemia recurrente, cirugía urgente o muerte relacionada con el procedimiento).
Cateterismo cardíaco: se realizó mediante abordaje de la arteria femoral (introductor de 6–7 F). En los pacientes con enfermedad multivaso se trató en principio la arteria culpable, se consideró como responsable la arteria en donde las pruebas de inducción de isquemia reportaran "isquemia moderada o severa". El introductor arterial se retiró cuatro horas posteriores al procedimiento y sólo en casos especiales cuando se necesitó el apoyo del balón intraaórtico de contrapulsación (BIAC), permanecieron por 24 horas o más. El apoyo del Servicio de Anestesiología se realizó en todos los casos. Todas las coronariografías fueron revisadas con detalle, en busca de trombo antes de la ACTP y luego del implante de los stents. El grado de severidad de la estenosis arterial así como el diámetro del vaso receptor del stent y el porcentaje de lesión residual en la predilatación post stent fueron medidos directamente de la angiografía coronaria. El diámetro de referencia del vaso fue definido como el promedio de los diámetros de referencia proximal y distal, medidos justo antes y después del segmento que recibió el stent. El porcentaje de estenosis se calculó sustrayendo el diámetro luminal mínimo de la lesión, del diámetro luminar del segmento vascular normal adyacente. En las lesiones ostiales, sólo se midió el diámetro de referencia distal. Durante la estancia hospitalaria se realizaron diariamente ECG y determinación de CPK (MB) hasta el alta del paciente. Todos se citaron al mes, 3, 6, 9 meses en la consulta externa y se les evaluó isquemia miocárdica (PE eléctrica o por MN) cuando reportaran sintomatología clínica y los que aceptaran, se efectuó nuevo control angiográfico.
Régimen antitrombótico: Se administró bolo de heparina de 5,000 UI después de la colocación del introductor y dosis adicionales para mantener un tiempo de coagulación de sangre activado > 300 segundos, utilizando el sistema Hemochrom. Todos recibieron aspirina (100 a 300 mg al día) y clopidogrel con dosis de impregnación de 300 mg seguidos de 75 mg VO una vez al día, al finalizar el procedimiento se continuó con estos medicamentos seis meses y aspirina de forma indefinida. Los inhibidores IIb/ IIIa a dosis terapéuticas en los casos de síndrome inestable coronario agudo (SICA) a discreción del operador.
Se analizaron las siguientes variables: edad, sexo, HAS, DM, tabaquismo, hipercolesterolemia, obstrucción significativa, arterias culpables, localización del IAM, fracción de expulsión del ventrículo izquierdo (FEVI), indicaciones para la angiografía coronaria, diámetro de las arterias en mm, presión para la colocación e impactación de los stents máxima (atm), resultados inmediatos, revascularización de la lesión tratada (RLT), revascularización del vaso tratado (RVT), eventos cardíacos adversos mayores, estancia hospitalaria y complicaciones.
Análisis estadístico: Los resultados se analizaron a través de los valores descriptivos del valor más típico del grupo: valor medio ± desviación estándar (media ± DE) y porcentajes. Todas las variables fueron cualitativas nominales.
Resultados
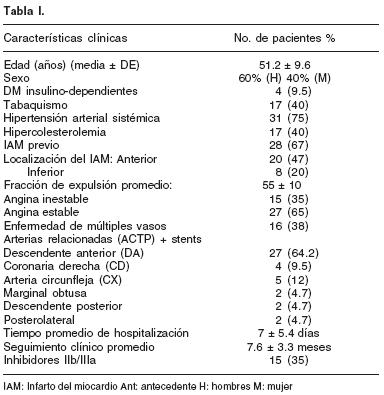
Características clínicas; los 42 pacientes diabéticos incluidos en este estudio fueron sometidos a ICP más colocación de stents medicados un total de 112 segmentos intracoronarios con un promedio de 2.6 stents por paciente, la edad promedio fue de 51.2 ± 9.6, con 25 hombres (60%) y 17 mujeres (40%). Con antecedentes de tabaquismo intenso 17 (40%), hipertensión arterial sistémica (HAS) 31 (75%), dislipidemia 17 (40%), angina inestable 15 (35%), angina estable 27 (65%), antecedentes del infarto del miocardio de localización anterior 20 (47%), inferior 8 (20%), enfermedad multivascular 16 (38%), la fracción de expulsión 55 ± 10. Uso de inhibidores IIb/IIIa en 15 (35%). Las arterias afectadas: descendente anterior 27 (64.2%), coronaria derecha 4 (9.5%), arteria circunfleja 5 (12%), marginal obtusa, descendente posterior y postero– lateral 2 (4.7%). En el seguimiento: mortalidad intrahospitalaria 0%, trombosis aguda o subaguda 0%, infarto agudo del miocardio en 0%, CRVM 0%. Tiempo promedio de hospitalización 7 ± 5.4 días, el seguimiento clínico promedio fue de 7.6 ± 3.3 meses. Las características clínicas de los pacientes se describen en la Tabla I.
Características angiográficas: las indicaciones para la implantación de los stents: resultado subóptimo 35 (83%), disección compleja 7 (17%). El tipo más frecuente de lesión encontrado fue: "B2" (60.8%), "C" (30.6%) y "B1" (8.6%). La relación entre el tipo de stent implantado y el diámetro del vaso fue 1:1 (3.15 ± 0.46) vs 3.0 ± 0.27. El grado de severidad de la obstrucción coronaria pre–stent fue de 85.9 ± 12.2 y post–stent 0, la presión atmosférica utilizada en promedio que se requirió para la impactación del stent fue de 12 ± 5. La longitud de la lesión promedio fue de 20.1 ± 5.25 mm.
El éxito clínico, técnico y angiográfico se obtuvo en 100%. Los tipos de stent utilizados fueron: paclitaxel (Taxus Boston Scientific) y de sirolimus (Cypher; Cordis, Johnson & Johnson): de tipo Taxus 60% y Cypher 40%. Solamente tuvimos una complicación de insuficiencia renal aguda por el medio de contraste utilizado, no fue necesario realizar diálisis, manejado médicamente y con hidratación. Ningún paciente fue enviado a cirugía de revascularización miocárdica (CRVM) de urgencia, ni en el seguimiento.
El seguimiento clínico promedio fue 7.6 ± 3.3 meses y se efectuó en la consulta externa al mes, a los tres meses, seis y nueve meses, se obtuvo en 34 (80.9%) de los pacientes, los cuales reportaron mejoría de su sintomatología anginosa, así como de la clase funcional y de la calidad de vida reflejada en la actividad cotidiana libre de síntomas. En todos en el seguimiento se efectuaron pruebas inductoras de isquemia eléctrica y/o por medicina nuclear. PE eléctrica (–) en 25 (59.5%) y por MN (+) en 9 (21.4%) con isquemia leve a moderada con relación a la arteria responsable, de éstos, sólo se documentó control angiográfico en 3 (7.1%), estos casos mostraron reestenosis en los bordes en dos e intrastent en uno, de la lesión tratada. El resto 6 (14.2%) no aceptó la realización de nuevo cateterismo cardíaco por motivos personales. No hubo complicaciones (muerte, infarto, reinfarto) durante la hospitalización ni en el seguimiento. Encontramos reestenosis clínica en el seguimiento en 2 (4.7%) y angiográfica en 3 (7.1%). RLT de 5 (11.8%) (Tabla II).
Discusión
Los estudios angiográficos han mostrado que los pacientes DM tienen una propensión mayor para oclusión total después del implante del stent, lo cual incrementa la mortalidad a largo plazo. Los vasos pequeños, la longitud de la lesión y la carga de placa pueden contribuir adicionalmente a una mayor reestenosis en estos pacientes. Aunque el stent coronario atenúa significativamente la reestenosis y la RVT en el paciente DM comparado con la ACTP convencional, la frecuencia y severidad de la reestenosis permanece elevada, comparada con los no DM, traduciéndose en una revascularización incompleta más frecuente y un mayor riesgo de morbimortalidad.15–21 En los stents liberadores de fármaco el polímero regula la liberación del paclitaxel (Taxus Boston Scientific) y sirolimus (Cypher; Cordis , Johnson & Johnson) en el sitio de lesión arterial y reduce la reestenosis clínica y angiográfica en lesiones de novo vs con los stents convencionales.22–26
Los estudios de STRESS37y BENESTENT38demostraron por primera vez, de manera significativa, la eficacia del stent para reducir la reestenosis comparada con la ACTP sólo con balón (32% con stent vs 42% con balón). Rodríguez desde 199539 demostró que con el empleo de stents se redujo la reestenosis en pacientes con ACTP exitosa, en las cuales se documentó "pérdida temprana" de la ganancia obtenida por retracción elástica. El subanálisis de los 92 pacientes DM del estudio STRESS I y II, que comparaba la eficacia clínica y la tasa de reestenosis a seis meses entre pacientes aleatorizados a ACTP con balón o a ACTP con stent, demostró que el stent en DM se asociaba a una mayor tasa de éxito angiográfico inicial, con una ganancia inicial más elevada (1.61 vs 1.06 mm; p < 0.001) y de éxito del procedimiento (stent 100%, balón 82%; p < 0.01); y a largo plazo, el stent determinaba una incidencia menor de reestenosis a seis meses (24% vs 60%; p < 0.01) y de necesidad de nueva RVT (13% vs 31%) p = 0.03. Desde un punto de vista clínico, los DM tienen una evolución peor que los no DM a medio y largo plazo, a 5 años, la incidencia de acontecimientos clínicos fue un 39% superior, se encontró que la DM junto a la hipertensión y la enfermedad multivaso, eran predictores independiente de la mala evolución a largo plazo. Los mecanismos involucrados en el proceso de reestenosis incluyen un estado protrombótico y antifibrinolítico, que incrementa el riesgo de trombosis vascular y disfunción del endotelio, que contribuye a la trombosis coronaria y vasoespasmo, además del efecto de la insulina combinado con factores tales como el factor–1 de crecimiento, factor–beta transformador de crecimiento y factor de crecimiento fibroblástico básico, que incrementa el proceso de reestenosis por inducción de la proliferación y migración de las células musculares lisas y la producción de matriz extracelular.10–14 La hiperinsulinemia puede provocar vasoespasmo y trombosis coronaria por estimulación del inhibidor tipo–1 de plasminógeno e inhibición de la fibrinólisis. 9,14,17,18–23,25 El estudio (RAVEL) incluyó a 19 centros y 238 pacientes con seguimiento a un año, 23% con DM. Reportó ECAM en 5.8% en stent medicado vs 28.8% con stent convencional (P < 0.001), RLT 0% vs 22.9% y reestenosis 0 vs 26.6% (P < 0.001) respectivamente, todos con control de angiografía cuantitativa y por IVUS, este informe multicéntrico hace evidente el beneficio de los stents medicados, ya que elimina el desarrollo de la proliferación neointimal, independientemente del diámetro del vaso y no existe una relación inversamente proporcional al porcentaje de reestenosis.26
El mecanismo primario de acción del paclitaxel es la despolimerización de los microtúbulos, lo cual se requiere en el proceso de mitosis en la anafase. Debido a que el paclitaxel modula la mitosis celular hacia la baja sw l TRAS/Raf/MAP quinasa e independientemente de las vías de transducción de señales del PI 3 quinasa/PKb/ mTOR es particularmente útil en DM con resistencia a la insulina, inhibiendo las vías de hiperplasia neointimal en paciente insulina y no insulina dependientes. Adicionalmente los microtúbulos controlan funciones celulares relacionadas a la reestenosis, incluyendo señales celulares, activación, proceso secretor y migración.40–43 Yang evalúa y compara el efecto de los stents liberadores de fármaco en los resultados clínicos y angiográficos en pacientes DM y no DM a quienes se les realizó ICP en práctica de "mundo real." Estudiaron 226 DM y 560 no DM reportó una frecuencia de reestenosis angiográfica de 10.1% vs 8.2% p = 0.41, la pérdida tardía fue de 0.41 ± 0.63 vs 0.36 ± 0.65 p = 0.31. La incidencia de ECAM fue similar 4.9 vs 4.8% y la tasa de RLT fue de 4.4% vs 4.1% p = 0.84. Los pacientes insulinodependientes mostraron mayor prevalencia de reestenosis (25% vs 8.5% p = 0.04). Encontrando resultados similares entre DM y no DM.44
Nosotros no realizamos un estudio comparativo, pero previamente ya publicamos nuestra experiencia en paciente DM con stent no medicado y obtuvimos reestenosis del 30% en el seguimiento de 6 a 9 meses, 32 además en la investigación actual sólo incluimos 4 (9.5%) DMID y los resultados son similares a lo reportado, desafortunadamente no fue posible realizar control angiográfico en todos, ya que no justificamos la razón de enviar a hemodinamia a pacientes sin pruebas de inducción de isquemia o con resultado negativo, en nuestro grupo el 59.5% fue negativa. Schofer45 en 35 centros clínicos Europeos enroló 352 pacientes con el 23% de DM con seguimiento a 8 meses informa que los factores que contribuyen al riesgo de reestenosis fueron: vasos pequeños, lesiones largas e implantación de múltiples stents. La RLT fue de 4%, comenta que el segmento del vaso adyacente puede ser lesionado con la predilatación, al impactar el stent y en la postdilatación o en la combinación de éstos, cubrir de manera incompleta una lesión o dejar un gap intrastents o el uso de stents de mayor diámetro puede ser resultado de fallar en el tratamiento. Nosotros no incluimos vasos pequeños, pero sí lesiones mayores de 20 mm y aplicamos múltiples stents, promedio de 2.6 por paciente, lo que convierte a este subgrupo en de alto riesgo, con cuidado en cubrir toda las lesiones sin dejar segmentos entre cada stent, en cuanto a la RLT 3 (7.1%) estamos dentro del rango de otras publicaciones. Moses y cols46 (SIRIUS) incluyen 1,058 pacientes de 53 centros con 26% DM con seguimiento a 9 meses con control angiográfico e IVUS, reportan RLT 16.6% con stent convencional vs 4.1% stent con sirulimus (P < 0.001) con una reducción del 22.3% a 6.9% (P < 0.001) y reestenosis del 3.2% stent sirulimus vs 35.4% stent no medicado (P < 0.001) con una reducción del 51.5% a 17.5%. Demuestran una supresión de la hiperplasia neoíntima, posterior a la colocación de stent medicado. Recomiendan el uso de técnica con predilatación con balón corto, el uso de un solo stent largo y cubrir la zona dañada por el balón de ACTP, ya que los sitios de reestenosis ocurren predominantemente en las márgenes de los stents que no son cubiertas de vasos pequeños. Nosotros no colocamos stent directo, siempre realizamos en este grupo predilatación y también siempre cubrimos la zona dañada por el balón. Schampaert47 del grupo (C–SIRIUS) comparó stent con sirulimus vs stent convencional en 100 pacientes, 24% con DM, con seguimiento a 270 días, diámetro del vaso de 2.63 ±0.33 mm, y longitud de 15 a 32 mm promedio 23.8 ± 8.4 mm control angiográfico a los 8 meses, reportó reestenosis angiográfica en 1 (2.3%) vs 23 (52.3%) P < 0.001. La RLT 4% vs 18% respectivamente (P = 0.05), este grupo se informa de alto riesgo por la longitud de la lesión,vasos pequeños y stents múltiples. Conclusión. Reduce dramáticamente la reestenosis. Gershlick del grupo europeo de evaluación de stent medicado con paclitaxel (ELUTES)48–49 con 190 pacientes con seguimiento angiográfico a 6 meses de 20.6 en el grupo control vs 3.2% Con RLT 16% en el grupo control vs 5% con stent medicado, ECAM no muertes, no infarto, no trombosis 82% en grupo control vs 86% stent con paclitaxel. Stone50 en el estudio multicéntrico de 53 hospitales y 1,314 pacientes con en 24.2% de DM, demostró que los tres principales determinantes de reestenosis después de la implantación de stents medicados en DM son: el diámetro de referencia, la longitud de la lesión y longitud del stent implantado, se encontró que el riesgo de reestenosis se redujo en 80%. Kastrati51 del estudio (ISAR–DESIRE) incluyó 300 pacientes 31% DM investigó como primer objetivo reestenosis a 6 meses con control angiográfico y encontró 44.6% en ICP y 14.3% en stent medicado con sirolimus y 21% con paclitaxel (P < .001) la incidencia de RVT 33% vs 8% con sirulimus y 19% con paclitaxel (P = 0.02) respectivamente, también demostró la superioridad del stent medicado. Hace mención que los resultados en lesiones bifurcadas y complejas tienen malos resultados. Nosotros no incluimos lesiones de oclusiones totales, de los hemoductos de vena safena, bifurcadas, ni del TCI, esto probablemente influyó en nuestros resultados. Hermiller del estudio TAXUS IV 52 incluyó 1,314 pacientes aleatorizados prospectivamente con el implante de stent liberador de fármaco con paclitaxel y stent convencional. En DM 318 (24%) 105 eran insulinodependientes. Se redujo la reestenosis angiográfica un 81% (6.4% vs 34.5%), p < 0.0001 y se redujo la RVT 65% (7.4% vs 20.9%) p = 0.0008), la RLT un 53% (11.3% vs 24%), p < 0.004 y los ECAM 44% (15.6% vs 27.7%) p = 0.0065. En el subgrupo de pacientes insulinodependientes el stent TAXUS redujo la reestenosis angiográfica un 82% (7.7% vs 42.9%), p = 0.0065 y la tasa de RLT 68% (6.2% vs 19.4%), p = 0.07 mostrando que el stent TAXUS es altamente efectivo en reducir la restenosis angiográfica y clínica en pacientes DM. Con todas las evidencias informadas no queda duda del beneficio otorgado a este grupo particular de pacientes.53–58
Limitaciones
Las limitaciones observadas en esta investigación son, primero: que no es un estudio aleatorizado y no es comparativo, es retrospectivo, observacional y descriptivo, por lo que los resultados obtenidos sólo demuestran una tendencia favorable de esta modalidad terapéutica, segundo: nuestra población contiene un grupo relativamente pequeño comparado con series internacionales o estudios multicéntricos, tercero: la mayoría de estos pacientes fueron tratados electivamente, posterior a resultado subóptimo de ICP con la aplicación inmediata del stent coronario, y los pacientes con IAM no se incluyeron, cuarto: desafortunadamente no contamos con control angiográfico de todos los pacientes para demostrar la contundencia de los resultados en cuanto a la reestenosis y RLT y RVT para establecer el papel benéfico y definitivo en este grupo particular de enfermos, nuestro seguimiento es relativamente aún corto, además se requiere investigar resultados en lesiones bifurcadas, oclusiones totales crónicas y del TCI.
Conclusiones
La población de pacientes diabéticos del país continúa actualmente en crecimiento, lo que indica que se deberá ser más juicioso en cuanto a la estrategia de manejo ya sea Qx o por ICP, en la medida en que se conjugue una buena terapia farmacológica, así como el control temprano de los factores de riesgo cardiovascular que retrasen la aparición de enfermedad arterial crónica, se mejorará el pronóstico y la sobrevida a largo plazo de los pacientes con DM, de tal manera que podremos obtener mejores resultados a mediano y largo plazo con esta nueva modalidad de stents medicados, de tal forma que dejemos a la cirugía de revascularización miocárdica con puentes de vena safena reversa o arteria mamaria interna como la última opción terapéutica para este grupo particular de enfermos. Nuestros resultados confirman los excelentes resultados obtenidos con stents medicados en los estudios multicéntricos randomizados en el mundo real.
Referencias
1. Escobedo de la Peña J: Frecuencia de la diabetes mellitus, mortalidad y morbilidad. Temas de Medicina Interna: Interamericana. Asociación de Medicina Interna de México; 1993; 4(1): 643–653. [ Links ]
2. Instituto Nacional De Nutrición Salvador Zubirán: Encuesta Nacional de Enfermedades Crónicas: Dirección General de Epidemiología; 1993. [ Links ]
3. Hamby R, Sherman L, Metha J, Aaintablian A: Repraisal of the role of diabetic state in coronary artery disease. Chest 1976; 70: 251–257. [ Links ]
4. Esmatjes E, Vidal J: Repercución cardíaca de la diabetes mellitus. Rev Esp Cardiol 1998; 51 (8): 661–670. [ Links ]
5. Dortimer A, Shenoy P, Shiroff R, Leaman D, Babb J, Liedtke A, et al: Diffuse coronary artery disease in diabetic patients: fact or fiction? Circulation 1978; 57: 133–136. [ Links ]
6. Kannel W, McGee D: Diabetes and cardiovascular disease: the Framingham Study. JAMA 1979;241: 2035–2038. [ Links ]
7. Uusitupa M, Niskanen L, Siitonen O, Voutilainen E, Pyorala K: 5 year incidence of atherosclerotic vascular disease in relation in general risk factor, insulin level and abnormalities in lipoprotein composition in non– insulin–dependent diabetic and no diabetic subjects. Circulation 1990; 82: 27–36. [ Links ]
8. Krolewiski A, Kozinki E, Warram J, Leland O, Busick E, Asmal A, et al: Magnitude and determinants of coronary artery disease in juvenile onset insulin–dependent diabetes mellitus. Am J Cardiol 1987; 59: 750–755. [ Links ]
9. Stamler J, Vaccaro O, Neaton J, Wenworth D, for the Multiple risk factor Interventional trial Research Group: Diabetes, other risk factors and 12 year cardiovascular mortality for men screened in the multiple risk factor intervention trial. Diabetes Care 1993; 16: 434–444. [ Links ]
10. Van B, Bauters C, Hubert R, Bodart J, Abolmaali K, Meurice T: Restenosis rates in diabetic patients: a comparison of coronary stenting and balloon angioplasty in native coronary arteries. Circulation 1997: 96; 1454–1460. [ Links ]
11. Serruys P, De Jaeguer P, Kiemenei F: A comparison of balloon–expandable–stent implantation with balloon angioplasty in patients with coronary artery disease. N Engl J Med 1994; 331: 489–495. [ Links ]
12. Berger P, Bell M, Grill D, Melby S, Holmes D: Frequency of adverse clinical events in the 12 following successful intracoronary stent placemen in patient treated with aspirin and ticlopidina. Am J Cardiol 1999; 81: 713–718. [ Links ]
13. Mousa Ï, Oetgen M, Roubin G, Colombo A, Wang X: Effectiveness of Clopidogrel and aspirin versus ticlopidina and aspirin in preventing stent thrombosis after coronary stent implantation. Circulation 1999; 18: 2364–2366. [ Links ]
14. Kleinman N, Lincoff A, Kereiakes D, Millier D, Aguirre F: Diabetes mellitus, glycoprotein IIb/IIIa blockade, and heparin. Evidence for a complex interaction in metacenters. Circulation 1998; 97: 1912–1920. [ Links ]
15. Stein B, Weintraub W, Gebhart S, Cohen C, Grosswald R, Liberman H, et al: Influence of diabetes mellitus on early and late outcome after percutaneous Transluminal Coronary Angioplasty. Circulation 1995; 91: 979–989. [ Links ]
16. Savage M, Fishman D, Slota P, Rake R, Leon M, Schatz R: Coronary intervention in the diabetic patient: improved outcome following stent implantation versus balloon angioplasty. J Am Coll Cardiol 1997; 29 (Suppl A): 188A. [ Links ]
17. Carroza J, Kuntz R, Fishman R, Baim D: Restenosis after arterial injury caused by coronary stenting in patients with diabetes mellitus. Ann Inter Med 1993; 118: 344–349. [ Links ]
18. Elezi S, Schulen H, Wehinger A, Ziztmann–Roth E, Walter H, Hausleiter J: Stent placement in diabetic versus non diabetic, six month angiographic follow–up. J Am Coll Cardiol 1997; 29(Suppl A): 118. [ Links ]
19. Yokoi H, Nosaka H, Kimura T, Tamura T, Nakagawa Y, Hamasaki N, et al: Coronary stenting in the diabetic patients: early and follow–up results. J Am Coll Cardiol 1997; 27 (Suppl A): 455A. [ Links ]
20. Abizaid A, Mehran R, Bucher T, Greenberg A, Popma J, Mintz G, et al: Does diabetics influence clinical recurrence after coronary stent implantation. J Am Coll Cardiol 1997; 29 (Suppl A): 188A. [ Links ]
21. Elezi S, Kastrati A, Pache J, Wehinger A, Hadamitzky M, Dirschinger J, et al: Diabetes mellitus and the clinical and angiographic outcome after coronary stent placement. J Am Coll Cardiol 1998; 32: 1866–1873. [ Links ]
22. Ortolani P, Ardissino D, Cavallini C, Bramucci E, Indolfi C, Aquilina M, et al: Effect of Sirolimus– Eluting Stent in Diabetic Patients with Smal Coronary Arteries (A SES–SMART Substudy). Am J Cardiol 2005; 96: 1393–98. [ Links ]
23. Hermiller J, Raizner A, Cannon L, Gurpel P, Kutcher M, Chiu S, et al: Outcomes with the polymer–based paclitaxel–eluting TAXUS stent in patients with diabetes mellitus. The TAXUS–IV trial. J Am Coll Cardiol 2005; 45: 1172–79. [ Links ]
24. Hammoud J, Tanguay J, Bourassa M: Management of coronary artery disease: therapeutic options in patients with Diabetes. J Am Coll Cardiol 2000; 36: 355–65. [ Links ]
25. Souza J, Costa M, Abizaid A, Renzing B, Abizaid A, Tanajura L, et al: Sustained suppression of neointimal proliferation by sirolimus–eluting stents. One year angiographic and intravascular ultrasound follow–up. Circulation 2001; 104: 2007–2011. [ Links ]
26. Morice M, Serruys P, Sousa E, Fajadet J, Ban Hayashi E, Perin M, et al: A randomized of sirolimus– eluting stent with a standard stent for coronary revascularization. N Engl J Med: 2002; 346: 1773–1789. [ Links ]
27. Ledesma M, Farrell J, Astudillo R, Abundes A, Escudero J, Montoya A: Stents coronarios: Experiencia en el Hospital de Cardiología del Centro Médico Siglo XXI. Arch Inst Cardiol Mex 1997; 67: 101–105. [ Links ]
28. Palomo J, Solorio S, Farrell J, Abundes A, Ledesma M: Resultados inmediatos post implante de stents coronarios en pacientes octogenarios. Arch Inst Cardiol Mex 1999; 68: 18–26. [ Links ]
29. Martinez RM, Elid G, Luna J, Villavicencio R, Ban E, Gaspar J, et al: Beneficio del stent coronario en la reducción de complicaciones cardíacas mayores en síndromes coronarios agudos. Arch Inst Cardiol Mex 1999; 69: 121–126. [ Links ]
30. Farrell J, Palomo J, Abundes A, Ledesma M: Stent en tronco coronario izquierdo protegido y no protegido:Resultados y seguimiento a corto plazo. Arch Inst Cardiol Mex 2000; 70: 38–45. [ Links ]
31. Palomo J, Reyes F, Plaza A, Farrel J, Abundes A, Montoya A, et al: Seguimiento clínico y angiográfico en adultos jóvenes post ACTP más stents intracoronarios. Arch Cardiol Mex 2001;71: 34–42. [ Links ]
32. Palomo J, Reyes F, Montoya A, Farrel J, Abundes A, Ledesma M: Resultados inmediatos y a mediano plazo post implante de stents coronarios en pacientes diabéticos. Arch Cardiol Mex 2002; 72: 36–44. [ Links ]
33. Palomo J, Padilla F, Reyes F, Montoya A, Astudillo R, Flores J, Farrel J, et al: Resultados de implantación de stent coronario en angioplastía primaria en el infarto agudo del miocardio. Rev Mex Cardiol 2004; 15(2): 66–74. [ Links ]
34. Mock M, Colmes D, Vliestra R, Gersh B, Detret K, Kelsey N, et al: Percutaneous transluminal coronary angioplasty (PTCA) in the elderly patients: experience in the National Heart, Lung and Blood Institute PTCA Registry. Am J Cardiol 1984; 53: 89C–91C. [ Links ]
35. Ryan T, Bauman W, Kennedy J, Kereiakes D, King III S, McCallister B, et al: Guidelines for percutaneous transluminal coronary angioplasty. A report of the American College of Cardiology/ American Heart Association task force on assessment of diagnostic and therapeutic cardiovascular procedures (Committee on percutaneous transluminal coronary angioplasty). J Am Coll Cardiol 1993; 22: 2033–2054. [ Links ]
36. Fedd M, O'Neill V, Safian R: Dissection and acute closure. The manual of Interventional Cardiology. Birmingham, Michigan. Physician's Press 2000: 387–405. [ Links ]
37. Fishman D, Leon M, Baim D: A randomized comparison of coronary stent placement and balloon angioplasty in the treatment of coronary artery disease. N Engl J Med 1994; 331: 496–501. [ Links ]
38. Serruys P, Jaegere P, Kiemeneij F: A comparison of balloon expandable stent implantation with balloon angioplasty in patients with coronary artery disease. N Engl J Med 1994; 331: 489–495. [ Links ]
39. Rodriguez A, Santaera O, Larribau M: Coronary stenting decreases restenosis in lesions with early loss in luminal diameter 24 hours after successful PTCA. Circulation 1995; 91: 1397–1402. [ Links ]
40. Grube E, Silber S, Hauptmann K, Mueller R, Buellesfeld L, Gerckens U, et al: TAXUS I. Six and twelve–months results from randomized, double–blind trial on a slow–release Paclitaxel–eluting stent for De Novo coronary lesions. Circulation 2003; 107: 38–42. [ Links ]
41. Tanabe K, Serruys P, Grube E, Smits P, Selbach G, Van Der Giessen W, et al: TAXUS III Trial. In stent restenosis treated with stent based delivery of paclitaxel incorporated in a slow–release polymer formulation. Circulation 2003; 107: 559–564. [ Links ]
42. Regar E, Serruys P, Bode C, Holubarsch C, Germonprez J, Wijns W, et al: Angiographic findings of the multicenter randomized study with the Sirolimus–eluting Bx Velocity balloon–expandable stent (RAVEL). Circulation 2002; 106: 1949–1956. [ Links ]
43. Smith S, Faxon D, Cascio W, Schaff H, Gardner T, Jacobs A, et al: Prevention Conference VI. Diabetes and Cardiovascular Disease. Revascularization in Diabetes Patients. Circulation 2002; 105: e165– e169. [ Links ]
44. Yang T, Park S, Hong M, Park D, Park K, Kim Y, et al: Impact of diabetes mellitus on angiographic and clinical outcomes in the drug–eluting stents era. Am J Cardiol 2005; 96: 1389–92. [ Links ]
45. Schofer J, Schluter M, Gerslick A, Winjs W, Garcia E, Schampaert E, et al: Sirolimus–eluting stents for treatment of patients with long atherosclerotic lesions in small coronary arteries: double– blind randomized controlled trial (E–SIRIUS). Lancet 2003; 362: 1093–1099. [ Links ]
46. Moses J, Leon M, Popma J, Fitzgerald P, Holmes D, O'Shaughnessy C, et al: Sirulimus–eluting stents versus standards stents in patients with stenosis in a native coronary artery. ( SIRIUS Investigators).N Engl J Med 2003; 349: 1315–1323. [ Links ]
47. Schampaert E, Cohen E, Schluter M, Reeves F, Traboulsi M, Title L, et al: The Canadian study of the Sirulimus–eluting stent in the treatment of patients with long De Novo Lesions in small native coronary arteries (C–SIRIUS). J Am Coll Cardiol 2004; 43: 1110–1115. [ Links ]
48. Ardisisino D, Cavallini C, Bramucci E, Indolfi C, Marzocchi A, Manari A, et al: (SES–MART) Sirulimus–eluting vs uncoated stents for prevention of restenosis in small coronary artery. JAMA 2004; 292: 2727–2734. [ Links ]
49. Gershlick A, De Scheerder I, Chevalier B, Sthephens A, Camenzind E, Vrints C, et al: Inhibition of restenosis with a paclitaxel–eluting, polymerfree coronary stent. The European evaluation of paclitaxel eluting stent. (ELUTES) trial. Circulation 2004; 109: 487–493. [ Links ]
50. Stone G, Ellis E, Cox D, Hermiller J, O'Shaughnessy C, Mann C, et al: A polymerbased paclitaxel–eluting stent in patients with coronary artery disease. N Engl J Med 2004; 350: 221–231. [ Links ]
51. Kastrati A, Mehilli J, Von Beckerth N, Dibra A, Hauslester J, Pache H, et al: Sirulimus–eluting stent or paclitaxel–eluting stent vs balloon angioplasty for prevention of recurrences in patients with coronary in–stent restenosis. JAMA 2005; 293: 165–171. [ Links ]
52. Hermiller J, Raizner A, Cannon L, Gurbel P, Kutchner M, Wong S, et al: Outcomes with the polymer–based paclitaxel–eluting TAXUS Stent in patients with Diabetes Mellitus. The TAXUS –IV Trial. J Am Coll Cardiol 2005; 45: 1172–1179. [ Links ]
53. Hong M, Mintz G, Lee CH, Song J, Ham K, Kang D, et al: Paclitaxel coating reduces in–stent intimal hyperplasia in human coronary arteries. A serial volumetrical intravascular ultrasound analysis from the Asian Paclitaxel–eluting stent clinical trial. (ASPECT). Circulation 2003; 107: 517–520. [ Links ]
54. Lansky A, Costa R, Mintz G, Tsuchiya Y, Midei M, Cox D, et al: Non Polymer based Paclitaxel coatedcoronary stents for the treatment of patients with De Novo coronary lesions. Angiographic follow–up of the DELIVER clinical trial. Circulation 2004; 109: 1948–1954. [ Links ]
55. Goy J, Stauffer J, Siegenthaler M, Benoit A, Seydoux C: A prospective randomized comparison between paclitaxel and sirolimus stents in the real world of Interventional Cardiology. The TAXI Trial. J Am Coll Cardiol 2005; 45: 308–311. [ Links ]
56. Babapulle M, Joseph L, Belisle P, Brophy J, Eisenberg M: A hierachial Batesian meta–analysis of randomized clinical trials of drug–eluting stents. Lancet 2004; 364: 583–591. [ Links ]
57. Windecker S, Remondino A, Eberli F, Juni P, Raber L, Wenaweser P, et al: Sirolimus–eluting and paclitaxel–eluting stents for coronary revascularization. N Engl J Med 2005; 353: 653–662. [ Links ]
58. Dibra A, Kastrati A, Mehilli J, Pache J, Schulen H, Von Beckerath N, et al: ISAR–DIABETES. Paclitaxel–eluting stent or Sirolimus–eluting stents to prevent restenosis in Diabetic patients. N Engl J Med 2005; 353: 663–670. [ Links ]














