Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.76 supl.4 Ciudad de México oct./dic. 2006
Investigación Clínica
Cardiopatía isquémica: evaluación anatomofuncional en una sola exploración con PET–CT multicorte
Ischemic heart disease: anatomic and functional evaluation in a single exploration with multi–slice PET–CT
Erick Alexánderson*, Patricio Cruz**, Carlos Sierra**, José Antonio Talayero**, Aloha Meave***
* Unidad PET–Ciclotrón, Facultad de Medicina, Universidad Nacional Autónoma de México. Imagen Cardiovascular, Instituto Nacional
de Cardiología Dr. Ignacio Chávez, México D. F.
Departamento de Medicina Nuclear y Tomografía Cardíaca. Instituto Nacional de Cardiología Dr. Ignacio Chávez.
** * Unidad PET–Ciclotrón, Facultad de Medicina, Universidad Nacional Autónoma de México. Imagen Cardiovascular, Instituto Nacional
de Cardiología Dr. Ignacio Chávez, México D. F.
*** Departamento de Resonancia Magnética y Tomografía Computada. Instituto Nacional de Cardiología Dr. Ignacio Chávez.
Correspondencia:
Dr. Erick Alexánderson Rosas.
Departamento de Medicina Nuclear
Instituto Nacional de Cardiología Ignacio Chávez.
Juan Badiano Núm. 1, col. Sección XVI, Tlalpan 14080, México D.F.
Correo electrónico: alexanderick@yahoo.com
Resumen
El abordaje integral del paciente con cardiopatía isquémica requiere de una evaluación precisa anatomo–funcional del miocardio así como de las arterias coronarias. Actualmente los avances tecnológicos permiten la valoración de la fisiología cardiovascular mediante Tomografía por Emisión de Positrones (PET). El PET es una herramienta confiable para el estudio del metabolismo cardíaco, la perfusión miocárdica, la función ventricular, el flujo coronario, la viabilidad miocárdica y la función endotelial. Sin embargo, una de las principales limitaciones del PET radica en su baja resolución espacial. La Tomografía Computada de Corazón (TCC) es un estudio anatómico que permite cuantificar el grado de calcificación intracoronaria (índice de calcio), estudiar tanto la luz como la pared arterial, verificar la permeabilidad vascular y determinar la extensión, severidad y composición de las placas ateroscleróticas. La principal limitación de la TC es que no permite evaluar la repercusión funcional de las alteraciones anatómicas encontradas. Debido a estas características ambos métodos resultan complementarios en la evaluación del paciente isquémico. Es por ello que hoy en día se pueden encontrar equipos híbridos PET–CT que permiten evaluar en una sola exploración el estado anatómico y funcional del paciente, brindando una enorme cantidad de información útil en el diagnóstico, clasificación y pronóstico.
Palabras clave: Cardiopatía isquémica. PET – CT. Tomografía por emisión de positrones (PET). Tomografía cardiovascular (TC).
Summary
A complete evaluation of the patient with ischemic heart disease requires an anatomical and functional assessment of the myocardium and coronary arteries. Recent technological advances have allowed a quantitative and physiological evaluation of the cardiovascular system with Positron Emission Tomography (PET).This method is a valuable tool for the assessment of heart metabolism, myocardial perfusion, ventricular function, coronary blood flow, myocardial viability and endothelial function. One of the major limitations of a PET study is its low spatial resolution. Cardiac Computed Tomography (CCT) is an anatomic study used for coronary calcium quantification, evaluation of wall and lumen of coronary arteries, study of vascular permeability and assessment of composition, extension and severity of atherosclerotic plaques. The main limitation of CCT is the lack of functional information that is obtained with this technique. Both methods are complementary in many ways. That is the reason of the wide spread of PET–CT hybrid equipments that can provide very useful functional and anatomic information of patients with ischemic heart disease in a single exploration.
Key words: Ischemic heart disease. PET–CT. Positron emission Tomography. Cardiovascular tomography.
Introducción
El abordaje integral del paciente con cardiopatía isquémica mediante estudios de imagen tiene como objetivo realizar un diagnóstico preciso, establecer el grado de severidad de la enfermedad arterial coronaria (EAC), definir pronóstico y por lo tanto, normar la conducta terapéutica a seguir. En los años recientes con el advenimiento de nuevas herramientas tecnológicas es posible estudiar al paciente con cardiopatía isquémica desde diferentes enfoques, obteniendo una gran cantidad de datos útiles para su manejo clínico. La tomografía por emisión de positrones (PET) y la tomografía computada de corazón (TCC) se han posicionado recientemente como los pilares del estudio no invasivo de la patología isquémica del corazón.1–5 Ambas técnicas aplicadas en conjunto poseen enormes recursos útiles para el estudio anatómico y funcional del paciente, sin embargo, cada método aislado presenta limitaciones técnicas que deben ser consideradas al momento de decidir qué estudio es el ideal para cada paciente en particular. El objetivo de esta revisión es analizar ambas técnicas de imagen por separado para comprender sus ventajas, limitaciones y el beneficio de conjuntar ambas opciones en un equipo híbrido que complementa y amplía las funciones de dichos estudios.
Tomografía por emisión de positrones (PET)
El PET es un estudio de gran utilidad en la clínica cardiovascular ya que permite evaluar de una manera cualitativa y semicuantitativa el estado funcional del corazón y de las arterias coronarias. Sus principales aplicaciones en este momento consisten en el estudio del metabolismo y la perfusión miocárdica, la determinación del flujo coronario, la función ventricular (principalmente del ventrículo izquierdo), la viabilidad miocárdica y la función endotelial.4,5
El PET como estudio funcional, requiere la elaboración de un radiofármaco (o radiotrazador) específico para evaluar las características fisiológicas del tejido que se estudia. Estos radiofármacos son moléculas biológicamente activas unidas a isótopos radioactivos que decaen mediante la liberación de positrones. Para obtener estos elementos radioactivos se requiere de un Ciclotrón que realice un bombardeo atómico y transfiera partículas subatómicas de un elemento a otro. Una vez que los protones penetran el núcleo se convierten en positrones, es decir partículas idénticas a un electrón pero con carga positiva. Debido a la diferencia de carga entre electrones y positrones se genera una gran atracción entre ellos, lo que provoca que choquen y se aniquilen. Durante la reacción de aniquilación se genera radiación gamma en forma de dos fotones que viajan en dirección opuesta a 180° uno con respecto del otro con una energía de 511 keV (kiloectron volts). La Cámara PET es capaz de detectar la coincidencia de este par de fotones y transformarlos en datos e imágenes útiles en la evaluación de la vía metabólica estudiada.6
Los radiotrazadores utilizados para evaluar la perfusión miocárdica son principalmente el nitrógeno–13 amonio ([13N]–NH3) con una vida media de 9.9 minutos, el oxígeno–15 agua ([15O]–H2O) con vida media de 122 segundos, el carbono–11–acetato (11C) con vida media de 20.4 minutos y el rubidio–82 (82Rb) con una vida media de 75 segundos; los primeros tres son producidos por un ciclotrón y el último es elaborado en un generador específico. Dentro de los radiotrazadores utilizados para evaluar el metabolismo cardíaco principalmente se encuentran la 18–fluorodeoxyglucosa ([18F] – FDG) con una vida media de 110 minutos y algunos ácidos grasos como el palmitato marcados con 11C.7 Dentro de las ventajas que ofrece la técnica PET se puede mencionar que es un estudio de imagen que requiere un corto tiempo de adquisición, que tiene una mejor corrección de la atenuación producida por tejidos blandos, utiliza radiotrazadores más fisiológicos y permite la cuantificación absoluta del flujo coronario así como del metabolismo cardíaco, lo que lo hace un método de mayor sensibilidad y especificidad que el SPECT para el diagnóstico de isquemia miocárdica.7,8
Aplicaciones del PET en el estudio de la cardiopatía isquémica
Viabilidad miocárdica
Una de las principales aplicaciones del PET en cardiología, quizá la más conocida y utilizada en la actualidad, se refiere a la valoración de la viabilidad miocárdica. Posterior a una lesión isquémica el miocardio cuenta con varios mecanismos de defensa para disminuir al mínimo el daño ocasionado. En pacientes con EAC estas respuestas se dan en forma de miocardio hibernante, miocardio aturdido y precondicionamiento isquémico.8–10 El metabolismo miocárdico y por lo tanto, la determinación de viabilidad, comúnmente se evalúa con [18F]–FDG, ya que en estados isquémicos el miocardio incrementa la utilización de glucosa como su principal sustrato metabólico. Se recomienda el método PET en pacientes con antecedente de infarto del miocardio transmural con mala función ventricular y sin evidencia de isquemia residual en quienes la detección de viabilidad mejorará notablemente el pronóstico.11,12
Cuantificación del flujo coronario y evaluación de la función endotelial
Utilizando PET mediante la aplicación del radiofármaco 13N–amonio, es posible medir el flujo coronario en ml/g/min de masa miocárdica. Debido a la utilización de radiotrazadores con vida media corta, el método es eficaz para cuantificar de forma dinámica el flujo coronario. El protocolo habitual de evaluación del flujo coronario y función endotelial con PET incluye tres fases: 1) Cuantificación del flujo coronario basal o en reposo; 2) Determinación del flujo coronario durante la prueba de estimulación con frío (CPT por las siglas en inglés de "Cold Pressor Test"); y 3) Cuantificación del flujo coronario durante el esfuerzo farmacológico con adenosina o dipiridamol.13
La prueba de estimulación con frío (CPT) permite determinar de manera no invasiva la función endotelial. Mediante el CPT se han obtenido resultados que correlacionan significativamente con aquellos producto de la infusión intracoronaria de acetilcolina, considerada el estímulo clásico para evaluar la vasodilatación dependiente del endotelio.14 La prueba con CPT genera una estimulación simpática, con la subsecuente liberación de norepinefrina. La norepinefrina actúa sobre receptores αl,α2 y receptores β1 de las células de músculo liso generando vasoconstricción. Simultáneamente, a nivel del endotelio coronario normal se origina la liberación de óxido nítrico que estimula a la enzima guanilato–ciclasa del músculo liso vascular, lo que produce vasodilatación y por tanto contrarresta la vasoconstricción mediada por el estímulo adrenérgico.14,15 Por consiguiente, cuando existe una adecuada función endotelial la vasoconstricción mediada por la estimulación del músculo liso es menor que la vasodilatación mediada por el endotelio, lo que se traduce en vasodilatación y aumento del flujo coronario durante el CPT (Fig. 1).
En base al protocolo de Amonio–PET descrito anteriormente es posible calcular la reserva de flujo coronario (RFC), obtenida al dividir el flujo coronario de esfuerzo entre el flujo coronario en reposo, cuyo valor normal es > 3.0. Así mismo el empleo del CPT permite calcular el índice de vasodilatación endotelio dependiente (IVED), que se obtiene a partir de la división del flujo coronario durante el CPT entre el flujo coronario de reposo y cuyo valor normal es >1.5.14 En un estudio reciente, nuestro grupo documentó los valores normales de flujo coronario en la población mexicana estudiada mediante PET. La RFC normal promedio obtenida en este estudio fue de 3.5 (± 0.65) y el IVED normal promedio en la población mexicana sin EAC fue de 1.55 (± 0.33), coincidiendo de forma notable con los valores normales reportados en la literatura universal.13
Estudio de la perfusión miocárdica
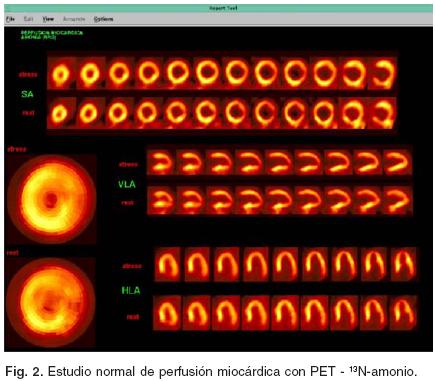
Otra importante aplicación del PET se refiere a la identificación de alteraciones en la perfusión miocárdica como parte del diagnóstico de cardiopatía isquémica. En esta técnica, al igual que para la valoración de los flujos coronarios, se utiliza 13N–amonio como radiofármaco16 (Figs. 2 y 3). El estudio se adquiere en dos fases: en una fase de reposo con una duración de 19 minutos y posteriormente la fase de estrés farmacológico con adenosina por espacio de 6 minutos. Con el resultado del estudio es posible documentar no sólo la presencia de isquemia miocárdica con una sensibilidad superior al 93% sino también determina la localization, extensión y severidad del proceso isquémico y su repercusión sobre la función ventricular.17,18

Estudio de la función ventricular: Gated–PET
El empleo de radiofármacos como el 13N–amonio y el rubidio–82 (82Rb) cuyas vidas medias son ultracortas permite una evaluación dinámica del corazón.7 Mediante la sincronización de la cámara PET con el ritmo cardíaco del paciente (Gated–PET) es posible conocer la función ventricular izquierda de forma precisa tanto en reposo como durante el estrés farmacológico con adenosina o dipiridamol.19–21 En pacientes con cardiopatía isquémica la cuantificación de la fracción de expulsión del ventrículo izquierdo (FEVI) durante el esfuerzo permite conocer el estado funcional del miocardio durante fases de hipoperfusión (Fig. 4). En condiciones fisiológicas el esfuerzo induce un aumento en la FEVI, necesario para cumplir con las demandas metabólicas del organismo durante el ejercicio. En pacientes isquémicos se ha demostrado que la FEVI durante el esfuerzo no sólo no aumenta con respecto a la del reposo, sino que por el contrario disminuye como reflejo de la disfunción ventricular condicionada por la isquemia. La reversibilidad de este fenómeno es una clara muestra de la utilidad del tratamiento anti–isquémico en este grupo de pacientes.22
El Gated–PET ofrece una amplia gama de datos que complementan la información sobre perfusión y flujo coronario obtenida en el mismo estudio, incrementado la sensibilidad y especificidad del método para la detección de cardiopatía isquémica.23
En pacientes con aterosclerosis severa y enfermedad trivascular, el efecto de la adenosina o el dipiridamol no permite una adecuada evaluación de la perfusión miocárdica. En este grupo de pacientes se produce un fenómeno denominado pseudonormalización del flujo coronario, en el que debido a la lesión en todos los territorios vasculares no es posible distinguir el tejido isquémico de aquel con adecuada perfusión. Al sumar los datos del Gated–PET con las imágenes de perfusión es posible detectar aquellos casos de enfermedad aterosclerosa severa con pseudonormalización del flujo, aumentando la sensibilidad y especificidad del método PET en el diagnóstico de cardiopatía isquémica.24,25
Tomografia cardiovascular
La tomografía computada cardiovascular (TCC) es uno de los estudios no invasivos más útiles para evaluar al paciente isquémico. El avance tecnológico ha permitido el desarrollo de nuevos equipos multicorte con mayor resolución temporal y espacial, permitiendo conocer a detalle la anatomía cardíaca. Actualmente los equipos multicorte de 64 detectores son capaces de evaluar la anatomía coronaria en todos los segmentos de relevancia clínica descritos por la American Heart Association (AHA), es decir aquellos segmentos con diámetros >1.5 mm.26–28
Angiotomografía (AngioTAC) coronaria
Mediante TC es posible estudiar de manera no invasiva la anatomía coronaria con resultados comparables con los obtenidos mediante la angiografía coronaria tradicional.28 El estudio tomográfico permite visualizar tanto la luz coronaria como la pared arterial y las estructuras circundantes, lo que ofrece ventajas al momento de evaluar al paciente en etapas tempranas de la enfermedad arterial coronaria (Fig. 5).
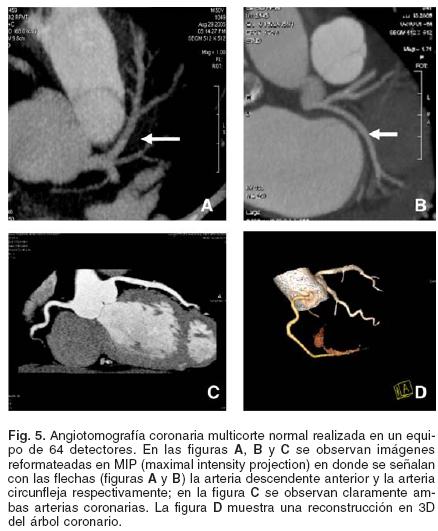
Este método se basa en la aplicación de material de contraste no–iónico, que permite evaluar la luz intravascular, diferenciándola de las estructuras extra–luminales. El tiempo de adquisición de las imágenes es de pocos segundos, lo que requiere muy cortos períodos de apnea para su realización. A pesar de ello, los mejores resultados se obtienen cuando se logra mantener al paciente con una frecuencia cardíaca cercana a 60 latidos por minuto. Este objetivo requiere la administración de agentes β bloqueadores, lo que permite obtener imágenes de mejor calidad al reducir los artefactos producto del movimiento cardiaco.29
Leschka y colaboradores estudiaron recientemente el valor de la angiotomografía coronaria con un equipo de 64 cortes para identificar lesiones aterosclerosas.26 Al comparar los resultados de la AngioTAC de 64 cortes con los obtenidos por angiografía coronaria tradicional, se obtuvieron valores de sensibilidad del 94%, especificidad del 97%, valor predictivo positivo del 87% y valor predictivo negativo del 99%. Valores superiores han sido reportados por Ro–pers y Achenbach usando equipos 64 multicorte comparando cada segmento con su contraparte angiográfica.30 Es notable el alto valor predictivo negativo de la técnica, lo que indica su utilidad para descartar la presencia de enfermedad arterial coronaria.
Calcio coronario
El método tomográfico permite evaluar la composición y densidad de los tejidos estudiados. En el caso de la pared de las arterias coronarias, la presencia de calcio es resultado del proceso aterogénico. Durante la evolución de la placa aterosclerosa es común que se deposite calcio sobre las lesiones, incluso desde etapas tempranas. La TC es capaz de detectar y cuantificar la cantidad de calcio que se encuentra ocupando la pared coronaria, incluso antes de que se presente estenosis arterial significativa.29 La determinación cuantitativa de calcio intracoronario es fundamental para definir el pronóstico del paciente. Ha sido demostrado ampliamente que a mayor índice de calcio coronario peor pronóstico a largo plazo. Valores de Calcio de 0 a 100 Unidades Agatston (UA) confieren un riesgo relativo bajo a moderado, de 100 a 400 UA se considera riesgo intermedio, de 400 a 1000 UA se debe considerar alto riesgo que se acentúa a valores mayores a 1000 UA.2,29,31 De esta forma, la presencia de calcio coronario es un factor de riesgo independiente a considerar dentro del abordaje integral del paciente con cardiopatía isquémica, ya que correlaciona de forma estrecha con el volumen y la extensión de la placa aterosclerosa (Fig. 6).
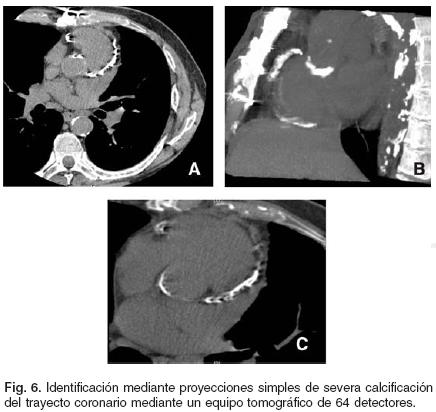
La presencia de calcio coronario es un marcador de aterosclerosis de gran valor en el estudio tomográfico, sin embargo la presencia de este elemento en la pared arterial limita la visualización del lumen. Por este motivo la calcificación coronaria es una limitante de la precisión diagnóstica de la angiotomografía coronaria.32 No toda calcificación coronaria tiene repercusión funcional, sin embargo, a valores más altos de calcio intracoronario la probabilidad de que se desencadene isquemia se incrementa.
Evaluación de la composición y evolución de la placa aterosclerosa
La determinación de calcio coronario por angiotomografía ha brindado una nueva oportunidad para revisar el proceso evolutivo de la placa aterosclerosa. Glagov y colaboradores describieron hace años el crecimiento excéntrico de la placa, proceso difícil de evaluar aun con métodos invasivos.33 La TC ha permitido detectar calcio coronario desde etapas tempranas, aun sin producirse estenosis luminal, evidenciando el crecimiento excéntrico inicial de la placa descrito hace décadas por Glagov y confirmando que sólo es hasta muchos años después de iniciarse la EAC cuando se producen estenosis detectables por métodos convencionales. Así mismo, este hallazgo ha denotado la importancia de estudiar incluso a pacientes asintomáticos con riesgo de EAC, ya que sólo en etapas avanzadas de la enfermedad se presenta sintomatología. La tomografía permite estudiar no sólo la placa calcificada sino también la placa no calcificada, su extensión, localización y definir con precisión sus bordes.34
Indudables implicaciones pronosticas se derivan del estudio de la composición de la placa. En el momento actual no existe evidencia que soporte la idea de que placas no calcificadas son más susceptibles de fractura que aquéllas calcificadas, sin embargo tradicionalmente se ha considerado como más vulnerable a la placa no calcificada, mayores estudios se requieren para delimitar el pronóstico de cada tipo de placa ateromatosa.3,34 Hoy en día se están desarrollando métodos que permitan clasificar las placas coronarias en base a su composición y densidad cuantificada en Unidades Hounsfield (UH).35 Es precisamente en este apartado donde la fusión PET–CT brindará nuevos horizontes diagnósticos al evaluar la composición tisular y el estado inflamatorio de la placa.
Utilidad de la angiotomografía coronaria en pacientes con hemoductos y Stents
El paciente que ha sido sometido a procedimientos de revascularización requiere de un monitoreo estrecho para garantizar la permeabilidad de las arterias tratadas, ya sea mediante procedimientos quirúrgicos o intervencionistas. El advenimiento de un método no invasivo que logra identificar el estado de los hemoductos o Stents ha permitido reducir la necesidad de someter a este grupo de pacientes a procedimientos invasivos para control post–tratamiento. La angiotomografía coronaria es capaz de identificar el trayecto de hemoductos desde su nacimiento hasta su anastomosis distal, logrando caracterizar el estado de la pared y de la luz vascular.5 En el caso de los Stents, se están desarrollando equipos multicorte de nueva generación que intentan evaluar la permeabilidad de la endoprótesis.3 Sin embargo, en este momento el estudio de la permeabilidad del Stent no es una indicación formal para la realización de un estudio de AngioTAC coronaria (Fig. 7).

PET–CT: Integración anatomofuncional
Durante el abordaje de un paciente con sospecha de cardiopatía isquémica es necesario confirmar el diagnóstico, establecer la severidad de la enfermedad y definir un pronóstico. El estudio mediante TC permite demostrar la presencia de aterosclerosis, cuantificar el grado de calcificación coronaria y definir el grado de estenosis encontrada. A pesar de ello, la presencia de estenosis coronaria no es criterio suficiente para enviar al paciente a tratamiento invasivo.36 Actualmente es necesario demostrar la repercusión funcional de las lesiones identificadas para normar la conducta terapéutica a seguir. En muchos casos un resultado de TC positiva es indicación para la realización de un estudio de perfusión miocárdica que confirme el diagnóstico y justifique la intervención terapéutica, ya que no todas las lesiones coronarias encontradas por TC tienen repercusión en la perfusión miocárdica.36 Ambos métodos por separado tienen enormes ventajas pero con algunas limitaciones. El PET es un estudio predominantemente fisiológico, mientras que la TC es anatómico. Debido a que las limitaciones de un método se complementan notablemente con los recursos que ofrece la otra técnica, fue natural el desarrollo de equipos híbridos que complementen la información de ambos recursos diagnósticos. Mediante el empleo de equipos híbridos PET–CT de 64 cortes es posible conocer actualmente con exactitud la función endotelial, la perfusión miocárdica, el flujo coronario, la función ventricular en esfuerzo y reposo, la anatomía coronaria, la presencia de aterosclerosis, el índice de Calcio, el grado de estenosis producto de las placas de ateroma y la composición de las mismas en un solo estudio con duración menor a una hora.1–4 De esta forma y como nunca antes, un solo método no invasivo permite diagnosticar, clasificar, establecer pronóstico y dictar la conducta a seguir en pacientes con enfermedad arterial coronaria desde etapas subclínicas, en donde el paciente incluso se encuentra asintomático (Fig. 8).
La capacidad del equipo para detectar pacientes con EAC desde etapas iniciales lo convierte en una herramienta ideal para prevenir las complicaciones que la aterosclerosis conlleva a largo plazo. En el caso de pacientes con EAC conocida, el método permite evaluar la evolución de las placas aterosclerosas, su composición, el grado de obstrucción de la luz coronaria y el efecto de estas alteraciones sobre la perfusión y función del músculo cardíaco. Para los pacientes sometidos a tratamiento, a los que se les ha colocado hemoductos o Stents, el método se convierte en una herramienta de seguimiento de la permeabilidad de los vasos tratados y del estado funcional cardíaco. En pacientes con antecedentes de infarto del miocardio la técnica PET–CT permite detectar zonas de miocardio isquémico o viable e identificar la lesión o lesiones culpables, con el fin de elaborar un plan terapéutico a la medida del paciente.3
Conclusiones
El empleo del PET–CT en pacientes con cardiopatía isquémica permite que en un solo estudio no invasivo se puedan conocer de forma integral elementos fundamentales para el manejo posterior del paciente. La realización de un solo estudio reduce de forma notable los costos de ambas técnicas, complementa la información que cada una ofrece por separado y añade valor diagnóstico y pronóstico a ambos métodos. La precisión diagnóstica del PET–CT contribuirá a la reducción en el número de procedimientos invasivos que se efectúan para obtener los mismos datos que esta herramienta nos ofrece. Poder visualizar la anatomía y comprender el efecto en la fisiología del proceso patológico permitirá entender con mayor claridad la historia natural de la cardiopatía isquémica para poder incidir en ella en beneficio de la calidad de vida de los pacientes.
En un futuro la técnica PET–CT nos brindará mayor información sobre la evolución de la aterosclerosis. En pocos años seremos capaces de identificar lesiones coronarias, conocer la composición de la placa y el grado de inflamación que presenta. Esta información será crucial en el manejo a corto, mediano y largo plazo de los pacientes con cardiopatía isquémica. Las ventajas de obtener toda esta información en un solo estudio explican el amplio desarrollo de este campo de la Cardiología hoy en día. Afortunadamente en el país se cuenta con amplia experiencia que garantiza el éxito de estos métodos diagnósticos en los años por venir.
Referencias
1. Di Carli M, Dorbala S: Integrated PET–CT for cardiac imaging. Q J Nucl Med Mol Imaging 2006; 50: 44–52. [ Links ]
2. Berman D, Hachamovitch R, Shaw L, Friedman J, Hayes S, Thompson L, et al: Roles of Nuclear Cardiology, Cardiac Computed Tomography, and Cardiac Magnetic Resonance: Assessment of Patients with Suspected Coronary Artery Disease. J Nucl Med 2006; 47: 74–82. [ Links ]
3. Schwaiger M, Ziegler S, Nekolla S: PET–CT: Challenge for Nuclear Cardiology. J Nucl Med 2005; 46: 1664–1678. [ Links ]
4. Di Carli MF: Advances in Positron Emission Tomography. J Nucl Cardiol 2004; 11: 719–32. [ Links ]
5. Di Carli MF, Dorbala S, Hachamovithc R: Integrated Cardiac PET–CT for the diagnosis and managment of CAD. J Nucl Cardiol 2006; 13: 139–44. [ Links ]
6. Schelbert H, Henze E: Positron Emission Tomography of the Heart. Semin Nucl Med 1980; 10: 355–373. [ Links ]
7. Takalkar A, Mavi A, Alavi A, Araujo L: PET in cardiology. Radiol Clin N Am 2005; 43: 107–119. [ Links ]
8. Bengel FM, Schwaiger M: Assessment of myocardial viability by PET. In: Valk P, editor. Positron emission tomography: principles and clinical practice. London: Springer Verlag; 2003:447–63. [ Links ]
9. Kloner R, Bolli R, Marban E: Medical and cellular implications of stunning, hibernation and preconditioning: an NHLBI Workshop. Circulation 1998; 97: 1848–67. [ Links ]
10. Wijns W, Vainer SF, Camiri PG: Hibernating myocardium. N Engl J Med 1998; 339: 173–81. [ Links ]
11. Meave A, Ricalde A, Sierra Fernández C, Rojas Castillo L, Alexánderson E: Study of myocardial viability: Comparison of PET and MRI. Arch Cardiol Mex 2005; 75: 71–8. [ Links ]
12. Alexánderson E, Gómez–Martín D, Benito I, Ruiz–Ramírez L, Ricalde A, Meave A: Positron Emission Tomography (PET): A useful tool for the assessment of cardiac metabolism. Arch Cardiol Mex 2004; 74: 220–8. [ Links ]
13. Alexánderson E, Ricalde A, Estradas J, Alexánderson EG, Meave A: Evaluation of coronary flow by means of PET in the Mexican population without coronary artery disease. Arch Cardiol Mex 2005; 75: 23–8. [ Links ]
14. De Silva R, Camici PG: The role pf positron emission tomography in the investigation of coronary circulatory function inman. Cardiovasc Res 1994; 28: 1595–1612. [ Links ]
15. Di Carli MF, Tobes MC: Effects of cardiac sympathetic inervation of coronary blood flow. Cardiovasc Res 1994; 28: 1595–1612. [ Links ]
16. Alexánderson E, Graff–Guerrero A, Altamirano J, Estrada G, Gómez–Martín D, Meave A: Evaluación de la perfusión miocárdica mediante Tomografía por emisión de positrones (PET) con 13N–amonia: Experiencia inicial en México. Arch Cardiol Mex 2003; 73(4): 301–303. [ Links ]
17. Schelbert HR, Wisenberg G, Phelps ME: Noninvasive assessment of coronary stenoses by myocardial imagin during pharmacologic coronary vasodilation. VI Detection of coronary artery disease in human beings with intravenous N–13 ammonia and positron computed tomography. Am J Cardiol 1982; 49: 1197–1207. [ Links ]
18. Tamaki N, Yonekura Y, Senda M: Value and limitation of stress thallium–201 single photon emisión computed tomography: Comparison with nitrogen–13 ammonia positron tomography. J Nucl Med 1988; 29: 1181–1188. [ Links ]
19. Khorsand A, Graf S, Eidher H, Wadask W, Kletter K, Sochor H, et al: Gated Cardiac 13N–NH3 PET for assessment of left ventricular volumens, mass, and ejection fraction: comparison with electrocardiography–gated 18F–FDG PET. J Nucl Med 2005; 46: 2009–13. [ Links ]
20. Hofman HA, Knaapen P, Boellaard R, Bonda–Renko O, Gotte MJ, Van Dockum WG, ET AL: Measurement of left ventricular volumes and function with O–15–Labeled carbon monoxide gated positron emission tomography: comparison with magnetic resonance imaging. J Nucl Cardiol 2005; 12: 620–1. [ Links ]
21. Khorsand A, Graf S, Eidher H, Wadask W, Kletter K, Sochor H, et al: Gated Cardiac 13N–NH3 PET for assessment of left ventricular volumens, mass, and ejection fraction: comparisonwith electro cardiography–gated 18F–FDG PET. J Nucl Med 2005; 46: 2009–13. [ Links ]
22. Alexánderson E, Gómez–Martín D, Fermon S, Meave A: Correlación entre la fracción de expulsión obtenida con SPECT sincronizado y la ventriculografía con radionúclidos en pacientes con cardiopatia isquémica. Arch Cardiol Mex 2004; 74: 25–30. [ Links ]
23. Nekolla S, Souvatzoglou M, Hauslelter J: Integration of function and morphology in cardiac PET/CT: A feasibility study in patients with chronic ischemic heart disease. J Nucl Cardiol 2005; 12: s45. [ Links ]
24. Uren NG, Cake T, Lefroy DC, De Silva R, Davies GJ, Maseri A: Reduced coronary vasodilator function in infracted and normal myocardium after myocardial infraction. N Engl J Med 1994; 331: 222–7. [ Links ]
25. Yoshinaga K, Katoh C, Noriyasu K, Iwado Y, Furuyama H, Ito Y: Reduction of coronary flow reserve in areas with and without ischemia on stress perfusion imaging in patients with coronary artery disease: a study using oxygen 15–labeled water PET. J Nucl Cardiol 2003; 10: 275–283. [ Links ]
26. Leschka S, Alkadhi H, Plass A: Acuracy of MSCT coronary angiography with 64–slice technology: First experience. Eur Heart J 2005; 26: 1482–87. [ Links ]
27. Austen WG, Edwards JE, Frye RL, Gensini GG, Gott VL, Griffith LS, et al: A reporting system on patients evaluated for coronary artery disease: A report of the Ad Hoc Committee for grading of coronary artery disease, council of cardiovascular surgery, American Heart Association. Circulation 1975; 51: 5–40. [ Links ]
28. Mollet N, Cademartiri F, Van Mieghem C, Runza G, Me Fadden E, Baks T, et al: High–resolution spiral computed tomography coronary angiography in patients referred for diagnostic conventional coronary angiography. Circulation 2005; 112: 2318–2323. [ Links ]
29. Budoff M: Tracking progression of heart disease with cardiac computed tomography. J Cardiovasc Pharmacol Therapeut 2004; 9: 75–82. [ Links ]
30. Ropers D, Rixe J, Anders K, Kuttner A, Baum U, Bautz W, et al: Usefulness of multidetector row spiral computed tomography with 64 x 0.6 mm collimation and 330 ms rotation for the noninvasive detection of significant coronary artery stenoses. Am J Cardiol 2006; 97: 343–8. [ Links ]
31. Agastston AS, Janowitz WR, Hildner FJ: Quantification of coronary artery calcium using ultra fast computed tomography. J Am Coll Cardiol 1990;15: 827–832. [ Links ]
32. Rumberg JA, Simons DB, Fitzpatrick LA: Coronary artery calcium area by electron–beam computed tomography and coronary atherosclerotic plaque area: a histopathologic correlative study. Circulation 1995; 92: 2157–2162. [ Links ]
33. Glagov S, Weisenberg E, Zarins CK: Compensatory enlargement of human atherosclerotic coronary arteries. N Engl J Med 1987; 316: 1371–1375. [ Links ]
34. Achenbach S, Moselewski F, Ropers D: Detection of calcified and noncalcified coronary atherosclerotic plaque by contrast–enhanced, submillimeter multidetector spiral computed tomography: a segment based comparison with intravascular ultrasound. Circulation 2004; 109: 14–17. [ Links ]
35. Becker CR, Nikolau K, Muders M: Ex vivo coronary atherosclerotic plaque characterization with multidetector row CT. Eur Radiol 2003; 13: 2094–2098. [ Links ]
36. Berman DS, Wong ND, Gransar H: Relationship between stress–induced myocardial ischemia and atherosclerosis measured by coronary calcium tomography. J Am Coll Cardiol 2004; 44: 923–930. [ Links ]














