Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.76 supl.4 Ciudad de México oct./dic. 2006
Investigación básica
Los flavonoides y el sistema cardiovascular: ¿Pueden ser una alternativa terapéutica?
Flavonoids and the cardiovascular system: Can they be a therapeutic alternative?
Fermín Alejandro Tenorio López,* Leonardo del Valle Mondragón,* Gustavo Pastelín Hernández*
* Departamento de Farmacología. INCICH.
Correspondencia:
Fermín Alejandro Tenorio López.
Departamento de Farmacología.
Instituto Nacional de Cardiología Ignacio Chávez
(INCICH Juan Badiano Núm. 1, Col. Sección XVI, 14080, Tlalpan, México, D.F.). México.
Tel: 55–73–29–11 Ext. 1317 ó 1344.Fax: 55–73–09–26.
Correo electrónico: fatl@att.net.mx ft24@hotmail.com
Resumen
Se ha sugerido que el consumo de flavonoides en la dieta puede reducir el riesgo de desarrollar una enfermedad cardiovascular. Por otra parte, los estudios realizados in vitro e in vivo indican que los flavonoides presentan un gran abanico de actividades biológicas. Esta revisión tiene por objeto evidenciar el efecto de los flavonoides sobre varios sistemas enzimáticos que pudiesen ser un blanco terapéutico potencial. Basados en los reportes que diversos grupos de investigación líderes en el campo de los productos naturales han aportado a lo largo de los años, y con el objeto de conjuntar estos resultados con los hallazgos aportados por algunos estudios epidemiológicos, se podría fundamentar, a futuro, la introducción de estos compuestos en la práctica clínica.
Palabras clave: Flavonoides. Sistema cardiovascular. Sistemas enzimáticos. Estudios epidemiológicos.
Summary
It has been suggested that dietary intake of flavonoids may reduce the risk of cardiovascular diseases. On the other hand, in vitro and in vivo studies shows that flavonoids has a vast array of biological activities. Our aim in this review is to put in evidence the effect of flavonoids on several enzymatic systems that could act as potential therapeutic targets, based on the reports of diverse research groups, leaders in the natural products research area, have published through the years, and with the goal of consolidating those results with the findings provided by some epidemiological studies, could support the introduction of these compounds into the clinic.
Key words: Flavonoids. Cardiovascular system. Enzymatic systems. Epidemiological studies.
Introducción
Los flavonoides son un amplio grupo de metabolitos secundarios –compuestos orgánicos que se sintetizan a partir de aminoácidos, carbohidratos, lípidos, proteínas y ácidos nucleicos que aparentemente no son indispensables para vivir– de plantas, incluyendo las destinadas para consumo humano. La ingesta diaria de flavonoides proviene del consumo de cebolla, manzanas, uvas, vino, té, cerezas, jugo de cítricos, especias, entre otras. Aunque es altamente variable, ha podido estimarse que el consumo de flavonoides totales por día oscila entre 23 y 500 mg de estos metabolitos.1–3
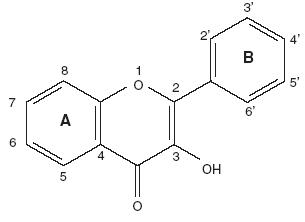
Químicamente, son compuestos de bajo peso molecular que se encuentran en plantas vasculares. Estructuralmente (Fig. 1), pueden ser considerados como fenilbenzo–pironas (fenilcromonas) compuesto de dos anillos bencénicos (anillos A y B) unidos mediante un anillo heterocíclico de pirano o pirona (anillo C). De acuerdo a los sustituyentes presentes en estas tres estructuras cíclicas, se subdividen en función de la presencia o ausencia de un doble enlace entre los carbonos 4 y 5 del anillo C, de la presencia o ausencia de un doble enlace entre los carbonos 2 y 3 del anillo C, y de la presencia de grupos hidroxilo en el anillo B. En función de sus sustituyentes químicos los flavonoides se clasifican en: (1) flavanoles, (2) antocianidinas, (3) flavonas, flavanonas y chalconas (Fig. 1, Tablas I y II).4–7
Estos compuestos tienen efectos muy importantes en la bioquímica y fisiología de las plantas, en donde actúan como antioxidantes, inhibidores enzimáticos, precursores de sustancias tóxicas, así como en la formación de pigmentos y filtros solares.8 También estos compuestos están involucrados en mecanismos de fotosensibilización y de transferencia de energía, regulando así las reacciones de crecimiento, de control de la respiración, la fotosíntesis, la morfogénesis, la determinación sexual y la defensa contra infecciones. Ejemplos de lo anterior lo constituyen varios reportes que muestran que los flavonoides causan la activación de genes moduladores involucrados en el control de la fijación del nitrógeno en varias especies de Rhizobium, lo que sugiere una importante relación entre un tipo particular de flavonoide y la activación y expresión de genes.9–12
Se ha reconocido que en el hombre, los flavonoides poseen propiedades antiinflamatorias, antioxidantes, antialérgicas, hepatoprotectoras, antitrombóticas, antivirales y anticarcinogénicas.13–18 Al ser considerados también como compuestos fenólicos, pueden actuar como potentes quelantes de metales, como "scavengers" de radicales libres y como antioxidantes rompedores de cadena, es decir, finalizan la cadena de formación de especies pro–oxidantes mediante la donación o aceptación tanto de un átomo de hidrógeno como un electrón.19–23
Debido a la gran variedad de efectos a nivel bioquímico y farmacológico, en este trabajo revisamos la actividad de los flavonoides sobre varios sistemas enzimáticos que pueden ser un blanco terapéutico potencial en el sistema cardiovascular, así como el uso potencial que estos compuestos podrían tener en la terapéutica médica, según evidencias aportadas por algunos estudios epidemiológicos.
Evidencias básicas y hallazgos epidemiológicos
Los estudios epidemiológicos más importantes llevados a cabo entre 1958 y 1970, con la participación de Italia, Grecia, Yugoslavia, Holanda, Finlandia, los Estados Unidos de Norteamérica y Japón,24–31 mostraron que hay una asociación inversa entra la ingesta diaria de flavonoides y la mortalidad a causa de una enfermedad coronaria. Este efecto cardioprotector podría explicarse por la combinación de propiedades antioxidantes, antiagregantes plaquetarios y vasodilatadores.18,32–36 Recientemente se ha reportado que tanto la quercetina como metabolitos metilados de ésta, ejercen efectos antihipertensivos y reducen la hipertrofia del ventrículo izquierdo, la disfunción endotelial y mejoran el estatus oxidativo plasmático y hepático.37–39 Otro interesante hallazgo fue aportado por Haji–Faraji y Haji–Tarkhani,40 en donde evaluaron el efecto de decocciones de jamaica (Hibiscus sabdariffa) en la hipertensión esencial. Para este caso, se seleccionaron al azar pacientes con hipertensión esencial moderada, incluyendo a pacientes cuyas cifras de presión sistólica se situaran entre 160–180 mm Hg y de presión diastólica entre 110–114 mm Hg, encontrando una reducción del 11.2% de las cifras de presión sistólica, así como un decremento del 10.7% de la presión diastólica 12 días después de iniciado el protocolo. Estos resultados han sido confirmados en nuestro país por Herrera–Arellano y cois.41 en una muestra de pacientes diagnosticados con hipertensión, cuyas edades fluctúan entre 30 a 80 años. La administración de Hibiscus sabdariffa fue mediante infusiones de 10 g del cáliz seco de la flor en 0.51 L de agua diariamente, en ayunas, durante un período de 4 semanas. Al término de este período, se encontró que la infusión de H. sabdariffa causaba una disminución estadísticamente significativa tanto de la presión sistólica (de 139.05 a 123.73 mm Hg) como de la presión diastólica (de 90.81 a 79.52 mm Hg), siendo el compuesto responsable de este efecto hipotensor, la antocianidina, cuyo contenido fue estandarizado a 9.6 mg de antocianidina por día. Más recientemente, los resultados obtenidos en el estudio DASH (Dietary Approaches to Stop Hypertension) muestran una disminución sustancial de las cifras de presión arterial, así como una disminución de los lípidos séricos. La dieta DASH es rica en flavonoles, flavanonas, flavan 3–oles, beta–caroteno, beta–criptoxantina, licopena, luteína y fitosteroles,42 por lo que los beneficios de esta dieta son atribuibles a estos fitoquímicos y puede esperarse una reducción del riesgo cardiovascular, pues se ha sugerido que los compuestos polifenólicos muestran propiedades de protección miocárdica.43 En cuanto al mecanismo mediante el cual los flavonoides disminuyen la presión arterial, se ha propuesto que el canal de sodio epitelial (EnaC) tiene un papel crucial en la regulación de la presión sanguínea, contribuyendo además al mecanismo de reabsorción de sodio (Na+) en los túbulos renales. Mediante el tratamiento con quercetina (10 mg/kg/día) y la asociación de quercetina con una dieta hipersódica, se observó que la ingesta de quercetina disminuye la expresión en el mRNA del ENaC–alpha, observando una clara disminución en las cifras de presión arterial.44
En otro estudio, se evaluó la efectividad del jugo de la uva Concord, una variedad de uva originaria de los Estados Unidos de Norteamérica, para reducir las cifras de presión arterial en pacientes hipertensos. A 40 voluntarios se les administró 5.5 mL/kg de peso corporal/día del jugo de la uva Concord, o bien, una bebida con igual contenido calórico, durante un período de 8 semanas. Al término del período de administración de los tratamientos, se observó una disminución en el grupo tratado con jugo de uva de 7.2 mm Hg (presión arterial sistólica) y 6.2 mm Hg (presión arterial diastólica), respectivamente, por lo que los autores consideraron favorable el consumo del jugo de uva.45
En otro estudio se evaluó la efectividad de pycnogenol, una proantocianidina aislada de la corteza de Pinus maritina, un pino originario de Europa, en pacientes hipertensos, a los cuales se les administró 100 mg de este compuesto durante 12 semanas. La ingesta de dicho bioflavonoide disminuyó las concentraciones plasmáticas de endotelina–1 y de angiotensina II, observándose además, incrementos de la 6–ceto prostaglandina Fia y del óxido nítrico plasmáticos. El ritmo cardíaco, los electrolitos y el nitrógeno ureico no fueron modificados.46 Finalmente, los flavonoides de la familia flavan–3–oles (flavanoles), presentes en el vino tinto, té negro, cerezas y cocoa, han recibido mucha atención pues se ha demostrado ampliamente sus efectos cardioprotectores en lo que respecta a la función vascular y a la reactividad plaquetaria.47
Biosíntesis de flavonoides
Los flavonoides se biosintetizan en las plantas y participan en la fase luminosa de la fotosíntesis, en donde catalizan el transporte de electrones.17 Los aminoácidos aromáticos fenilalanina y tirosina provienen de la ruta del ácido siquímico (Fig. 2). Mediante la acción de las liasas amoniacales de fenilalanina (PAL) y tirosina (TAL), estos aminoácidos puede interconvertirse en los ácidos cinámico y p–hidroxicinámico, respectivamente, los cuales, mediante una reducción, pueden convertirse en cinamaldehído y p–hidroxicinamaldehído (Fig. 3).48–49 Así, el ácido cinámico (o el ácido p–hidroxicinámico, o bien, derivados de ácidos fenólicos tales como los ácidos cafeico, ferúlico y clorogénico, los cuales son considerados derivados del ácido cinámico) se condensan con las unidades de acetato, y mediante un rearreglo de Fries, forman la porción cinamoil de los flavonoides, los cuales generan el núcleo estructural básico de los flavonoides. Para generar el núcleo de las chalconas y flavanonas, tiene lugar una condensación catalizada por álcali entre una molécula de o–hidroxiacetofenona con un derivado del benzaldehído. Para la formación del núcleo de las 2–hidroxiflavanonas y flavonas, ocurre la misma reacción de condensación, sólo que en esta ocasión, participan la ohidroxiacetofenona y un derivado de ácido benzoico (cloruros de acilo o anhídridos) (Fig. 4).48
Capacidad antioxidante de los flavonoides
Desde el punto de vista químico, un antioxidante es un compuesto químico que previene la oxidación de otra especie química. Bajo una consideración biológica, un antioxidante puede definirse como aquella sustancia que cuando se encuentra presente a concentraciones mucho menores que las de un sustrato oxidable, disminuye o inhibe significativamente la oxidación de dicho sustrato, por lo que los antioxidantes desempeñan un papel fundamental en la protección de estructuras celulares que pudiesen ser dañadas en reacciones que involucren radicales libres,50 pues éstos atacan a los ácidos grasos saturados en las biomembranas, causando así peroxidación de lípidos, disminución en la permeabilidad membranal así como daño a proteínas membranales, procesos todos implicados en el desarrollo de cáncer, enfermedades cardiovasculares, cataratas, declive del estado inmune y disfunción cerebral.51 El consumo de infusiones de té negro y verde,52 lima mexicana,53 productos derivados del cacao,47 cítricos, manzana, cereza, jitomate, cebolla, entre otros, son una fuente excelente de flavan–3–oles, los cuales además de ser capaces de estabilizar o desactivar a los radicales libres antes de que ejerzan un daño a un órgano blanco, al parecer también son capaces de regular la síntesis de glutatión, importante antioxidante celular endógeno.54
Efecto de los flavonoides sobre algunos sistemas enzimáticos
Se ha demostrado que, in vitro, los flavonoides afectan la actividad de diversos sistemas enzimáticos, aunque existen evidencias de que también pueden hacerlo in vivo, por lo que es pertinente indicar los efectos de los flavonoides sobre aquellos sistemas enzimáticos que pueden ser potencialmente blancos terapéuticos en el sistema cardiovascular.
Cinasas
Una cinasa es una proteína que cataliza la transferencia de un grupo fosfato proveniente de una molécula de trifosfato de adenosina (ATP) hacia una molécula específica. La proteína cinasa C (PKC) es una enzima que fosforila residuos de serina y treonina, ampliamente distribuida en los mamíferos, siendo dependiente de Ca2+ y de fosfolípidos, con una participación activa en funciones celulares tales como mitogénesis, procesos secretorios, funcionalidad de las células inflamatorias, funcionamiento de los linfocitos T, promoción de tumores, entre muchas otras funciones.55–57 Se ha demostrado que la PKC puede ser inhibida in vitro por ciertos flavonoides,58–64 en donde la quercetina inhibe la actividad de fosforilación del virus de sarcoma Rous, transformando el producto génico tanto in vitro como in vivo. Experimentos realizados por Ferriola y cois.62 demostraron que los flavonoides fisetina, quercetina y luteolina fueron los inhibidores más activos de la PKC de cerebro. En experimentos en los cuales emplearon diferentes sustratos proteicos (histona y protamina) así como diversos activadores (diacilglicerol y acetato de tetradecanoilforbol), mostraron que tanto la fisetina como la luteolina inhibían el sitio de unión del ATP en la unidad catalítica de la PKC. Otras enzimas que emplean ATP como sustrato fueron inhibidas por flavonoides mediante la unión competitiva del flavonoide al sitio de unión del ATP, mostrando además que la adición de un grupo hidroxilo en la posición 3 (Fig. 1) elimina esta actividad inhibitoria.65
La proteína activada por mitógeno (MAP) cinasa en células de cáncer epidérmico humano fue fuertemente inhibida por la quercetina a una concentración 30 µM.66
La cinasa de la cadena ligera de miosina (MLCK) cataliza la fosforilación de las cadenas ligeras de miosina en varios tipos celulares, la cual es esencial para el desarrollo de la actividad tensora en las células de músculo liso así como también para el movimiento y la migración de otras células. Por ello, resulta interesante observar que el kaempferol actúa como un inhibidor relativamente específico (IC50 = 0.45 µM) en MLCK purificadas de aortas bovinas,67 siendo 30 veces más activo para esta cinasa que para otras. Como ya se ha visto en otros sistemas con diferentes flavonoides, el kaempferol actúa competitivamente con el ATP. La MLCK purificada de aves también fue inhibida por varios flavonoides, especialmente los que posean una doble ligadura entre los carbonos 2 y 3 así como una polihidroxilación en dos de los tres anillos.68 En contraparte, tanto la metoxilación como la glicosilación, por separado, abaten considerablemente esta actividad.
ATPasas
Los flavonoides pueden afectar la función de la ATPasa dependiente de Na+/K+,69–71 la ATPasa mitocondrial y la ATPasa dependiente de Ca2+ 72,73 La ecto–ATPasa dependiente de Mg2+ de leucocitos humanos es inhibida por quercetina.74 La Ca2+–ATPasa del retículo sarcoplásmico de músculo de ratón fue inhibida por varios flavonoides, en donde se observó también que éstos pueden inhibir la liberación de histamina de las células masticas.75 En estudios de las proteínas contráctiles de músculo esquelético de conejo,76 se encontró que la quercetina causa un cambio conformacional en la estructura de la miosina, lo que coincide también con un incremento en la actividad de la ATPasa. A concentraciones mayores, la quercetina inhibe la super precipitación de actomiosina así como actividad de la ATPasa. En lo que respecta a la ATPasa dependiente de Na+/K+, se ha demostrado que el sitio de inhibición no está relacionado con el sitio de unión específico para glicósidos cardíacos.77
FosfotipasaA2
La fosfolipasa A2 (PLA2) es una enzima involucrada en procesos de activación celular, catalizando la hidrólisis de fosfolípidos esterificados en el carbono 2 del esqueleto de glicerol. El ácido araquidónico es esterificado en esta posición, y la PLA2 libera al ácido araquidónico que será posteriormente metabolizado por la vía de la ciclooxigenasa (CO) y la lipooxigenasa (LO). Adicionalmente, la PLA2 juega un papel fundamental como mediador de los procesos inflamatorios intra y extracelulares.78 La quercetina es un inhibidor efectivo de la PLAO en leucocitos humanos79 y de conejo.80 La quercetagenina, el kaempferol– 3– (9–galactósido y la escutelareína inhiben la PLA2 sino vial humana con valores de IC50 que van de 12.2 a 17.6 µM.81
lipooxigenasas y ciclooxigenasas (LOy CO)
La liberación del ácido araquidónico de los fosfolípidos de membrana, o de otras fuentes, es metabolizada por la vía la LO del músculo liso con la generación respectiva de leucotrienos vasoactivos (LTC4, LTD4, LTE4, así como el quimioatractor LTB4),82 los cuales están íntimamente relacionados en procesos inflamatorios, alérgicos y asmáticos, así como en otros procesos fisiológicos y patológicos. Yamamoto y cois.83 estudiaron el efecto de varias benzoquinonas, así como de diversos flavonoides, sobre algunas enzimas de la vía biosintética de los leucotrienos vasoactivos, encontrando que la 3'–4'–5–trihidroxi–6,7–dimetoxiflavona es un potente inhibidor de la 5–LO (IC50 = 0.1 µM). La 5–LO parcialmente purificada es fuertemente inhibida por este compuesto.84 Para lograr tal inhibición, se requiere que el flavonoide posea una combinación de propiedades quelantes y reductoras de hierro,85 lo que se logra con flavonoides polihidroxilados.86 Así, la inhibición selectiva de estas vías enzimáticas podría representar una esperanza terapéutica para la introducción de fármacos más eficaces y seguros para el tratamiento del cáncer, de procesos inflamatorios, lo cual deteriora la función endotelial, del mal de Alzheimer y de procesos alérgicos, entre otros.
Fosfolipasa C(PLC)
No se han reportado los efectos directos de los flavonoides sobre la PLC. Sin embargo, la evidencia sugiere87 que la fosforilación dependiente de protein tirosín cinasa (PTK) de la PLC–y es un paso crucial para la activación de esta enzima, en consecuencia, la inhibición de PTK con genisteína bloquea la activación de la PLC y la subsecuente formación de inositol trifosfato (IP3) y diacilglicerol (DAG).
Fosfodiesterasa de nucleótidos cíclicos
Los nucleótidos cíclicos monofosfato cíclico de adenosina (AMPc) y monofosfato cíclico de guanosina (GMPc) median diversos procesos biológicos a través de su capacidad para estimular a las proteínas cinasas dependientes de nucleótidos cíclicos, las cuales, en turno, fosforilan a los sustratos proteicos celulares y desencadenan respuestas específicas. El AMPc y el GMPc se forman a partir de ATP y GTP mediante la actividad catalítica de las adenilato y guanilato ciclasas, respectivamente, estimuladas a su vez, por diversos agentes. Tanto el AMPc como el GMPc participan en la regulación de procesos celulares, tales como la división celular, la contractilidad del músculo liso, funciones secretoras, procesos inmunológicos y agregación plaquetaria, por nombrar sólo algunas funciones. Esta actividad se interrumpe por acción de la fosfodiesterasa de nucleótidos cíclicos (PDE). La inhibición de la PDE por flavonoides ha sido ampliamente descrita,88,89 proponiendo como requerimientos estructurales para esta inhibición la presencia de un núcleo flavona, flavanol o flavilio.90 Se ha propuesto que la capacidad inhibitoria de la PDE por flavonoides se debe a la semejanza estructural con el anillo de pirimidina del AMPc y a la presencia del anillo de piranona en los flavonoides activos.91 Por lo anteriormente expuesto, las PDE son un blanco celular muy importante, y dado que algunos flavonoides aislados y purificados de plantas muestran una inhibición selectiva, éstos podrían servir como agentes vasodilatadores para una alternativa de tratamiento para padecimientos tales como angina de pecho, hipertensión e, inclusive, disfunción eréctil.
Adenilato ciclasa
Se ha reportado92 que compuestos tales como flavona, crisina, prunetina y apigenina, disminuyen la actividad plaquetaria inducida por prostaciclina, un efecto que ha sido atribuido a la inhibición de la adenilato ciclasa, por lo que inhibidores selectivos de esta enzima podrían presentar una notable actividad antiagregante plaquetaria.
Sialidasa
La sialidasa (neuraminidasa) cataliza la hidrólisis de residuos del ácido siálico a partir de siaglicoconjugados, ejerciendo un efecto sobre funciones biológicas ante la presentación de antígenos y de receptores. La sialidasa de hígado de ratón es inhibida no competitivamente por la isoscutelareína–8–O–glucorónido (IC50=40 µM), mientras que la sialidasa del virus de la influenza es inhibida débilmente.93 En ambos casos se observó que los núcleos estructurales flavanona y chalcona carecían de esta actividad. En otros estudios con la sialidasa del virus de influenza,94,95 se encontró que los compuestos trihidroxilados (como por ejemplo la 5,7,4'–trihidroxi–8–metoxiflavona) son moderadamente activos inhibiendo la infección por este virus en un modelo que emplea células renales de perro, así como también la replicación del virus en embriones de pollo, por lo que algunos flavonoides podrían ser modificados estructuralmente para generar compuestos con actividad antiviral.
Óxido nítrico sintasa (NOS)
El óxido nítrico (NO) es un mediador químico que participa en procesos fisiológicos tales como la relajación del músculo liso, la lisis de células tumorales, la destrucción de microorganismos, entre otros procesos.96 Se sintetiza mediante la conversión del aminoácido L–arginina, en presencia de oxígeno molecular, a L–citrulina, siendo un subproducto de esta reacción el NO. Esta reacción es catalizada por un sistema enzimático denominado óxido nítrico sintasa, siendo para el caso que nos ocupa las isoformas inducible (iNOS) y endotelial (eNOS), el blanco molecular más importante para los flavonoides.97,98 A este respecto, hay una controversia muy interesante, pues por una parte, se ha acumulado evidencia de que la iNOS de células C6 de gliomas" puede ser inhibida por la genisteína y por compuestos polifenólicos capaces de atenuar la producción de NO en cultivos celulares C6 de astrocitos.100Adicionalmente, se ha reportado que los flavonoides quercetina, galato de epigalocatequina, morina, apigenina, taxifolina, fisetina y catequina inhiben la actividad de 3 isoformas de la NOS.101 Sin embargo, la evidencia más reciente al respecto apunta a que extractos y flavonoides (luteolina y cinarosida), procedentes de Cynara scolymus L. (alcachofa), son capaces de incrementar la actividad del promotor de la eNOS así como la expresión del RNAm de esta enzima, incrementando así la producción de óxido nítrico en cultivos celulares de células endoteliales humanas.102 También se ha reportado que la (–)–epicatequina, purificada de extractos de té verde, a una concentración de 100 µM, es capaz de generar una relajación dependiente del endotelio, la cual cursa con incrementos sustanciales en la producción de NO y GMPc.103 En otro estudio, un constituyente del té verde, epigalocatequina–3–galato, produce una vasodilatación dosis–dependiente (en el intervalo de concentración de 1 a 50 µM), la cual es dependiente del endotelio, basándose en una rápida activación de la eNOS por la fosfatidilinositol–3–cinasa, en un modelo de anillos aórticos. Dicha vasorrelajación es inhibida cuando los anillos aórticos son pretratados con iNw–nitro–L–arginina metil éster (L–NAME), lo que confirma la participación del NO como un importante mediador en el mecanismo de vasorrelajación.104 Otro estudio105 ha demostrado que el flavonoide crisina revierte la contracción inducida por noradrenalina en anillos aórticos con endotelio intacto. La remoción del endotelio, así como el L–NAME, inhibieron este efecto relajante, por lo que se puede afirmar que esta vasorrelajación es dependiente del endotelio y del NO.
Es factible que el amplio abanico de efectos de los flavonoides sobre los sistemas enzimáticos que hemos revisado pueda explicarse, al menos en parte, mediante dos hechos fundamentales: (1) la presencia de un doble enlace entre los carbonos 2 y 3 del núcleo flavonoide, y de una hidroxilación del anillo B, lo que favorece la interacción estereoespecífica de estas moléculas con los sitios enzimáticos activos y (2) la unión de los flavonoides a las proteínas, o bien, la formación de complejos estables de proteína flavonoide, haciendo inaccesibles estos sitios activos.106,107
Conclusiones
Los estudios básicos y los epidemiológicos han mostrado efectos benéficos de algunos flavonoides, flavanonas y antocianidinas en el sistema cardiovascular, con particular énfasis en sus efectos vasorrelajante e hipotensor, sin dejar a un lado sus notables capacidades antioxidante y antiagregante plaquetario. A pesar de toda esta positiva evidencia, aún es muy apresurado buscar introducir estos compuestos en la práctica terapéutica, pues es necesario ahondar en los estudios básicos para precisar su mecanismo de acción y la compleja relación estructura química/actividad biológica, que permitiría el diseño de moléculas prototipo que sigan conservando el efecto terapéutico que nos interesa, y que preserven, además, la notable tolerabilidad y ausencia de efectos adversos que estos compuestos presentan. Los conceptos de relación estructura química/actividad biológica que hemos revisado permiten proponer que moléculas con núcleos básicos flavilio, con dobles ligaduras entre los carbonos 2 y 3 del núcleo flavonoide y que posean grupos hidroxilo, serían candidatos excelentes a ser evaluados y modificados químicamente en estudios posteriores para afinar sus perfiles biofarmacéuticos. Paralelamente a lo anterior, será necesario llevar a cabo más estudios epidemiológicos que se centren en no sólo verificar el efecto vasorrelajante y/o hipotensor que a muchos productos naturales que contienen flavonoides se les ha atribuido, sino en evaluar objetivamente la efectividad terapéutica de estos potenciales fitofármacos en comparación con los fármacos empleados actualmente en la práctica clínica, buscando, además, una mejor relación costo/beneficio.
Referencias
1. Hertog MGL, Feskens EJM, Hollman PCH, Katan MB, Kromhout D: Intake of potentially anticarcinogenic flavonoids and their determinants in adults in The Netherlands. Nutr Cancer 1993; 20: 21–29. [ Links ]
2. Kühnau J: The flavonoids: a class of semi–essential food components: their role in human nutrition. World Rev Nutr Diet 1976; 24: 117–120. [ Links ]
3. Manach C, Regerat F, Texier O, Argullo G, Demigne C, Remesy C: Bio availability, metabolism and physiological impact of 4–oxo–flavonoids. Nutr Res 1996; 16: 517–544. [ Links ]
4. Middleton E, Kandaswami C, Theoharides TC: The Effects of Plant Flavonoids on Mammalian Cells: Implications for Inflammation, Heart Disease, and Cancer. Pharmacol Rev 2000; 52: 673–751. [ Links ]
5. Bilyk A, Sapers GM: Distribution of quercetin and kaempferol in lettuce, kale, chive, garlic chive, leek, horseradish, red radish, and red cabbage tissues. J Agrie Food Chem 1985; 33: 226–228. [ Links ]
6. Hertog MGL, Hollman PCH, Katan MB: Content of potentially anticarcinogenic flavonoids of 28 vegetables and 9 fruits commonly consumed in the Netherlands. J Agric Food Chem 1992; 40: 2379–2383. [ Links ]
7. Timberlake CF, Henry BS: Plant pigments as natural food colours. Endeavour 1986; 10: 31–36. [ Links ]
8. Smith DA, Banks SW: Formation and biological properties of isoflavonoid phytoalexins. En: Cody V, Middleton E, Harborne JB. Eds. Plant Flavonoids in Biology and Medicine: Biochemical, Pharmacological, and Structure–Activity Relationships. New York. Alan R. Liss., 1986: 113–124. [ Links ]
9. Firmin JL, Wilson KE, Rossen L, Johnston AWB: Flavonoid activation of nodulation genes in Rhizobium reversed by other compounds present in plants. Nature 1986; 324: 90–92. [ Links ]
10. Peters NK, Frost JW, Long SR: A plant isoflavone, luteolin, induces expression of Rhizobium meliloti nodulation genes. Science 1986; 233: 978–980. [ Links ]
11. Djordjevic MA, Redmond JW, Batley M, Rolfe BG: Clovers secrete specific phenolic compounds which either stimulate or repress nod gene expression in Rhizobium trifolii. EMBO J 1987; 6: 1173–1179. [ Links ]
12. Zaat SAJ, Wijffelman CA, Spaink HP, VanBrussel AAM, Okker RJH, Lugtenberg BJJ: Induction of the nodA promoter of Rhizobium leguminosarum symplasmid pRLIJI by plant flavanones and flavonoids. J Bacteriol 1987; 169: 198–204. [ Links ]
13. Gabor M: Anti–inflammatory substances of plant origin. En: Vane JR, Ferreira JH. Eds. Handbook of Experimental Pharmacology: Anti–Inflammatory Drugs. New York. Springer–Verlag., 1979: 698–739. [ Links ]
14. Havsteen B: Flavonoids: A class of natural products of high pharmacological potency. Biochem Pharmacol 1984; 32: 1141–1148. [ Links ]
15. Selway JWT: Antiviral activity of flavones and flavans. En: Cody V, Middleton E, Harborne JB. Eds. Plant Flavonoids in Biology and Medicine: Biochemical, Pharmacological, and Structure–Activity Relationships. New York. Alan R. Liss., 1986: 521–536. [ Links ]
16. Welton AR, Hurley I, Will P: Flavonoids and arachidonic acid metabolism. En: Cody V, Middleton E, Harborne JB. Eds. Plant Flavonoids in Biology and Medicine II: Biochemical, Cellular and Medicinal Properties. New York. Alan R. Liss., 1988: 301–312. [ Links ]
17. Das DK: Naturally occurring flavonoids: Structure, chemistry, and high performance liquid chromatography methods for separation and characterization. Methods Enzymol 1994; 234:410–420. [ Links ]
18. Carroll KK, Guthrie N, So FV, Chambers AS: Anticancer properties of flavonoids, with emphasis on citrus flavonoids. En: Rice–Evans CA, Packer L. Eds. Flavonoids in Health and Disease. New York. Marcel–Dekker., 1998: 437–446. [ Links ]
19. Hughes RE, Wilson HK: Flavonoids: Some physiological and nutritional consideration. Prog Med Chem 1977; 14: 285–301. [ Links ]
20. Torel J, Cillard J, Cillard P: Antioxidant activity of flavonoids and reactivity of with peroxy radical. Phytochemistry 1986; 25: 383–385. [ Links ]
21. Clemetson CAB: Biflavonoids. En: Clemetson CAB. Ed. Vitamin C. Boca Raton. CRC Press., 1989: 101–128. [ Links ]
22. Kandaswami C, Middleton E: Free radical scavenging and antioxidant activity of plant flavonoids. En: Armstrong D. Ed. Free Radicals in Diagnostic Medicine. New York. Plenum Press., 1994:351–376. [ Links ]
23. Kandaswami C, Middleton E: Flavonoids as antioxidants. En: Shahidi F. Ed. Natural Antioxidants: Chemistry, Health Effects and Applications. Champaign, IL. AOCS Press., 1995: 174–203. [ Links ]
24. Hertog MGL, Hollman PCH, Katan MB, Kromhout D: Dietary antioxidant flavonoids and risk of coronary heart disease: the Zutphen Elderly Study. Lancet 1993; 342: 1007–1011. [ Links ]
25. Hertog MGL, Kromhout D, Aravanis C, Blackburn H, Buzina R, Fidaza F, et al: Flavonoid intake and long–term risk of coronary heart disease and cancer in the seven countries study. Arch Intern Med 1995; 155: 381–386. [ Links ]
26. Hertog MG, Feskens EJ, Kromhout D: Antioxidant flavonols and coronary heart disease risk. Lancet 1997; 349: 699. [ Links ]
27. Hertog MGL: Epidemiological evidence on potential health properties of flavonoids. Proc Nutr Soc 1996; 55: 385–397. [ Links ]
28. Knekt P, Järvinen R, Reunanen A, Maatela J: Flavonoid intake and coronary mortality in Finland: a cohort study. Br J Med 1996; 312: 478–481. [ Links ]
29. Rimm ER, Katan MB, Ascherio A, Stampfer M, Willet W: Relation between intake of flavonoids and risk of coronary heart disease in male health professionals. Ann Intern Med 1996; 125: 384–389. [ Links ]
30. Yochum L, Kushi LH, Meyer K, Folsom AR: Dietary flavonoid intake and risk of cardiovascular disease in postmenopausal women. Am J Epidemiol 1999; 149: 943–949. [ Links ]
31. Hirvonen T, Piettnen P, Virtanen M, Ovaskainen ML, Hakkinen S, Albanes D, Virtamo J: Intake of flavonols and flavones and risk of coronary heart disease in male smokers. Epidemiology 2001; 12: 62–67. [ Links ]
32. Ko FN, Huan TF, Teng CM: Vasodilatory action mechanisms of apigenin isolated from Apium graveolens in rat thoracic aorta. Biochim Biophys Acta 1991; 1115: 69–74. [ Links ]
33. Duarte J, Pérez–Vizcaíno F, Jimenez F, Tamargo J, Zarzuelo A: Vasodilatory effects of flavonoids in rat aortic smooth muscle. Structure–activity relationships. Gen Pharmacol 1993; 24: 857–862. [ Links ]
34. Duarte J, Pérez–Vizcaíno F, Zarzuelo A, Jimenez J, Tamargo J: Vasodilator effects of quercetin on isolated rat vascular smooth muscle. Eur J Pharmacol 1993; 239: 1–7. [ Links ]
35. Duarte J, Pérez–Vizcaíno F, Zarzuelo A, Jimenez J, Tamargo J: Inhibitory effects of quercetin and staurosporine on phasic contractions in rat vascular smooth muscle. Eur J Pharmacol 1994; 262: 149–156. [ Links ]
36. Duarte J, Pérez–Vizcaíno F, Jiménez J, Tamargo J, Zarzuelo A: Flavonoids and cardiovascular diseases. En: Atta–Ur–Rahman. Ed. Studies in Natural Products Chemistry. Vol 25, part F. Amsterdam. Elsevier., 2001: 565–605. [ Links ]
37. Duarte J, Galisteo M, Ocete MA, Pérez–Vizcaíno F, Zarzuelo A, Tamargo J: Effects of chronic quercetin treatment on hepatic oxidative status of spontaneously hypertensive rats. Mol Cell Biochem 2001; 221: 155–160. [ Links ]
38. Duarte J, Pérez–Palencia R, Vargas F, Pérez–Vizcaíno F, Zarzuelo A, Tamargo J: Antihypertensive effects of the flavonoid quercetin in spontaneously hypertensive rats. Br J Pharmacol 2001; 133: 117–124. [ Links ]
39. Pérez–Vizcaíno F, Ibarra M, Cogolludo AL, Duarte J, Zaragoza– Arnáez F, Moreno L, et al: Endothelium–Independent Vasodilator Effects of the Flavonoid Quercetin and Its Methylated Metabolites in Rat Conductance and Resistance Arteries. J Pharmacol Exp Ther 2002; 302(1): 66–72. [ Links ]
40. Haji–Faraji M, Haji–Tarkhani AH: The effect of sour tea (Hibiscus sabdariffa) on essential hypertension. J Ethnopharmacol 1999; 65: 231–236. [ Links ]
41. Herrera–Arellano A, Flores–Romero S, Chavez–Soto MA, Tortoriello J: Effectiveness and tolerability of a standardized extract from Hibiscus sabdariffa in patients with mild to moderate hypertension: a controlled and randomized clinical trial. Phytomedicine 2004; 11(5): 375–382. [ Links ]
42. Most MM: Estimated phytochemical content of the dietary approaches to stop hypertension (DASH) diet is higher than in the Control Study Diet. J Am Diet Assoc 2004; 104(11): 1725–1727. [ Links ]
43. Javorkova V, Pechanova O, Andriantsitohaina R, Vrbjar N: Effect of polyphenolic compounds on the renal Na+,K(+)–ATPase during development and persistence of hypertension in rats. Exp Physiol 2004; 89(1): 73–81. [ Links ]
44. Aoi W, Niisato N, Miyazaki H, Marunaka Y: Flavonoid–induced reduction of EnaC expression in the kidney of Dahl salt–sensitive hypertensive rat. Biochem Biophys Res Commun 2004; 315(4): 892–896. [ Links ]
45. Park YK, Kim JS, Kang MH: Concord grape juice supplementation reduces blood pressure in Korean hypertensive men: double–blind, placebo controlled intervention trial. Biofactors 2004; 22(1–4): 145–147. [ Links ]
46. Liu X, Wei J, Tan F, Zhou S, Wurthwein G, Rohdewald P: Pycnogenol, french maritime pine bark extract, improves endothelial function in hypertensive patients. Life Sci 2004; 74(7): 855–862. [ Links ]
47. Keen CL, Holt RR, Oteiza PI, Fraga CG, Schmitz HH: Cocoa antioxidants and cardiovascular health. Am J Clin Nutr 2005; 81(1): 298S–303S. [ Links ]
48. Hellner W, Forkmann G: Biosynthesis. En: Harborne JB. Ed. The Flavonoids. Advances in Research since 1986. London. Chapman and Hall., 1993: 499–535. [ Links ]
49. Wagner H, Farkas L: Synthesis of flavonoids. En: Harborne JB, Mabry TJ, Mabry H. Eds. The Flavonoids. Part I. New York. Academic Press., 1975,p 127–213. [ Links ]
50. Atoui AK, Mansouri A, Boskou G, Kefalas P: Tea and herbal infusions: their antioxidant activity and phenolic profile. Food Chem 2005; 89: 27–36. [ Links ]
51. Ames BN, Shigenaga MK, Hagen TM: Oxidants, antioxidants, and the degenerative diseases of aging. Proc Natl Acad Sci 1990; 90: 7915–7922. [ Links ]
52. Negishi H, Xu JW, Ikeda K, Njelekela M, Nara Y, Yamori Y: Black and green tea polyphenols attenuate bloodpressure increases in stroke–prone spontaneously hypertensive rats. J Nutr 2004; 134(1): 38–42. [ Links ]
53. Ubando–Rivera J, Navarro–Ocaña A, Valdivia–López MA: Mexican lime peel: comparative study on contents of dietary fibre and associated antioxidant activity. Food Chem 2005; 89: 57–61. [ Links ]
54. Moskaug JO, Carlsen H, Myhrstad MC, Blomhoff R: Polyphenols and glutathione synthesis regulation. Am J Clin Nutr 2005; 81(1): 277S–283S. [ Links ]
55. Nishizuka Y: Studies and perspective of protein kinase C. Science 1986; 233: 305–312. [ Links ]
56. Nishizuka Y: The molecular heterogeneity of protein kinase C and its implications for cellular regulation. Nature 1988; 334: 661–665. [ Links ]
57. Nishizuka Y: Protein kinase and lipid signaling for sustained cellular responses. FASEB J 1995; 9: 484–496. [ Links ]
58. Graziani Y, Chayoth R, Karny N, Feldman B, Levy J: Regulation of protein kinase activity by quercetin in Ehrlich Ascites tumor cells. Biochim Biophys Acta 1981; 28: 415–421. [ Links ]
59. Gschwendt M, Horn F, Kittstein W, Marks F: Inhibition of the calcium –and phospholipid– dependent protein kinase activity from mouse brain cytosol by quercetin. Biochem Biophys Res Comm 1983; 117:444–447. [ Links ]
60. End DW, Look RA, Shaffer NL, Balles EA, Persico FJ: Non–selective inhibition of mammalian protein kinases by flavonoids in vitro. Res Commun Chem Pathol Pharm 1987; 56: 75–86. [ Links ]
61. Hagiwara M, Inoue S, Tanaka T, Nunoki K, Ito M, Hidaka H: Differential effects of flavonoids as inhibitors of tyrosine protein kinase and serine/ threonine protein kinases. Biochem Pharmacol 1988; 37: 2987–2999. [ Links ]
62. Ferriola PC, Cody V, Middleton E: Protein kinase C inhibition by plant flavonoids, kinetic mechanism and structure–activity relationships. Biochem Pharmacol 1989; 38: 1617–1624. [ Links ]
63. Picq M, Dubois M, Munari–Silem Y, Prigent AF, Pacheco H: Flavonoid modulation of protein kinase C activation. Life Sci 1989; 44: 1563–1571. [ Links ]
64. Graziani Y, Erikson E, Erikson RL: The effect of quercetin on the phosphorilation activity of the Rous sarcoma virus transforming gene producti in vitro and in vivo. Eur J Pharmacol 1983; 135: 583–589. [ Links ]
65. Alexandrakis M, Singh L, Boucher W, Letourneau R, Theoflopoulos P, Theoharides TC: Differential effects of flavonoids on inhibition of secretion and on accumulation of secretory granules in rat basophile leukemia cells. Int J Immuno pharmacol 1999; 21: 379–390. [ Links ]
66. Bird TA, Schule HD, Delaney PB, Sims JE, Thoma B, Dower SK: Evidence that MAP (mitogen–activated protein) kinase activation may be a necessary but not sufficient signal for a restricted subset of responses in IL–1 treated epidermoid cells. Cytokine 1992; 4: 429–440. [ Links ]
67. Rogers JC, Williams DL: Kaempferol inhibits myosin light chain kinase. Biochem Biophys Res Comm 1989; 164: 419–425. [ Links ]
68. Jinsart W, Ternal B, Polya GM: Inhibition of rat liver cyclic AMP–dependent protein kinase by flavonoids. Biol Chem Hoppe–Seyler 1992; 373: 205–211. [ Links ]
69. Rodney G, Swanson AL, Wheeler LM, Smith GN, Worrel CS: The effect of a series of flavonoids of hyaluronidase and some other related enzymes. J Biol Chem 1950; 183: 739–747. [ Links ]
70. Carpenedo F, Bortignon C, Bruni A, Santi R: Effect of quercetin on membrane–linked activities. Biochem Pharmacol 1969; 18: 1495–1500. [ Links ]
71. Lang DR, Racker E: Effects of quercetin on Fl inhibitor or mitochondrial ATPase and energy–linked reactions in submitochondrial particles. Biochim Biophys Acta 1974; 333: 180–186. [ Links ]
72. Deters DW, Racker E, Nelson N, Nelson H: Partial resolution of the enzymes catalyzing photophos phorylation. J Biol Chem 1975; 250: 1041–1047. [ Links ]
73. Cantley LC, Hammes GG: Investigation of quercetin binding sites on chloroplast coupling factor. Biochemistry 1976; 15: 1–8. [ Links ]
74. Long GD, DeChatelet LR, O'Flaherty JT, McCall CE, Blass DA, Shirley PS, Parce JW: Effects of quercetin on magnesium–dependent adenosine triphosphatase and the metabolism of human polymorphonuclear leukocytes. Blood 1981; 57: 561–566. [ Links ]
75. Fewtrell CMS, Gomperts BD: Effect of flavone inhibitors of transport ATP ases on histamine secretion from rat mast cells. Nature 1977; 265: 635–636. [ Links ]
76. Zyma VL, Miroshnichenko NS, Danilova VM, En–Grin E: Interaction of flavonoid compounds with contractile proteins of skeletal muscle. Gen Physiol Biophys 1988; 7: 165–175. [ Links ]
77. Hirano T, Oka K, Akiba M: Effects of synthetic and natural flavonoids on Na+, K+–ATPase: Aspects of the structure–activity relationship and action mechanism. Life Sci 1989; 45: 1111–1117. [ Links ]
78. Pruzanki W, Vadas P: Phospholipase A2 –A mediator between proximal and distal effectors of inflammation. Immunol Today 1991; 12:143–144. [ Links ]
79. Lee TP, Matteliano ML, Middleton E: Effect of quercetin on human polymorphonuclear leukocyte lysosomal enzyme release and phospholipid metabolism. Life Sci 1982; 31: 2765–2774. [ Links ]
80. Lanni C, Becker EL: Inhibition of neutrophilphos pholipase A2 by p–bromophenylacyl bromide, nordihydroguaiaretic acid, 5,8,11,14–eicotetra yenoic acid and quercetin. Int Arch Allergy Appl Immunol 1985; 76: 214–217. [ Links ]
81. Gil B, Sanz MJ, Terencio M, Ferrandiz ML, Bustos G, Paya M, et al: Effects of flavonoids on Naja naja and human recombinant synovial phospholipase A2 and inflammatory responses in mice. Life Sci 1994; 54: PL333–PL338. [ Links ]
82. Lewis RA, Austen KF: The biologically active leukotrienes: Biosynthesis, metabolism, receptors, functions and pharmacology. J Clin Invest 1984; 73: 889–897. [ Links ]
83. Yamamoto S, Yoshimoto T, Furukawa M, Horie T, Watanabe–Kohno S: Arachinodate S–lipoxygenase and its new inhibitors. J Allergy Clin Immunol 1984; 74: 349–352. [ Links ]
84. Yoshimoto T, Furukawa M, Yamamoto S, Hone T, Watanabe–Kohno S: Flavonoids: Potent inhibitors of arachinodate 5–lipoxygenase. Biochem Biophys Res Comm 1983; 116: 612–618. [ Links ]
85. Laughton MJ, Evans PJ, Moroney MA, Hoult JR, Halliwell B: Inhibition of mammalian 5 lipoxygenase and cyclo–oxygenase by flavonoids and phenolic dietary additives. Relationship to antioxidant activity and to iron ion–reducing ability. Biochem Pharmacol 1991; 42: 1673–1681. [ Links ]
86. Hoult JRS, Maroney MA, Paya M: Actions of flavonoids and coumarins on lipoxygenase and cyclooxygenase. Methods Enzimol 1994; 234: 443–454. [ Links ]
87. Cockcroft S: Phosphatidylinositol metabolism in mast cells and neutrophils. Cell Calcium 1982; 3: 337–349. [ Links ]
88. Ruckstuhl M, Landry Y: Inhibition of lung cyclic AMP– and GMP– phosphodiesterases by flavonoids and other chromone–like compounds. Biochem Pharmacol 1981; 30: 697–702. [ Links ]
89. Beretz A, Anton R, Cazenave JP: The effects of flavonoids on cyclic nucleotidephosphodiesterases. En: Cody V, Middleton E, Harborne JB. Eds. Plant Flavonoids in Biology and Medicine: Biochemical, Pharmacological and Structure–Activity Relationships. New York. Alan R. Liss., 1986, p 281–296. [ Links ]
90. Beretz A, Joly M, Stoclet JC, Anton R: Inhibition of 3',5'–AMP phosphodiesterase by flavonoids and xanthones. Planta Med 1979; 36: 193–195. [ Links ]
91. Ferrell JE, Chang–Sing PDG, Loew G, King R, Mansour JM, Mansour TE: Structure/activity studies of flavonoids as inhibitors of cyclic AMP phosphodiesterase and relationship to quantum chemical indices. Mol Pharmacol 1979; 16: 556–568. [ Links ]
92. Landolfi R, Nower RL, Steiner M: Modification of platelet function and arachidonic acid metabolism by bioflavonoids. Structure–activity relationships. Biochem Pharmacol 1984; 36: 907–914. [ Links ]
93. Nagai T, Miyaichi Y, Tomimori T, Yamada H: Inhibition of mouse liver sialidase by plant flavonoids. Biochem Biophys Res Comm 1989; 163: 25–31. [ Links ]
94. Nagai T, Miyaichi Y, Tomimori T, Suzuki Y, Yamada H: Inhibition of influenza virus sialidase and anti–influenza virus activity by plant flavonoids. Chem Pharm Bull 1990; 38: 1329–1332. [ Links ]
95. Nagai T, Miyaichi, Tomimori T, Suzuki Y, Yamada H: In vivo anti–influenza virus activity of plant flavonoids possessing inhibitory activity for influenza virus sialidase. Antiviral Res 1992; 19: 207–217. [ Links ]
96. Murad F: Discovery of some biological effects of nitric oxide and its role in cell signaling (Nobel Lecture). Agewandte Chemie International Edition 1999; 38: 1856–1868. [ Links ]
97. Ignarro LJ: Nitric oxide: a unique endogenous signaling molecule in vascular biology (Nobel Lecture). Angewandte Chemie International Edition 1999; 38: 1882–1892. [ Links ]
98. Wandehenne D, Pugin A, Klessig DF, Durner J: Nitric oxide: comparative synthesis and signaling in animal and plant cells. TRENDS in Plant Science 2001; 6(4): 177–182. [ Links ]
99. Feinstein DL, Galea E, Reis DJ: Supression of glial iNOS expression by tyrosine kinase inhibitors. Ann NY Acad Sci 1994; 738: 325–328. [ Links ]
100. Soliman KF, Mazzio EA: In vitro attenuation of nitric oxide production in C6 astrocyte cell culture by various dietary compounds. Proc Exp Biol Med 1998; 218: 390–397. [ Links ]
101. Chiesi M, Schwaller R: Inhibition of constitutive endothelial NO–synthase activity by tannin and quercetin. Biochem Pharmacol 1995; 14:495–501. [ Links ]
102. Li H, Xia N, Brausch I, Yao Y, Förstermann U: Flavonoids from Artichoke (Cynara scolymus L.) Up–Regulate Endothelial–Type Nitric–Oxide Synthase Gene Expression in Human Endothelial Cells. J Pharmacol Exp Ther 2004; 310(3): 926–932. [ Links ]
103. Huang Y, Chan NW, Lau CW, Yao XQ, Chan FL, Chen ZY: Involvement of endothelium/nitric oxide in vasorelaxation induced by purified green tea (–)epicatechin. Biochim Biophys Acta 1999; 1427(2): 322–328. [ Links ]
104. Wessler LM, Follmann E, Michaelis W, Dusterhoft T, Baumann G, Stangl K, Stangl V: A constituent of green tea, epigallocatechin–3–gallate, activates endothelial nitric oxide synthase by a phosphatidylinositol–3–OH–kinase–, cAMP–dependent protein kinase–, and Akt–dependent pathway and leads to endothelial–dependent vasorelaxation. J Biol Chem 2004; 279(7): 6190–6195. [ Links ]
105. Duarte J, Jimenez R, Villar IC, Perez–Vizcaino F, Jimenez J, Tamargo J: Vasorelaxant effects of the bioflavonoid chrysin in isolated rat aorta. Planta Med 2001; 67(6): 567–569. [ Links ]
106. Gugler R, Leschik M, Dengler HJ: Disposition of quercetin after single oral and intravenous doses. Eur J Clin Pharmacol 1975; 9: 229–234. [ Links ]
107. Manach C, Morand C, Crespy V, Demigne C, Texier O, Regerat F, Remesy C: Quercetin is recovered in human plasma as conjugated derivatives which retain antioxidant properties. FEBS Lett 1998; 24: 331–336. [ Links ]














