Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.76 supl.2 Ciudad de México abr./jun. 2006
Presentación
Tratamiento quirúrgico de la estenosis valvular aórtica con anillo aórtico pequeño
Surgical treatment of aortic stenosis in small aortic annulus
Felipe Santibáñez Escobar*
* Médico adscrito. Departamento de Cirugía Cardiovascular. INCICH. Instituto Nacional de Cardiología Ignacio Chávez
Correspondencia:
Felipe Santibáñez Escobar.
Instituto Nacional de Cardiología Ignacio Chávez. Departamento de Cirugía Cardiovascular.
(INCICH Juan Badiano Núm. 1 Col. Secc XVI, Tlalpan,14080, México D.F.)
Tel. 55.73.52.55 ext. 1352 Fax. 55.73.09.94.
Correo electrónico: santi_f@yahoo.com
Resumen
El propósito de esta presentación es demostrar que las técnicas previamente descritas de ampliación del anillo de la aorta, creadas con la finalidad de colocar números protésicos de mayor tamaño, es factible en nuestro medio, con excelentes resultados. Se realiza una revisión retrospectiva de los expedientes de 72 enfermos, con un promedio de edad de 46 años y una oscilación etérea de 13 a 75 años, sometidos a alguna de las técnicas de ampliación del anillo valvular de la aorta, con las consideraciones acerca de la correlación entre el número protésico y el área de superficie corporal del enfermo, a fin de evitar disparidad prótesis–paciente. Asimismo se revisan las causas de la mortalidad de esta serie, observándose que en aquellos enfermos con áreas de superficie corporal que varían entre 1.3 y 1.7 m2 es preferible colocar prótesis número 23 o mayores, a fin de evitar dejar gradientes residuales que impidan la regresión de la hipertrofia ventricular izquierda producto de la valvulopatía aórtica, y así prolongar la sobrevida de estos enfermos. Concluimos que las distintas técnicas de ampliación del anillo de la aorta son reproducibles, que hemos obtenido mejores resultados con la técnica descrita por Manouguian y Seybold–Epting, pero que cualquiera de ellas se encuentra claramente indicada en enfermos con disparidad prótesis–paciente.
Palabras clave: Estenosis valvular aórtica. Disparidad prótesis–paciente. Ampliación del anillo de la aorta.
Summary
The purpose of this work is to demonstrate that the aortic enlargement procedures, first described for patients with small aortic annulus, are reproducible with excellent results. A retrospective revision of 72 cases in which an enlargement procedure was done, with consideration regarding the relationship between valve size and patient body surface area, in order to avoid prosthesis–patient mismatch, was done. We consider the immediate mortality of the group, differentiating the cardiac mortality, concluding with other authors that body surface areas between 1.3 and 1.7 m2 should receive aortic prosthesis larger than # 23, which will eventually improve the late outcome of this population. We demonstrate that the aortic annular enlargement procedures can be safely done in our hospital, with a slight increase in mortality during the learning phase, but great benefit afterwards.
Key words: Aortic stenosis. Annular enlargement procedures. Prosthesis–patient mismatch.
Introducción
La estenosis valvular aórtica del adulto (EVA), causada por cardiopatía reumática inactiva (CRI) en nuestro medio, y que frecuentemente se asocia con calcificación severa del anillo y aparato valvular, ha quedado prácticamente en manos del cirujano para su resolución.1–4 Las técnicas de cardiología intervencionista, como la valvulotomía aórtica con balón, han demostrado ser efectivas en presencia de estenosis aórtica congénita, con una sobrevida de 95% a 8 años,5 y un 50% de posibilidad de no requerir reintervención en el mismo lapso de tiempo,5,6 sin embargo todos los autores están de acuerdo que en este marco, la valvuloplastía con balón solamente logra un efecto paliativo. En cuanto a la valvuloplastía aórtica con balón en adultos, ésta no modifica la historia natural de la estenosis aórtica sin tratamiento, siendo que a los 6 meses de realizado el procedimiento el 75% de los enfermos mostrarán signos de re–estenosis, y la sobrevida libre de eventos a tres años (muerte, cambio valvular aórtico o re–valvuloplastía) es de 6%,7 por lo que la valvulotomía con balón no se considera un sustituto para el reemplazo valvular aórtico.8 Por otra parte la mortalidad operatoria de esta patología aislada se ha disminuido de un 25.5% en la década de los 60, a 2.6% en la década de los 80.9 Con las actuales medidas de protección miocárdica, indicaciones más precisas del momento quirúrgico y el empleo de nuevas generaciones de prótesis, la morbi–mortalidad quirúrgica en este padecimiento ha permanecido baja, con excelentes resultados a mediano y largo plazo. En este sentido es importante hacer la observación que el empleo de las nuevas generaciones de prótesis bi–valvas han contribuido al disminuir el gradiente transvalvular y por ende la postcarga del ventrículo izquierdo (VI). Pero queda ese grupo de enfermos en los cuales la estenosis aórtica se acompaña de un anillo aórtico pequeño, que obliga al cirujano a colocar una prótesis de diámetro pequeño, que independientemente de si es mecánica bivalva o biológica, impedirá el paso libre de sangre a través de la misma, creando así gradientes transvalvulares significativos. Es así que deberá adecuarse el tamaño de la prótesis a las características del enfermo10,11(área de superficie corporal). Definimos el anillo aórtico como "pequeño" cuando existe disparidad entre el diámetro del mismo y el área de superficie corporal del enfermo (ASC).11,12 Debe tenerse en cuenta que el área del orificio efectivo de una prótesis mecánica o biológica es muy distinta del área de orificio efectiva de una válvula nativa.13 Se define como área de orificio efectivo de una prótesis el diámetro interno de la misma, sin tomar en cuenta el diámetro del anillo de sujeción.11 Es así que el área de orificio efectivo (AOE) de una válvula nativa de número 19 es de 1.9 cm2, mientras que el área de orificio efectivo de una prótesis biológica Perimount de Carpentier–Edwards de 19 mm de diámetro es de 1.2 cm2. Dicha disminución en el área efectiva se refleja en forma exponencial en el gradiente que se produce, según las leyes de la física e hidrodinámica. Es por ello que se ha sugerido correlacionar el AOE de las prótesis con el ASC del enfermo,14 según la siguiente ecuación:
AOE/ASC = radio
En donde AOE es el área de orifico efectivo de la prótesis (diámetro interno de la misma) en cm2, ASC es el ASC del enfermo en m2, y el resultado es el radio.11,14 Un radio menor 0.6 cm2/m2 es representativo de estenosis aórtica severa.14 Basándonos en esta ecuación, siendo el AOE de la prótesis Perimount de Carpentier–Edwards biológica de 19 mm de diámetro un valor de 1.21 ± 0.31 cm2, si dicha prótesis se le implanta a un paciente con un área de superficie corporal de 2 m2, el radio resultante será de 0.6 cm2/m2, es decir, habremos realizado el cambio valvular a nuestro enfermo, pero no hemos corregido la anormalidad hemodinámica, ya que habrá quedado una estenosis protésica residual severa.11 La misma prótesis colocada en un enfermo con ASC de 1.5 da un radio de 0.8 cm2/m2, es decir una estenosis aórtica residual leve.11 La conclusión importante estriba en el hecho de que es necesario hacer una correlación entre el área efectiva de la prótesis a implantar y el área de superficie corporal del enfermo, a fin de colocar la prótesis que mayor beneficio proporcione a nuestro enfermo, y no la que la anatomía del anillo aórtico permita. Para ello se han descrito en la literatura varias técnicas quirúrgicas que permiten ampliar el anillo aórtico, a fin de poder colocar prótesis de mayor tamaño. De las técnicas descritas, hemos empleado básicamente tres, las dos primeras son técnicas de ampliación del anillo por vía posterior, la primera de ellas descrita por Nicks,15 la segunda descrita por Manouguian y Seybold–Epting,16 y la ampliación del anillo de la aorta por vía anterior descrita por Konno.17 Todas estas técnicas han sido descritas con detalle por sus autores respectivos.15–17
Material y métodos
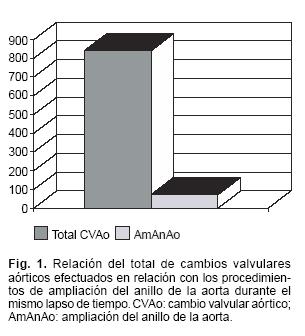
De enero de 1995 a julio del 2001, de 840 cambios valvulares aórticos (CVAo) realizados en nuestro servicio, aislados o asociados a otras valvulopatías, en 72 de ellos (8.5%) se realizó ampliación del anillo de la aorta concomitante al CVAo (Fig. 1). De este universo de enfermos, 33 eran del sexo masculino y 39 del sexo femenino, con un promedio de 46 años y una variación de 13 a 75 años. En 54 de nuestros casos (75%) la etiología fue CRI, 12 (16.6%) fueron disfunciones protésicas en las que el implante de una prótesis pequeña era la causa de la disfunción, y en 6 casos (8.33%) la causa etiológica fue congénita. Se realizaron 54 primeras cirugías, 50 por vía de esternotomía media longitudinal, y 4 por vía de miniesternotomía en T invertida, así como 18 reoperaciones, que incluyen las 12 disfunciones protésicas y los 6 congénitos que ya habían sido sometidos a cirugía conservadora de la válvula aórtica (valvulotomía quirúrgica) previamente. El área de superficie corporal de nuestros enfermos fue en promedio de 1.53 m2, con un rango de 1.0 a 2.0 m2. Los diámetros del anillo aórtico pre–ampliación fueron en promedio de 19 mm, con un rango que varió de 17 a 23 mm. Los diámetros postampliación fueron en promedio de 23 mm, con un rango que varió de los 19 a los 25 mm (Fig. 2). El gradiente transvalvular aórtico preoperatorio fue en promedio de 67.5 mmHg, con un rango de 24 a 120 mm Hg. El gradiente transvalvular aórtico postoperatorio fue en promedio de 13 mm Hg, con un rango entre 2 y 22 mmHg en los 57 enfermos en los que se contó con la medición de dicho gradiente por ecocardiografía transtorácica postoperatoria. La técnica quirúrgica empleada fue estándar, por esternotomía media longitudinal completa, con excepción de los casos en los que se realizó miniesternotomía, empleo de cardioplejía anterógrada—retrógrada sanguínea helada, e hipotermia corporal moderada. El tiempo de circulación extracorpórea fue en promedio de 161 minutos, con un rango de 90 a 278 min. El tiempo de pinzamiento aórtico promedio fue de 98.6 min, con un rango de 65 a 177 min. Se colocaron un total de 20 prótesis biológicas, todas ellas de pericardio bovino, y 52 prótesis mecánicas, de las cuales 31 fueron de disco único y 21 bivalvas. Se realizaron procedimientos concomitantes en un total de 28 enfermos del grupo (38.8%), las cuales se encuentran detalladas en la Tabla I. En los casos en los que consideró prudente, se emplearon inotrópicos para la salida de la bomba. La clase funcional preoperatoria del grupo fue básicamente en clase II y III de la NYHA (Fig. 3). Se realizaron un total de 39 procedimientos con la técnica descrita por Manouguian y Seybold–Epting,16 30 procedimientos con la técnica descrita por Nicks,15 y 3 con la técnica descrita por Konno.17



Resultados
La mortalidad total del grupo fue de 13 casos (18.0%), con una mortalidad por causa cardíaca de 7 casos (9.7%). Desglosando las mortalidades, de 39 procedimientos de Manouguian que se realizaron, cinco fallecieron (12.8% de mortalidad), pero solamente dos de ellos fueron por causa cardíaca atribuible a la técnica quirúrgica (5.1%), es decir, falla del VI irreversible, las otras tres fueron una endocarditis tardía, otra por trombosis protésica secundaria a mala anticoagulación deficiente, y la tercera por una sepsis severa. De los 30 procedimientos con técnica de Nicks, siete fallecieron (23.3% de mortalidad global), pero solamente 4 de ellos por causa cardíaca, es decir, falla VI irreversible (13.3% de mortalidad por causa cardíaca), las otras cuatro defunciones no tuvieron relación con disfunción miocárdica, fueron secundarias a un EVC tardío, un evento de tamponade súbito y dos casos de endocarditis bacteriana. De los tres procedimientos de Konno realizados, uno falleció, siendo éste por disfunción VI (33% de mortalidad cardíaca).
Discusión
El objetivo a alcanzar en un enfermo con estenosis aórtica debe ser en todos los casos eliminar la postcarga excesiva al VI, buscando con ello cambiar la historia natural esperada de la valvulopatía. Ya ha sido descrito con anterioridad en la literatura el problema de la disparidad prótesis–paciente18 y se ha definido como un área protésica efectiva inadecuada (menor que el área de orificio efectivo de la válvula nativa) para satisfacer las necesidades hemodinámicas del enfermo. Debido a que la mortalidad quirúrgica del CVAo ha disminuido drásticamente, la decisión para operar deberá estar basada en el mejor tiempo para efectuar la cirugía a fin de maximizar la sobrevida a largo plazo. Ha quedado claro en la literatura que la hipertrofia del VI es un factor predictivo de eventos mórbidos en enfermos que cursan con HAS asintomática.19 Asimismo se ha demostrado que en presencia de estenosis aórtica severa existe un mayor riesgo de mortalidad temprana en aquellos pacientes con un corazón de tamaño pequeño pero con presencia de hipertrofia significativa y obstrucción a la vía de salida del VI.20,21 Debido a la disparidad prótesis–paciente se han diseñado diversas técnicas para la ampliación del anillo aórtico, con el objeto de colocar prótesis de mayor tamaño.15–17,22–24 Existen reportes en la literatura con mejoría en la sobrevida en aquellos enfermos en quienes se colocaron prótesis aórticas de mayor tamaño comparándolas con prótesis aórticas de menor tamaño, y esto puede ser debido a una hipertrofia ventricular preoperatoria menos severa, o bien, a una reducción en la masa VI postoperatoria más pronunciada, por la presencia misma de una prótesis de mayor tamaño.25,26 Cada vez más autores solamente indican el implante de prótesis de talla 19 y 21 en posición aórtica en mujeres con área de superficie corporal pequeña y a pacientes mayores de 60 años con vida sedentaria.27 Existe evidencia en cuanto a que las prótesis valvulares pequeñas en posición aórtica que generan un gradiente transvalvular hemodinámicamente significativo disminuyen la sobrevida a largo plazo, como lo demuestra Connolly,13 aun cuando este estudio fue realizado en enfermos con estenosis aórtica y disfunción ventricular izquierda, por análisis univariado para mortalidad operatoria se identificaron dos factores de riesgo: prótesis de tamaño pequeño y edad avanzada, y por análisis multivariado, el único predictor de mortalidad operatoria fue el empleo de prótesis de tamaño pequeño (47% de mortalidad para válvulas protésicas de tamaño 21o menor contra 15% para prótesis 23 o mayores).13 Resulta importante recalcar que las tasas de mortalidad reportadas son muy elevadas debido a que el grupo de enfermos estudiados tenían baja función ventricular asociada a la CVAo, sin embargo, los hallazgos en cuanto al tamaño de la prótesis son extrapolables a cualquier población de enfermos con estenosis aórtica, aun cuando no hayan llegado al extremo del espectro clínico de la misma. Se ha demostrado por mediciones ecocardiográficas que tanto para prótesis mecánicas como biológicas los gradientes medios de Doppler disminuyeron, y el área de orificio efectivo indexada aumentó conforme se incrementó el número protésico.20 Los mismos autores reportan que el gradiente de presión medio, el tipo de prótesis valvular empleada, y su tamaño, jugaron un papel estadísticamente significativo para explicar la regresión en el índice de masa VI. De tal forma, la regresión en el índice de masa VI fue más marcado en presencia de prótesis mecánicas que en biológicas,20 lo cual se explica por el hecho que las prótesis mecánicas son menos obstructivas que las bioprótesis con soporte comparando válvulas del mismo tamaño. Se ha llegado a considerar que una prótesis mecánica de 21 mm se equipara en funcionamiento hemodinámico a una biológica con soporte de 23 mm.20 A menor número protésico mayor gradiente transvalvular, menor regresión del índice de masa del VI en el postoperatorio, lo que se traduce como una mayor hipertrofia VI residual, mayor índice de disfunción del VI y mayor índice de arritmias fatales a mediano y largo plazo. Por todo esto nuestro objetivo al realizar una cirugía de CVAo es disminuir al máximo posible la presencia del gradiente postoperatorio, evitando con ello la progresión de la enfermedad.11 Resulta evidente que correlacionando el ASC de nuestro enfermo con el AOE de la prótesis podemos saber el beneficio resultante de la cirugía. A mayor correlación entre estos dos índices (AOE/ASC) mayor el beneficio del acto quirúrgico. Es decir, en enfermos con áreas de superficie corporal entre 1.3 y 1.7 m2 (lo cual incluye a una vasta proporción de nuestros enfermos) deberá buscarse el implantar una prótesis mecánica no menor a 23 mm. En este grupo de enfermos el empleo de una prótesis de 21 mm o menor implica no resolver completamente el problema hemodinámico del enfermo.10 Se ha logrado correlacionar en estudios previos que la presencia de una prótesis de segunda generación (bivalva) de tamaño pequeño (menor a 23) en posición aórtica se asocia con una mayor incidencia de muertes relacionadas con la prótesis, y los autores especulan que las prótesis de tamaño pequeño en posición aórtica se encuentran sujetas a fuerzas mayores que aumentan la incidencia de fugas paravalvulares y crean turbulencias en el flujo sanguíneo que favorecen la presencia de trombosis, embolismo y endocarditis.28 En el grupo de enfermos en los cuales se indica una prótesis mecánica, existen en el mercado algunas casas comerciales que producen prótesis con anillos de sujeción más pequeños, lo que permite que el AOE sea ligeramente mayor, sin embargo este aumento no siempre es lo suficiente para compensar por ASC mayore s de 1.5 m2. Asimismo, para los enfermos que requieren de prótesis biológicas, existe la alternativa de las prótesis sin soporte, las cuales, al no tener anillo de sujeción aumentan considerablemente el AOE.29 Desgraciadamente este tipo de bioprótesis sin soporte no se encuentran ampliamente disponibles en nuestro medio lo que limita la experiencia en su colocación, que difiere de la colocación de una bioprótesis con soporte. En nuestra serie, durante la primera parte de nuestra experiencia en ampliación del anillo de la aorta, la mortalidad fue elevada, explicable por la curva de aprendizaje necesaria para dominar la técnica, y es en ese momento de nuestra curva de aprendizaje donde se acumuló el grueso de la mortalidad. Es importante recordar que nuestro grupo de enfermos con una elevada frecuencia cursaban con disfunción severa preoperatoria VI, y muchos de ellos fueron intervenidos de urgencia por las condiciones críticas de su padecimiento. Nosotros atribuimos las defunciones secundarias a disfunción ventricular izquierda postoperatoria como inherentes a la técnica quirúrgica, sin embargo en un alto porcentaje de ellos la disfunción ventricular fue secundaria a las malas condiciones cardiológicas preoperatorias, en particular a daño crónico irreversible VI. Una de las consideraciones que se utilizaron para emplear la técnica de ampliación del anillo de la aorta fue el disminuir significativamente los gradientes aórticos postoperatorios, buscando con ello minimizar la disfunción ventricular izquierda postoperatoria. Es probable que de no haber empleado la técnica de ampliación de anillo de la aorta, la mortalidad en este grupo de enfermos por causa cardíaca fuese aún mayor.
La dificultad de la técnica de ampliación del anillo de la aorta fue en decremento conforme avanzamos en la experiencia (Tabla II). Durante nuestra etapa inicial realizamos un mayor número de procedimientos de Nicks, los cuales nos permiten ampliar el anillo aórtico en un número protésico, y cuya dificultad técnica es menor que los otros dos descritos y empleados por nosotros (Konno y Manouguian), sin embargo nuestra principal complicación fue desgarro del techo de la aurícula izquierda al bajar la prótesis sin incidir previamente el techo de la aurícula izquierda (Nicks), motivo por el que hemos decidido cambiar al procedimiento descrito por Manouguian–Seybold Epting, con el cual se evita el desgarro de esta estructura, además que permite la ampliación del anillo de la aorta hasta en dos ó tres tallas protésicas más, dependiendo de la anatomía del anillo aórtico. No existió, en nuestra experiencia, causa directamente atribuible a la ampliación, es decir, dificultades técnicas durante el procedimiento que culminaran con el deceso del enfermo. Nuestra principal complicación técnica fue el sangrado en el sitio de colocación del parche de pericardio, lo que resolvimos a base de una mayor experiencia en la técnica de implantación del mismo.
A diferencia de la técnica descrita por Manouguian–Seybold Epting,16 hemos decidido no emplear un segundo parche para cerrar el techo de la aurícula izquierda en un intento de simplificar la técnica original, realizamos el cierre del techo de la aurícula izquierda con puntos de prolene 4–0 anclados en perlas de pericardio, sujetándolo al parche de pericardio empleado en la ampliación y sucesivamente al anillo de la prótesis, formando así el neo–anillo. El material que hemos empleado para la ampliación es pericardio bovino tratado con glutaraldehído, el cual ha demostrado ser durable, sin complicaciones a mediano y largo plazo.30 En el último año y medio de la casuística hemos perdido un solo enfermo por causa cardíaca, y es en este período cuando hemos realizado la gran mayoría de los procedimientos (Tabla II). Resulta entonces evidente que se necesita una curva de aprendizaje, pero que una vez superada ésta los resultados mejoran en forma considerable, quedando la mortalidad supeditada al daño miocárdico preoperatorio y no a la técnica quirúrgica. Finalmente debemos de aclarar que intentamos en un selecto grupo de enfermos (4 casos) realizar la técnica de ampliación del anillo de la aorta mediante mini–esternotomía superior en T, sin embargo decidimos abandonar este acceso debido a que dificulta innecesariamente la visibilidad del campo quirúrgico, lo que a su vez dificulta el procedimiento y alarga peligrosamente los tiempos de circulación extracorpórea, en un vano intento de abordaje cosmético que sacrifica la seguridad del procedimiento.

Agradecimientos
Agradecemos la ayuda del Dr. José Miguel Casanova, Jefe del Departamento de Bioestadística, por los datos estadísticos proporcionados.
Referencias
1. Carabello BA, Green LH, Grossman W, Cohn LH, Koster JK, Collins JJ: Hemodynamic determinants of prognosis of aortic valve replacement in critical aortic stenosis and advanced congestive heart failure. Circulation 1980; 62(1): 42–8. [ Links ]
2. Smith N, Me Anulty JH, Rahimtoola SH: Severe aortic stenosis with impaired left ventricular function and clinical heart failure: Results of valve replacement. Circulation 1978; 58(2): 255–64. [ Links ]
3. Monin JL,Monchi M,GestV, Duval–Moulin AM, Dubois–Rande JL, Gueret P: Aortic stenosis with severe left ventricular dysfunction and low transvalvular pressure gradients. JACC 2001; 37: 2101–7. [ Links ]
4. Blitz LR, Gorman M, Herrmann H: Results of aortic valve replacement for aortic stenosis with relatively low transvalvular pressure gradients. Am J Cardiol 1998; 81: 358–62. [ Links ]
5. Moore P, Egito E, Mowrey H, Perry SB, Lock JE, Keane JF: Midterm results of balloon dilatation in congenital aortic stenosis: Predictors of success. JACC 1996; 27(5): 1257–63. [ Links ]
6. Borghi A, Agnoletti G, Valsecchi 0, Carminati M: Aortic balloon dilatation for congenital aortic stenosis: Report of 90 cases. Heart 1999; 82: e10. [ Links ]
7. Lieberman EB, Bashore TM, Hermller JB, Wilson JS, Pieper KS, Keeler GP, Pierce CH, Kisslo KB, Harrison JK, Davidson CJ: Ballon aortic valvuloplasty in adults: Failure of procedure to Improve long term survival. JACC 1995; 26(6):1522–8. [ Links ]
8. Carabello B, De Leon AC, Edmunds LH, Fedderly BJ, Freed MD, Gaasch WH, Mckay CR, Nishimura RA, O'Gara PT, O'Rourke RA, Rahimtoola SH: ACC/AHA Guidelines for the management of patients with valvular heart disease. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Management of patients with Valvular Heart Disease). JACC 1998; 32(5): 1486–588. [ Links ]
9. Verheul HA, Van der Brink RBA, Bouma BJ, Hoedemaker G, Moulijn AC, Dekker E, Bossuyt P, Dunning AJ: Analysis of risk factors for excess mortality after aortic valve replacement. JACC 1995; 26(5): 1280–6. [ Links ]
10. Shigenobu M, Sano S: Criteria to select proper valve prosthesis for aortic valve replacement. J Cardiovasc Surg 1993; 34: 203–8. [ Links ]
11. Rao V, Jamieson E, Ivanov J, Armstrong S, David TE: Prosthesis–Patient mismatch affects survival afier aortic valve replacement. Circulation 2000; 102(Suppl III): III 5 III 9. [ Links ]
12. Ghosh P, Kumar S, Pandey S, Kumar AS, Sinha N: Small aortic Annulus: A functional definition. AnnThorac Cardiovasc Surg 1998; 5: 251–61. [ Links ]
13. Connolly HM, Oh JK, Schaff HV, Roger VL, Osborn SL, Hodge DO, Tajik AJ: Severe aortic stenosis with low transvalvular gradient and severe left ventricular dysfunction. Results of aortic valve replacement in 52 patients. Circulation 2000; 101:1940–46. [ Links ]
14. Pellikka PA, Nishimura RA, Bailey KR, et al: The natural history of adults with asymptomatic, hemodinamically significant aortic stenosis. JACC 1990; 15: 1012–17. [ Links ]
15. Nicks R, Cartmill T, Bernstein L: Hypoplasia of the aortic root. The problem of valve replacement. Thorax 1970; 25: 339–46. [ Links ]
16. Manouguian S, Seybold–Epting W: Patch enlargement of the aortic valve ring by extending the aortic incision into the anterior mitral leaflet. New operative technique. J Thorac Cardiovasc Surg 1979; 78(3): 402–12. [ Links ]
17. Konno S, Imai Y, Nakajima M, Fida Y: A new method for prosthetic valve replacement in congenital aortic stenosis associated with hypoplasia of theaortic valvering. Bull Heart Inst Jpn 1974; 15: 1–17. [ Links ]
18. Rahimtoola SH: The problem of valve prosthesis–patient mismatch. Circulation 1978; 58(1): 20–4. [ Links ]
19. Levy D, Garrison RJ, Savage DD, Kannel WB, Castelli WP: Prognostic implications of echocardiographically determined left ventricular mass in the Framingham heart study. N Engl J Med 1990; 322: 1561–6. [ Links ]
20. Bech–Hanssen O, Wallentin I, Houltz E, Beckman Suurkula M, Larsson S, Caidahl C: Gender differences in patients with severe aortic stenosis: impact on preoperative left ventricular geometry and function, as well as early postoperative morbidity and mortality. Eur J Cardiothorac Surg 1999; 15: 24–30. [ Links ]
21. Levy D, Garrison RJ, Savage DD, Kannel WB, Castelli WP: Prognostic implications of echocardiographically determined left ventricular mass in the Framingham heart study. N Engl J Med 1990; 322: 1561–6. [ Links ]
22. David TE, Uden DE: Aortic Valve Replacement in Adults with small aortic Annuli. Ann Thorac Surg 1983; 36(5): 577–83. [ Links ]
23. Blank RH, Pupello DF, Bessone LN, Harrison EE, Sbar S: Method of managing the small aortic annulus during valve replacement. Ann Thorac Surg 1976: 356–61. [ Links ]
24. Summers KE, David TE: Aortic valve replacement with patch enlargement of the aortic annulus. Ann Thorac Surg 1997; 63: 1608–12. [ Links ]
25. Abdelnoor M, Nitter–Hauge S, Trettli S: Relative survival of patients after heart valve replacement. Eur Heart J 1990; 11: 23–8. [ Links ]
26. Morris JJ, Schaff HV, Mullany CJ, Rastogi A, McGregor CGA, Daly RC, et al: Determinants of survival and recovery of left ventricular function after aortic valve replacement. Ann Thorac Surg 1993; 56: 22–30. [ Links ]
27. Bech–Hanssen O, Caidahl K, Wall B, Myken P, Larsson S, Wallentine I: Inftuence of aortic valve replacement, prosthesis type and size on functional outcome and ventricular mass in patients with aortic stenosis. J Thorac Cardiovasc Surg 1999; 118(1): 57–65. [ Links ]
28. Debétaz LF, Ruchat P, Hurni M, Fischer A, Stumpe F, Sadeghi H, Van Melle G, Goy JJ, St. Jude Medical Valve Prosthesis: An analysis of long term outcome and prognostic factors. J Thorac Cardiovasc Surg 1997; 113(1): 134–48. [ Links ]
29. Collinson J, Henein M, Flather M, Pepper JR, Gibson DG: Valve replacement for aortic stenosis in patients with poor left ventricular function. Comparison of early changes with stented and stentless valves. Circulation 1999; 100(suppl II): II–1–II–5. [ Links ]
30. David TE: The use of pericardium in acquired heart disease: A review article. J Heart Valve Dis 1998; 7: 13–8. [ Links ]














