Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.76 no.2 Ciudad de México abr./jun. 2006
Investigación clínica
Estado actual del trasplante cardíaco en Nuevo León: Primeros 33 casos
Programas de Trasplante Cardíaco de la Unidad Médica de Alta Especialidad No. 34 del IMSS, del Hospital San José TEC de Monterrey y Hospital Christus Muguerza
Heart transplant in "Nuevo Leon" the first 33 cases
Eduardo Herrera Garzaa, Julio Molina Gamboab, Horacio Decanini Arcautec, Marcos Ibarra Floresd, MyrellaTorres Garcíae, Carlos Macías Hidalgof, Roberto González Oviedog, Felipe de Jesús de la Fuente Magallanesh, Luis Ángel Elizondo Sifuentesi, Miguel Ángel Villarreal Arredondoj, Óscar Ortega Durank, Pedro Martínez Bermúdezl, Armando García Castillom, Oralia Becerra Garcían, Diana Martínez Rodríguezn, Carmen Contreras Larae, María del Consuelo Olivares de la Cerdañ, Alfonso Treviño Treviñoo
a Coordinador de Trasplantes, IMSS Monterrey, Responsable de Subcomité de Trasplante Cardíaco, Hospital San José TEC de Monterrey.
b Responsable de Infectología del Programa de Trasplante Cardíaco, IMSS Monterrey.
c Jefe de Anatomía Patológica, IMSS Monterrey.
d Secretario del Subcomité del Programa de Trasplante Cardíaco, Hospital San José TEC de Monterrey.
e Enfermera de Trasplantes, IMSS Monterrey.
f Jefe de Rehabilitación Cardíaca, IMSS Monterrey.
g Jefe de Anestesiología, IMSS Monterrey.
h Jefe de División de Cardiología, IMSS Monterrey.
i Director Médico, IMSS Monterrey.
j Jefe de Terapia Intensiva, IMSS Monterrey.
k Jefe del Servicio de Asistencia Ventricular Hospital Christus Muguerza.
l Profesor del Servicio de Cardiología, IMSS Monterrey
m Jefe de Unidad de Cuidados Coronarios, IMSS Monterrey.
n Trabajadora Social de Trasplantes, IMSS Monterrey.
ñ Anestesióloga de Trasplantes.
o Ex–Director del IMSS Monterrey.
Correspondencia:
Dr. Eduardo Herrera Garza.
Universidad de Coahuila Núm. 718, Col. Villa Universidad,
San Nicolás de los Garza Nuevo León, México. 66420.
Tel. y Fax (0181) 83321967, Cel. (0181) 83622046,
E–mail: eduardoherrera@intercable.net
Recibido: 29 de septiembre de 2004
Aceptado: 17 de enero de 2006
Resumen
La insuficiencia cardíaca se ha constituido como una de las principales causas de muerte en nuestra comunidad. El trasplante cardíaco se ha erigido como la última alternativa eficaz cuando el manejo médico y quirúrgico de la insuficiencia cardíaca han sido agotados, brindando al paciente tasas de sobrevida del 80% a un año. Desafortunadamente, la evolución de un paciente trasplantado de corazón puede acompañarse de complicaciones como rechazo del injerto o infecciones secundarias al uso de inmunosupresores. En el presente artículo reportamos la experiencia adquirida con 33 casos. Nuestro programa ha alcanzado logros importantes como trasplantar con éxito no sólo a pacientes de edad avanzada, sino por primera vez en América Latina a pacientes asistidos de manera ambulatoria con el Sistema Thoratec TLC II. A pesar de las condiciones económicas limitadas que prevalecen en nuestro país y de haber enfrentado las mismas complicaciones que el resto de los programas a nivel mundial, en los enfermos tratados, la sobrevida es del 82% a un año, cifra similar a la reportada en la literatura.
Palabras clave: Trasplante cardíaco. Sirolimus. Basiliximab.
Summary
Heart failure is one of the most important causes of death worldwide. Heart transplant is the last effective alternative when the medical and surgical treatments have failed in patients with end stage heart failure, giving them an 80% one year survival rate. Unfortunately, during the outcome, the heart transplant patients can develop complications such as graft rejection and opportunistic infections because of the use of immunosuppressive therapy. In the present article we report the experience with 33 heart transplant patients. Our program not only has successfully transplanted patients with advanced age but, for the first time in Latin America we have transplanted patients assisted with the ambulatory Thoratec TLC II system. Even with limited resources, we have managed the same complications than other heart transplant programs, our 82% one year survival rate is similar than reports in medical literature.
Key words: Heart transplant. Sirolimus. Basiliximab.
Introducción
La insuficiencia cardíaca se ha convertido en un problema de salud pública en países desarrollados, se calcula que en Estados Unidos 4.8 millones de personas la padecen y anualmente se diagnostican 400,000 a 700,000 nuevos casos, afecta al 2% de la población americana y a un 10% del grupo de edad mayor de 65 años.1 El trasplante cardíaco (TC) con sus diferentes modalidades (ortotópico biauricular, ortotópico bicaval y heterotópico) ha significado una opción terapéutica para mejorar las expectativas y la calidad de vida de pacientes portadores de insuficiencia cardíaca terminal.
Historia
Por primera vez realizado en Sudáfrica en 1967 por Barnard,2 el TC no representó una opción eficaz para pacientes con falla cardíaca avanzada debido a los malos resultados obtenidos a consecuencia de la alta incidencia de pérdida del injerto y del enfermo a causa de rechazo celular; no es sino hasta la década de los ochenta cuando se introduce a la ciclosporina (CsA),3 inmunosupresor que al inhibir a la calcineurina impide la activación de los linfocitos T y por ello suprime la respuesta celular temprana a estímulos antigénicos. La adición de dicho inmunosupresor al esquema terapéutico de pacientes trasplantados significó una mejoría sustancial en su sobrevida mostrándose un cambio efectivo en el pronóstico de la insuficiencia cardíaca en etapas terminales.
El Dr. Alfonso Treviño Treviño, autor intelectual del programa de TC en Monterrey, inició en 1994 la redacción del protocolo y con visión a largo plazo, diseñó la logística necesaria para lograr la autorización por las autoridades competentes del establecimiento de un programa de TC fuera de la ciudad de México. No es sino hasta 1997 cuando se incorpora el concepto de muerte cerebral como equivalente de muerte física del individuo en el código penal del estado de Nuevo León y en noviembre 19 de 1997 el Dr. Humberto Rodríguez González efectúa el primer TC en Monterrey.
Material y métodos
Describimos los resultados obtenidos con los programas de TC tanto en la medicina institucional en la Unidad Médica de Atención Especializada No. 34 del Instituto Mexicano del Seguro Social (IMSS) como en la privada, en el Hospital San José TEC de Monterrey (HSJ) y en el Hospital Christus Muguerza (HCM). Seleccionamos a los pacientes que han recibido un TC desde el inicio de cada programa. Reportamos etiología subyacente que motiva el trasplante, características demográficas de los receptores, evolución posterior al trasplante, complicaciones, etc. Los resultados son expresados en porcentajes y media con desviación estándar.
Resultados
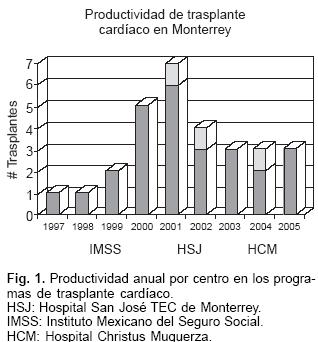
A julio del 2005 se han realizado 33 TC, 30 en el IMSS, 2 en el HSJ y 1 en el HCM. La Figura 1 refleja la productividad anual de TC, es claro que luego de un inicio lento, nuestra actividad de trasplantes ha mostrado un incremento importante.
Se han trasplantado 29 pacientes de sexo masculino y a 4 femeninas. Las etiologías que indican el trasplante se han distribuido de la siguiente forma: 19/33 (59%) con cardiomiopatía dilatada idiopática, 9/33 (27%) cardiopatía isquémica, 4/33 (12%) por enfermedad valvular, dos de ellos con prótesis mitral disfuncional por insuficiencia severa crónica y dos pacientes con insuficiencia aórtica severa crónica, uno de ellos con síndrome de Marfán y prótesis aórtica con insuficiencia severa y disección aórtica DeBakey I, finalmente, un paciente se trasplantó con diagnóstico de cardiomiopatía hipertrófica apical. El rango de edad en el grupo va de 20 a 70 años con media de 45.4 ± 14.3 años.
El 24% (8/33) de los pacientes llegaron al TC en clase funcional II, 9/33 (27%) en III, 13/33 (39%) en IV y 3 (10%) en clase funcional I (gracias a que llegaron a su trasplante recibiendo asistencia ventricular izquierda portátil Thoratec TLC II, por espacio de 12, 178 y 189 días respectivamente).
Ocho pacientes (24%) fueron trasplantados mientras se encontraban hospitalizados recibiendo inotrópicos y diuréticos intravenosos para estabilización de su cuadro de insuficiencia cardíaca, tres de ellos recibieron apoyo circulatorio con el balón de contrapulsación intra–aórtico previo al trasplante, una de ellos, además se mantuvo con una asistencia circulatoria centrífuga tipo Biomedicus mientras esperaba ser trasplantada. Los 25 enfermos restantes fueron llamados a su domicilio para recibir su trasplante.
El tratamiento médico de base para la insuficiencia cardíaca de los 33 enfermos incluyó diuréticos de asa (furosemida), todos (salvo el portador de cardiomiopatía hipertrófica apical) en algún momento de su manejo recibieron digoxina, dosis variables de inotrópicos (dobutamina, amrinona, milrinona y 7 pacientes levosimendán) intravenosos. Sólo 7 de los 33 pacientes no toleraron la administración continua de inhibidores de enzima convertidora de angiotensina (Captopril o enalapril) hasta el trasplante ya que meses previo al mismo desarrollaron falla de bomba e hipotensión arterial sintomática ameritando su suspensión. Treinta y un enfermos recibieron al menos 25 mg diarios de espironolactona.
Veinte de los 33 pacientes (60%) acudieron al menos a 10 sesiones supervisadas de rehabilitación cardíaca en la etapa previa al trasplante. Considerando el grupo sanguíneo, 22/33 (66%) de los receptores con grupo O +, 6/33 (18%) A + y el 16% restante (5 pacientes), B +. Treinta y dos de los receptores fueron trasplantados con un injerto de grupo sanguíneo idéntico al propio, sólo un paciente B + recibió donación de grupo sanguíneo compatible (O +). Treinta y dos enfermos fueron sometidos a TC ortotópico (uno con técnica biauricular y los 31 restantes con técnica bicaval). El primer TC realizado en Monterrey se efectuó utilizando la técnica heterotópica.
La media del grupo donador fue 25.4 ± 9.4 años (rango 16 a 47), las causas de la muerte cerebral de los donadores fue traumatismo craneoencefálico en 78% y 22% por hemorragia intracraneal espontánea.
La media de estancia hospitalaria posterior al trasplante de nuestros trasplantados es 22.7 ± 17.8 (rango de 8 a 75) días y la estancia en Terapia Intensiva es de 10.1 ± 7 días (rango de 3 a 36). Posterior al trasplante, el paciente es admitido a la Unidad Postquirúrgica de Trasplantes, una vez que el paciente ha sido extubado y ha mostrado estabilidad hemodinámica, es trasladado a la Unidad de Postrasplante en piso hospitalario donde inicia su rehabilitación cardíaca postrasplante la cual han recibido los últimos 27 pacientes, iniciando a los 13 ± 9 días, dicho programa tuvo una duración de 10 ± 4 semanas. Las pruebas de ejercicio al inicio de la rehabilitación respecto a la final mostraron variaciones importantes en algunos parámetros de los cuales destacan la respuesta presora que se redujo de 11 ± 8 mm Hg/MET (elevada) a 4.7 ± 1.7 mm Hg/MET (normal); la reducción funcional aeróbica que inicialmente se encontraba en 78 ± 10 bajó a 36 ± 10 (normal = 0) y el VO2 máximo que inicialmente fue 7.7 mL O2/k/min (2.2 ± 1.1 MET), al final de la rehabilitación, alcanzó niveles de 24.5 mL O2/k/min (7 ± 2.3 MET).
Si el paciente muestra datos clínicos de estabilidad y ha entendido esquemas y horarios de medicamentos, se contemplará su alta hospitalaria una vez que se obtenga el resultado de la primera biopsia endomiocárdica sin evidencia de rechazo celular importante.
Importancia de las biopsias endomiocárdicas
Nuestro programa contempla biopsias endomiocárdicas en dos circunstancias: de rutina y ante la sospecha de rechazo (aún y con datos clínicos inespecíficos). Las biopsias de rutina se realizan semanalmente las primeras 6 semanas, quincenalmente las semanas 8, 10 y 12, mensualmente al cumplir el mes 4o, 5o y 6o, posteriormente al año y anualmente en lo sucesivo. Las biopsias no rutinarias se efectúan en cualquier momento de la evolución del paciente si existe la sospecha de rechazo y de confirmarse tal diagnóstico, se inicia tratamiento específico, efectuándose nueva biopsia ajuicio del trasplantólogo (generalmente a dos semanas de iniciado el tratamiento) para evaluar respuesta histológica.
De los 33 trasplantados, 12 (36%) han mostrado cambios histológicos de rechazo celular significativo, catalogado 3 A o 3 B de acuerdo a la ISHLT (por sus siglas en inglés de International Society for Heart and Lung Transplantation), uno de ellos, posteriormente desarrolló un rechazo de características humorales diagnosticado por inmunofluorescencia de muestra en fresco. De estos 12 pacientes, el rechazo celular se acompañó de deterioro hemodinámico manifestado por una disminución de la fracción de eyección del ventrículo izquierdo en cuatro y como disfunción ventricular derecha grave (en valoración ecocardiográfica) en uno más, en los 7 pacientes restantes, la detección del episodio de rechazo se logró gracias al uso rutinario de biopsias endomiocárdicas (ya que todos ellos se encontraban asintomáticos), el manejo individualizado de inmunosupresores se acompañó de reversión del episodio de rechazo en una biopsia de seguimiento.
El grado de rechazo celular encontrado en las biopsias restantes ha variado entre grados 1 A, 1 B y 2, ninguno de ellos considerado como significativo por lo que no se contempló la necesidad de realizar cambios en el manejo inmunosupresor.
Gracias a las biopsias rutinarias, detectamos una infección del injerto por Toxoplasma gondii, el diagnóstico temprano permitió el iniciar manejo adecuado y la curación del proceso.
Esquemas inmunosupresores
En la Tabla I se describen los diversos esquemas de inducción, inmunosupresión y tratamiento de rechazo así como la profilaxis indicada en nuestros pacientes. Nuestro triple esquema convencional involucró a la CsA, azatioprina (AZA) la cual ha sido sustituida por micofenolato mofetilo (MFM) y finalmente prednisona (PDN).
El muronomab CD–3 (OKT–3) a dosis total de 70 mg ha sido utilizado cuatro ocasiones en tres pacientes, en dos como inductor de inmunosupresión por la presencia de insuficiencia renal aguda en el postrasplante inmediato. Un paciente lo recibió en dos ocasiones por la presencia de rechazo celular severo en el postrasplante temprano y a los 9 meses por la presencia de rechazo humoral.
Veintidós de los últimos 23 trasplantados recibieron inducción (rutinaria ya en nuestro programa) con basiliximab debido a que la mayoría han llegado al TC con deterioro importante de su función renal.
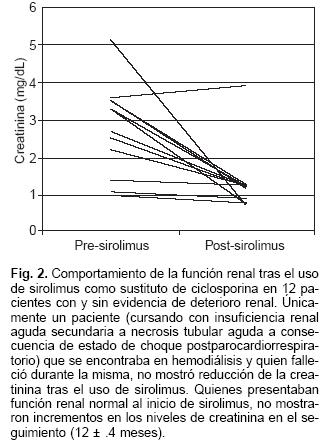
Hemos manejado los episodios de rechazo celular con un pulso de metilprednisolona (MPDN) consistente en dosis diaria única de 1 gramo intravenoso por 3 días consecutivos. El advenimiento del sirolimus a la práctica clínica en trasplante de órganos sólidos ha resultado de valor incalculable para nuestro programa, a la fecha, hemos convertido a 9 pacientes de CsA a sirolimus por evidencia de toxicidad directamente atribuible a CsA, en 7 pacientes por nefrotoxicidad con normalización ulterior de la creatinina (Fig. 2) y en dos por neurotoxicidad e hiperplasia gingival. Cinco pacientes con evidencia de rechazo celular 3 A ó 3 B (dos de ellos con evidencia de deterioro hemodinámico) fueron manejados exitosamente sustituyendo a la CsA por sirolimus hasta revertir el episodio de rechazo. Trece pacientes más lo han recibido de primera intención desde el inicio de su trasplante como manejo estándar para lograr una inmunosupresión libre de inhibidores de calcineurina. Hasta el momento, quienes han sido convertidos a sirolimus se encuentran libres del uso de CsA.
Tres pacientes han recibido tacrolimus de primera intención.
Profilaxis
Todos los trasplantados han recibido profilaxis contra Pneumocystis carinii a base de trimetoprim–sulfametoxazol. Nuestros primeros dos pacientes recibieron aciclovir como antiviral, desde la introducción del ganciclovir en nuestro país, lo hemos indicado a los últimos 31 trasplantados para evitar infección por Citomegalovirus, para reducir el riesgo de infección por Aspergillus el antimicótico utilizado es el itraconazol el cual ha sido recibido por todos.
Sobrevida e impacto socioeconómico
En la Tabla II se proporciona la curva de sobrevida actual. Seguimos ambulatoriamente a 23 trasplantados (69.7% del total). La media de sobrevida es 27.44 ± 23.72 meses (rango de 0.5 a 85.23). Diez pacientes (30.3%) han fallecido, tres de ellos por infección (uno con enfermedad por Citomegalovirus, el segundo con sepsis secundaria a Mucory Aspergillusy el tercero por sepsis por Klebsiella pneumoniaé). Como previamente se manifestó, dos pacientes fallecieron por rechazo celular y otro por rechazo humoral, este último no respondió a manejo con incremento de inmunosupresión, inmunoglobulinas humanas y a sesiones de plasmaféresis, un paciente fallece por edema cerebral secundario a insuficiencia renal aguda a consecuencia de estado de choque posterior a paro cardiorrespiratorio secundario a rechazo celular temprano, otro fallece súbitamente en su domicilio cursando su mes 38 postrasplante, la autopsia evidenció enfermedad coronaria severa del injerto, un paciente fallece a consecuencia de proceso abdominal agudo y el décimo a consecuencia de síndrome de insuficiencia respiratoria progresiva del adulto. Un parámetro importante para nuestro programa es que el trasplantado vuelva a ser potencialmente activo e independiente, a excepción de 5 pacientes que nunca pudieron reincorporarse a la actividad productiva, los 28 (85%) restantes han recuperado la capacidad física para trabajar tiempo completo o ser autosuficientes, de ellos, 24 se reincorporaron en algún momento de su evolución a actividades laborales.

Complicaciones
Prácticamente todos los trasplantados han tenido complicaciones que van desde irrelevantes a graves. Por complicaciones postquirúrgicas incluiremos al portador de un trasplante heterotópico, la colocación del corazón del donador en el hemitórax derecho se acompañó de parálisis hemidiafragmática ipsilateral, intubación prolongada y traqueostomía, 5 pacientes desarrollaron sangrado profuso durante el evento quirúrgico con la consecuente politransfusión y estado de choque transoperatorio, ello condicionó que de manera indirecta apareciera insuficiencia renal aguda y obligara al uso de OKT–3 en dos de ellos.
Se han diagnosticado 5 infecciones postoperatorias: dos mediastinitis, dos osteomielitis esternales y una pericarditis piógena, el diagnóstico temprano, el tratamiento oportuno y específico ha evitado decesos directamente relacionados a estas complicaciones tempranas, más complicaciones postoperatorias incluyen la reintervención por sangrado en lecho quirúrgico superior a lo esperado en cuatro pacientes.
En el manejo de pacientes con TC es particularmente difícil encontrar el equilibrio entre el grado de inmunosupresión y la permanencia libre de infecciones oportunistas, posterior al uso de OKT–3, hemos detectado una toxoplasmosis del injerto cardíaco. Un paciente desarrolló cuadro de abdomen agudo secundario a úlcera gástrica perforada y muerte, en la autopsia se encontraron como patógenos a Mucory Aspergillus. Finalmente, el tercero en recibir OKT–3 se complicó con neumonía por Pneumocystis carinii. Se han detectado otros episodios de infecciones que han puesto en riesgo la vida del paciente tras el incremento de inmunosupresión para manejo de episodios de rechazo, tal es el caso de una neumonía por Críptococcus neoformans que se presentó posterior al incremento en las dosis de sirolimus, el tratamiento adecuado curó dicho proceso.
Once pacientes (todos ellos con cardiomegalia IV previo al TC) desarrollaron en la etapa temprana posterior al trasplante derrame pericárdico masivo, siete de ellos con evidencia de colapso diastólico del ventrículo derecho por lo que ameritaron pericardiocentesis evacuadora. Dos trasplantados han ameritado sesiones de hemodiálisis en el postrasplante temprano por anuria.
Discusión
La insuficiencia cardíaca se ha colocado como una de las causas líderes de mortalidad en adultos a nivel mundial. En la actualidad, es difícil conceptualizar un programa de TC sin una clínica de insuficiencia cardíaca que lo sustente, el nuestro no es la excepción, desde la instauración de la clínica, ha sido factible manejar y vigilar estrechamente a estos enfermos con el logro de disminuir el número de hospitalizaciones, incapacidades laborales y principalmente seleccionar a aquellos que realmente son portadores de un estadio terminal de su falla cardíaca. Sin duda, un logro de la clínica de insuficiencia cardíaca en nuestro programa ha sido que sólo cuatro enfermos hubiesen llegado al TC sin ser controlados en ella, del resto, todos fueron atendidos al menos un par de ocasiones, y de hecho, algunos fueron atendidos por períodos superiores a los 50 meses de manera ambulatoria, ello permitió alcanzar algunos objetivos como optimizar el tratamiento médico, encontrando lo que el autor llama "dosis máxima tolerada" (que no necesariamente es la dosis máxima recomendada) para cada paciente con respecto a inhibidores de enzima convertidora de angiotensina y bloqueadores de los receptores (β adrenérgicos, fomentar un proceso de aprendizaje acerca del trasplante e iniciar períodos de rehabilitación cardíaca previos al trasplante. El logro de estos objetivos, sin duda ha mejorado los resultados de nuestro programa pues la tercera parte de los pacientes acudieron a su trasplante en clases funcionales I o II. Sin duda, estas condiciones beneficiaron la recuperación pronta de los pacientes después del trasplante, logrando un inicio de rehabilitación cardíaca en el postrasplante temprano lo cual favoreció un incremento de la capacidad aeróbica incluso en períodos tan cortos como a 2.5 meses, este aumento en la capacidad aeróbica es similar a lo reportado por Osada quien demuestra en un período de 11.2 meses una modificación preoperatoria de 14.2 mL O2/k/min a 21.4 mL O2/k/min en 77 pacientes postrasplantados de corazón, respecto a la modificación de la reducción funcional aeróbica final que en el grupo de Osada fue de 30%, en el nuestro fue de 36%.4
Las etiologías subyacentes en nuestro grupo muestra que 86% de ellos contaban con cardiomiopatía dilatada idiopática o cardiopatía isquémica, 12% valvulares y 1 enfermo con una indicación <<miscelánea>> o poco frecuente como la cardiomiopatía hipertrófica apical, estas cifras son muy semejantes a lo reportado por otros programas del mundo.5
Un logro de nuestro programa es el haber realizado un trasplante a un paciente con síndrome de Marfán ya que la asociación de esta entidad y TC no es frecuente, Kesler reporta que para 1994 sólo se habían realizado 11 TC a enfermos con dicho síndrome en Norte América.6 En estos momentos nuestro paciente cursa su mes 71 posterior al trasplante, trabaja tiempo completo y se encuentra libre de complicaciones.
Al aumentar las expectativas de vida de la población, la demanda por trasplantes en enfermos de edad avanzada se ha convertido en una situación cotidiana. Se ha descrito como ventaja en este grupo de pacientes el estado de inmunosupresión <<natural>> a la que la edad los orilla, de hecho, en TC se sugiere que los esquemas de inmunosupresores se manejen a dosis inferiores a las habituales para disminuir complicaciones infecciosas y neoplásicas. Las expectativas de vida en receptores mayores de 70 años son similares a las de los jóvenes.7
Nuestro grupo, como la mayoría de los centros es cada vez más liberal al considerar indicaciones o contraindicaciones (las últimas, prácticamente restringidas a enfermos con HIV +, con neoplasias activas o con menos de 5 años de haber alcanzado remisión, enfermedad vascular cerebral o periférica severa, toxicomanías o pobre adherencia al tratamiento médico establecido) para incluir a un candidato a TC, los mayores de 55 años no son la excepción, 10 de los 33 pacientes, al momento del trasplante eran mayores de 57 años (64.5 ± 4 años). Un punto a considerar es que evidentemente, este grupo de pacientes es evaluado de manera muy acuciosa en búsqueda de neoplasias o enfermedades concomitantes que puedan disminuir las expectativas o la calidad de vida después del trasplante, obviamente en estos pacientes no encontramos contraindicación alguna para incluirlos en nuestro programa.
Las técnicas quirúrgicas para efectuar un TC han variado poco en los últimos años. Básicamente existen dos tipos de TC, el ortotópico en el que el corazón del enfermo es extraído y el corazón del donador es colocado en la posición anatómica correcta para un corazón humano. Un paciente de nuestro grupo fue sometido a un TC ortotópico con la técnica conocida como biauricular, ya que un remanente de cada aurícula del receptor es conservada y anastomosada a la del donador. La técnica bicaval es conocida de esa manera ya que las anastomosis se realizan entre las venas cavas superior e inferior. Dicha técnica ofrece las ventajas teóricas de no interferir con la propagación del impulso sinusal por la aurícula por lo que al alcanzar un ritmo sinusal se logran parámetros hemodinámicos más cercanos a la normalidad que con la técnica original, otras ventajas incluyen la disminución en la incidencia de insuficiencia tricuspídea y arritmias auriculares postoperatorias, en nuestro programa, 30 pacientes se sometieron al TC con esta técnica.
Al TC heterotópico se le conoce así porque el injerto se coloca en el lado derecho del tórax y se anastomosa al corazón nativo del enfermo, el cual permanece en su posición natural, este tipo de trasplante funciona como un sistema de asistencia ventricular <<biológica>> ya que el ventrículo izquierdo del donador asume la mayor parte de la carga hemodinámica ipsilateral y el ventrículo derecho del receptor continúa llevando la carga de la circulación pulmonar. El trasplante heterotópico tiene indicaciones muy precisas, una de ellas es la desproporción en la superficie corporal entre el donador y receptor mayor del 20%, situación en la que se espera que el injerto será insuficiente para mantener hemodinámicamente al enfermo si se procede con un trasplante ortotópico, ésta fue la razón por la que el programa inició con un TC heterotópico, en la actualidad la indicación de TC heterotópico es cada vez más inusual.8
Los sistemas de asistencia ventricular han sido ampliamente utilizados en programas de TC, el puente a trasplante y a recuperación ventricular son las indicaciones primordiales para su instalación. Con los resultados del estudio REMATCH,9 se ha demostrado la superioridad de la asistencia ventricular sobre la terapia médica convencional en pacientes con insuficiencia cardíaca terminal. Hemos asistido a tres pacientes hasta el trasplante con el sistema Thoratec el cual consiste en un soporte neumático con capacidad de proporcionar hasta 7 litros/minuto de gasto de la bomba y con la facilidad de brindar asistencia uni o biventricular. Una ventaja adicional representa la posibilidad de utilizar el sistema TLC II, este dispositivo portátil, con un peso de 8 kg posee las mismas atribuciones funcionales de la consola dual.10 Gracias a la consola TLC II manejamos a los tres pacientes extrahospitalariamente por espacio de 2, 45 y 55 días respectivamente, en su momento, fueron los primeros en América Latina y dentro de los primeros en el mundo en ser exitosamente asistidos ambulatoriamente con el sistema TLC II hasta alcanzar el TC, a la fecha, los tres alcanzan sobrevidas postrasplante de 54, 48 y 27 meses respectivamente.
El principal objetivo de indicar un TC es incrementar las expectativas de vida de los candidatos con insuficiencia cardíaca terminal, se ha reportado una sobrevida a un año de alrededor de 80%, 65 a 70% a cinco años y aproximadamente 50% a diez años,11 como se aprecia en la Figura 3, la curva de sobrevida en los 33 pacientes es similar a lo reportado a nivel internacional al alcanzar un 82% a los primeros dos años.
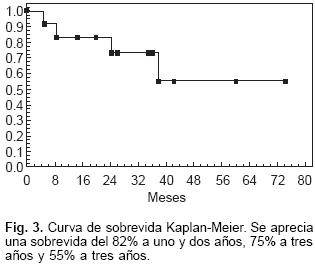
Las causas más frecuentes de muerte en el primer año posterior a un TC son muy claras: rechazo e infección, posterior al año, la vasculopatía coronaria del injerto se convierte en causa común de pérdida del injerto y/o mortalidad. A la fecha de redación, 10 pacientes han fallecido, 7 en los primeros 12 meses del TC y la distribución ha sido 40% por infección, 30% por rechazo y el resto por el desarrollo de complicaciones directas de insuficiencia renal aguda y al síndrome de insuficiencia respiratoria progresiva del adulto. Al contar con sobrevivientes a largo plazo, han aparecido complicaciones propias del tiempo de evolución, un paciente falleció luego de 3 años de trasplantado, la necropsia demostró severa enfermedad coronaria del injerto (conocida también como rechazo crónico, vasculopatía del injerto cardiaco, arteriopatía del injerto, aterosclerosis acelerada del injerto, etc.). Se han reportado como lesiones ateromatosas amarillentas difusas en todo el trayecto de las tres coronarias epicárdicas e incluso en ramas intramusculares.12 La afectación difusa y el engrosamiento progresivo de la íntima arterial (generalmente con respeto de la media) de las coronarias y sus ramas han sido las características fundamentales de este tipo de complicación. De etiología multifactorial pues se han involucrado factores inmunológicos, citocinas (interleucina–1 y 6, factor de necrosis tumoral alfa), factores infecciosos (Citomegalovirus, Chlamydia pneumoniaé), asociación con rechazo celular y humoral, factores de riesgo coronario para no trasplantados como diabetes mellitus, hiperlipidemia, hipertensión, etc. Las diferencias fundamentales entre la enfermedad coronaria del injerto y la enfermedad arterial coronaria en vasos nativos se presentan en la Tabla III.
Para prevenir la infección, se antojaría el uso de medidas de aislamiento muy estrictas, nosotros no indicamos aislamientos especiales, pero sí aplicamos particular atención al lavado estricto de manos y al manejo estéril de líneas vasculares, cuidados y curaciones de heridas quirúrgicas, así como en procedimientos invasivos, ya que estas simples acciones han permitido disminuir el número de días hospital y costos al reducir el número de infecciones y el consumo de ropa estéril.13
Nuestro esquema de tratamiento profiláctico incluye el uso de trimetoprim–sulfametoxazol para antagonizar al Pneumocystis carinii.14 El 20% de los sometidos a TC presentan infecciones micóticas de las cuales Aspergillus ocasiona el 64%, por ello utilizamos itraconazol como profilaxis antimicótico.15
Nuestro primer trasplantado falleció 4 meses después de su TC a consecuencia de enfermedad por citomegalovirus, la profilaxis antiviral que recibió fue a base de aciclovir que tiene poca o nula actividad contra dicho patógeno, en la era postganciclovir no hemos identificado episodios de infección o enfermedad por citomegalovirus, esto correlaciona con lo reportado en la literatura en donde en la era preganciclovir la mortalidad por enfermedad por citomegalovirus alcanzaba 25 a 70%, una vez que el ganciclovir estuvo disponible, la mortalidad disminuyó a 7%.16
La otra causa frecuente de muerte en cualquier programa de TC es la aparición de rechazo, identificamos dos tipos de rechazo, celular y humoral, dependiendo de la respuesta inmune que se monte para desencadenarlo, el más común es el celular ya que se reporta que en los primeros seis meses de sobrevida después del trasplante 62% de los pacientes habrán desarrollado al menos un episodio de rechazo celular significativo, menos frecuente pero asociado con mayor incidencia de mortalidad o pérdida del injerto es el humoral. Por tal razón la mayor parte de los programas de TC en el mundo realizan biopsias endomiocárdicas del ventrículo derecho rutinariamente en etapas tempranas y aún tardías del post TC y ante la sospecha de rechazo para su detección.17 Nuestras biopsias son interpretadas y reportadas de acuerdo al ISHLT18 y a la fecha doce pacientes han mostrado cambios de rechazo celular significativo. Precisamente, uno de ellos que respondió a tratamiento inmunosupresor, falleció meses después de rechazo humoral, se estableció el diagnóstico por inmunofluorescencia en la biopsia, este paciente no respondió a manejo con plasmaféresis y administración de inmunoglobulinas intravenosas que constituyen el tratamiento indicado.19
Una utilidad adicional de las biopsias endomiocárdicas de rutina es el diagnóstico temprano de infecciones localizadas al injerto cardíaco como ocurrió en un paciente con síndrome de Marfán el cual a pesar de estar asintomático, le fue detectado una toxoplasmosis cardíaca.20
La inmunosupresión es la piedra angular que sostiene los resultados del TC, su uso racional y equilibrado es indispensable. Particular dificultad se presenta para alcanzar el justo medio con el cual se evita el rechazo sin la consecuente aparición de infecciones oportunistas.
Nuestro esquema inmunosupresor básico en el inicio del programa incluía el triple esquema de CsA, AZA y PDN. Posteriormente sustituimos a la AZA con MFM que igualmente ejerce su acción inmunosupresora gracias a su efecto inhibidor sobre la síntesis de las purinas.21
El OKT–3 es un anticuerpo monoclonal que facilita la eliminación de linfocitos T que expresan el complejo CD–3, impidiendo de dicha manera el reconocimiento por parte de estas células de antígenos que serían el estímulo para la producción de interleucina 2, fundamental en el proceso de rechazo. El OKT–3 ha sido ampliamente utilizado como inductor de inmunosupresión en trasplante de órganos sólidos o como tratamiento efectivo de rechazo celular resistente a esferoides.22 Por todos es conocida su capacidad inmunosupresora que sin embargo incrementa el riesgo de infecciones oportunistas. Tres de nuestros pacientes recibieron este anticuerpo monoclonal, en todos los casos el OKT–3 resolvió el problema por el cual fue indicado, desafortunadamente todos presentaron complicaciones infecciosas, siendo la única fatal la encontrada en un paciente con una úlcera gástrica perforada por Aspergillusy Mucor. La relación de úlceras gástricas perforadas y Mucor está bien descrita en trasplante de órganos sólidos.23
El basiliximab, es un anticuerpo monoclonal contra el receptor de la interleucina 2 que en nuestro programa se ha indicado como inductor de inmunosupresión para la prevención de rechazo, se utilizaron dos dosis de 20 mg intravenosos el día del trasplante y cuatro días posterior al mismo respectivamente, este medicamento ha demostrado su capacidad como inductor de inmunosupresión con la ventaja de no inducir los fenómenos de liberación masiva de citocinas como las observadas con el uso del OKT–3.24 La administración de esferoides por vía oral o intravenosa a dosis altas se ha convertido en una medida terapéutica rutinaria para el tratamiento de rechazo celular y del de origen humoral, se han propuesto diversos esquemas de dosificación para MPDN y PDN. En quienes presentaron un episodio de rechazo, adoptamos la conducta de administrar 1 gramo de MPDN intravenosa diaria por 3 días consecutivos, con retorno a la dosis de PDN previo a la aparición del episodio de rechazo.25
La introducción del sirolimus a la práctica clínica ha resultado en un impacto benéfico en el cuidado de pacientes con trasplante de órganos sólidos. Este antibiótico macrocíclico cuenta con actividad antifúngica, antitumoral, antiproliferativa e inmunosupresora. Ejerce su mecanismo de acción evitando la transducción de las señales ocasionadas por interleucinas 2, 4, 7, 12 y 15. Estos bloqueos a la respuesta esperada tras la liberación de dichas citocinas previene la proliferación de células T activadas y bloquea la progresión del ciclo celular en la fase Gj.26 Además de sus efectos sobre la actividad de células T, sirolimus inhibe la producción de inmunoglobulinas G, M y A con lo que ejerce potentes efectos inmunorregulatorios. En trasplante renal, ha demostrado ser tan eficaz como CsA para prevenir rechazo y prolongar sobrevida del injerto sin ejercer un efecto nefrotóxico y alcanzando una mejor tasa de filtración glomerular a los 12 meses de su utilización.27,28 Con el conocimiento del uso exitoso en algunos casos de TC pediátricos,29 iniciamos su utilización en casos de deterioro en la función renal, ante episodios de rechazo celular severo con o sin deterioro renal y en los últimos pacientes como inmunosupresor de primera intención. Su eficacia ha sido demostrada en los pacientes en los que hemos utilizado, pues ha revertido los episodios de rechazo así como ha facilitado el retorno a los rangos normales de la función renal del paciente. Gracias a su capacidad para revertir episodios de rechazo severos sin la necesidad de utilizar inmunosupresores potentes como el OKT–3, sirolimus ha permitido reducir gastos de operación por concepto de hospitalizaciones, intervenciones y medicamentos que ya observamos en quienes recibieron el OKT–3.
En nuestro programa, es una prioridad que el paciente vuelva a ser productivo, por rutina esperamos al menos 8 semanas de evaluación antes de planear que un trasplantado retorne a laborar. Setenta y dos por ciento de nuestros pacientes se han reincorporado a sus actividades laborales. Las cifras de reintegración laboral son similares al 69% a 1 y 5 años de retorno a labores en pacientes sometidos a TC reportado por Kavanaugh.30 Únicamente cinco pacientes no recuperaron con el trasplante la fortaleza para ser autosuficientes, ello nos habla del potencial del TC para mejorar no sólo las expectativas de vida sino también la calidad de vida.
Conclusiones
El trasplante cardíaco es una opción excelente para incrementar las expectativas de vida de pacientes con insuficiencia cardíaca terminal con altas posibilidades de muerte a corto plazo, sin embargo, complicaciones como rechazo o infección son las determinantes comúnmente asociadas a la reducción en las tasas de éxito del trasplante, es por ello que el paciente trasplantado de órganos sólidos debe someterse a tratamiento inmunosupresor y al manejo de antibióticos profilácticos.
Nuestros resultados se sustentan en el funcionamiento armónico de la clínica de insuficiencia cardíaca y de los programas de rehabilitación cardíaca y asistencia ventricular. La conjunción de dichos programas ha permitido que los pacientes sean trasplantados en mejores condiciones físicas y clínicas lo cual sin duda redunda en mejores resultados postrasplante.
Logros como trasplantar con éxito a mayores de 65 años, trasplantar un paciente con síndrome de Marfán y el trasplantar con éxito por vez primera en América Latina a tres pacientes sostenidos con asistencia ventricular portátil Thoratec TLC II nos anima a continuar con nuestro programa de trasplante cardíaco. A pesar cualquier logro alcanzado, estamos conscientes de que hay mucho camino que recorrer para lograr beneficiar a más pacientes portadores de insuficiencia cardíaca terminal.
Referencias
1. Roger VI, Weston SA, Redfield MM: Trends in heart failure incidence and survival in a community–based population. JAMA 2004; 292: 344–50. [ Links ]
2. Barnard CN: The operation. A human cardiac transplant: an interim report of a successful operation performed at Groóte Schuur Hospital. Cape Town. S Afr Med J 1967;41: 1271–1274. [ Links ]
3. Aziz S, Bieber CP, Reitz BA, Bieber MM, Oyer PE, Hoit G, et al: Preparation and efficacy of Cyclosporin–A liposomes for prolongation ofcardiac allograft survival. Transplant Proc 1981; 13(1 Pt 1): 410–411. [ Links ]
4. Osada N, Chaitman BR, Donohue TJ, Wolford TL, Stelken AM, Miller LW: Long term cardiopulmonary exercise performance afierheart transplantation. Am J Cardiol 1997; 79: 451–456. [ Links ]
5. Taylor DO, Edwards LB, Mohacsi PJ, Boucek MM, Trulock EP, Keck BM, et al: The registry of the International Society for Heart and Lung Transplantation: twentieth official adult heart transplant report–2003. J Heart Lung Transplant 2003; 22: 616–624. [ Links ]
6. Kesler KA, Hanosh JJ, O'Donnell J, Faust S, Turrentine MW, Mahomed Y, et al: Heart transplantation in patients with Marian s syndrome: a survey of attitudes and results. J Heart Lung Transplant 1994; 13(5): 899–904. [ Links ]
7. Blanche C, Blanche DA, Kearney B, Sandhu M, Czer LS, Kamlot A, et al: Heart transplantation in patients seventy years of age and older: A comparative analysis of outcome. J Thorac Cardiovasc Surg 2001; 121(3): 434–435. [ Links ]
8. Herrera GE, Noon GP, Durand JB, Stetson SJ, Zylics S, Johnson L, et al: Trasplante cardíaco heterotópico: Experiencia de trece años en el Hospital Metodista del Colegio de Medicina de Baylor. Arch lnst Cardiol Mex 1999; 69: 526–533. [ Links ]
9. Rose EA, Gelijns AC, Moskowitz AJ, Heitjan DF, Stevenson LW, Dembitsky W, et al: Long term use of a left ventricular assist device for end stage heart failure. N Engl J Med 2001; 345:1435–1443. [ Links ]
10. Farrar DJ, Buck KE, Coulter JH, Kupa EJ: Portable pneumatic biventricular driver for the Thoratec ventricular assist device. ASAIO Journal 1997; 43: M631–M634. [ Links ]
11. Lindenfeld JA, Miller GG, Shakar SF, Zolty R, Lowes BD, Wolfel EE, et al: Drug therapy in the heart transplant recipient: Part I: Cardiac rejection and immunosuppressive drugs. Circulation 2004; 110(24): 3734–3740. [ Links ]
12. Michaels PJ, Espejo ML, Kobashigawa J, Alejos JC, Burch C, Takemoto S, et al: Humoral rejection in cardiac transplantation: risk factors, hemodynainic consequences and relationship to transplant coronary artery disease. J Heart Lung Transplant 2003; 22: 58–69. [ Links ]
13. Slota M, Green M, Farley A, Janosky J, Carcillo J: The role of gown and glove isolation in the reduction of nosocomial infection in children with solid organ transplantation. Critical Care Medicine 2001; 29(2): 405–412. [ Links ]
14. Lenner R, Padilla M, Teirstein A, Gass A, Schilero G: Pulmonary complications in cardiac transplant recipients. Chest 2001; 120(2): 508–513. [ Links ]
15. Grossi P, Farina C, Fiocchi R, Dalla Gasperina D: Prevalence and outcome of invasive fungal infections in 1963 thoracic organ transplant recipients: a multicenter retrospective study. Italian Study Group of Fungal Infections in Thoracic Organ Transplant Recipients. Transplantation 2000; 70(1): 112–116. [ Links ]
16. Antretter H, Hofer D, Klaus A, Larcher C, Margreiter J, Margreiter R: Cytomegalovirus infection afier heart transplantation. Retrospective analysis of an antiviral CMV prevention. Dtsch Med Wochenschr 2000; 125(15): 445–451. [ Links ]
17. Grader WQ, D'Amico C, Smith AL, Vega D, Book WM: Routine surveillance endomyocardial biopsy continues to detect significant rejection late after heart transplantation. J Heart Lung Transplant 2001; 20(5): 497–502. [ Links ]
18. Balk AH, Zondervan PE, van der Meer P, van Gelder T, Mochtar B, Simoons ML, et al: Effect of adopting a new histological grading system of acute rejection after heart transplantation. Heart 1997; 78(6): 603–607. [ Links ]
19. Michaels PJ, Espejo ML, Kobashigawa J, Alejos JC, Burch C, Takemoto S, et al: Humoral rejection in cardiac transplantation: risk factors, hemodynamic consequences and relationship to transplant coronary artery disease. J Heart lung Transplant 2003; 22: 58–69. [ Links ]
20. Wagner FM, Reichenspurner H, Uberfuhr P, Weiss M, Fingerle V, Reichart B: Toxoplasmosis after heart transplantation: diagnosis by endomyocardial biopsy. J Heart Lung Transplant 1994; 13(5): 916–918. [ Links ]
21. Keogh A: long–term Benefits of Mycophenolate Mofetil after Heart Transplantation. Transplantation 2005; 79(3): S45–S46. [ Links ]
22. Midtvedt K, Fauchald P, Lien B, Hartmann A, Albrechtsen D, Bjerkely BL, et al: Individualized T cell monitored administration of ATG versus OKT3 in steroid–resistant kidney graft rejection. Clin Transplant 2003; 17: 69–74. [ Links ]
23. Knoop C, Antoine M, Vachiery JL, Depre G, Alonso–Vega C, Struelens M, et al: Gastric perforation due to mucormycosis after heart–lung and heart transplantation.Transplantation 1998; 66(7): 932–935. [ Links ]
24. Halloran PF: Immunosuppressive drugs for kidney transplantation. N Engl J Med 2004; 351: 2715–2729. [ Links ]
25. Castro P, Arriagada G, Moreno M, Moran S, Becker P, Zalaquett R, et al: Humoral rejection in heart transplantation. Report of 2 cases. Rev Med Chil 2000; 128(11): 1245–1249. [ Links ]
26. Meiser Bruno, Reichart Bruno, Adamidis Ioannis, Uberfuhr Peter, Kaczmarek Ingo: First experience with de novo Calcineurin–Inhibitor–Free Immunosuppression Following Cardiac Transplantation. American Journal of Transplantation 2005; 5(4): 827–831. [ Links ]
27. Keogh A, Richardson M, Meroula B, Ruygrok P, Spratt P, Galbraith, et al: Sirolimusin denovo heart transplant recipients reduces acute rejection and prevents coronary artery disease at 2 years: A randomized clinical trial. Circulation 2004; 110(17): 2694–2700. [ Links ]
28. Souza GS, Garcia–Gallont R, Mairen JA, Villaca SS, Gontijo RC, Viotti EA, et al: Sirolimus and Micophenolate Mofetil: A reliable drug combination to prevent acute rejection and to protect graft function after renal transplantation. A retrospective analysis of 1 year's follow up in adult kidney recipients. Transplantation 2004; 78(2): 269–270. [ Links ]
29. Straatman LP, Coles JG: Pediatric utilization of rapamycin for severe cardiac allograft rejection. Transplantation 2000; 70(3): 541–3. [ Links ]
30. Kavanaugh T, Yacoub MH, Kenedy J, Austin PC: Return to work after heart transplantation: 12 year follow up. J Heart Lung Transplant 1999; 18(9): 846–851. [ Links ]














