Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.76 no.1 Ciudad de México ene./mar. 2006
Comunicaciones breves
Pericarditis purulenta: presentación de un caso y diagnósticos diferenciales
Purulent pericarditis. Case report
Antonio Vargas Cruz,* Enrique Gómez Álvarez,** Andrés Jaime Uribe,*** María Edith Salgado Alday****
*Médico adscrito al Servicio de Hemodinamia CMN "20 de Noviembre" ISSSTE.
**Jefe del Servicio de Cardiología CMN "20 de Noviembre" ISSSTE.
***Médico adscrito al Servicio de Cirugía Cardíaca CMN "20 de Noviembre" ISSSTE.
****Médico adscrito al Servicio de Anatomía Patológica CMN "20 Noviembre" ISSSTE.
Correspondencia:
Dr. Antonio Vargas Cruz
Médico adscrito al Servicio de Hemodinamia CMN "20 de Noviembre" ISSSTE
Félix Cuevas Núm. 540 Colonia del Valle México DF 03100
E–mail: avargascruz@hotmail.com
Resumen
La pericarditis purulenta es una enfermedad poco frecuente que afecta al pericardio y tiene una alta mortalidad. El diagnóstico se sospecha ante un paciente febril, con datos de falla cardíaca derecha y un foco infeccioso primario. Sin embargo, no todos los casos se presentan de esta forma y el diagnóstico junto con el tratamiento se dificulta volviéndose un verdadero reto. En el presente trabajo se expone un caso con este diagnóstico, así como otras posibilidades etiológicas.
Palabras clave: Pericarditis purulenta. Pericardio. Patología.
Summary
Purulent pericarditis is an infrequent disease which affects the pericardium and has a high mortality rate. The diagnosis is suspected in a febrile patient with right cardiac failure and a primary infectious source. However, not all patients present in this form therefore the diagnosis and treatment can be difficult and a real challenge. This report is of a patient with this disease and other etiologic possibilities are discussed.
Key words: Purulent pericarditis. Pericardium. Pathology.
Presentación del caso
Hombre de 69 años de edad, originario del estado de Guerrero. Ocupación campesino, con alcoholismo suspendido. Sin otros antecedentes de importancia para el padecimiento actual. Negó enfermedades cardiovasculares previas. Ingresa a nuestro hospital con cuadro clínico de tres meses y medio de evolución caracterizado por tos productiva con secreción amarillenta que se había presentado de manera intermitente, disnea progresiva y edema de miembros pélvicos, así como pérdida de 7 kilogramos de peso. A la exploración física se encuentra afebril, presión arterial de 110/70 mm Hg, frecuencia cardiaca 78 lpm, frecuencia respiratoria 18 rpm, temperatura 36.5 grados centígrados. Consciente, bien orientado, caquéctico, tolerando el decúbito dorsal, ingurgitación yugular grado I, sin adenomegalias cervicales. Los ruidos cardíacos son rítmicos con intensidad normal y sin fenómenos agregados, no se ausculta frote pericárdico. Pulmones con estertores crepitantes básales derechos. Abdomen plano, blando y depresible, no se encuentran visceromegalias ni puntos álgidos, peristaltismo normal. Miembros pélvicos con edema hasta tercio proximal de ambas piernas, blando y no doloroso. Pulsos periféricos normales.
Al interrogatorio dirigido los familiares del paciente refieren una infección dérmica en antebrazo derecho, secundaria a canalización venosa, la cual causó edema doloroso del mismo, fiebre, ataque al estado general y poco después se agregó la tos. Desde entonces el paciente se ha manejado con diferentes esquemas de antibióticos y antipiréticos en su lugar de origen de manera intermitente.
Los laboratorios de ingreso reportan: Hemoglobina 13 mg/dL, hematócrito 39.6%, plaquetas 202,000, leucocitos totales 10,000 con 86% de neutrófilos sin bandas, glucosa 107 mg/dL, BUN 20 mg/dL, creatinina 1.1 mg/dL, Na 139 mmol/ L, K 2.95 mmol/L, Cl 109 mmol/L, ALT 24 UI/L, AST 34 UI/L, LD 256 UI/L (máximo normal 180 UI/L), CK 44 UI/L, bilirrubina directa 0.7 e indirecta 1.3 mg/dL.
La radiografía de tórax demostraba cardiomegalia ICT 0.56. En la base del pulmón derecho se encontraba una zona de consolidación con broncograma aéreo. Sin datos de hipertensión venocapilar.
El electrocardiograma en ritmo sinusal con 80 lpm. Ángulo de QRS 30 grados. PR 240 ms. QTc 540 ms. QRS 100 ms. Zona eléctricamente inactiva inferior e isquemia subepicárdica de Vl a V5 (Fig. 1). El paciente mostró imágenes de un ecocardiograma, realizado en su lugar de origen, en el que se observaba un derrame pericárdico localizado frente al ventrículo derecho que comprime esta cavidad.

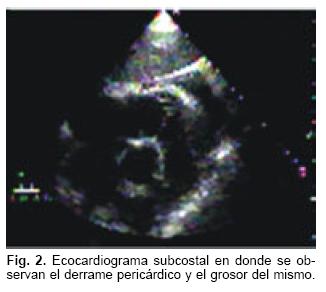
En este hospital se realiza un nuevo ecocardiograma de control (Fig. 2) que reportó derrame pericárdico casi resuelto con dilatación generalizada del ventrículo izquierdo y fracción de expulsión de 25%. Llamaba la atención que el derrame no era concéntrico, sino más bien loculado y localizado principalmente sobre el ventrículo derecho.
Se realizó una tomografía axial computada, que reportó colección mediastinal compatible con probable absceso, así como probables adenomegalias vs absceso sobre la carina (Fig. 3).

Con los anteriores hallazgos se consideró como primera posibilidad un derrame pericárdico de origen neoplásico con primario muy probablemente en pulmón. La segunda posibilidad a considerar era una tuberculosis pulmonar con extensión a pericardio. Se solicitaron interconsultas a los servicios de oncología y neumología. El primero no encuentra más que comentar a la exploración física y diagnóstica síndrome de desgaste, solicita se realicen marcadores tumorales y broncoscopía con cepillado para descartar primario en pulmón. Los marcadores tumorales son negativos para neoplasia y neumología realiza broncoscopía con cepillado, el diagnóstico macroscópico fue de inflamación bronquial basal derecha. El reporte de patología fue: células bronquiales ++++ con hiperplasia atípica de tipo regenerativo, células mucosas ++, polimorfonucleares ++++, linfocitos +++. No se observan elementos de malignidad.
Ante la estabilidad que el paciente había presentado se comentó el caso con los servicios involucrados y se acordó egresarlo y programarlo para una biopsia de pulmón, órgano en el cual pensamos se encontraría el diagnóstico.
Previo a su egreso el paciente presentó disminución de la tensión arterial y aumento de la disnea, por lo que se solicita un nuevo ecocardiograma. Se reporta derrame pericárdico anterior que colapsa de manera parcial las cavidades derechas. En base al reporte anterior se decide realizar punción pericárdica guiada por ecocardiograma, dado que el derrame se encuentra loculado. Se extraen 250 ce de líquido francamente purulento. El examen químico reportó: aspecto purulento, leucocitos 12,970 por mm3 con 100% de neutrófilos, pH 8.0, hemoglobina +, proteínas totales 5,919 mg/dL, tinción de GRAM y BAAR negativos. El estudio patológico lo reportó como inflamatorio sin presencia de células neoplásicas. Finalmente el cultivo reportó Staphylococcus aureus sensible a vancomicina.
Se inició manejo con antibiótico y se presentó el caso a cirugía cardiovascular, quienes aceptaron drenar quirúrgicamente el derrame. Inicialmente se intentó un abordaje subxifoideo con fibroscopía. Sin embargo, la firmeza y grosor de la bolsa pericárdica no permitió que fuera exitoso, por lo que se cambió a esternotomía media, logrando así la resección del pericardio, el cual se encontró engrosado y con múltiples adherencias.
Durante el postoperatorio evoluciona bien, incluso es posible extubarlo sin complicaciones. Unas horas más tarde, estando consciente y de manera súbita presenta hipotensión arterial severa con deterioro neurológico hasta perder la conciencia. Se intentaron maniobras. Sin embargo no es posible revertir el cuadro y el paciente fallece en menos de una hora.
El departamento de patología reportó una pericarditis constrictiva con un grosor máximo del pericardio parietal de 1 centímetro. La causa de la muerte fue un choque hipovolémico secundario a perforación de la arteria pulmonar con hallazgo de 1,200 ce de sangre en mediastino (Figs. 4 y 5). En pulmón derecho se encontró, enfisema panacinar con antracosis y un absceso inespecífieo. Los ganglios peritraqueales con antracosis severa.


Discusión
El pericardio es una serosa que envuelve al corazón y se encuentra formada por dos hojas, la visceral o epicardio y la parietal. Esta última tiene un grosor de aproximadamente 2 milímetros y entre ellas se encuentran entre 15–35 mililitros de líquido seroso que es un ultrafiltrado del plasma. El pericardio parietal tiene una capa externa fibrosa compuesta, a su vez, de múltiples capas de fibras colágenas intercaladas con fibras elásticas y una serosa con microvellosidades especializadas en la secreción de líquido pericárdico.1,2
A la inflamación del pericardio se le denomina pericarditis. Esta inflamación puede ser acompañada de derrame en escasa cantidad (pericarditis seca), o en mayor cantidad que llegue incluso a causar taponamiento cardíaco. Se considera como aguda si tiene una duración igual o menor a doce semanas. Finalmente el grosor del pericardio puede llegar a tal punto que comprometa la contracción ventricular al restringir la misma causando una pericarditis constrictiva. La primera descripción de pericarditis fue realizada por Antonio Benivieni (1443–1502).3 Hoy en día el diagnóstico se basa en: 1) Dolor retroesternal. 2) La auscultación de frote pericárdico. 3) Cambios electrocardiográficos sugestivos. 4) Ecocardiograma y 5) Datos clínicos de taponamiento cardíaco.
Cuando uno piensa en pericarditis, debe considerar ocho posibles causas: 1) Idiopática. 2) Infecciosa. 3) Trastornos de estructuras contiguas al pericardio. 4) Asociada a enfermedades del tejido conectivo. 5) Trastornos del metabolismo. 6) Neoplasias. 7) Traumatismos. 8) Asociada a otros síndromes.
Todo lo anteriormente mencionado hace del diagnóstico y tratamiento de la pericarditis un reto confuso, en el que es muy importante considerar que dependiendo de la etiología de la misma, será el cuadro clínico esperado, pero que a su vez, todas las etiologías pueden cursar, en un momento dado, con cualquier cuadro clínico. Por ejemplo, la pericarditis viral es un cuadro agudo, que presenta escaso derrame pericárdico y habitualmente cede en dos semanas. Presenta frote en el 85% de los casos y cambios electrocardiográficos en el 80% (derivadas I, II, aVL, aVF y de V3 a V6). Sin embargo, en un momento dado puede volverse repetitiva, crónica y llegar incluso a causar una pericarditis constrictiva.4 Por otro lado la pericarditis neoplásica, tuberculosa, urémica o infecciosa, se diagnostica por la presencia de derrame pericárdico en moderada cantidad, electrocardiográficamente puede cursar con alternancia eléctrica o microcomplejos y a la auscultación los ruidos cardíacos pueden estar disminuidos en intensidad. Finalmente en el caso de la pericarditis asociada a enfermedades del tejido conectivo, el derrame habitualmente acompaña a una florida sintomatología relacionada con artralgias, mialgias, artritis, caída de cabello, úlceras orales, alteraciones hematológicas etc. En conclusión, para realizar el diagnóstico es necesario considerar la forma más común de presentación, posible etiología y el contexto clínico en el que se encuentra el paciente.
En el presente caso clínico tenemos a un paciente con derrame pericárdico crónico, que además presenta pérdida de peso, un trastorno pulmonar multitratado con antibiótico y disnea. Inicialmente pensamos que la causa podría ser neoplásica o secundaria a tuberculosis pulmonar. El ecocardiograma de control, realizado en nuestro hospital, reportó que el derrame se encontraba loculado y en remisión, por lo que una punción pericárdica representaba un alto riesgo, con pocas posibilidades de obtener el diagnóstico. Por otro lado, teníamos la opción de estudiar las vías respiratorias bajas, en donde seguramente tendríamos más oportunidad de encontrar la etiología del padecimiento. Llamaba la atención que el derrame pericárdico hubiera disminuido. Sin embargo, esto coincidió con la aparición de un derrame pleural en el pulmón derecho, lo que nos hizo pensar que se abría drenado espontáneamente a esta región. De cualquier modo el tratamiento dependería del diagnóstico y éste de los hallazgos en el estudio pulmonar.
Un deterioro clínico obligó a realizar un ecocardiograma de control, los hallazgos de éste permitieron realizar una punción pericárdica, la cual resultó francamente purulenta con los resultados antes comentados.
Los pacientes con derrame pericárdico se presentan a los servicios de urgencia y en un momento dado involucran a diferentes especialistas, aunque su cuidado finalmente será supervisado por el cardiólogo, el objetivo principal es mejorar los síntomas y en segundo lugar determinar la causa del derrame. La punción continúa siendo el método de elección, no sólo para mejorar el estado del paciente, sino también para llegar al diagnóstico. En un estudio inglés se reporta la experiencia de 10 años en pacientes que llegaron a urgencias con derrame pericárdico y datos de taponamiento cardíaco. La causa principal con el 44% fue neoplásica (mama, pulmón, linfoma, ovario, tiroides, nasofaringe, mesotelioma y leucemia). La segunda causa fue tuberculosis con 26%. La viral sólo representó el 2%.5
La pericardiocentesis está indicada en los pacientes con signos clínicos o ecocardiográficos evidentes de taponamiento cardíaco, (ingurgitación yugular, pulso paradójico, hipotensión arterial, colapso diastólico de cavidades derechas o derrame mayor de 20 mm en diastole). También se puede realizar en pericarditis purulenta, tumor o derrames persistentes que requieren de diagnóstico. No se recomienda drenar más de 1 litro de una vez para evitar la dilatación aguda del ventrículo derecho.6,7
En caso de origen neoplásico del derrame, las células tumorales se pueden encontrar en el líquido extraído hasta en un 70% de los casos. El antígeno carcinoembrionario también ayuda al diagnóstico, pues, una concentración intrapericárdica de 5 ng/mL tiene una sensibilidad de 75% y una especificidad de hasta 100% para enfermedad maligna. Es importante considerar que el tumor metastásico es 40 veces más frecuente que el primario.5 En un estudio realizado en Ontario Canadá se reportan 99 pacientes con derrame pericárdico de origen neoplásico a los que se les aplicó tetraciclina o doxiciclina. Como se menciona arriba, los tumores de mama y pulmón fueron la causa más común encontrándose en el 76% de los casos. El síntoma de presentación más frecuente fue la disnea en el 91% de los casos, tos 42%, ortopnea 32%, dolor retroesternal 20%, edema periférico 17%. El signo más común encontrado fue el pulso paradójico 62% seguido por ingurgitación yugular en el 51%.8
En lo relacionado a la tuberculosis, el diagnóstico depende del hallazgo del bacilo, directa o indirectamente, en el líquido pericárdico. La presencia de TB en otra parte del cuerpo o la respuesta al tratamiento antifímico. La forma en que esta enfermedad afecta al pericardio puede ser: 1) Por extensión de una neumonía (rara). 2) En tuberculosis miliar, en cuyo caso otro órgano se encuentra habitualmente afectado. 3) Por continuidad al romperse un ganglio mediastinal. 4) Por drenaje linfático.9
El derrame pericárdico se encuentra presente al momento del diagnóstico entre el 60 y 90% de los casos. En el examen del líquido se encuentra predominio de linfocitos en el 75% de los casos. El bacilo se aisla en el 17% y hasta en un 80%, es de características hemáticas. El estudio de PCR tiene resultados similares al histopatológico, pero es más rápido. La adenosin deaminasa a un nivel de 30U/1 tiene una sensibilidad de 94% y una especificidad de 68%. Los signos y síntomas más frecuentes son: fiebre (73–97%), disnea (80–88%), dolor retroesternal (39–59%), linfadenopatía cervical (13–28%). Además de pérdida de peso y sudoraciones nocturnas. La radiografía de tórax muestra signos de TB en sólo el 30% de los casos. Cuando el derrame es de origen fímico es muy importante llegar al diagnóstico, pues el manejo es con esferoides que podrían ser perjudiciales en caso de que la etiología sea otra.10,12
La pericarditis purulenta es una entidad rara pero fulminante, frecuentemente letal. Ésta se presenta aproximadamente en el 5% de los casos.13 En la mayoría de los casos de pericarditis purulenta una o varias de las siguientes características se encuentran presentes: 1) Un foco infeccioso primario. 2) Signos y síntomas compatibles con una respuesta inflamatoria sistémica (fiebre, taquicardia, taquipnea, leucocitosis etc.) 3) Líquido pericárdico purulento con entre 10,000 y 30,000 leucocitos y por lo menos un 90% de polimorfonucleares. 4) Cultivos positivos. Se describen cuatro posibles mecanismos que condicionan la infección del pericardio: 1) Extensión de focos infecciosos dentro del tórax. 2) Extensión de un foco infeccioso dentro del corazón (endocarditis). 3) Diseminación hemática. 4) Inoculación directa por trauma o un procedimiento quirúrgico. Como dato agregado, el citoquímico del líquido pericárdico demuestra disminución de la glucosa con aumento de las proteínas y de DHL.14,16
El agente causal ha variado a través del tiempo, tradicionalmente los agentes más frecuentes eran los gram positivos como el Staphylococus aureusy el Streptococcus pyogenes o neumoniae. Sin embargo, los avances terapéuticos se han asociado con cambios en el espectro patógeno, hoy en día éste depende del lugar geográfico, estado socioeconómico, la edad y el estado inmunológico del paciente. En los últimos tiempos los casos de pericarditis purulenta son más bien aislados y entre los gérmenes reportados se encuentran: Citrobacter freundii, Actinomyces, Coxiella burnetn, Borrelia burgdorferí, Chlamydia sp, Legionella pneumophila, Neisseria meningitídis, E. coliy Salmonella.17–19
Un reporte que incluyó la experiencia de 20 años en un Hospital General en Barcelona España, encontró solamente 33 casos de pericarditis purulenta. El diagnóstico fue hecho con el paciente vivo, en 19 casos los restantes fueron por autopsia. Cinco de los pacientes tenían algún tipo de inmunodeficiencia. Únicamente en dos pacientes no se documentó otro foco infeccioso, el más frecuentemente encontrado fue el pulmón. Entre los signos y síntomas hallados tenemos: fiebre 100%, derrame pericárdico 94%, disnea 89%, datos de taponamiento cardíaco 79%, derrame pleural 63%, dolor retroesternal 37% y frote pericárdico 37%. En el electrocardiograma se encontró elevación difusa del segmento ST en el 30%, disminución del voltaje QRS 21%, fibrilación auricular 12% e inversión difusa de la onda T en el 9% de los casos. Todos los pacientes tenían algún grado de cardiomegalia.20
El manejo de estos pacientes se puede resumir en dos pasos básicos: 1) Extraer el líquido purulento. 2) Antibioticoterapia intravenosa exhaustiva.21 Con el fin de drenar el absceso se puede realizar una pericardiocentesis, que además es obligatoria en estos pacientes. Extraer el líquido con ayuda de un catéter de "pig tail", el cual se puede dejar por hasta 72 horas, tiempo en el que se realizará de manera intermitente aspiración. En los casos en que exista demasiada fibrina y el derrame no disminuya, es posible aplicar localmente estreptocinasa con el fin de facilitar su extracción. Como complicación se reporta hemorragia y aneurisma submitral.22,23
En general, todos los autores recomiendan realizar drenaje quirúrgico del espacio pericárdico mediante pericardiotomía subxifoidea o toracotomía media si es necesario, se reporta una mortalidad alrededor del 8%.
A pesar del manejo la pericarditis purulenta es fatal en alrededor del 40% de los casos y las principales causas de muerte son: 1) Taponamiento cardíaco. 2) Sepsis. 3) Pericarditis constrictiva.24 Un buen número de pacientes con pericarditis purulenta evolucionan a constrictiva, que consiste en un engrosamiento crónico, fibrótico del pericardio, en ocasiones con calcificación del saco, que dificulta el llenado diastólico.25 Como mencionamos anteriormente, el pericardio parietal tiene un grosor de aproximadamente 2 mm, cuando éste aumenta a más de 4 mm sugiere pericarditis constrictiva, pero si es mayor de 6 mm el diagnóstico prácticamente se encuentra hecho. Se ha reportado que hasta un 12% de pacientes con pericarditis constrictiva, el pericardio se encontraba con fibrosis, pero tenía un grosor de 2 mm o menos.26
Este padecimiento se presenta como una falla cardíaca derecha crónica y debilitante, con ingurgitación yugular, hepatomegalia, ascitis, edema periférico y puede presentar derrame pleural.27
Aunque se han reportado casos de resolución espontánea de la pericarditis constrictiva, éstos son más frecuentes en los casos de pacientes con pericarditis idiopática, sin que hasta el momento se haya reportado alguno en pericarditis purulenta. Por lo tanto el único tratamiento definitivo consiste en pericardiectomía radical para mejorar hemodinámicamente al paciente y restablecer el llenado diastólico. La mortalidad varía con las series, llegando a ser de hasta el 50% dependiendo del grado de fibrosis y adherencias. Las causas más frecuentes de muerte son, la falla cardíaca y la ruptura ventricular.28–30
En el presente caso suponemos que el paciente presentó una bacteriemia secundaria a la infección dérmica, por lo que la manera en que el pericardio se pudo haber infectado sería hemática, esta forma de contaminación pericárdica ya se ha descrito antes, por ejemplo, en niños con varicela complicada con infección por bacterias.3132 Las pericarditis por estafilococo son catastróficas y agudas. Sin embargo, el paciente siempre se mantuvo con manejo antibiótico por su problema respiratorio, lo cual pudo haber cambiado la evolución. En relación a este problema respiratorio, patología reportó un absceso pulmonar inespecífico, por lo que no podemos descartar que inicialmente la infección llegara a pulmón y de aquí al pericardio. De cualquier modo, el síndrome de desgaste que el paciente presentaba nos hizo pensar en neoplasia o tuberculosis. El diagnóstico lo obtuvimos hasta que realizamos la pericardiocentesis, lo cual nos habla de lo importante que resulta realizar este procedimiento cuando se piensa en ese tipo de patologías. Finalmente, es importante resaltar la alta mortalidad con que cursan estos pacientes a pesar del tratamiento.
Referencias
1. Braunwald E: Heart Disease. A Textbook of Cardiovascular Medicine. 6TH Edition. Philadelphia, W.B. Saunders, 2001. [ Links ]
2. Troughton RW, Asher CR, Klein AL: Pericarditis. Lancet 2004; 363: 717–727. [ Links ]
3. Cohen BM: Cross Your Heart: Some Historical Comments About Fibrinous Pericarditis. Hum Pathol 2004; 35: 147–149. [ Links ]
4. Lange AR, Hillis DL: Acute Pericarditis. N Engl J Med 2004; 351: 2195–2202. [ Links ]
5. Gibbs RC, Watson DSR, Singh PS, Lip HYG: Management of Pericardia! Effusion by Drainage: a Survey of 10 Years Experience in a City Centre General Hospital Serving a Multiracial Population. Postgrad Med J 2000; 76: 809–13. [ Links ]
6. Sauleda SJ: Diagnóstico y Guía Terapéutica del Paciente con Taponamiento Cardíaco o Constricción Pericárdica. Rev Esp Cardiol 2003; 56(2): 195–205. [ Links ]
7. Maisch B, Seferovic MP, Ristic DA, Erbel R, Reinmuller R, Adler Y, Tomkowski ZW: Guidelines on the Diagnosis and Management of Pericardial Diseases of de European Society of Cardiology. Eur Heart J 2004; 25: 587–610. [ Links ]
8. Maher EA, Shepherd FA, Todd TR: Pericardial Sclerosis as the Primary Management of Malignant Pericardial Effusion and Cardiac Tamponade. J Thorac Cardiovasc Surg 1996; 112(3): 637–643. [ Links ]
9. Cherian G: Diagnosis of Tuberculosis Etiology in Pericardial Effusions. Postgrad Med J 2004; 80: 262–66. [ Links ]
10. Koh K, Kim E, Cho C: Adenosine Deaminaseand Carcinoembryonic Antigen in Pericardial Effusion Diagnosis, Especially in Suspected Tuberculosis Pericarditis. Circulation 1994; 89: 2728–2735. [ Links ]
11. Levy PY, Corey R, Berger P, Habib G, Bonnet JL, Messana T, Djiane P: Etiologic Diagnosis of Pericardial Effusion. Medicine 2003; 82: 385–391. [ Links ]
12. Brook I, Frazier HE: Microbiology of Acute Purulent Pericarditis. Arch Intern Med 1996; 156: 1857–1860. [ Links ]
13. Maisch B, Ristic AD: The Classification of Pericardial Disease in the Age of Modern Medicine. Curr Cardiol Rep 2002; 4: 13–21. [ Links ]
14. Sauleda SJ, Almenar L, Angel J, Bardají A, Bosch X, Guido J: Guías de Práctica Clínica de la Sociedad Española de Cardiología para Patología Pericárdica. Rev Esp Cardiol 2000; 53: 389–394. [ Links ]
15. Snyder RW, Todd B: Purulent Pericarditis with Tamponade in a Postpartum Patient Due to Group F Streptococcus. Chest 1999; 115(6): 1746–1747. [ Links ]
16. Altemeir WA, Tonelli MR, Aitken ML: Pseudomonal Pericarditis Complicating Cystic Fibrosis. Pediatr Pulmonol 1999; 27: 62–64. [ Links ]
17. Nardell EA, Dalí F, Shepard JA, Mark EJ: Case 22–2004: A 30 Year–Old Woman with a Pericardial Effusion. N Engl J Med 2004; 351(3): 279–287. [ Links ]
18. Rayo GM, Lacalzada AJ, Laynez CI, Bosa OF, Domínguez RA, Armas TD: Pericarditis Meningocócica Primaria por Serogrupo C. Rev Esp Cardiol 2000; 53: 1541–1544. [ Links ]
19. Sauleda SJ, Barrabes JA, Miralda PG, Soler SJ: Purulent Pericarditis: Review of a 20–Year Experience in a General Hospital. J Am Coll Cardiol 1993; 22: 1661–1665. [ Links ]
20. Maisch B, Ristic DA: Practical Aspects of the Management of Pericardial Disease. Heart 2003; 89:1096–1103. [ Links ]
21. Canver CC, Patel KA, Kosolcharoen P, Voytovich CM: Fungal Purulent Constrictive Pericarditis in a Heart Transplant Patient. Ann Thorac Surg 1998; 65:1792 1794. [ Links ]
22. Juneja R, Sharma R, Kothari SS: Submitral Pseudo aneurysm in Purulent Pericarditis. Heart 2000; 83(6): 713–714. [ Links ]
23. Rajnish J, Khotari SS, Saxena A, Rajesh S, Anuradha J: Intrapericardial Streptokinase in Purulent Pericarditis. Arch Dis Child 1999; 80(3): 275–277. [ Links ]
24. Rosenthal A: Massive Purulent Pericarditis and Cardiac Tamponade Caused by Staphylococcus aureus Urosepsis. J Cardiovasc Surg 2002; 43: 837–839. [ Links ]
25. Ling LH, Oh JL, Breen JF: Calcine Constrictive Pericarditis is it still with us? Ann Intern Med 2000; 132: 444–450. [ Links ]
26. Talreja DR, Edwards DW, GK Danielson, Schaff VH, Tajik JA, Tazelaar DH: Constrictive Pericarditis in 26 Patients with Histologically Normal Pericardial Thickness. Circulation 2003; 108: 1852–1857. [ Links ]
27. Sauleda SJ: Pericardial Constriction: Uncommon Patterns. Heart 2004; 90: 257–258. [ Links ]
28. Bertog CS, Thambidorai KS, Parakh K, Schoenhagen P, Ozdura V,Houghtaling LP: Constrictive Pericarditis: Etiology and Cause Specific Survival after Pericardiectomy JACC 2004; 43(8): 1445–1452. [ Links ]
29. Sauleda SJ, Sánchez JA, Soler SJ, Permanyer MG: Effusive Constrictive Pericarditis. N Engl J Med 2004; 350(5): 469–475. [ Links ]
30. Haley HJ, Tajik JA, Danielson GK, Schaff VH, Mulvagh LS. Oh JK: Transient Constrictive Pericarditis: Causes and Natural History. JACC 2004; 43(2): 271–275. [ Links ]
31. Ulloa GR, Avila AM: Varicella associate with Staphylococcus aureus purulent pericarditis. Pediatr Infect Dis J 2003; 22(10): 935–936. [ Links ]
32. Gold L, Barbour S, Guerrero TL, Koopot R, Lewis K, Rudinsky MF: Staphylococcus aureus Endocarditis Associatet with Varicella Infection in Children. Pediatric Infect Dis J 1996; 15(4): 377–379. [ Links ]














